2. 中化作物保护品有限公司,上海 200125
2. Sinochem International Crop Care Company Limited, Shanghai 200125
集约化农业的不合理发展导致土传病害频发,造成严重的粮食减产和经济损失。以茄科劳尔氏菌(Ralstonia solanacearum)引起的土传细菌性病害——青枯病为例,该病害在我国大部分地区都有分布,能够侵害马铃薯、番茄、烟草、花生等20多种重要的经济作物,严重时造成绝收[1-2]。传统的化学防治,如农药或对土壤熏蒸,短期内见效快,但存在诱导耐药菌产生的风险,且严重破坏了土壤的土著微生物区系;抗性品种、嫁接轮作等措施研发周期长、田间应用效果不稳定。所以土传病害的防控亟需高效稳定、精准靶向病原菌的生防措施。土壤中存在一类特殊的微生物——噬菌体,能够特异性侵染细菌的一类病毒。噬菌体在环境中普遍存在,其数量是细菌的10倍以上,土壤中噬菌体的丰度高达109/g土,且多样性高[3]。土壤中丰富的噬菌体资源在土传青枯病的生物防控中发挥着重要的作用。不同类型的青枯菌专性噬菌体,如巨型肌尾噬菌体ΦRSL1[4]、肌尾噬菌体ΦRSA1[5]、短尾噬菌体ΦRSB1[6]和丝状噬菌体ΦRSM1[7]均能从环境中分离获得,部分噬菌体也完成了基因组测序分析,不断丰富了噬菌体库。这些青枯菌专性噬菌体对土传青枯病具有一定的防控效果。Fujiwara等[8]利用3株噬菌体ΦRSL1、ΦRSA1和ΦRSB1抑制青枯菌,结果发现ΦRSA1和ΦRSB1单独或与其它噬菌体组合处理,都能快速降低病原菌的数量。利用噬菌体抑制土传病原菌具有很多优势:(1)宿主专一性,噬菌体能够特异性靶定病原菌,对环境扰动小;(2)噬菌体能够快速增殖,高效裂解病原菌;(3)相比病原菌对抗生素耐药性的单向进化,噬菌体与宿主菌协同进化,动态阻控病原菌等[9-11]。噬菌体的抑菌优势使得其成为土传病害防控重要的“后备军”。
土传青枯病难以防控的一个重要原因是环境中病原青枯菌的遗传型和生理型呈现高度的多样性。前期研究发现即使来自同一株植物的青枯菌的生理型也存在较大变异,而噬菌体对不同来源的青枯菌的侵染能力不同,呈现空间上的原位适应性,即噬菌体对来自同一个地区的细菌侵染能力更强。为了更好地靶定特定环境下的病原青枯菌,可以从病原菌丰富的原位土壤中筛选侵染能力强的噬菌体,其效果一般优于其他地区分离获得的噬菌体。在获得抑菌能力强的噬菌体后,为了最大限度发挥噬菌体的防控效率,还需要要考虑其环境稳定性、最佳的保存条件和应用方法。若保藏方法不当会造成噬菌体污染,且抑菌能力下降。为了保证噬菌体稳定的抑菌效果,且兼顾噬菌体产品的生产、运输成本,需要探究噬菌体最佳的保存方式,以维持噬菌体的效价和活性。噬菌体在应用过程中,传统的灌根接种方式下,噬菌体与病原菌的定向互作会受到土壤结构、水分、温度及根际微生物等生物和非生物因素的影响,为了减少土壤因素对噬菌体的影响,需要探究噬菌体最佳的应用方式。与灌根法相比,茎部注射的接种方式被认为是一种经济有效的措施[12],但是否适用于噬菌体的接种还有待进一步研究。
目前利用噬菌体防控土传青枯菌仍缺乏从筛选→鉴定→稳定性和保存→应用效果的提升这一套完整的研究体系,本研究拟以青枯病发病典型地区的番茄根际土壤中分离的强致病性青枯菌为宿主,从原位土壤中分离筛选专性青枯菌的噬菌体,并以其中一株抑菌能力最强的噬菌体为研究材料,研究了该噬菌体的基础生物学特性,并检测了其在不同胁迫下的稳定性,以及噬菌体的最佳保存方式,最后比较了灌根和茎部注射接种方式对该噬菌体防控番茄土传青枯病效果的影响,以确定经济有效的噬菌体施用方式。本研究系统地阐明了噬菌体防控土传青枯病的研究过程,旨为大规模利用噬菌体疗法防控土传病害奠定理论基础和提供研究模式。
1 材料与方法 1.1 材料供试土样:从南京麒麟后村蔬菜大棚(118°57' E,32°03' N)番茄青枯病发病田块中采集植株根际土壤样品。
供试菌株:宿主青枯菌为从南京市麒麟镇发病番茄植株中分离获得的具有强致病力的青枯菌QL-Rs1115(简称RS)[13]。
供试番茄品种:Mcrio-Tom矮化品种,美国泛美种子公司生产。
1.2 方法 1.2.1 噬菌体的分离与纯化称取10 g根际土样于已灭菌三角瓶中,加入90 mL无菌水混匀,于摇床中30℃,170 r/min振荡培养1 h,离心(12 000 ×g,5 min),过滤(0.22 µm的水系滤膜)获得无菌的悬液;取5 mL悬液接种至青枯菌RS菌液(OD600为0.5,~108 CFU/mL)中,30℃,170 r/min振荡富集培养12 h。将富集后的悬液于12 000 ×g高速离心5 min,取上清液过滤,得到噬菌体原液。取10 mL RS菌液与150 mL冷却至室温的NA半固体培养基(NA培养基:葡萄糖10 g/L,蛋白胨5 g/L,牛肉浸膏3 g/L,酵母粉0.5 g/L)混匀,立即倒入已凝固的NA固体培养基平板上制成双层平板,待上层培养基凝固后将平板分区,分别点接20 µL梯度稀释的噬菌体悬液(101-108)于平板分区中,30℃静置培养24 h。挑取最高稀释倍数下单个最大的噬菌斑接入到RS菌液中,振荡培养12 h,悬液离心过滤获得较纯的噬菌体。上述方法重复3-4次,获得纯化后的噬菌体。
1.2.2 噬菌体的基础特性检测噬菌斑大小:不同噬菌体梯度稀释后点接在含宿主青枯菌的双层琼脂平板上,30℃静置培养24 h,检测单个噬菌体形成的噬菌体斑的直径大小。
噬菌体的抑菌效果:利用微孔板培养系统,196 μL NA培养基中接种2 μL RS菌液(~108 CFU/mL)和2 μL噬菌体悬液(~107 PFU/mL),以2 μL无菌水作为对照,30℃,170 r/min振荡培养,测定不同时间点病原菌的生长情况(OD600值)。噬菌体的抑菌时间为青枯菌的OD600开始增长的时间点;噬菌体的抑菌率=(OD600对照-OD600处理)/ OD600对照。
噬菌体的形态观察:取20 µL浓缩后的噬菌体粗制颗粒滴在铜网上,静置沉淀15 min,滴一滴2%的PTA(磷钨酸)进行染色,静置10 min后用滤纸吸走侧面多余的染色液,继续静置5 min使样品干燥,利用透射电子显微镜观察噬菌体的形态。
1.2.3 噬菌体基因组测序按照试剂盒提供的方法提取噬菌体基因组DNA,检测DNA浓度和纯度。由上海凌恩生物科技有限公司利用Illumina Hiseq技术对样品DNA进行paired-end测序。用SOAPdenovo(版本:2.04)和GapCloser(版本:1.12)组装得到噬菌体全基因组。用GeneMarkS(版本4.25)预测基因,与NR、Swiss-Prot、KEGG、COG、VFDB数据库比对注释。
1.2.4 噬菌体稳定性及保存效果检测噬菌体稳定性测定:热稳定性,噬菌体悬液(~108 PFU/mL)分别放在4、20、30、40、50、60、70和80℃水浴锅中水浴2 h;pH耐受力测定:噬菌体悬液(~108 PFU/mL)分别加入到pH为3、4、5、6、7、8、9、10的已灭菌NA培养基中,28℃水浴2 h;紫外线耐受力测定:噬菌体悬液(~108 PFU/mL)3 mL均匀平铺于无菌培养皿中,放入超净工作台距离紫外灯30 cm处照射0、10、20、30、40、50、60、70、80、90 min。比较不同处理后噬菌体对青枯菌的抑菌效果,具体方法同方法1.2.2,以噬菌体的抑菌效果评估其稳定性。
噬菌体储存条件:噬菌体悬液(~1011 PFU/mL)分别与无菌水、30%甘油、生理盐水(0.85% NaCl)、SM缓冲液(MgSO4·7H2O 2.0 g/L,NaCl 5.8 g/L,1 mol/L Tris-HCl(pH7.5)50 mL/L,2%明胶5 mL/L)按照1:1比例混匀于无菌离心管中,置于4、25和37℃温度下培养7 d,分别在1 d、2 d、4 d、7 d检测噬菌体效价和侵染活性的变化。其中噬菌体效价测定利用双层琼脂平板法,侵染活性的测定利用微孔板法。
1.2.5 噬菌体防控番茄土传青枯病的效果检测盆栽试验:设置灌根、茎部注射2种方式接种噬菌体,以不接种噬菌体为对照处理,共3个处理,每个处理3个重复,每个重复9株番茄苗。番茄种子经表面消毒后催芽2 d,育苗,3片真叶时移栽至9孔盆钵中。移栽7 d后接种青枯菌,浓度为~107 CFU/g干土。接种青枯菌7 d后接种噬菌体悬液,茎部注射处理:植株第一片真叶叶柄下方,先用含有75%酒精的棉签消毒,然后用移液枪注射10 µL噬菌体(~109 PFU/mL);灌根处理:5 mL噬菌体浇灌到根部土壤中(~106 PFU/g干土)。所有盆钵置于温室条件下(江苏宜兴国家有机类肥料工程技术研究中心,白天25-32℃,夜间20-25℃,自然光照时间)培养,每隔2 d随机调整盆钵的位置,减少环境误差。盆栽试验结束时统计各处理的青枯病的发病率。发病指数=[∑(各级病株数×相应发病等级)/(调查总株数×最高发病等级)]×100%,其中发病等级是根据发病时叶片萎蔫程度分为5个等级,0级:无法发病症状,1级:植株有1%-25%的叶片出现萎蔫症状并且可以恢复;2级:植株有26%-50%的叶片出现萎蔫症状并且只有部分可以恢复;3级:植株有51%-75%的叶片出现萎蔫症状;4级:植株有75%以上的叶片出现萎蔫症状甚至死亡[14]。采集根际土壤用于检测根际病原菌的数量。
根际病原菌数量测定:称取根际土3 g,加27 mL无菌水放置在30℃,170 r/min摇床中震荡2 h,吸取浊液梯度稀释后在青枯菌选择性培养基SMSA上进行涂布[15],培养48 h后,统计各平板菌落数量,通过稀释倍数计算得到病原菌数量。
1.2.6 数据分析数据处理使用SigmaPlot v 12.5、R语言(R v 3.5.1)(Team,2015)和SPSS v 20等统计分析软件。方差分析方法为邓肯多重检验(Duncan’s Multiple Range Test,DMRT,P < 0.05)。
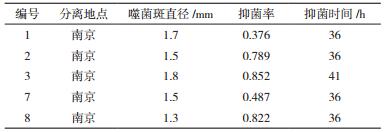
2 结果 2.1 青枯菌专性噬菌体的分离与鉴定从南京麒麟青枯病发病的大棚中采集番茄植株根际土壤样品,利用双层琼脂平板法分离了5株青枯菌专性噬菌体,噬菌体的基本抑菌特性如表 1所示。其中3号噬菌体的噬菌斑直径、抑菌率和抑菌时间均最好,所以以这株噬菌体为后续试验的材料,命名为NJ-P3。噬菌体NJ-P3在青枯菌平板上形成圆形噬菌斑,且噬菌斑清晰透明(图 1-A)。由图 1-B看出,噬菌体NJ-P3头部均呈正十二面体结构,具有短尾,尾部长度在16-20 nm之间。经过与国际病毒分类委员会的分类标准比对,该噬菌体属于有尾噬菌体目Caudovirales,短尾噬菌体科Podoviridae。
|
| 图 1 番茄根际土壤中分离筛选的青枯菌专性噬菌体NJ-P3的噬菌斑(A)及电镜形态(B) |
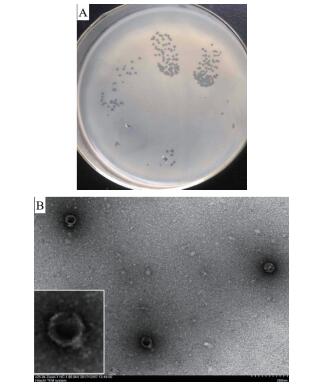
基于头尾连接蛋白分析噬菌体NJ-P3与数据库中其他噬菌体的系统发育距离,结果发现NJ-P3与来自韩国Seogwipo的番茄青枯病发病土壤的短尾青枯菌噬菌体DU_RP_II亲缘关系最近,相似性达到72.63%,属于短尾噬菌体(图 2-A)。
|
| 图 2 噬菌体NJ-P3头尾连接蛋白发育树(A)及基因图谱(B) |
如图 2-B所示的基因组信息表明噬菌体NJ-P3基因大小为42 528 bp。经预测噬菌体NJ-P3含有51个基因,总长度为38 454 bp,覆盖了基因组的90.42%,平均基因长度为754 bp,基因的GC百分含量为62.86%。噬菌体NJ-P3在CAZY数据库中注释到了裂解酶和乙酰胞壁质酶;在TCDB数据库中注释到了RagB/SusD结构域蛋白;在SwissProt数据库中注释到了裂解酶、整合酶和DNA聚合酶;在KEGG数据库中注释到了脱氧核糖核酸内切酶RuvC;在AntiCRISPR数据库中注释到了II-C型AntiCRISPR蛋白;在VFDB数据库中注释到了效应蛋白pipB2;在NR数据库中注释到了末端酶大亚基、头尾连接蛋白、主要衣壳蛋白、RecT重组酶、穴蛋白、小尾部蛋白、整合酶、DNA结合蛋白、PD-(D/E)XK核酸酶、cI样转运调节蛋白。
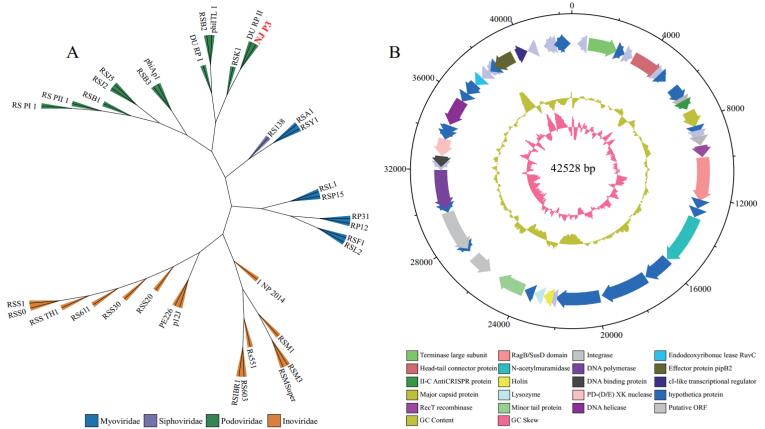
2.3 青枯菌专性噬菌体的稳定性及储存条件根据不同条件处理后噬菌体对病原青枯菌的抑制能力表征噬菌体的稳定性。0-50℃范围内噬菌体NJ-P3对青枯菌均具有稳定的裂解活性,抑制率维持在76%左右。随着温度升高,噬菌体对青枯菌的抑制率急剧下降,说明噬菌体NJ-P3不能耐受60℃及以上的温度(图 3-A)。pH在4-10的范围噬菌体NJ-P3对青枯菌均具有一定的抑制效果,抑菌率在60%以上,说明噬菌体NJ-P3能够耐受此pH范围。pH为7时,噬菌体的抑菌效果最好,达到78%(图 3-B)。紫外线照射0 min-60 min的噬菌体NJ-P3能够稳定抑制青枯菌的生长,抑菌率在83%左右,但随紫外照射时间的延长,噬菌体NJ-P3的抑菌效果逐渐减弱。在90 min时噬菌体NJ-P3失去抑菌能力(图 3-C)。
|
| D中噬菌体滴度的变化由噬菌体滴度随时间变化的曲线的线下积分面积表征;不同小写字母表示差异的显著性P < 0.05 图 3 噬菌体NJ-P3的稳定性(热稳定性A、酸碱耐受性B、紫外线耐受性C)及不同温度和溶剂对噬菌体保存效果的影响(D) |
比较不同温度和溶剂对噬菌体NJ-P3货架期(滴度)的影响。这里以不同处理下噬菌体7 d内滴度变化曲线的线下面积来表征不同处理对噬菌体滴度的影响:面积越大,说明噬菌体滴度变化较小,保存效果好;反之说明该处理噬菌体滴度下降快,保存效果不稳定。如图 3-D所示:不同温度对噬菌体保存效果的影响有显著差异(F2,35=14.564,P < 0.001),且随温度的升高(4℃→25℃→37℃)噬菌体的保存效果呈下降趋势。不同保存溶剂同样影响了噬菌体的保存效果,其中在3个温度下SM缓冲液均表现出最好的的效果,而生理盐水保存效果最差。30%的甘油在25℃时保存效果最好,在4℃和37℃时与对照(无菌水)相比差异不显著。
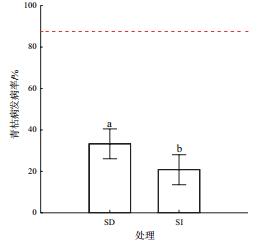
2.4 青枯菌专性噬菌体的生防效果盆栽试验结果表明,与对照处理(不接种噬菌体)的高发病率(87.5%)相比,接种噬菌体NJ-P3能够有效防控番茄青枯病的发生,平均降低了69.0%的发病率。不同的接种方式(灌根和茎部注射噬菌体NJ-P3)对青枯病生防效率差异显著(T检验:t4=-3.858,P=0.018,图 4)。相比灌根法,茎部注射接种噬菌体平均提高了37.5%的生防效率。综合这些结果,表明茎部注射噬菌体是最优施用噬菌体的方式。
|
| SD:灌根接种;SI:茎部注射接种 图 4 盆栽试验中不同接种方式对噬菌体防控番茄土传青枯菌效果的影响 |
本研究从土传青枯病发病严重的南京麒麟蔬菜大棚中原位分离青枯菌专性噬菌体,并系统研究了其中一株抑菌能力强的噬菌体NJ-P3的稳定性、保存及应用效果。噬菌体NJ-P3在青枯菌平板上形成直径为1-2 mm的清晰透明噬菌斑,透射电镜观察结果表明该噬菌体头部呈正二十面体,属于有尾噬菌体目,短尾噬菌体科。基因组信息也表明NJ-P3与短尾噬菌体DU_RP_II亲缘性较高。噬菌体全基因组信息能够揭示噬菌体进化的起源、方向、频率,预测其与宿主相互作用的位点等信息[16]。通过分析噬菌体和病原菌基因组中的CRISPR、限制性修饰、原噬菌体等相互作用区域,可以构建噬菌体-细菌侵染网络,预测噬菌体的侵染范围[17-18]。噬菌体NJ-P3对病原青枯菌具有较强的侵染能力,可能与其位于orf45上的一个蛋白有关,通过比对基因注释此蛋白属于Pentapeptide_4蛋白超家族,由371个氨基酸组成。我们猜想是否因为此蛋白为毒力蛋白,进一步对其进行VFDB和GO注释,VFDB数据库注释结果为沙门氏菌SL254的效应蛋白pipB2,而基因图谱显示该区域GC%显著高于均值,因此猜测该蛋白可能是基因水平转移的结果;而GO注释发现比对的得分不高,但是结果表明其分子作用为结合,可能存在于宿主细胞上,其生物学特性应该与致病性有关,如需确定此蛋白是否具有较强毒力,还有待进一步研究。
噬菌体的存活受到很多环境因素的影响,包括温度、pH和紫外线等[19]。评估噬菌体对环境因子的适应能力是后期田间应用的基础。本研究发现噬菌体NJ-P3的热稳定范围较宽,能够耐受20-50℃,能满足常规环境的施用温度。pH值的大小能够影响噬菌体的吸附程度,由于环境pH改变会引起噬菌体基团电荷的改变,进而对噬菌体的吸附蛋白和细胞受体的空间构象产生影响,而使二者之间难于相互匹配。噬菌体NJ-P3在pH为4-10范围抑菌效果稳定,在中性环境(pH为7)裂解活性最高。有研究表明,紫外线主要是通过对微生物的辐射损伤和破坏核酸的功能使微生物失活,噬菌体NJ-P3在经过紫外线照射80 min后仍有较高的裂解能力,当照射时间超过90 min时,其杀菌能力完全丧失,噬菌体自身对紫外线有一定的耐受能力,但超过一定时间噬菌体会失活,丧失抑菌能力。与现有的青枯菌噬菌体资源相比[8],噬菌体NJ-P3的稳定性较强。
为了保证噬菌体稳定的抑菌效果,且兼顾噬菌体产品的生产、运输成本,本研究评估不同方式对噬菌体NJ-P3的保存效果(货架期)的影响。传统的冻液法和干燥法对噬菌体的长期保存效果好,但对设备要求高,如超低温冰箱和干燥仪等,且生产成本高[20]。本研究拟提供经济适用、效果稳定、适合大规模生产的悬液保存法。研究发现噬菌体NJ-P3在SM缓冲液中的保存效果最好,短期内噬菌体的滴度变化不大。前人的研究也表明SM缓冲液可以有效保护噬菌体[21-22],可能是由于SM缓冲液中的镁离子可以保护噬菌体蛋白外壳[23];明胶可以阻止低分子物质的碳化和氧化,且减弱温度变化对噬菌体的活性物质的影响;Tris可以缓冲环境pH的剧烈变化。利用SM缓冲液作为噬菌体的保护剂,方法简单、成本低,具有较好的应用前景。
噬菌体施用到土壤中时会受到很多因素的影响,如土壤的养分可利用性、pH、温度、水分含量和土壤黏粒等均会影响噬菌体与宿主细菌之间的相互作用[19],进而影响噬菌体对病原菌的抑制效果。为了减少土壤环境对噬菌体的影响,本研究提出利用茎部注射接种噬菌体,直接将青枯菌-噬菌体互作的“主战场”从根际转到外部干扰较小的植物茎部,增加噬菌体与青枯菌的接触率和互作强度。盆栽试验结果表明,相对于灌根法接种噬菌体,茎部注射能够提高噬菌体对土传青枯病的防控效果,达到37%以上。另外茎部注射噬菌体用量少、效率高,对开发低剂量高效率的噬菌体接种策略具有指导作用。
本探究获得了一株高效抑制病原青枯菌的噬菌体NJ-P3,并进一步评估了其稳定性和防控效果。但根际的青枯菌基因型和生态型均呈现高度的多样性,单一噬菌体的防控效果是有限的,利用更多抑菌效果好的噬菌体资源组合成噬菌体鸡尾酒,或与有益微生物配合,多重措施协同,稳定高效阻控病原青枯菌。
4 结论本研究从番茄根际分离纯化了一株专性裂解病原青枯菌的短尾噬菌体NJ-P3。噬菌体NJ-P3对环境适应性强,能够耐受20-50℃、pH为4-10、紫外线80 min照射;置于SM缓冲液中低温(4℃)、常温(25℃)下短期保存效果稳定。盆栽试验结果表明,茎部注射噬菌体对土传青枯病的防控效果达到86%。
| [1] |
Hayward AC. Biology and epidemiology of bacterial wilt caused by pseudomonas solanacearum[J]. Annual Review of Phytopathology, 1991, 29: 65-87. DOI:10.1146/annurev.py.29.090191.000433 |
| [2] |
Jiang G, Wei Z, Xu J, et al. Bacterial wilt in china :History, current status, and future perspectives[J]. Frontiers in Plant Science, 2017, 8: 1549. DOI:10.3389/fpls.2017.01549 |
| [3] |
Swanson MM, Fraser G, Daniell TJ, et al. Viruses in soils :Morphological diversity and abundance in the rhizosphere[J]. Annals of Applied Biology, 2009, 155(1): 51-60. DOI:10.1111/j.1744-7348.2009.00319.x |
| [4] |
Yamada T, Satoh S, Ishikawa H, et al. A jumbo phage infecting the phytopathogen ralstonia solanacearum defines a new lineage of the myoviridae family[J]. Virology, 2010, 398(1): 135-147. |
| [5] |
Fujiwara A, Kawasaki T, Usami S, et al. Genomic characterization of ralstonia solanacearum phage phi rsa1 and its related prophage(phi rsx)in strain gmi1000[J]. J Bacteriol, 2008, 190(1): 143-156. DOI:10.1128/JB.01158-07 |
| [6] |
Kawasaki T, Shimizu M, Satsuma H, et al. Genomic characterization of ralstonia solanacearum phage phi rsb1, a t7-like wide-host-range phage[J]. Journal of Bacteriology, 2009, 191(1): 422-427. DOI:10.1128/JB.01263-08 |
| [7] |
Kawasaki T, Nagata S, Fujiwara A, et al. Genomic characterization of the filamentous integrative bacteriophages ΦRSS1 and ΦRSM1, which infect Ralstonia solanacearum[J]. Journal of Bacteriology, 2007, 189(16): 5792-5802. DOI:10.1128/JB.00540-07 |
| [8] |
Fujiwara A, Fujisawa M, Hamasaki R, et al. Biocontrol of Ralstonia solanacearum by treatment with lytic bacteriophages[J]. Applied and Environmental Microbiology, 2011, 77(12): 4155-4162. DOI:10.1128/AEM.02847-10 |
| [9] |
Abedon ST. Phage therapy :Eco-physiological pharmacology[J]. Scientifica(Cairo), 2014, 2014: 581639. |
| [10] |
Jones JB, Jackson LE, Balogh B, et al. Bacteriophages for plant disease control[J]. Annu Rev Phytopathol, 2007, 45: 245-262. DOI:10.1146/annurev.phyto.45.062806.094411 |
| [11] |
Levin BR, Bull JJ. Population and evolutionary dynamics of phage therapy[J]. Nat Rev Microbiol, 2004, 2(2): 166-173. DOI:10.1038/nrmicro822 |
| [12] |
韦中.生物有机肥防控土传番茄青枯病的效果及其机制研究[D].南京: 南京农业大学, 2012. Wei Z. Effects and mechanisms of bio-organic fertilizers on suppression of bacterial wilt of tomato[D]. Nanjing : Nanjing Agricultural University, 2012. |
| [13] |
Wei Z, Yang XM, Yin SX, et al. Efficacy of bacillus-fortified organic fertiliser in controlling bacterial wilt of tomato in the field[J]. Applied Soil Ecology, 2011, 48(2): 152-159. DOI:10.1016/j.apsoil.2011.03.013 |
| [14] |
Chen Y, Yan F, Chai YR, et al. Biocontrol of tomato wilt disease by bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation[J]. Environmental Microbiology, 2013, 15(3): 848-864. DOI:10.1111/j.1462-2920.2012.02860.x |
| [15] |
Elphinstone JG, Hennessy J, Wilson JK, et al. Sensitivity of different methods for the detection of Ralstonia solanacearum in potato tuber extracts[J]. EPPO Bulletin, 1996, 26(3-4): 663-678. DOI:10.1111/j.1365-2338.1996.tb01511.x |
| [16] |
Kawasaki T, Narulita E, Matsunami M, et al. Genomic diversity of large-plaque-forming podoviruses infecting the phytopathogen Ralstonia solanacearum[J]. Virology, 2016, 492: 73-81. DOI:10.1016/j.virol.2016.02.011 |
| [17] |
Bernheim A, Sorek R. The pan-immune system of bacteria : Antiviral defence as a community resource[J]. Nature Reviews Microbiology, 2020, 18(2): 113-119. DOI:10.1038/s41579-019-0278-2 |
| [18] |
Jacobssera D, Marinelli LJ, Bowman CA, et al. On the nature of mycobacteriophage diversity and host preference[J]. Virology, 2012, 434(2): 187-201. |
| [19] |
Kimura M, Jia ZJ, Nakayama N, et al. Ecology of viruses in soils : Past, present and future perspectives[J]. Soil Science and Plant Nutrition, 2008, 54(1): 1-32. DOI:10.1111/j.1747-0765.2007.00197.x |
| [20] |
丛聪, 袁玉玉, 渠坤丽, 等. 关于噬菌体实用保藏方法的研究进展[J]. 中国抗生素杂志, 2017, 42(9): 742-748. Cong C, Yuan YY, Qu KL, et al. Research progress on the methods of bacteriophages collection[J]. Chinese Journal of Antibiotics, 2017, 42(9): 742-748. |
| [21] |
Dini C, de Urraza PJ. Effect of buffer systems and disaccharides concentration on podoviridae coliphage stability during freeze drying and storage[J]. Cryobiology, 2013, 66(3): 339-342. DOI:10.1016/j.cryobiol.2013.03.007 |
| [22] |
Lee WJ, Billington C, Hudson J, et al. Isolation and characterization of phages infecting bacillus cereus[J]. Letters in Applied Microbiology, 2011, 52(5): 456-464. DOI:10.1111/j.1472-765X.2011.03023.x |
| [23] |
Wang W. Lyophilization and development of solid protein pharmaceuticals[J]. International Journal of Pharmaceutics, 2000, 203(1-2): 1-60. DOI:10.1016/S0378-5173(00)00423-3 |