2. 天津宏仁堂药业有限公司,天津 300122;
3. 宁夏回药现代化工程技术研究中心 宁夏回医药协同创新中心 回医药现代化教育部重点实验室,银川 750004
2. Tianjin Hongrentang Pharmaceutical Co., Ltd. Tianjin 300122;
3. Ningxia Huifei Modernization Engineering Technology Research Center/Ningxia Hui Medicine Collaborative Innovation Center/Key Laboratory of Medicine Modernization, Ministry of Education, Yinchuan 750004
逆境胁迫是对植物生长发育和生存不利的各种环境因素的总和,主要分为生物胁迫和非生物胁迫。逆境在植物自然生长过程中时常会对其造成损伤,严重时甚至会导致植物死亡[1]。目前化学农药、化肥虽然可以暂时缓解某些逆境胁迫,但长期使用不仅诱发病原菌产生抗药性,而且易伤害非靶标生物,污染环境,严重破坏生态平衡[2]。因此,积极开发微生物菌剂具有重要的理论和实际价值。
微生物菌剂(Microbial agents),通称为生物肥料、菌肥、接种剂,是一类以微生物生命活动及其产物使农作物得到特定肥料效应的微生物活体制品。微生物是土壤最活跃的组成,土壤微生物被称为土壤C、N、S和P等养分元素的“转化器”,环境污染的“净化器” [3]。刘洪光[4]发现盐胁迫条件下接种AM真菌作为生物肥料,具有提高枸杞生长,以及改善枸杞产品品质的潜力。何艳慧[5]研发了一款微胶囊菌剂并发现其对棉花具有解盐、促生效果。武海涛[6]研究发现枯草芽孢杆菌菌液可以有效减缓铅对植物的伤害,从而增强小麦对铅胁迫的适应性。只要条件适合,肥料中的微生物就能够保持其自身旺盛的繁殖力和进行新陈代谢等生命活动,进而进行物质转化和产生有益的代谢物,增加植物养分的供应,促进植物生长,增强植物抗逆性,改善农业生态环境及提高农产品品质[7]。
由于短小芽孢杆菌(Bacillus pumilus)能产生热稳定的内生芽孢,且耐高温、耐酸碱及耐挤压等抗逆能力强,并对多种病原真菌、细菌均有较强的抑制作用,抗菌谱广泛,成为越来越受瞩目的生防研究材料之一[8]。实验室前期从甘草根中分离纯化获得一株优良菌株,经生测实验具有耐盐、酸碱性,对多种病原菌具有拮抗活性[9],经鉴定为短小芽孢杆菌。且经盆栽实验表明该菌可定植于甘草内部,从而缓解干旱胁迫,促进生长[10]。本研究对短小芽孢杆菌进行发酵条件优化实验,获得制备高产新型微生物菌剂的制备工艺,并研究该菌剂对旱盐逆境胁迫下甘草幼苗的发芽、生长情况,考察其对甘草抗氧化系统、渗透调节、碳氮代谢过程的影响,旨为以后植物抵抗逆境胁迫开辟新的途径[11]。
1 材料与方法 1.1 材料 1.1.1 菌种短小芽孢杆菌保藏号为CGMCC No.16879:课题组前期从甘草根中分离、纯化、鉴定所得。
1.1.2 基础培养基(NA培养基)葡萄糖1.5%;牛肉膏0.5%,蛋白胨1.5%;无机盐NaCl 0.5%;水96%,用NaOH或HCl调pH至7-8,121℃高压灭菌20 min。固体培养基向其中加1.6%的琼脂。
1.1.3 种子培养基(牛肉膏蛋白胨培养基)牛肉膏0.3%;蛋白胨1.0%;NaCl 0.5%;其余为水。调pH至7-8,121℃高压灭菌20 min。固体培养基向其中加1.6%的琼脂。
1.1.4 主要试剂葡萄糖、麦芽糖、乳糖、蔗糖、山梨醇、D-聚糖、D-木糖、可溶性蛋白、酵母浸粉、蛋白胨、大豆蛋白胨、牛肉膏、Na2HPO4、KCl、K2HPO4、MgSO4·7H20和KH2PO4等。
1.1.5 仪器设备紫外分光光度计、高温灭菌锅、超净工作台、恒温摇床、恒温培养箱、电子分析天平;培养皿、玻璃棒、试管及试管架、烧杯和锥形瓶等。
1.2 方法 1.2.1 菌种活化将分离得到的短小芽孢杆菌菌株转接到NA固体培养基,37℃恒温培养48 h,备用。
1.2.2 种子液的制备挑取单菌落,接入NA培养基中,置于控温摇床,30℃,170 r/min培养24 h,备用。
1.2.3 菌体生物量测定方法采用比浊法[12]检测菌体量:将发酵液稀释100倍,以未接种培养基作对照稀释100倍后分光光度计275 nm处检测吸光度。
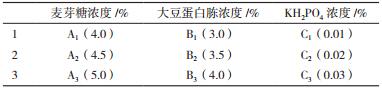
1.2.4 短小芽孢杆菌培养基筛选优化单因素筛选发酵培养基的碳源、氮源、无机盐的种类和浓度碳源种类设为葡萄糖、麦芽糖、乳糖、蔗糖、山梨醇、D-聚糖、D-木糖和可溶性蛋白,浓度为0.5%-5.0%。氮源设为酵母浸粉、蛋白胨、大豆蛋白胨及牛肉膏,浓度为0.5%-5.0%。无机盐为Na2HPO4、KCl、K2HPO4、MgSO4·7H20、KH2PO4、NaCl和NaOH,浓度为0.01%-0.08%。在单因素试验的基础上选用3因素3水平L9(33)正交表(表 1)进行实验,以寻求培养基中各组分的最佳配比。
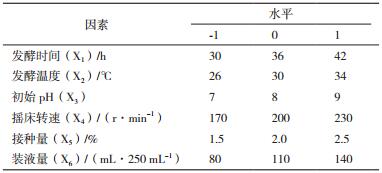
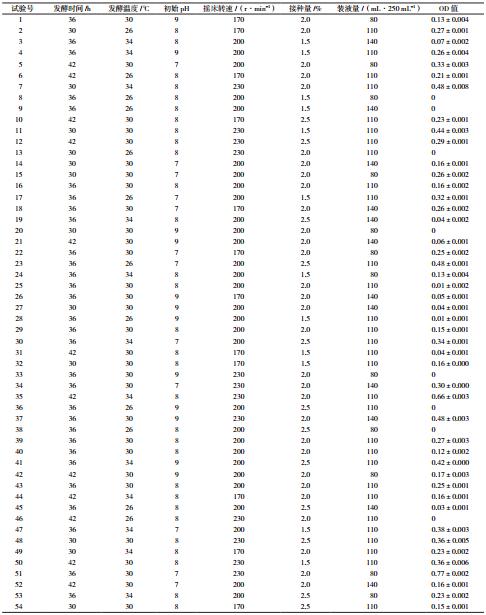
以实验室前期筛选优化所得发酵配方进行接下来的发酵工艺优化实验。探究发酵时间、发酵温度、初始pH、摇床转速、接种量及装液量单因素对短小芽孢杆菌生长的影响。以基础发酵工艺为基础,考察某因素时,固定其他因素。发酵时间从12 h开始考察,每隔6 h取样测定OD275;发酵温度设置为26-42℃;初始pH3-10;摇床转速110 r/min-230 r/min;接种量0.5%-5.0%;装液量50/250-230/250 mL。以单因素试验结果作为中心点,发酵液OD275为响应值,进行RSM设计[13]。每个试验重复3次,取其平均值,试验因素水平及相应的编码见表 2。RSM方法采用“Design-Expert 8.0.6”esignBBD模型,得到6因素3水平共54组的试验设计(表 3)。将实验后的数据进行多元回归拟合,并对回归方程进行方差分析及拟合度检验,讨论模型所在响应面特征,预测最大响应值并验证模型。
经优化后发酵培养基、发酵工艺生产所得发酵液即为短小芽孢杆菌液体菌剂。液体菌剂呈深褐色,有效活菌数为425CFU/mL,pH7-8,存放于4℃冰箱备用。施用方式为稀释50倍,浸种。
1.2.7 甘草水培发芽试验甘草种子收获于2019年,经宁夏医科大学药学院张新慧教授鉴定为甘草(Glycyrrhiza uralensis Fisch.)种子。净种后,将其装入牛皮纸袋置于冰箱冷藏室贮藏。
1.2.7.1 种子预处理本试验精选籽粒饱满、大小均一的甘草种子,先用85%浓H2SO4浸润45 min,不定时搅拌,然后用蒸馏水冲洗3遍,再用0.1%的H2O2消毒10 min,最后用蒸馏水冲洗数次至无黏性,洗净后置于烧杯中,用蒸馏水浸泡6-8 h使种子充分吸水,待用。
1.2.7.2 实验设计采用完全随机设计,盐基采用中性盐NaCl,浓度为100 mmol/L;聚乙二醇(Polyethylene glycol,PEG)6000模拟干旱胁迫,浓度为10%;处理分别为对照(CK)、盐胁迫(S)、干旱胁迫(D)、对照加菌(CK+B)、盐胁迫加菌(S+B)、干旱胁迫加菌(D+B)。选取充分吸水、饱满均一的甘草种子,吸干表面水分,将其均匀摆放在垫有双层无菌滤纸并加入5 mL不同浓度处理溶液的培养皿(9 cm × 9cm × 3 cm)中进行萌发,每皿40粒。实验条件为光照/黑暗(12 / 12 h,28 / 20℃)。每天用称重法加蒸馏水至恒质量以保持恒定的处理液浓度。实验第2天测定发芽数,第6天基本发芽结束,第9天采样,采样过程中测定生长及生理生化指标。
1.2.7.3 生长及生理生化特性测定(1)种子萌发指标测定
发芽率(%)=(发芽种子数/供试种子数)×100%;
发芽势(%)=(规定日期内发芽种子数/供试种子数)×100%;
发芽指数=Σ第几日的发芽数/发芽试验第几日)。
幼苗活力指数=幼苗生长量(长度或重量)×发芽指数。
(2)生长指标测定用直尺测定甘草胚芽、胚根长度,游标卡尺测定胚芽、胚根的粗度等生长指标。
(3)抗逆生理生化指标测定谷胱甘肽(Glutathione,r-glutamyl cysteingl +glycine,GSH)、抗环血酸AsA含量测定采取分光光度法[14]:可溶性蛋白测定采取考马斯亮蓝法,可溶性糖测定采取蒽酮比色法[15];硝酸还原酶(Nitrate reductase,NR)、蔗糖转化酶(Invertase,INV)测定采取比色法[16]。
1.2.8 统计分析采用SPSS 17.0软件进行方差分析和显著性检验,多重比较用Duncan法(P < 0.05),Excel 2003作图,图中的数据均为3次重复的均值±标准误。响应面分析采用Design Expert 8.0.6软件。
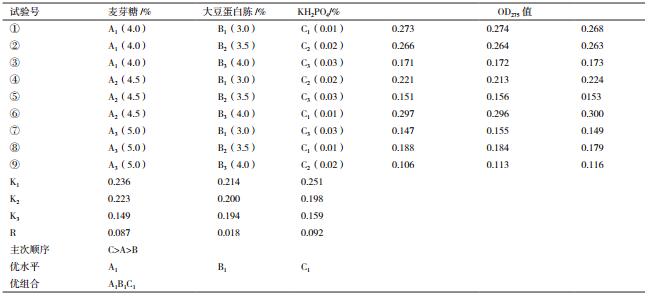
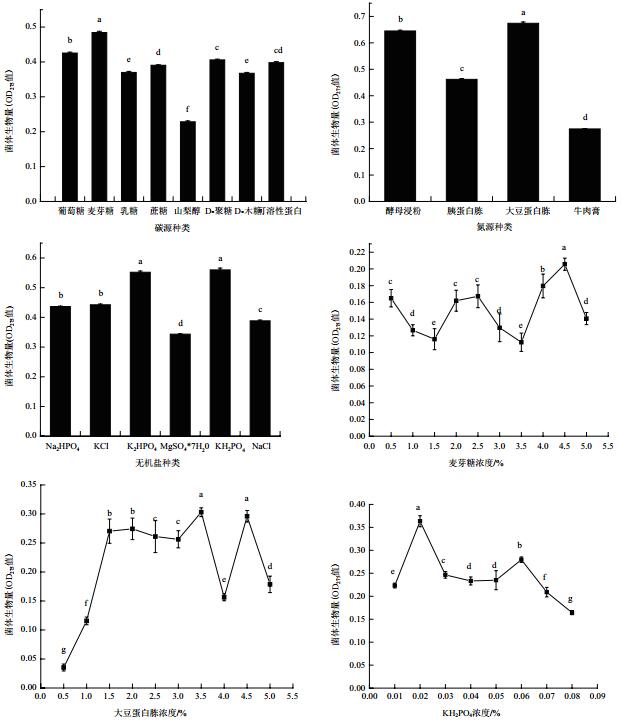
2 结果 2.1 发酵培养基单因素试验结果由图 1可知,适合短小芽孢杆菌生长的最佳碳源是麦芽糖,最佳重量百分比为4.5%;适合短小芽孢杆菌生长的最佳氮源是大豆蛋白胨,最佳重量百分比为3.5%;适合短小芽孢杆菌生长的最佳无机盐是KH2PO4,最佳重量百分比为0.02%。
|
| 不同小写字母代表处理间差异显著P<0.05,下同 图 1 碳源、氮源、无机盐的种类及重量百分比对菌体生物量的影响 |
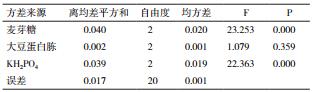
由表 4可知,极差分析结果为:RC>RA>RB,各因素影响菌体生长程度从大到小为KH2PO4>麦芽糖>大豆蛋白胨。最佳组合为A1B1C1,即麦芽4.0%,大豆蛋白胨3.0%,KH2PO40.01%。
由表 5方差分析可得:麦芽糖、KH2PO4对OD275值均有显著影响,而大豆蛋白胨没有显著影响。但其影响的程度有较大差异,这3个因素对菌体生物量OD275值作用的大小依次为:A>C>B,即各因素影响菌体生长程度从大到小为麦芽糖、KH2PO4、大豆蛋白胨。综上可得:极差分析与方差分析结果均显示最佳组合为A1B1C1,即麦芽糖4.0%、大豆蛋白胨3.0%、KH2PO4 0.01%。
短小芽孢杆菌分别在优化后的培养基与优化前的培养基中,即基础培养基采用常规的发酵工艺在250 mL的恒温摇床中发酵,用紫外分光光度法测定OD275值;优化后的培养基较优化前OD275值显著增159.4%
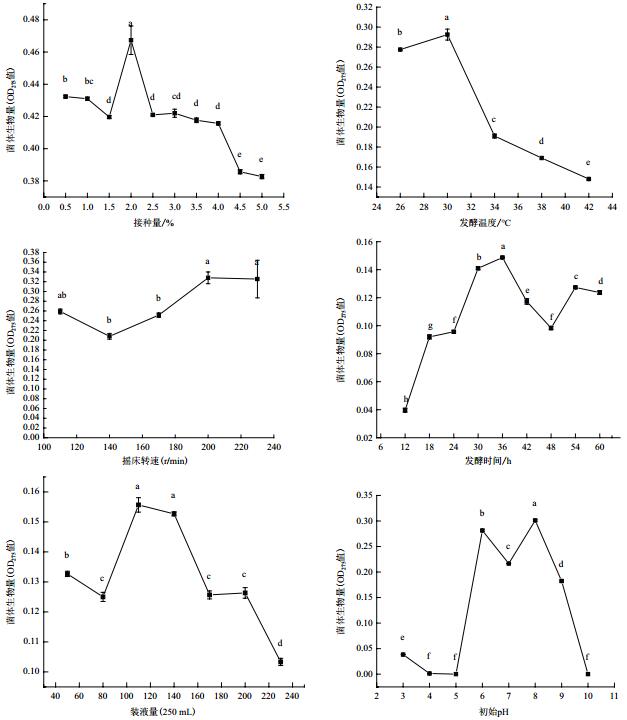
2.4 发酵工艺单因素试验结果由图 2可知,不同的发酵时间、发酵温度、初始pH、摇床转速、接种量和装液量对菌体的生物量有显著影响(P < 0.05)。单因素试验可得:发酵时间36 h,发酵温度30℃,摇床转速200 r/min,接种量2.0%,装液量为110 mL/250 mL,并选择其作为下一步响应面试验的中心试验点。
|
| 图 2 发酵时间、发酵温度、初始pH等6个单因素对菌体生物量的影响 |
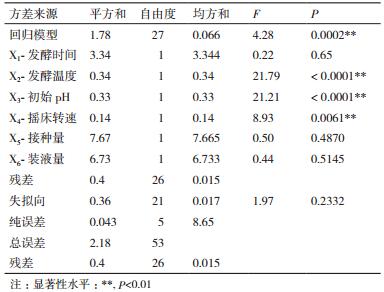
响应面试验设计及结果见表 3。利用Design Expert 8.0软件对表 5数据进行多元回归拟合,获得的响应值菌体生物量(Y)对编码自变量X1、X2、X3、X4、X5和X6的二次多项式回归模型方程为Y=24.81-0.03X1-0.39X2-3.05X3-0.08X4+0.49X5+0.02X6+5.97X1X2+4.96X1X3+7.65X1X4+8.79X1X5-2.24X1X6+0.03X2X3+1.35X2X4-2.28X2X5-2.94X2X6-1.52X3X4-0.03X3X5+2.64X3X6-2.76X4X5+2.46X4X6+1.48X5X6-4.12X12-1.24X22+0.12X32+1.33X42-0.02X52-1.48X62。
2.5.2 回归模型方差分析对上述回归模型进行方差分析,结果见表 6。可以看出,回归模型的P=0.000 2,失拟项的P = 0.233 2,模型回归极显著,失拟检验不显著,说明未知因素对实验结果干扰很小,不需要引入更高次数的项,模型适当。
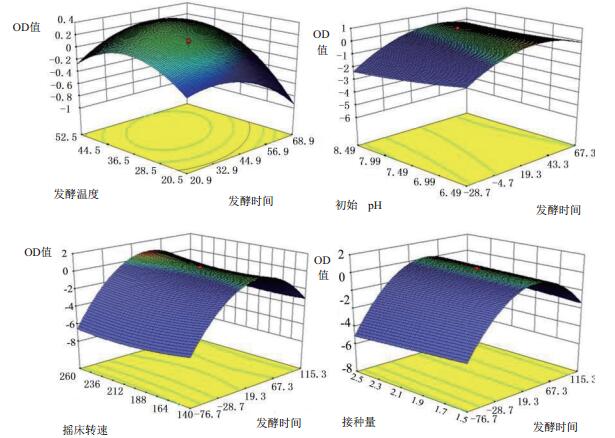
由回归方程所作的响应面立体分析图及其等高线如图 3-4所示,其中X1X2、X1X3、X1X4、X1X5、X2X5、X2X6及X5X6这7组响应面均为开口向下的凸形曲面,且通过方程可知,X1、X2、X3及X4二次项的系数均为负值,其所表征的抛物面开口向下,说明响应值存在极高值。软件所得数据结合实际确定最佳培养条件为:发酵时间为42 h、发酵温度为34℃初始pH为7.00、摇床转速为230 r/min、接种量为2.0%、装液量为100 mL/250 mL。
|
| 图 3 发酵时间与发酵温度、初始pH、接种量、摇床转速的交互作用所得3D响应面 |

|
| 图 4 发酵温度与接种量、装液量的交互作用及接种量与装液量的交互作用所得3D响应面 |
实际值与预测值拟合率达82%,有良好的拟合性,优化模型可靠。同时,优化后的菌体生物量比优化前提高了4.3倍,明显提高了短小芽孢杆菌的生物量。
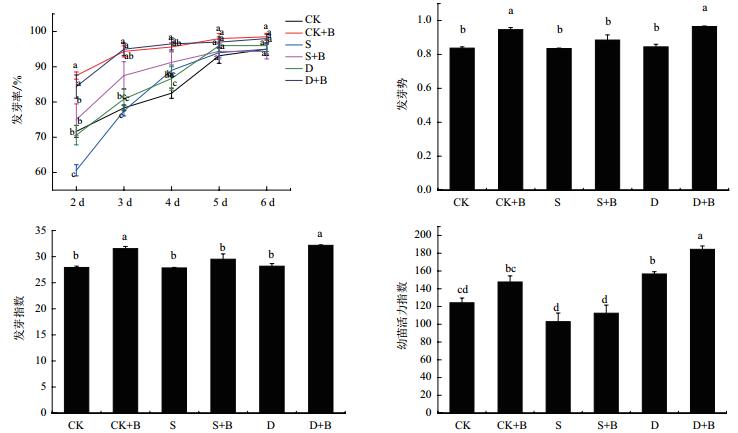
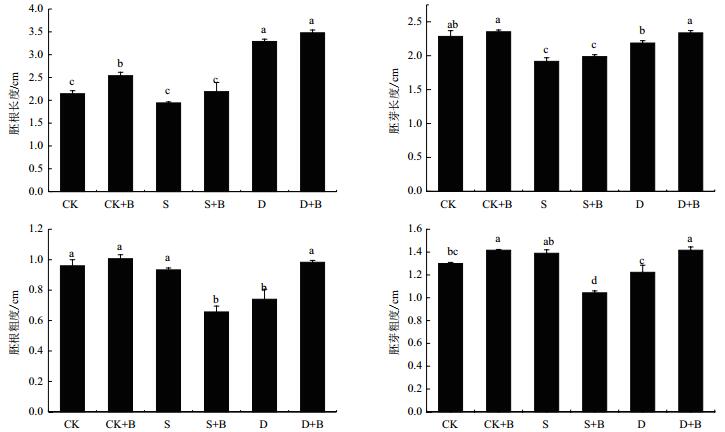
2.7 短小芽孢杆菌菌剂对旱盐胁迫下甘草发芽及生长情况的影响由图 5-6可知,接种微生物菌剂后,甘草幼苗发芽率、发芽势、发芽指数、幼苗活力指数均有不同程度增长。发芽势最高,在干旱胁迫下接种菌剂较干旱胁迫下未接种菌剂甘草的发芽势显著增长14%;发芽指数最高,在干旱胁迫下接种菌剂较干旱胁迫下未接种菌剂甘草的发芽指数显著增长15%;幼苗活力指数最高在干旱胁迫下接种菌剂较干旱胁迫下未接种菌剂显著可增长18%。接种微生物菌剂后,甘草胚根长度、胚根粗度、胚芽长度、胚芽粗度均有不同程度的增长,最高在干旱胁迫下接种菌剂较干旱胁迫下未接种菌剂甘草胚芽长度增长33%。
|
| CK:对照;S:盐胁迫;D:干旱胁迫;CK+B:对照加微生物菌剂;S+B:盐胁迫加微生物菌剂;D+B:干旱胁迫加微生物菌剂。下同 图 5 不同处理甘草幼苗发芽情况的变化 |
|
| 图 6 不同处理甘草幼苗生长指标的变化 |
由图 7可知,甘草抗氧化系统指标中GSH、AsA接种微生物菌剂后,对盐胁迫下的甘草幼苗的影响尤为显著。盐胁迫下接种菌剂甘草幼苗中GSH含量较未接种菌剂显著提高44%,AsA含量较未接种菌剂显著提高64%。

|
| 图 7 不同处理甘草幼苗中甘草抗氧化指标的变化 |
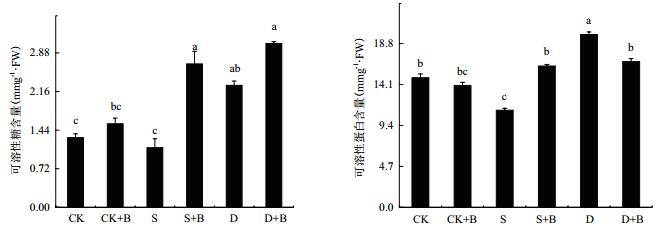
如图 8所示,在接种微生物菌剂后,对甘草渗透调节物质可溶性糖、可溶性蛋白具有显著影响,对盐胁迫下的甘草幼苗的影响尤为显著。盐胁迫下接种菌剂甘草幼苗中可溶性糖含量较未接种菌剂显著提高140%,可溶性蛋白含量较未接种菌剂显著提高45%。
|
| 图 8 不同处理甘草幼苗中渗透调节物质的变化 |
如图 9所示,在接种微生物菌剂后,甘草幼苗碳氮代谢酶NR、INV活性增加,对盐胁迫、干旱胁迫下的甘草幼苗均有显著影响,干旱胁迫下接种菌剂甘草幼苗中NR酶活性较干旱胁迫下不接种菌剂显著增加77%,盐胁迫下接种菌剂INV酶活性较盐胁迫下未接种菌剂显著增加445.5%。

|
| 图 9 不同处理甘草幼苗中碳氮代谢酶活性的变化 |
微生物菌剂的研究开发应用受到生物肥料及农药等研究开发者的普遍重视,产品种类繁多。液体菌剂由于生产周期短、水溶性好、施肥方式简便而广受欢迎,但在研究、生产和应用中也存在不少的问题,其中之一就是发酵液的活菌数量不高,限制了产品的推广使用。本研究将菌剂制备过程中的影响因素主要分为发酵培养基和发酵工艺两大模块进行探讨。王美英等[17]研究发现多粘类芽孢杆菌对麦芽浸粉的利用率最高,可以作为生产芽孢的有效碳源。林戎斌等[18]以细胞生物量为指标筛选优化地衣芽孢杆菌的培养基时发现大豆蛋白胨为其最适氮源。有研究表明,钾离子可提高细菌发酵产物产量,提高其催化及代谢功能,增强抑菌活性[19-20]。吴婷婷[8]以芽孢数量筛选优化短小芽孢杆菌Y11的培养基时发现KH2PO4对其具有显著影响。以上研究与本研究结果一致,采用优化后发酵培养基菌体生物量提高了将1.59倍。本研究发现,短小芽孢杆菌在12 h-18 h快速生长,36 h时短小芽孢杆菌的生物量达到最大值。当菌体的发酵温度升高达到30℃时,菌体生物量达到峰值。这与尹萌萌等[21]研究发现短小芽孢杆菌产蛋白酶、菌体生长的最适培养温度为28℃基本一致。本研究发现当发酵pH6.0菌体生物量达到第一个峰值,当发酵pH值为8.0时达到第二个峰值,此时为菌体生物量的最大值,这可能与菌体自身的某些生物学特性有关,呈现明显的嗜弱酸、弱碱性[22]。在本研究中,短小芽孢杆菌在其他水平接种量时菌体生物量并无明显升高及降低,但在接种量为2.0%时菌体的生物量明显升高,有大量研究发现,接种量2.0%时菌体生长最好,与本研究结果一致[23]。液体发酵过程中氧浓度对菌体生长影响显著,最直接的体现在摇瓶的装液量,本研究发现,装液量在110 mL/250 mL-140 mL/250 mL时,短小芽孢杆菌生物量较高,这可能与芽孢杆菌为严格需氧与兼性厌氧菌种的生物特性有关[24]。
3.2 菌剂对旱盐胁迫下甘草生长及发芽情况的影响内生菌作为一种促进植物生长发育、增强宿主抗逆性的天然资源,对盐胁迫下植物的生长具有显著促进作用。如庞发虎等[25]研究发现内生细菌可以促进小麦的生长;傅蕾[26]研究发现象草内生菌能够有效缓解中、低盐浓度胁迫对杂交狼尾草种子萌发的毒害作用,对种子的发芽率、发芽指数、胚芽长度都有显著的增益和改善作用。在本研究中,旱盐胁迫下接种短小芽孢杆菌菌剂后,甘草生长指标有不同程度的增长;甘草幼苗发芽率、发芽势、发芽指数、幼苗活力指数均有不同程度增长。
3.3 菌剂对旱盐胁迫下甘草抗氧化系统的影响植物受到环境胁迫时,首先通过自身系统的特异保护机制来减轻环境对自身的伤害作用,即促进抗氧化酶类的活性及非酶抗氧化剂(GSH、ASA)的含量。本研究结果表明,接种短小芽孢杆菌菌剂可显著提高盐胁迫下甘草中GSH、AsA含量。已有大量研究表明,接种内生菌可以提高大豆、小麦、番茄、玉米等作物的抗氧化酶活性,增强作物清除活性氧的能力,使作物抗盐性增强,促进植物的生长发育[27]。张诗婉[28]研究发现接种植物内生菌可以增强GSH-AsA循环中相关物质的活性,缓解逆境胁迫对水稻的伤害。
3.4 菌剂对旱盐胁迫下甘草渗透调节物质的影响渗透调节是植物抵御逆境的一种重要方式,也是植物在逆境胁迫下诱导保护性应答的一种重要生理机制。可溶性蛋白、可溶性糖是植物重要的渗透调节物质,它的升高会提高幼苗对胁迫的耐受能力。研究表明,植物的渗透调节能力与抗逆效果存在相关性,抗逆效果强的植物其渗透调节能力也相对较强。周红艳等[29]研究表明,喷施EM菌剂可促进重金属铅胁迫下沟叶结缕草生长,显著提高可溶性糖含量、可溶性蛋白等渗透调节物质的积累,增强抗性。而本研究中,接种短小芽孢杆菌菌剂后,旱盐胁迫下甘草幼苗中可溶性糖显著增加;可溶性蛋白在盐胁迫下显著增加,在干旱胁迫下反而呈下降趋势。
3.5 菌剂对旱盐胁迫下甘草碳氮代谢过程中酶活性的影响碳氮代谢是植物体内基本代谢途径,直接或间接影响着植物产量及其品质的形成。研究表明硝酸还原酶活性强弱与植物氮代谢强弱呈正相关,其活性强,氮代谢旺盛,植物生长旺盛;蔗糖转化酶与植物的生长有密切关系,是衡量同化产物的转化和利用、植物细胞代谢及生长强度的指标[30]。本研究发现短小芽孢杆菌菌剂可显著提高干旱胁迫下甘草硝酸还原酶、蔗糖转化酶活性,显著提高盐胁迫下蔗糖转化酶的活性,对硝酸还原酶的影响不大。
综上所述,制备所得短小芽孢杆菌菌剂通过提高抗氧化物质含量、渗透调节物质含量以及调节碳氮代谢过程的酶活性,提高甘草的抗旱耐盐性,进而促进生长。研究结果为干旱地区、盐碱地区土壤改良和生态修复提供了基础数据和技术支持。
4 结论单因素结合正交试验得到最佳发酵培养基为:麦芽糖4.0%,大豆蛋白胨3.0%,KH2PO4 0.01%,其余为水。单因素结合响应面优化得到最佳发酵工艺为:发酵时间42 h、发酵温度34℃、初始pH 7.00、摇床转速230 r/min、接种量2.0%、装液量100 mL/250 mL。最佳发酵培养基、发酵工艺下生产短小芽孢杆菌获得的液体菌剂:有效活菌数425×108CFU/mL,pH为7-8,颜色为深褐色,有特殊气味。
菌剂施用于甘草,可提高抗氧化物质、渗透调节物质含量及调节碳氮代谢酶活性,提高甘草的抗旱耐盐性,进而促进其生长。
| [1] |
张文晋, 解植彩, 郎多勇, 等. 硅对旱盐双重胁迫下甘草种子萌发和幼苗生长的影响[J]. 时珍国医国药, 2017, 28(4): 209-212. Zhang WJ, Xie ZC, Lang DY, et al. Effects of silicon on seed germination and seedling growth of Glycyrrhiza uralensis under drought and salt stress[J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(4): 971-974. |
| [2] |
王险峰. 农业有害生物抗药性综合治理[J]. 北方水稻, 2018, 48(2): 40-46. Wang XF. Comprehensive approach on the drug resistance of agricultural pest[J]. Northern Rice, 2018, 48(2): 40-46. |
| [3] |
宋长青, 等. 中国土壤微生物学研究10年回顾[J]. 地球科学进展, 2013, 10(10): 1087-1105. Song CQ, et al. Advances of soil microbiology in the last decade in China[J]. Progress in Earth Sciences, 2013, 10(10): 1087-1105. |
| [4] |
刘洪光. AM真菌提高枸杞耐盐性的机制研究[D].杨凌: 西北农林科技大学, 2016. Liu HG. Mechanism of AM fungi improving salt tolerance of Lyciumbarbarum[D]. Yangling : Northwest A & F University, 2016. |
| [5] |
何艳慧.微胶囊化解盐促生菌株SRPG-396与棉花互作特性研究[D].石河子: 石河子大学, 2016. He YH. Study on the interaction characteristics of microencapsulated salt-resolving and growth-promoting strain SRPG-396 and cotton[D]. Shihezi : Shihezi University, 2016. |
| [6] |
武海涛. Bacillus subtilis QM3对铅胁迫下小麦叶片的缓解作用[D].临汾: 山西师范大学, 2016. Wu HT. Alleviating effects of Bacillus subtilis QM3 on wheat leaves under lead stress use[D]. Linfen : Shanxi Normal University, 2016. |
| [7] |
苏群, 孙磊, 马翠华, 等. 液体复合微生物肥料研制及其促生效果研究[J]. 农业与技术, 2019, 39(11): 1-3. Su Q, Sun L, Ma CH, et al. Development of liquid compound microbial fertilizer and its growth promotion effect[J]. Agriculture and Technology, 2019, 39(11): 1-3. |
| [8] |
吴婷婷.短小芽孢杆菌产孢培养技术的研究[D].武汉: 华中农业大学, 2013. Wu TT. Research on spore-producing culture technology of Bacillus pumilus[D]. Wuhan : Huazhong Agricultural University, 2013. |
| [9] |
郎多勇, 等. 宁夏产甘草内生细菌分离纯化、拮抗植物病原菌菌株的筛选及鉴定[J]. 时珍国医国药, 2017, 28(9): 2226-2228. Lang DY, et al. Isolation and purification of endophytic bacteria from licorice in Ningxia, screening and identification of antagonistic strains of plant pathogens[J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(9): 2226-2228. |
| [10] |
Xie Z, Chu Y, Zhang W, et al. Bacillus pumilus alleviates drought stress and increases metabolite accumulation in Glycyrrhiza uralensis Fisch[J]. Environ Exp Bot, 2019, 158: 99-106. DOI:10.1016/j.envexpbot.2018.11.021 |
| [11] |
臧远义, 张品文, 王连军. 微生物菌剂在番茄应用效果研究[J]. 现代农业研究, 2019(9):53-54. Zang YY, Zhang PW, et al. Study on the effect of microbial agent on tomato[J]. Modern Agricultural Res, 2019(9):53-54. |
| [12] |
徐世友, 等. 分光光度法测定W135群脑膜炎奈瑟菌生物量[J]. 中国生物制品学杂志, 2017, 30(12): 1326-1330. Xu SY, et al. Determination of bacterial biomass of serogroup W135 Neissria meningitidis by spectrophotometry[J]. Chinese J Biologicals, 2017, 30(12): 1326-1330. |
| [13] |
Hitit ZY, et al. Hydrogen production by co-cultures of Clostridium butyricum and Rhodospeudomonas palustris :Optimization of yield using response surface methodology[J]. Int J Hydrogen Energy, 2017, 42(10): 6578-6589. DOI:10.1016/j.ijhydene.2016.12.122 |
| [14] |
李芳晓.黑穗醋栗(Ribes nigium L.)叶片抗坏血酸多样性及与果实的关系研究[D].哈尔滨: 东北农业大学, 2014. Li FX. Black currant(Ribes nigium L.)leaf ascorbic acid diversity and its relationship with fruit[D]. Harbin : Northeast Agricultural University, 2014. |
| [15] |
李红霞. 根外追肥对紫丁香叶片几种渗透调节物质含量的影响[J]. 江苏林业科技, 2019, 46(3): 6-9. Li HX. Effect of topdressing on osmotic substance contentof Syringa oblata Lindl[J]. Jiangsu Forestry Science and Technology, 2019, 46(3): 6-9, 13. |
| [16] |
位辉琴, 等. 不同覆膜处理对烤烟生长及蔗糖转化酶、硝酸还原酶活性的影响[J]. 河南农业大学学报, 2006(1):18-21. Wei HQ, Yang XY, Liu GS, et al. Effects of different mulching treatment upon invertase and nitrate reductase of flue-cured tobacco[J]. J Henan Agricultural Univ, 2006(1):18-21. |
| [17] |
王美英, 王芳, 韩金志, 等. Paenibacillus polymyxa JSa-9发酵培养基优化及其在黄瓜枯萎病中的应用研究[J]. 南京农业大学学报, 2016, 39(4): 673-680. Wang MY, Wang F, Han JZ, et al. Optimization of fermentation medium and application in cucumber Fusarium wilt of Paenibacillus polym JSa-9[J]. Journal of Nanjing AgriculturalUniversity, 2016, 39(4): 673-680. |
| [18] |
林戎斌, 谢迺鸿, 张慧, 等.地衣芽孢杆菌CHB6液体高密度发酵条件优化[C]第四届全国微生物资源学术暨国家微生物资源平台运行服务研讨会论文集, 2012. Lin RB, et al. Optimization of liquid high-density fermentation conditions for Bacillus licheniformis CHB6[C]Proceedings of the 4th National Microbial Resources Academic and National Microbial Resources Platform Operation Service Symposium, 2012. |
| [19] |
陈秀珠, 何松. 乳链菌肽高产菌株AL2的发酵条件研究[J]. 微生物学通报, 1995, 22(4): 215-218. Chen XZ, He S. Study on fermentation conditions of nisin highproducing strain AL2[J]. Microbiology China, 1995, 22(4): 215-218. |
| [20] |
田宇, 洪芳, 胡承, 等. 类细菌素产生菌HF08的选育及其发酵条件的研究[J]. 食品与发酵工业, 2004, 30(3): 56-60. Tian Y, Hong F, Hu C, et al. Selection of an bacteriocinlike substance producing strain and study onits fermentation conditions[J]. Food Ferment Ind, 2004, 30(3): 56-60. |
| [21] |
尹萌萌, 贺婷停, 王超, 等. 响应面法优化短小芽孢杆菌SCU11发酵产碱性蛋白酶及关键基因转录调控分析[J]. 应用与环境生物学报, 2016, 22(3): 371-376. Yin MM, He TT, Wang C, et al. Optimization of alkaline protease production by Bacillus pumilus SCU11 fermentation and transcriptional regulation analysis of key genes by response surface methodology[J]. J Appl Environ Biol, 2016, 22(3): 371-376. |
| [22] |
叶姜瑜, 张将, 钟以蓉. 响应曲面法优化溶藻细菌发酵条件的研究[J]. 安徽农业科学, 2011, 39(23): 14256-14259. Ye JY, Zhang J, Zhong YR. Optimization of fermentation condition of algicidal bacteria using response surface methodology[J]. Anhui Agricultural Sciences, 2011, 39(23): 14256-14259. |
| [23] |
李驰, 等. 海洋细菌Vibrio fluvialis的分离鉴定和产琼胶酶条件优化及酶的分离纯化[J]. 食品与发酵工业, 2020(7): 35-42. Li C, et al. Isolation and identification of agarose producing Vibrio fluvialis for agarase preparation and purification[J]. Food Ferment Ind, 2020(7): 35-42. |
| [24] |
刘国红, 刘波, 林乃铨, 林营志. 芽孢杆菌的系统进化及其属分类学特征[J]. 福建农业学报, 2008, 23(4):436-449. Liu GH, Liu B, Lin NQ, et al. Phyletic evolution and taxonomic characteristics of Bacillus[J]. Fujian Journal of Agricultural Sciences, 2008, 23(4):436-449. |
| [25] |
庞发虎, 杜瑞卿, 王坦, 等. 小麦内生细菌促生菌株的筛选及其影响小麦生长的因子的相关性分析[J]. 中国农业大学学报, 2016, 21(1): 8-21. Pang FH, Du RQ, Wang T, et al. Screening of wheat growthpromoting entophytic bacteriai strains and correlation analysis of factors influencing wheat growth[J]. Journal of China Agricultural University, 2016, 21(1): 8-21. |
| [26] |
傅蕾.植物内生菌Pantoea sp. PP04促进杂交狼尾草生长及提高其耐盐能力的作用机制研究[D].镇江: 江苏大学, 2017. Fu L. Plant endophyte Pantoea sp. PP04 promotes the growth of hybrid Pennisetum and improves its salt tolerance[D].Zhenjiang : Jiangsu University, 2017. |
| [27] |
郑元元, 等. 盐胁迫下解盐促生细菌Rs-5和Rs-198促进棉花种子发芽的机理探讨[J]. 中国农业科学, 2008(5): 1326-1332. Zheng YY, et al. Physiochemical characters and ability to promote cotton germinaton of bacteria strains Rs-5 and Rs-198 under salt stress[J]. China Agricultural Sciences, 2008(5): 1326-1332. |
| [28] |
张诗婉.植物内生真菌高Y1-1对镉胁迫下水稻幼苗生长缓解作用的研究[D].沈阳: 沈阳师范大学, 2016. Zhang SW. Research on the alleviating effect of plant endophytic fungus Gao Y1-1 on rice seedling growth under cadmium stress[D]. Shenyang : Shenyang Normal University, 2016. |
| [29] |
周红艳, 朱瑛, 陈晓波, 等. EM菌剂对重金属铅胁迫下沟叶结缕草生长和渗透调节物质的影响[J]. 辽宁农业科学, 2016(6): 5-8. Zhou HY, Zhu Y, Chen XB, et al. Effects of EM microbial agents on the growth and osmotic adjustment substances of Zoysia matrella under heavy metal lead stress[J]. Liaoning Agricultural Sciences, 2016(6): 5-8. |
| [30] |
李洪臣, 杨志晓, 武云杰, 等. 氮肥用量和施用方式对烟草中部叶碳氮代谢的影响[J]. 江苏农业科学, 2013(3): 65-68. Li HC, Yang ZX, Wu YJ, et al. Effects of nitrogen fertilizer rates and application methods on carbon and nitrogen metabolism in central tobacco leaves[J]. Jiangsu Agricultural Sciences, 2013(3): 65-68. |