植物根际是植物与土壤生态系统进行物质交换的主要场所[1]。1904年,德国微生物学家Lorenz Hiltner首次提出了根际这一概念[2],他将根际定义为根系周围、受根系生长影响的土体。根际微生物作为该土体的一种特殊生物群体,与植物根系相互作用形成了“植物-微生物-土壤”这一根系微生态系统[3-6]。根际微生物参与了植物根系与土壤环境的物质能量代谢,并影响了根际土壤的理化性质和植物根系的发育与生长,进而影响了植物类药材的品质[7-9]。因此,探讨不同生态环境下两面针植物根际土壤酸度、有机质含量、土壤机械组成、真菌的物种多样性的差异以及环境因子对真菌菌群结构间的影响作用,对开展两面针药材种植有重要意义。
本研究以中国传统中药两面针药材原植物为研究对象,研究不同产地两面针植物根际土壤真菌种群多样性的差异,并分析土壤酸碱度、有机质含量,土壤机械组成等环境因子与其相关性,旨为两面针药材在不同地域的生长发育差异和种植研究提供参考依据。
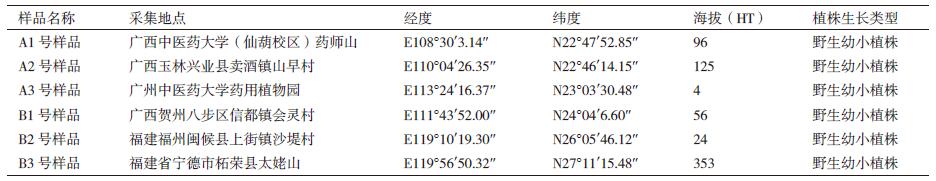
1 材料与方法 1.1 材料本研究在2019年4-5月间分别从广西南宁、广西玉林、广东广州、广西贺州、福建福州、福建宁德等地采集植株大小相近、长势良好的野生幼小两面针Zanthoxylum nitidum(Roxb.)DC.植物根际土壤。土壤采集方法以田间根际土壤样品采集方法[10]为基础,结合实际研究情况进行了改良,即采集植物根系周围半径≤ 5 mm,深度≤ 30 cm范围内的土壤,除去杂质,混合均匀后作为研究样品,放入冰袋内,运回实验室保存至4℃冰箱备用。每份土壤样品分成2份,1份用于DNA提取和测序,另一份用于土壤PH、有机质含量和土壤质地检测(表 1)。
土壤样品PH的测定依据中国农业行业标准(NY/T 1377-2007)中土壤PH的测定方法进行测定。土壤有机质含量测定依据中国农业行业标准(NY/T 1121.6-2006)中土壤检测第6部分:土壤有机质的测定方法进行测定。土壤质地测定依据中国林业行业标准(LY/T 1225-1999)中森林土壤颗粒组成(机械组成)测定方法的吸管法进行机械组成测定并确定土壤质地名称。
1.2.2 土壤样品基因组DNA提取参照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit的试剂盒使用说明书进行土壤样品DNA的提取。将提取的基因组DNA在琼脂糖凝胶上检测其完整性和浓度。利用Qubit2.0 DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应应加入的DNA量。
1.2.3 土壤样品真菌ITS1-ITS2区域测序及多样性分析选择真菌核糖体内转录间隔区(ITS)的ITS1-ITS2区域作为扩增区域。利用Illumina Miseq双端测序(2×300 bp)法测序。PCR所用的引物融合了测序平台的ITS1-ITS2通用引物。ITS1F引物为5'-CTTGGTCATTTAGAGGAAGTAA-3';ITS2R引物为5'-GCTGCGTTCTTCATCGATGC-3'。Miseq测序获得数据后首先去除引物接头序列,在根据PE reads之间的overlap关系,将成对的reads拼接(Merge)成一条序列,然后按照barcode标签序列识别并区分样品,得到各样本数据,对其进行质控过滤,再利用Usearch去除非特异性扩增序列和嵌合体序列,得到各样本最终有效数据。对获得的各样品有效数据进行操作单元分类(Operational Taxonomic Units,OTU),并在此基础之上进行聚类分析、物种多样性和物种分类分析。样品宏基因组测序及数据处理委托生工生物工程(上海)股份有限公司完成。
1.2.4 真菌多样性与土壤环境因子的相关性分析基于97%相似性水平的样品OTU分类,进行去趋势对应分析(Detrended Correspondence Analysis,DCA),确定开展环境因子、土壤样品、真菌菌群结构三者间相关性研究的分析模型即冗余分析(Redundancy analysis,RDA)或典范对应分析(Canonical correspondence analysis,CCA)分析,进而进行三者的相互关系研究[11]。
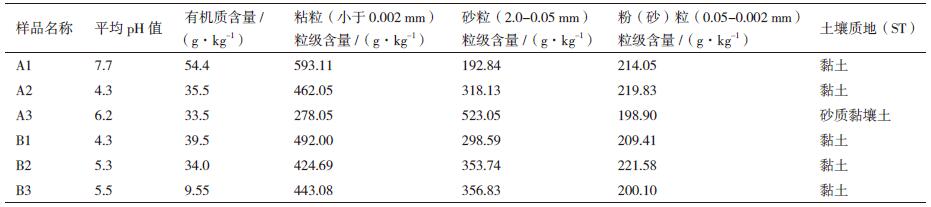
2 结果 2.1 土壤样品pH、有机质含量和土壤质地检测结果6个产地两面针根际土壤样品的测定结果如表 2所示。从表 2可知,6个产地土壤样品除A1样品pH=7.7,显中性外,其余5个样品pH均小于7,显酸性。按pH从大到小排列,6个样品的pH排序为A1 > A3 > B3 > B2 > A2=B1。有机质含量以A1样品最高,B3样品最低。粘粒粒级含量A1最高,A3最低。砂粒粒级含量A3最高,A1最低。粉(砂)粒粒级含量B2最高,A3最低。6个样品中除A3样品为砂质黏壤土外,其余5个样品土壤质地均为黏土。
对6个产地两面针植物根际土壤样品进行高通量测序,利用Usearch软件(Version5.2.236)和Uchime软件(Version4.2.40)及数据库BLASTN比对,对测序数据进行质控,剔除非扩增序列、细胞器组织序列、嵌合体(Chimera)及靶区域外序列后得到各产地样品的有效reads数目,A1样品78 040条、A2样品79 006条、A3样品97 001条、B1样品57 426条、B2样品65 988条、B3样品31 417条。
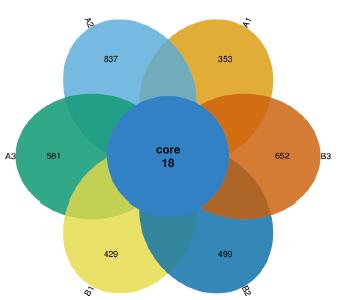
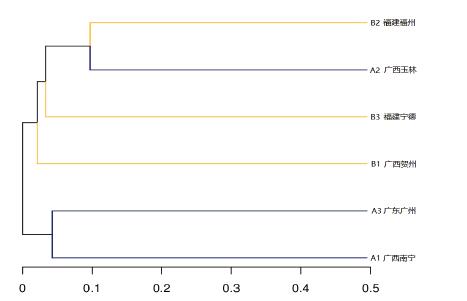
2.3 OTU分析结果利用Usearch软件(Version :5.2.236),在相似性≧ 97%的水平上对各样品的有效序列进行OTU聚类,筛选出OTUs的代表性序列,并利用R制作韦恩图(图 1)。6个土壤样品分别检测到的OTU单元数为620个(A1)、1 555个(A2)、933个(A3)、971个(B1)、1 106个(B2)、1 060个(B3)。从图 1可知,6个样品所含OTU数目均由特异OTU数目和共有OTU数目组成,重叠区包含18个共有OTU数目。各样品所含特异OTU数目以A2最多,A1最少。稀释性曲线(Rarefaction Curve)显示各样品测序数据量合理。基于6个样品的OTU丰度,使用非加权组平均法(UPGMA)构建样本聚类树图,A1和A3可聚为一类,B2和A2可聚为一类,如图 2所示。A1和A3的相似度高于B2和A2。
|
| 图 1 6个土壤样品的OTU韦恩图 |
|
| 图 2 基于OTU的6个样本聚类树图 |
本研究6个样品的Alpha多样性分析中Chao1指数和ACE指数反映样品群落丰富度(Community richness);Shannon指数和Simpson指数反映样品群落多样性(Community diversity)。覆盖度Coverage均大于99%,说明测序结果能够代表样品的真实情况。6个土壤样品中Chao1指数的大小顺序为A2(1651.24) > B2(1225.25) > B1(1046.63) > B3(1066.68) > A3(956.25) > A1(631.51);ACE指数的大小顺序为A2(1701.71) > B2(1273.95) > B3(1072.21) > B1(1078.92) > A3 (960.36) > A1(642.53);两者反映土壤真菌丰度趋势相同,A2样品最高,B2次之,A1最低。6个土壤样品的Shannon指数分别为:A1样品3.302695、A2样品4.395274、A3样品4.943063、B1样品3.306774、B2样品4.09175、B3样品5.577571;Simpson指数分别为:A1样品0.118144、A2样品0.050758、A3样品0.015423、B1样品0.116719、B2样品0.054879、B3样品0.011545。
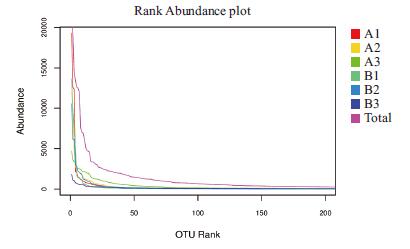
2.4.2 Rank-abundance曲线分析Rank-abundance曲线在横轴上越宽,表示物种的组成越丰富;曲线形状越平坦,表示物种组成的均匀程度越高。从图 3可以看出,6个土壤样品的横坐标长度均一致,均比较平坦,说明6个土壤样品的物种组成都比较丰富,物种组成的均匀程度也较高。
|
| 图 3 不同土壤样品的Rank-abundance曲线 |
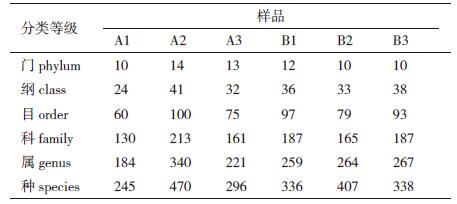
利用blastn将OTU序列与对应数据库进行比对,筛选出OTU序列的最佳比对结果,并对比对结果进行过滤,默认满足相似度 > 90%且coverage > 90%的序列被用来后续分类,不满足条件的序列则被归为unclassified。6个土壤样品在各个层级上的物种分类结果见表 3。A2样品在各个层级上的物种分类最多,A1样品的物种分类最少。
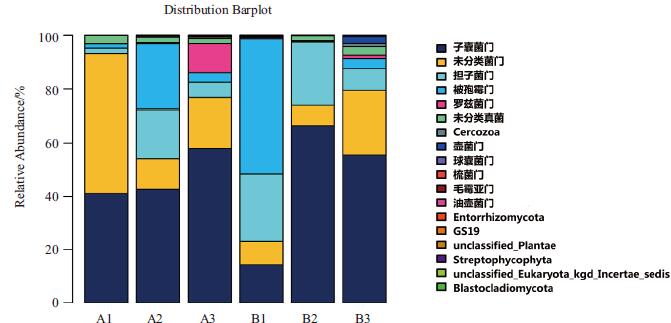
根据物种分类结果,使用统计学方法进行土壤菌群结构分析,并利用R制作物种菌落结构组分图,观测各样品菌落结构。在门分类水平上,6个土壤样品真菌群落组成见图 4。研究发现,6个土壤样品的真菌主要分属子囊菌门Ascomycota、担子菌门Basidiomycota、被孢霉门Mortierellomycota、罗兹菌门Rozellomycota、壶菌门Chytridiomycota、球囊菌门Glomeromy-cota、unclassified、unclassified_ Fungi等8个门类,各样品间存在明显差异。A1样品中子囊菌门Ascomycota和unclassified占比较高,分别为41.02%和52.17,为其优势菌门。A2样品中子囊菌门Ascomycota、担子菌门Basidiomycota、unclassified、和被孢霉门Mortierellomycota占比较高,分别为42.66%、18.4%、11.47%和24.38%,为其优势菌门。A3样品中子囊菌门Ascomycota、unclassified和罗兹菌门Rozellomycota占比较高,分别为57.96%、18.79%和10.86%,为其优势菌门。B1样品中罗兹菌门Rozellomycota、担子菌门Basidiomycota和子囊菌门Ascomycota占比较高,分别为50.19%、25.31%和14.31%,为其优势菌门。B2样品中子囊菌门Ascomycota和担子菌门Basidiomycota占比较高,分别为66.49%和23.63%,为其优势菌门。B3样品中子囊菌门Ascomycota和unclassified占比较高,分别为55.58%和23.83%,为其优势菌门。
|
| 图 4 phylum水平所有样本群落结构分布图 |
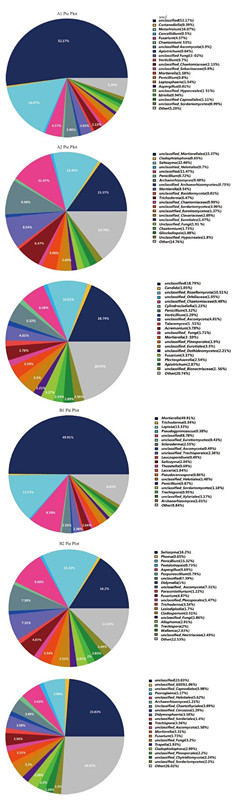
在属分类水平上,本研究对6个土壤样品的菌落组成进行了研究。并对样品物种分类中丰度占比最高的前50个物种分类的分布情况进行大小排序,剩余物种的分类合并成other。从图 5可看出,A1样品相对丰度排名前5的菌属分别为未分类菌属unclassified 52.17%、绿僵菌属Metarhizium 16.07%、其他菌属other 5.29%、镰刀菌属Fusarium 4.57%、子囊菌门未分类菌属unclassified_Ascomycota 3.9%。A2样品为为分类的被孢霉目未分类菌属unclassified_Mortierellales 15.37%、其他菌属other 14.76%、Saitozyma 12.46%、未分类菌属unclassified 11.47%、Archaeorhizomyces 9.48%。A3样品为其他菌属other 20.74%、未分类菌属unclassified 18.79%、unclassified_Rozellomycota 10.51%、毛壳科未分类菌属unclassified_Chaetomiaceae 6.48%。B1样品为被孢霉属Mortierella 49.91%、环柄菇属Lepiota 13.33%、其他菌属other 8.84%、未分类菌属unclassified 8.78%、硬皮马勃属Scleroderma 2.55%。B2样品为Saitozyma 16.2%、青霉菌Penicillium 15.32%、其他菌属other 12.53%、曲霉属Aspergillus 9.69%、未分类菌属unclassified 7.39%。B3样品为其他菌属other 26.02%、未分类菌属unclassified 23.83%、煤炱目未分类菌属unclassified_Capnodiales 5.98%、柔膜菌目未分类菌属unclassified_Helotiales 5.62%、刺盾炱目未分类菌属unclassified_Chaetothyriales 3.89%。
|
| 图 5 genus水平所有样本群落结构分布图 |
热图中每一列代表一个样本,行代表群落结构,菌落分布丰度值可通过颜色深浅来反映变化情况,从而直观反映种水平上群落分布组成的异同。为了展示效果,只显示丰度最高的前50个物种分类信息,剩余的物种分类合并成other。以种分类水平为例,图 6为6个样品在种水平的物种丰度热图,颜色块代表相对物种丰度值,颜色越红表示相对丰度越高,颜色越蓝反之。与此同时,热图对样本做了聚类,样本菌群分布越类似则样本距离越近,聚类树中的位置越靠近。从图 5可以看出,除未分类种(unclassified)和其他菌种other 外,只有子囊菌门菌种Ascomycota_sp和真菌Fungi_sp两个真菌菌种均具有较高丰度。而其他真菌只在部分样品中表现出较高丰度,如Saitozyma_podzolica、长穗被孢霉菌Mortierella_elongata、镰刀霉菌Fusarium_sp、假球壳目菌Pleosporales_sp、粗糙孔菌属Trechispora_sp等。在差异性方面,6个样品真菌菌种丰度整体差异较大,在个别菌种丰度上也呈现出特有性。A1样品中金龟子绿僵菌Metarhizium_anisopliae真菌的丰度明显高于其他样品。A2样品中被孢霉属 Mortierellales_ sp、库氏被孢霉Mortierella_kuhlmanii、珊瑚菌科Clavariaceae_sp、曲线颈槽蛇菌Gliocladiopsis_curvata真菌的丰度明显高于其他样品。A3样品中生赤壳菌科菌Bionectriaceae_sp、座囊菌纲菌Dothideomycetes_ sp、唐菖蒲青霉Penicillium_gladioli、尼泊尔枝顶孢Acremonium_nepalense、孔氏青霉菌Penicillium_ kongii、癣囊腔菌Plectosphaerella_cucumerina真菌的丰度明显高于其他样品。B1样品中火焰环柄菇属Lepiota_flammeotincta、类变形被孢霉Mortierella_ amoeboidea、Trechisporales_sp真菌的丰度明显高于其他样品。B2样品中Allophoma_tropica、热带节担菌属Wallemia_tropicalis真菌的丰度明显高于其他样品。B3样品中分支裂孔菌Cladophialophora_sp、煤炱目Capnodiales_sp真菌的丰度明显高于其他样品。
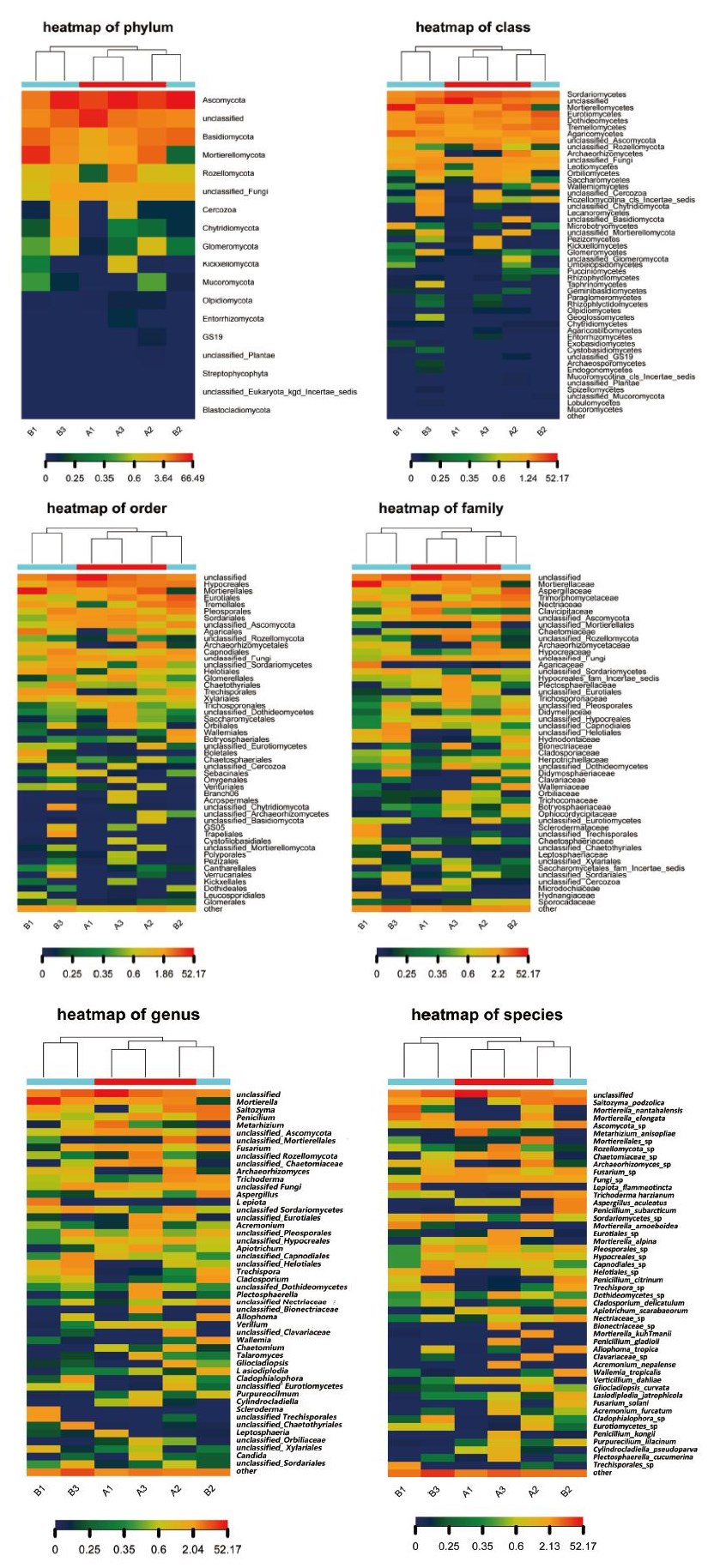
|
| 图 6 6个样品在门、纲、目、科、属、种的物种丰度热图 |
本研究将6个土壤样品的酸碱度(PH)、有机质(ORM)、海拔(HT)、土壤粘粒(CP)、土壤砂粒(SP)、土壤粉(砂)粒(SSG)等因子作为环境因子,结合样品OUT聚类结果进行RDA分析,其结果如图 7所示。从图中各环境因子箭头与样品中心连线的夹角可以看出,A1样品与酸碱度(PH)、有机质(ORM)、土壤粘粒(CP)夹角为锐角,呈正相关;与土壤砂粒(SP)、土壤粉(砂)粒(SSG)为钝角,呈负相关。A2和B2样品则与A1样品相反。A3和B3样品与酸碱度(PH)、有机质(ORM)、土壤粘粒(CP)、土壤砂粒(SP)、土壤粉(砂)粒(SSG)均为锐角,呈正相关。B1样品与有机质(ORM)、土壤粘粒(CP)为锐角,呈正相关;与其他因子为钝角呈负相关。通过各样品对各环境因子的箭头连线作投影,其投影点距箭头的距离可以用于评价该环境因子对样品菌群的影响。从图 7可以看出,各环境因子对A1样品的影响程度的大小顺序为:有机质含量(ORM) > 土壤粘粒(CP) > 土壤粉(砂)粒(SSG) > 酸碱度(PH) > 土壤砂粒(SP)。对A2样品的影响程度的大小顺序为:土壤粉(砂)粒(SSG) > 土壤砂粒(SP) > 有机质含量(ORM) > 土壤粘粒(CP) > 酸碱度(PH)。对A3样品的影响程度的大小顺序为:土壤粉(砂)粒(SSG) > 土壤砂粒(SP)≈有机质含量(ORM) > 土壤粘粒(CP) > 酸碱度(PH)。对B1样品的影响程度的大小顺序为:有机质含量(ORM) > 土壤粘粒(CP) > 土壤砂粒(SP) > 土壤粉(砂)粒(SSG) > 酸碱度(PH)。B2样品受环境因子的影响与A2一样,B3样品受环境因子的影响与A3一样。而海拔(HT)因子未表现出对样品真菌种群有影响。
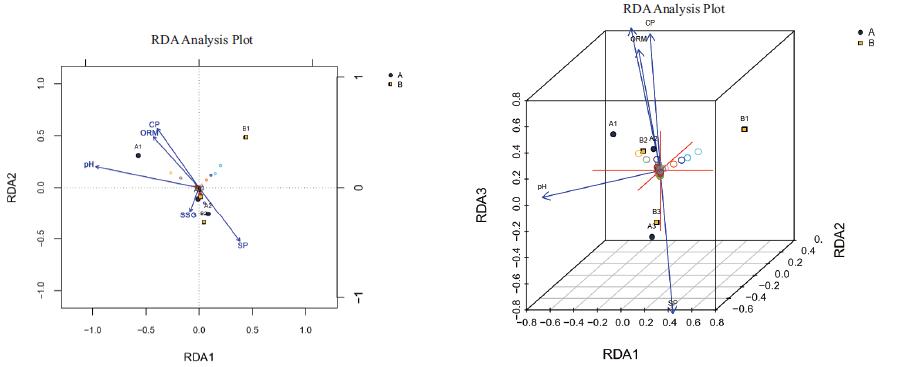
|
| 图 7 各土壤样品真菌菌群与土壤理化因子的RDA分析2D图和3D图 |
根际土壤真菌作为“植物-土壤-微生物”这一根际微生态系统中的关键参与者[12],其在维持根际微生态系统稳定、协同植物及其内生菌促进植物生长发育、营养物质的摄取与输布、代谢调节和抗病虫害等发挥有重要的调节作用[3, 13]。本研究分别从两面针主产区广东、广西、福建等地采集了6份两面针根际土壤样品,利用分子生物学和高通量测序技术对各产地的根际土壤真菌种群多样性进行研究,并通过冗余分析(Redundancy analysis,RDA)研究了土壤真菌菌群与环境因子的相关性分析。研究结果表明,6个实验样品真菌种群多样性丰富。在真菌种群结构上,不同产地土壤样品中真菌物种组成虽有一定的相似性,但其差异性非常明显,尤其在物种丰度上。环境因子土壤酸碱度(PH)、有机质含量(ORM)、土壤粘粒(CP)、土壤砂粒(SP)、土壤粉(砂)粒(SSG)等对样品真菌菌群组成和物种丰度均有不同程度的影响。但与海拔(HT)因子无关,其可能与海拔对根际土壤微生态体系中酶活性的空间变异程度的影响有关[14]。
从物种分类学来看,两面针根际土壤真菌种群中90%以上的真菌来自于子囊菌门Ascomycota、unclassified、担子菌门Basidiomycota、被孢霉门Mortierellomycota和罗兹菌门Rozellomycota。子囊菌门Ascomycota真菌在各样品真菌种群的占比较高,其中在B2样品中占比最高,达到了66.49%,其次是A3和B3样品,分别占比57.96%和55.58%,B1样品菌种中占比最小仅为14.31%。子囊菌门Ascomycota是真菌中种类最多的类群,占真菌总数的40%。根据王海英[15]等研究表明,子囊菌之所以会在微生物种群中占有较大比重,可能得品子囊菌门Ascomycota的占比却不及被孢霉门益于奠基者效应,与其遗传特性有关。而在B1样Mortierellomycota和担子菌门Basidiomycota,其是否与植物、环境以及其他微生物的影响有关还有待进一步研究。担子菌门Basidiomycota真菌是样品真菌种群中占比较大的另一真菌门类,为优势菌门,但其与子囊菌门Ascomycota不同,其在各个样品中的占比差异较大,如在B1、B2和A2样品中的占比分别为25.31%、23.63%和18.4%,但在A1、A3、B3样品中的占比较低。其可能是采样环境与人类的活动有关。被孢霉门Mortierellomycota在A2和B1样品中占比较大,在其他样品中的占比较少,是A2和B1的优势菌群。罗兹菌门Rozellomycota在A3样品中的占比明显高于其他样品,其是A3样品的一类优势菌属。此外,各样品中还存在大量未分类真菌unclassified。在属分类水平上,样品间几乎没有共有菌属。而在种分类水平上,6个样品真菌菌种丰度整体差异较大,在个别菌种丰度上具有一定的特有性。综合来看,6个产地的两面针根际土壤真菌种群在菌群物种和丰度上具一定的共性和差异性。
从李毳等[16]研究发现,党参、柴胡和远志3个药用植物根际土壤真菌主要来源于子囊菌门Ascomycota和担子菌门Basidiomycota,且物种丰度也较高,属于优势菌属。从潘争艳等[17]对辽宁省14种药用植物根际土壤真菌的研究表明,子囊菌门Ascomycota真菌在药用植物根际真菌中的种类和丰度均较高。而从属水平来看,青霉属Penicilliums、曲霉属Aspergillus、木霉属Trichoderma和镰孢菌属Fusarium均为药用植物根际土壤真菌常见的优势菌属[16-18],但不同药用植物其物种丰度有显著差异。对比以上药用植物根际土壤真菌种群多样性的研究发现,不同药用植物根际土壤真菌在物种组成上具有较高的相似性,其主要的差别在于物种的丰度差异[16-20],其可能也与土壤本身的微生物种群有关系[21]。
在植物根际微生态系统中,植物、土壤、微生物3个因素是相互联系,相互影响的,并且受到植物群落和气候条件等外界环境的影响。因此,开展三者在根际微生态系统中的生物作用关系研究,对揭示不同地域植物生长发育、中药道地药材形成机制具有重要的意义[22-23]。两面针是我国南方常见中药材,主要分布于广东、广西、福建等地[24]。有研究表明[25],不同生长方式的两面针所含氯化两面针碱的含量有较大差异,而其与地域、品种和栽培方式的差异相关性较小。据相关文献研究表明[26],两面针植物内生真菌能够产生与宿主植物相同或相似的化学成分,而内生真菌作为真菌的一种,其在生理特性和亲缘关系上与土壤真菌具有密切联系,因此本研究从土壤从根际真菌入手,探讨不同地域环境下两面针根际真菌种群多样性的异同,为两面针药材的合理化种植提供参考依据。
植物根际微生物多样性受到植物物种、生态环境、地理因素以及人类生产活动等因素影响[27-30],因而开展植物根际微生物多样性研究是关键的,也是复杂的。高通量测序技术的出现大力推动了植物根际微生物多样性研究的快速发展,研究人员可通过分子生物学、生物信息分析学以及统计学等交叉学科分析,了解根际微生物的种类、物种丰度、遗传关系以及功能预测。但由于其涉及学科较多,使得数据分析难度增大,加之微生物种类庞大、分类复杂,因此给合理开展微生物多样性评价和分析结果的运用增添了不小的难度。
4 结论通过对6个不同产地两面针植物根际土壤真菌菌落组成和物种丰度的对比分析研究,发现两面针根际土壤真菌菌落组成和物种丰度非常丰富,共分属于8个真菌门类,涉及数百个真菌物种,但不同产地的土壤真菌菌落组成和物种丰度存在显著差异。菌落组成和物种丰度受土壤颗粒、酸碱度、有机质含量等环境因素影响。研究表明,6个产地根际土壤多偏于酸性,质地多为黏土土质。6个产地根际土壤真菌生物多样性由高到低分别为B3 > A3 > A2 > B2 > B1 > A1。
| [1] |
曾曙才, 苏志尧, 陈北光, 等. 植物根际营养研究进展[J]. 南京林业大学学报:自然科学版, 2003(6): 79-83. Zeng SC, Su ZY, Chen BG, et al. A review on the rhizosphere nutrition ecology research[J]. Journal of Nanjing Forestry University :Natural Sciences Edition, 2003(6): 79-83. |
| [2] |
郝大程, 陈士林, 肖培根. 基于分子生物学和基因组学的植物根际微生物研究[J]. 微生物学通报, 2009, 36(6): 892-899. Hao DC, Chen SL, Xiao PG. Study of rhizosphere microbe based on molecular biology and genomics[J]. Microbiology, 2009, 36(6): 892-899. |
| [3] |
蒋婧, 宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用[J]. 植物生态学报, 2010, 34(8): 979-988. Jiang J, Song MY. Review of the roles of plants and soil microorganisms in regulating ecosystem nutrient cycling[J]. Chinese Journal of Plant Ecology, 2010, 34(8): 979-988. |
| [4] |
沈仁芳, 赵学强. 土壤微生物在植物获得养分中的作用[J]. 生态学报, 2015, 35(20): 6584-6591. Shen RF, Zhao XQ. Role of soil microbes in the acquisition of nutrients by plants[J]. Acta Ecologica Sinica, 2015, 35(20): 6584-6591. |
| [5] |
吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298-310. Wu LK, Lin XM, Lin WX. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates[J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310. |
| [6] |
麦靖雯, 黎瑞君, 张巨明. 根际微生物研究概况[J]. 现代农业科技, 2017(13): 135-136. Mai JW, Li RJ, Zhang JM. Research summary on rhizospheric microorganisms[J]. Modern Agricultural Science and Technology, 2017(13): 135-136. |
| [7] |
朱永兴, 韩学宏, 武东坡, 等. 枸杞道地性与其根际微生物的研究进展[J]. 中国农学通报, 2013, 29(34): 40-43. Zhu YX, Han XH, Wu DP, et al. The advances of the genuineness of Lyceum bararum L. and rhizosphere microorganism[J]. Chinese Agricultural Science Bulletin, 2013, 29(34): 40-43. |
| [8] |
倪元博.不同土壤条件下羊蹄根际土壤微生物与药用成分比较研究[D].长春: 吉林大学, 2019. Ni YB. Comparative study on soil microbes and medicinal components in rhizosphere of Rumex japonicus Houtt under different soil conditions[D]. Changchun : Jilin University, 2019. |
| [9] |
罗世琼.黄花蒿土壤微生物与抗疟相关成分的关联性研究[D].重庆: 西南大学, 2013. Luo SQ. Study on correlation between soil microorganisms anti-malarial-related compounds of Artemisia annua L.[D]. Chongqing : Southwest University, 2013. |
| [10] |
苏宝玲, 韩士杰, 王建国. 根际微域研究中土样采集方法的研究进展[J]. 应用生态学报, 2000(3): 477-480. Su BL, Han SJ, Wang JG. Advance in soil sampling methods in rhizosphere microzone study[J]. Chinese Journal of Applied Ecology, 2000(3): 477-480. |
| [11] |
赖江山. 生态学多元数据排序分析软件Canoco5介绍[J]. 生物多样性, 2013, 21(6): 765-768. Lai JS. Canoco 5 :a new version of an ecological multivariate data ordination program[J]. Biodiversity Ence, 2013, 21(6): 765768. |
| [12] |
Lambers H, Mougel C, Jaillard B, et al. Plant-microbe-soil interactions in the rhizosphere : evolutionary perspective[J]. Plant Soil, 2009, 321: 83-115. DOI:10.1007/s11104-009-0042-x |
| [13] |
赵官成, 梁健, 淡静雅, 等. 土壤微生物与植物关系研究进展[J]. 西南林业大学学报, 2011, 31(1): 83-88. Zhao GC, Liang J, Dan JY, et al. Review of studier on relationship between soil microbes and plans[J]. Journal of Southwest Forestry Nniversity, 2011, 31(1): 83-88. |
| [14] |
李丹维.太白山不同海拔土壤微生物及酶活性的空间变异特征[D].杨凌: 西北农林科技大学, 2016. Li DW. Spatial variation pattern of soil microorganism and soil enzyme activity in different altittude at Taibai mountain[D]. Yangling : Northwest A & F University, 2016 : 8-9. |
| [15] |
王海英, 郭守玉, 黄满荣, 等. 子囊菌较担子菌具有更快的进化速率和更高的物种多样性[J]. 中国科学:生命科学, 2010, 53(8): 731, 737-765, 772. Wang HY, Guo SY, Huang MR, et al. Ascomycota has a faster evolutionary rate and higher species diversity than Basidiomycota[J]. Sci China Life Sci, 2010, 53: 1163-1169. |
| [16] |
李毳, 刘怡. 晋东南3种道地药材植物根际真菌群落特性[J]. 生态环境学报, 2019, 28(7): 1388-1393. Li C, Liu Y. Characteristics of rhizosphere fungal community of three genuine medicinal plants in southeast Shanxi province[J]. Ecology and Environmental Sciences, 2019, 28(7): 1388-1393. |
| [17] |
潘争艳, 傅俊范, 周如军, 等. 辽宁省14种药用植物根际土壤真菌种类及数量分析[J]. 沈阳农业大学学报, 2009, 40(4): 481-484. Pan ZY, Fu JF, Zhou RJ, et al. Species and quantity of fungi from soils of 14 kinds of medicinal plants in Liaoning province[J]. Journal of Shenyang Agricultural University, 2009, 40(4): 481484. |
| [18] |
慕东艳, 吕国忠, 孙晓东, 等. 黑龙江省药用植物根际土壤真菌多样性[J]. 生态学报, 2013, 33(1): 229-237. Mu DY, Lü GZ, Sun XD, et al. Fungal diversity in rhizosphere soil of medicinal plants in Heilongjiang Province[J]. Acta Ecologica Sinica, 2013, 33(1): 229-237. |
| [19] |
潘争艳, 傅俊范. 辽宁省主要药用植物根际土壤真菌优势属种类和数量分析[J]. 辽宁农业科学, 2009(4): 18-20. Pan ZY, Fu JF. Species and quantity analysis of fungi of rhizosphere soil of major medicinal plants in Liaoning province[J]. Liaoning Agricultural Sciences, 2009(4): 18-20. |
| [20] |
杨皓.四川几种道地药材根际土壤真菌的初步研究[D].雅安: 四川农业大学, 2008. Yang H. Preliminary study on the rhizosphere fungi of some medicinal plants in Sichuan[D]. Ya'an : Sichuan Agricultural University, 2008. |
| [21] |
王芳, 图力古尔. 土壤真菌多样性研究进展[J]. 菌物研究, 2014, 12(3): 178-186. Wang F, Bau T. Research advances in the diversity of soil fungi[J]. Journal of Fungal Research, 2014, 12(3): 178-186. |
| [22] |
何冬梅, 王海, 陈金龙, 等. 中药微生态与中药道地性[J]. 中国中药杂志, 2020, 45(2): 290-302. He DM, Wang H, Chen JL, et al. Microecology and geoherbalism of traditional chinese medicine[J]. China Journal of Chinese Materia Medica, 2020, 45(2): 290-302. |
| [23] |
江曙, 段金廒, 钱大玮, 等. 根际微生物对药材道地性的影响[J]. 土壤, 2009, 41(3): 344-349. Jiang S, Duan JA, Qian DW, et al. Effects of microbes in plant rhizosphere on geoherbalism[J]. Soils, 2009, 41(3): 344-349. |
| [24] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015. Chinese Pharmacopoeia Commission. Pharmacopoeia of the people's republic of China[M]. Beijing: China Medical Science Press, 2015. |
| [25] |
韩正洲, 谈英, 覃兰芳. 两面针野生品与栽培品质量比较研究[J]. 现代中药研究与实践, 2013, 27(2): 65-66. Han ZZ, Tan Y, Qin LF. Comparative study on the quality of wild and cultivated Zanthoxylum nitidum(Roxb.)DC[J]. Chin Med J Res Prac, 2013, 27(2): 65-66, 38. |
| [26] |
陈龙, 梁子宁, 朱华. 植物内生菌研究进展[J]. 生物技术通报, 2015, 31(8): 30-34. Chen L, Liang ZN, Zhu H. Research advances in the studies of plant entophytic[J]. Biotechnology Bulletin, 2015, 31(8): 3034. |
| [27] |
姚晓华. 土壤微生物群落多样性研究方法及进展[J]. 广西农业生物科学, 2008(S1): 84-88. Yao XH. Advancement of methods in studying soil microbial diversity[J]. Journal of Guangxi Agricultural and Biological Science, 2008(S1): 84-88. |
| [28] |
张薇, 魏海雷, 高洪文, 等. 土壤微生物多样性及其环境影响因子研究进展[J]. 生态学杂志, 2005, 24(1): 48-52. Zhang W, Wei HL, Gao HW, et al. Advances of studies on soil microbial diversity and environmental impact factors[J]. Chinese Journal of Ecology, 2005, 24(1): 48-52. |
| [29] |
邓廷飞, 刘彦, 颜秋晓, 等. 贵州典型山银花土壤机械组成与养分特性及其关系[J]. 水土保持学报, 2014, 28(5): 209-214. Deng TF, Liu Y, Yan QX. Soil mechanical composition and soil nutrient characteristics and their relationships in typical Lonicera cinfusa soil of Guizhou[J]. Journal of Soil and Water Conservation, 2014, 28(5): 209-214. |
| [30] |
张彩霞.新一代高通量测序技术研究土壤微生物群落结构对环境条件的响应[D].南京: 南京农业大学, 2012. Zhang CX. The research of microorganism composition responces to environment conditions with the next generation high throughput and sequencing technology[D]. Nanjing : Nanjing Agricultural University, 2012. |