2. 长治学院化学系 长治 046011
2. Department of Chemistry, Changzhi University, Changzhi 046011
植物根际是指植物根表面狭窄且靠近根的区域。它是土壤,根系和微生物相互作用的区域[1]。根际中植物根与有益微生物之间的相互作用是植物健康和土壤肥力的决定因素[2]。在植物的根际中存在促进植物生长的有益细菌,称为植物促生根际细菌(Plant growth promoting rhizobacteria,PGPR)[3]。生物根际固氮微生物通过生命活动将大气中的N2分子转化为含氮化合物氨,并提供宿主植物生长所需的氮元素,以供植物吸收和利用,促进植物生长[4]。迄今为止,研究发现的根际促生菌的促生机制逐渐被科学家阐明,包括固氮[5]、磷酸盐增溶[6]、植物激素产生[7]、病原体抑制[8]、减轻压力和乙烯控制[9-10]。如PGPR通过溶磷和生物固氮作用直接促进生长,还可以通过活跃的土壤微生物生态系统间接促进植物生长。到目前为止,已经从水稻[11]、小麦[12]、棉花[13]、玉米[14]等多种农作物的根际分离出许多固氮细菌。这些固氮细菌属于固氮菌属(Azotobacter)、伯克霍尔德氏菌(Burkholderia)、农杆菌属(Agrobacterium)、假单胞菌属(Pseudomonas)、无色杆菌属(Achromobacter)、芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、草螺菌属(Spirospira)、克雷伯菌属(Klebsiella)和沙雷氏菌属(Serratia)等。而对药用植物苦参的根际固氮菌的研究报道较少。
苦参(Sophora flavescens Ait)为豆科槐属多年生落叶亚灌木,又名苦槐、地槐、野槐、牛参等,全国各地均有分布,是中国传统的药用植物[15]。苦参作为药用植物含有多种生物碱(苦参碱、氧化苦参碱、槐果碱和氧化槐果碱等),在中国已有二千多年的历史,其药效始载于《神农本草经》,常以根入药,具有清热、燥湿,杀虫、利尿的功效。苦参含有多种化学成分,其有效成分苦参碱和氧化苦参碱具有良好的抗癌活性[16]。随着苦参的开发利用及市场需求量的稳步扩大,苦参原料的需求也随之增加。因此,苦参野生资源采挖趋势有增无减,且优质苦参资源短缺,影响到临床用药的准确性和中成药疗效的稳定性,成为苦参产业发展的制约因素[17]。为推进道地药材基地建设,我国相关部门编制了《全国道地药材生产基地建设规划(2018-2025年)》,对促进特色农业发展和农民持续增收、加快发展现代中药产业、实现乡村振兴具有重要意义。
单一菌种普遍存在功能多样性缺乏和抵抗负荷差等缺点,复合菌群菌种多样性的特点使其能够适应各种生境,相互协调。本研究从三年生苦参根际土壤中分离、筛选了20株固氮细菌,选取促生、固氮能力较好的两株固氮细菌,分为单菌株接种和复合菌株接种苦参幼苗,研究其对苦参幼苗的促生长能力,不仅为固氮菌在微生物复合菌肥中的研发应用提供了理论基础,而且在促进环境可持续发展,形成绿色有机的生态格局方面具有重要的现实意义。
1 材料与方法 1.1 材料 1.1.1 供试土壤供试土壤采自“山西省长治市振东道地药材股份有限公司”三年生苦参种植基地根际土,共设5个采样点,每个点随机选取3株苦参,去掉地表枯枝落叶层,小心挖取苦参根,将根际土小心抖落在无菌小指管中带回,4℃冰箱保存备用。
1.1.2 培养基阿须贝氏(Ashby)固氮菌培养基:甘露醇10.0 g,KH2PO4 0.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaSO4·2H2O 0.2 g,CaCO3 5.0 g,H2O定容至1 L。pH 7.0-7.2。
蒙金娜有机磷培养基配方:葡萄糖10 g,(NH3)2SO4 0.5 g,酵母浸粉0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.03 g,MnSO4 0.03 g,卵磷脂0.2 g,CaCO3 1.0 g,H2O定容至1 L。pH 7.2。
1.2 方法 1.2.1 苦参根际土壤固氮菌的筛选、鉴定取5 g三年生苦参根际土壤加入到含30 mL吐温80的无菌水中,振荡20 min,静置1 h,将其制成悬浊液,分别以10-1、10-2、10-3、10-4、10-5和10-6梯度稀释后,依次涂布于Ashby无氮培养基上,各稀释梯度设3个重复,置于28℃下培养3-4 d直至单菌落出现,进行分离纯化3次以上至获得纯培养,挑取单菌落至斜面培养基培养2-3 d后,4℃条件下保存,备用。
1.2.2 菌株鉴定采用常规理化指标检测和《常见细菌系统鉴定手册》对菌株的形态特征与生理生化进行分析[18]。
采用细菌提取试剂盒(TaKaRa,大连)提取细菌DNA,对16S rRNA基因序列测定:琼脂糖凝胶电泳检测DNA质量后,采用细菌16S rRNA基因通用引物对27F :5'-AGAGTTTGATCCTGGCTCAG-3'和1492R :5'-GGTTACCTTGTTACGACTT-3'进行PCR扩增。PCR反应条件:94℃ 2 min;94℃ 30 s,56℃ 30 s,72℃ 1 min,共30个循环;72℃ 10 min。PCR产物经1%琼脂糖凝胶电泳鉴定,将扩增得到的大小约为1 500 bp的条带,连接到T-easy载体上,转化大肠杆菌DH5α感受态细胞,提取阳性克隆质粒后送至北京Invitrogen公司进行测序。根据测序结果,将得到的序列提交NCBI获得序列号,同时登陆EzTaxon server(http://www.EzTaxon.org)进行序列比对,得出相似性较高的相关菌株的16S rRNA基因序列,然后通过MEGA 5.0软件进行序列分析,用邻接法(Neighbor-Joining,NJ),采用Kimura 2-parameter作为模型,复制(Bootstrap replication) 1000次,检验模型稳定性,得到进化树。
1.2.3 产IAA能力测定利用Salkowki比色法[19]对分离获得的20株PGPR菌株分泌IAA特性进行测定参照,培养基中需加入色氨酸,每个样品设3个重复,以培养液为空白对照,测定波长530 nm处各培养液的吸光度值,通过标准曲线计算样品的IAA浓度。
1.2.4 溶磷活性的测定接种分离的固氮菌单菌落于LB液体培养基中,30℃ 180 r /min培养24 h,10 000 r /min离心1 min后去上清液,无菌水重悬菌体,取1 mL接种于50 mL蒙金娜液体培养基中,同样体积的对照接种在蒙金娜液体培养基,所有处理均设3个重复,同时于30℃ 180 r /min条件下培养1-7 d。从第1天开始,每天定时取上述菌悬液4℃ 10 000 r /min离心后10 min,取上清,使用钼锑抗比色法[20],测定上清液中可溶性磷含量。待测菌株溶磷量即为可溶性磷含量的差值。
1.2.5 固氮酶活性测定选取促生能力较好的8株菌株,采用乙炔还原法[21]测定固氮酶活性。将固体培养基中活化的菌株接种于LB培养基中,30℃恒温条件下培养8 h。4℃下,5 000 r/min离心10 min后收集菌液,用0.85%的生理盐水洗涤3遍,用无氮培养基重悬至OD600=1.0。将2 mL菌种加入于20 mL顶空瓶中,顶空瓶中加入5 mL无氮培养基,用封口膜密封在30℃恒温条件下培养24 h,再用无菌顶空瓶盖密封。用无菌注射器抽出2 mL气体,再注入等体积乙炔,继续培养72 h。抽取0.5 mL气体进入气相色谱仪分析,测定样品乙烯的峰面积及乙烯含量。每种菌株设3个重复,根据标准乙炔气体的标准曲线得到菌株的固氮能力。固氮酶活性(nmol /mg·h)计算公式如下。固氮酶活性=(所测菌株乙烯峰面积×瓶子上方体积)/(1 nmoL乙烯的峰面积×注入气体体积×菌体蛋白含量×反应时间)
1.2.6 V选取菌株NF1-17和NF2-4,用接种环挑取少量菌体接种于含有50 mL LB培养基的培养瓶中,30℃、180 r/min振荡培养48 h。取上述菌液离心(4℃、6 000 r/min离心5 min),无菌水洗涤菌体3次,调节菌悬液浓度至108 CFU/mL制成菌剂。将菌剂NF1-17和NF2-4分单独、复合(1:1)接种,接入已萌发的苦参种子(种子在播种之前,先用浓硫酸处理软化种皮)种于育苗基质(腐熟花生皮:蛭石:珍珠岩:鸡蛋壳为50:25:20:5)中,接种量为每盆2 mL,每个菌剂接种10盆,每盆种植3株苦参;置于温室(25℃)培养,每个对照组则用等量无菌水代替,接种30 d后,对所获取的根系样本进行分析,测定不同处理的总根长、根系表面积、平均根系直径、根体积、根尖数、主根长等。
1.2.7 数据分析 实验数据使用Excel和SPSS 13.0统计软件进行方差分析和多重比较。采用Epson扫描仪获取根系样本,运行WinRHIZO Pro根系分析系统软件。
2 结果 2.1 根际固氮菌的分离根际固氮菌的分离从三年生苦参根际土壤中,共分离出20株固氮菌株。菌落形态如图 1所示,菌株NF1-4和菌株1-17为杆状,菌株2-4和菌株3-24为球状。
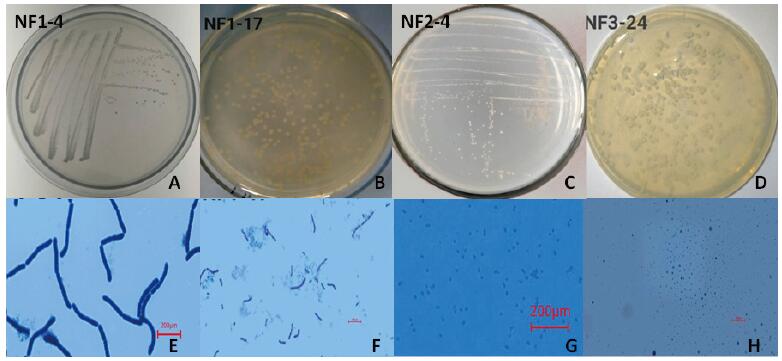
|
| 图 1 部分菌株的菌落形态(A-D)和显微观察结果(E-H) |
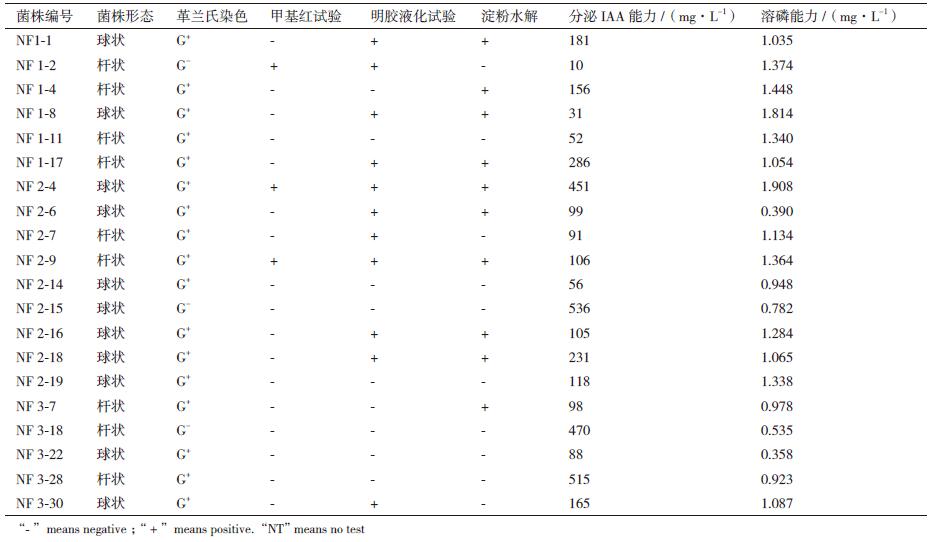
分离的20株菌株经甲基红试验、明胶液化和淀粉水解试验等(表 1)。淀粉水解实验如图 2所示,菌株1-4和菌株1-17滴加碘液后淀粉被水解的地方会产生透明圈(图 2-B和图 2-C),为阳性反应;NF2-4不能水解淀粉,在滴加碘液后会不产生透明圈(图 2-A),鉴定为阴性。对于20株菌株的产IAA分泌能力不同,分泌量在10-536 mg/L,其中分泌量较高的菌株NF2-15、NF3-28、NF3-18、NF2-4及NF1-17的能力分别为536 mg/L、515 mg/L、470 mg/L、451 mg/L和286 mg/L;20株菌株的溶磷能力也不同,大小分别在0.390-1.908 mg/L,溶磷能力较大的菌株NF2-4、NF1-8、NF1-4、NF1-2、NF1-11的溶磷能力分别为1.908 mg/L、1.814 mg/L、1.448 mg/L、1.374 mg/L及1.340 mg/L。其中菌株NF1-17的溶磷能力为1.054 mg/L。
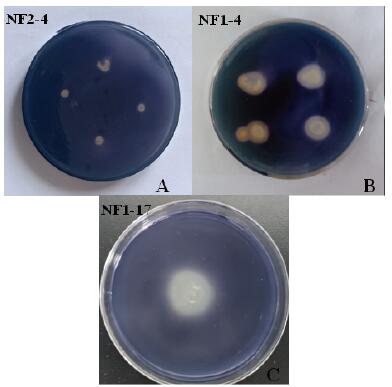
|
| 图 2 淀粉水解实验结果 |
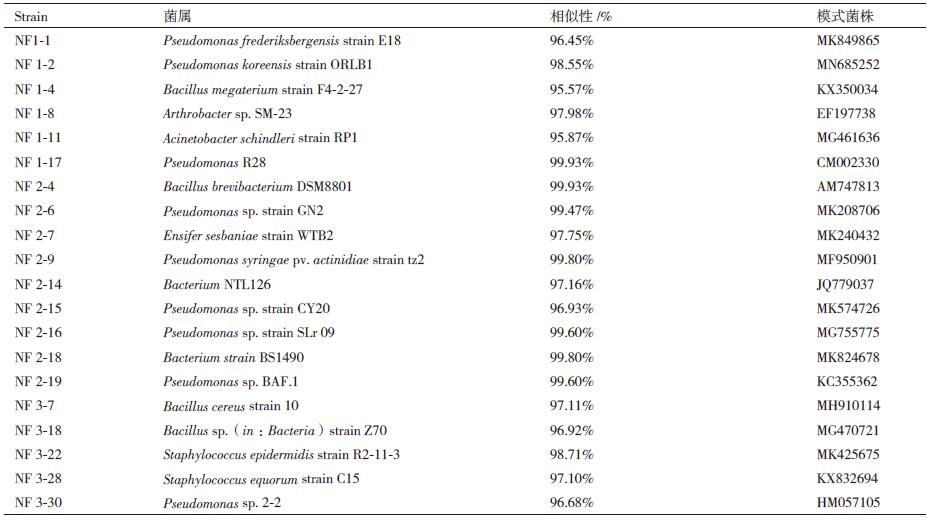
对20株菌株扩增16S rRNA基因的条带,经1.0%的琼脂糖凝胶电泳鉴定,其大小均在1.5 kb的单一条带,经克隆后测得的序列在NCBI与EzBioCloud数据库中进行比对,结果显示,这些菌株在系统发育上分别分布于假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、剑菌属(Ensifer)、节杆菌属(Arthrobacter)以及表皮葡萄球菌属(Staphylococcus)等。其中有10株为假单胞菌属和4株芽孢杆菌属菌株。菌株NF1-17(MT140118)属于假单胞菌属Pseudomonas,与Pseudomonas R28的序相似性最高(99.93%);菌株NF2-4(MT140119)属于芽孢杆菌属(Bacillus),与Brevibacterium frigoritolerans DSM 8801的序列相似性最高(99.93%)(表 2,图 3)。
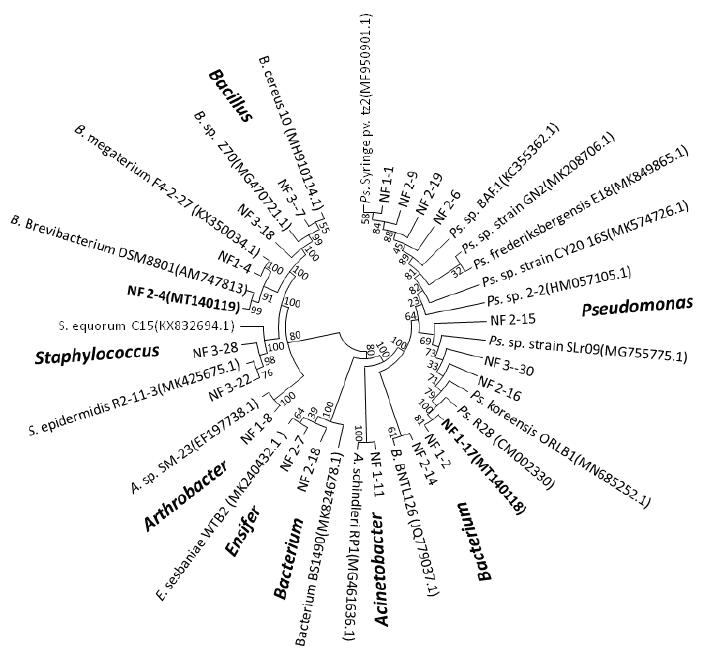
|
| 图 3 基于16S rRNA基因序列构建的20株苦参根际固氮菌株系统发育树 |
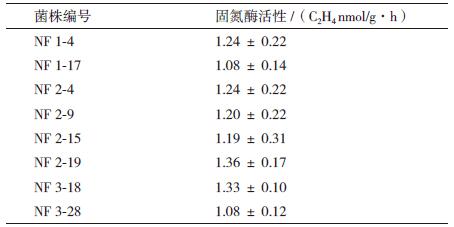
从分离的20株菌株中,结合其产IAA与溶磷能力,选取8个菌株,每个菌株设3个重复,取平均值计算固氮酶活性,结果显示8个菌株的固氮酶活性范围为1.08-1.36 nmol/(g·h)(表 3)。其中菌株NF2-19、菌株NF3-18、菌株NF2-4和菌株NF1-4的固氮酶活性分别为1.36 ± 0.17 nmol C2H4/(g·h)、1.33 ± 0.10 nmol C2H4/(g·h)、1.24 ± 0.22 nmol C2H4/(g·h)和1.24 ± 0.22 nmol C2H4/(g·h)。
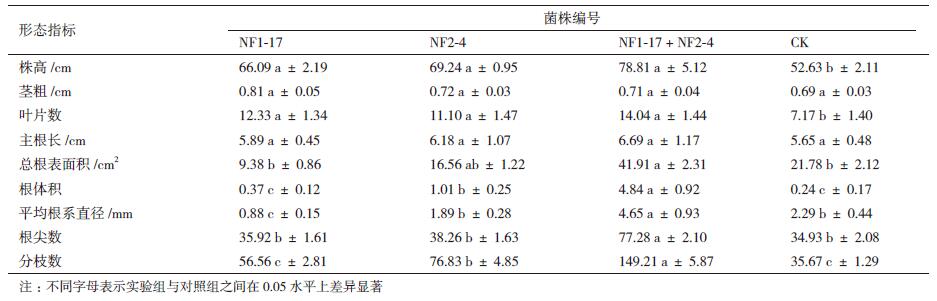
腐熟花生皮:蛭石:珍珠岩:鸡蛋壳为50:25:20:5作为基本基质,种入萌发的苦参种子,结合产IAA和溶磷能力,对菌株NF1-17和NF2-4进行发酵,分别采用单一接种、混和接种的方式,每个菌剂接种10盆,每盆种植3株苦参,测定苦参幼苗的生长指标。各项生长指标结果如表 4所示,接种不同处理菌剂30 d后的苦参幼苗,其长势为:接种NF2-4和NF1-17复合菌剂 > 单独接种NF2-4菌剂 > 单独接种NF1-17菌剂 > 接种无菌水(图 4)。接种NF1-17和NF2-4复合发酵菌剂的株高比单独接种发酵菌剂NF1-17和NF2-4均表现出显著的促生作用;接种复合菌剂的叶片数、总根体积、总根表面积、平均根系直径都远超于其他单独接种及未接种对照组,尤其根表面积、总根体积、平均直径、根尖数、除茎粗外,添加NF1-17和NF2-4复合菌剂的苦参的显较低,同时由图 4所示,添加菌剂的苦参幼苗长势明显促进苦参幼苗的生长,根系最发达,且复合发酵菌剂的形态指标高于单独添加菌剂的植株。

|
| A:接种无菌水;B:接种NF1-17菌剂;C:接种NF2-4菌剂;D:接种NF2-4和NF1-17复合菌剂 图 4 接种不同菌剂苦参幼苗及根系生长图 |
实现农业的可持续发展已成为全球的战略共识。目前,我国农业过度依赖化肥、农药等化学物质,化肥的平均施用量是发达国家化肥施用上限的2倍,农药用量是世界的3倍,已造成严重的土壤退化、沙化、水源污染和食品安全问题,这种不可持续的农业发展模式亟需改变。微生物菌肥中应用的根瘤菌、固氮菌、溶磷菌、促生菌和生防菌等PGPR是能够在植物根际定殖,提高植物营养的可给性、抑制病原菌的生长或产生某些特殊的促生物质,促进植物种子萌发和植物生长、发育的一类细菌。研究表明,使用PGPR菌肥,能够减少化肥用量20%30%,减少农药用量30%以上,农作物增产10%80%,在发展可持续农业中的作用越来越受到重视,是实现化肥、农药双减目标的重要途径[22]。土壤中不同属的PGPR拥有不同的促生能力,如假单胞菌属(Pseudomonas)、芽胞杆菌属(Bacillus)是促生能力较强的细菌类群[23],它们的促生功能得到了广泛关注和研究。
本研究中分离了20种固氮细菌,这些菌株在系统发育上分别分布于假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、剑菌属(Ensifer)、节杆菌属(Arthrobacter)以及表皮葡萄球菌属(Staphylococcus)等。其中有10株为假单胞菌属和4株芽孢杆菌属菌株。分离的假单胞菌属占分离菌株的50%,是根际优势菌属。假单胞菌是生防微生物的重要类群,也是自然界分布最广的微生物之一,其繁殖快、定殖能力强、营养要求简单,具有抑制多种植物病害和促进植物生长的作用而被广泛研究[24]。其次为芽孢杆菌属,在土壤,水或与植物相关的土壤中的革兰氏阳性,孢子形成,杆状和兼性需氧细菌[25],具有多种PGPR特性,例如固氮,磷酸盐增溶,吲哚-3乙酸生成和生物防治能力[26]。芽孢杆菌能够产生芽孢,存活时间长,能够在多种土壤环境中生存,此外有些菌株能产生抗菌物质,提高植物的抗逆性,进而促进植物生长和增强植物抗病害的能力,很多菌株被作为植物根际促生菌而广泛研究,其在可持续农业的发展中具有重要的现实意义[27-28]。
固氮菌能够通过生物固氮等不同机制提高宿主的产量和改善宿主的品质。筛选固氮能力比较强的菌株对于提高豆科植物的共生有效性,促进豆科植物的生长有着重要的实际意义。本研究中分离的20株固氮菌中,菌株NF2-4(Bacillus)无论从分泌IAA、溶磷能力,还是固氮酶活性等方面,都表现出较高的水平,故作为研究促生菌的首选。并且从接种实验的研究结果看来,菌株NF2-4的促生作用极为明显,较对照组表现出明显的促生优势。然而,单一菌种普遍存在功能多样性缺乏和抵抗负荷差等缺点,单一PGPR菌株的产品已很难完全满足作物的需求。复合菌群菌种多样性的特点使其能够适应各种生境,相互协调,在农业上,复合菌群能提高土壤肥力,加速土壤养分的分解转化,从而达到节约肥料,促进植物根生长的功效;另外,有些复合菌群对杂草危害和病虫害具有防治作用,同时能够提高作物的抗病、抗寒、抗旱能力。因此,开发针对育苗的专用的复合菌群生物制品,对于促进农业增产具有重要意义。因此综合其分泌IAA能力和溶磷能力等指标,同时选择菌株NF1-17(Pseudomonas)作为复合菌肥的研究对象。
株高和茎粗是评价植物幼苗生长速度和壮硕程度的重要形态指标,而根系是植物的两大工厂(叶和根)之一,它担负着艰巨而繁重的工作,具有吸收水分和无机盐,进行新陈代谢,固定植物等作用。发育良好的根系,侧根较多,根体积较大,吸收面积较大,吸收能力也越强,尤其对于药用部位是根部的药用植物,根的发育更为重要。苦参根系生长发达与否关系到苦参作为药材的产量及质量,苦参根系的壮硕程度可以作为接种剂促生效率的评价指标。本研究中,接种NF1-17和NF2-4菌株在温室的基质中显著促进了苦参幼苗的生长,表现出较强的促生效果,尤其接种复合菌株的苦参幼苗,其株高、叶片数、主根长、总根表面积、总根体积、平均根直径、根尖数和分枝数等,与对照及单菌接种相比,都表现出显著的促生优势。
4 结论共分离了苦参根际高效固氮菌20株,其中芽孢杆菌NF2-4表现出良好的促生能力,为进一步研究复合微生物菌肥的促生优势,添加固氮菌株假单胞菌NF1-17,对苦参盆栽苗接种,结果复合发酵菌株表现出良好的促生效果,为今后PGPR菌株的在复合微生物菌肥中的推广应用提供可行性。
| [1] |
Walker TS, Bais HP, Grotewold E, et al. Root exudation and rhizosphere biology[J]. Plant Physiology, 2003, 132(1): 44-51. |
| [2] |
Sarkar J, Chakraborty B, Chakraborty U. Plant growth promoting rhizobacteria protect wheat plants against temperature stress through antioxidant signalling and reducing chloroplast and membrane injury[J]. Journal of Plant Growth Regulation, 2018, 37(4): 1396-1412. DOI:10.1007/s00344-018-9789-8 |
| [3] |
Suslow TV, Schroth MN. Rhizobacteria of sugarbeets :effects of seed application and root colonization on yield[J]. Phytopathology, 1982, 72(2): 199-206. DOI:10.1094/Phyto-72-199 |
| [4] |
刘畅, 黄文茂, 韩丽珍. PGPR复合菌系对花生生长及根际土壤微生物的影响[J]. 西南农业学报, 2019, 32(10): 2367-2372. Liu C, Huang WM, Han LZ. Effect of PGPR compound flora on peanut seedling growth and rhizosphere soil microorganism[J]. Southwest China Journal of Agricultural Sciences, 2019, 32(10): 2367-2372. |
| [5] |
王秀呈, 曹艳花, 唐雪, 等. 水稻内生固氮菌Herbaspirillum seropedicae DX53的筛选及其促生特性[J]. 微生物学报, 2014, 54(3): 292-298. Wang XC, Cao YH, Tang X, et al. Rice endogenous nitrogen fixing and growth promoting bacterium Herbaspirillum seropedicae DX35[J]. Acta Microbiologica Sinica, 2014, 54(3): 292-298. |
| [6] |
杨顺, 杨婷, 林斌, 等. 两株溶磷真菌的筛选、鉴定及溶磷效果的评价[J]. 微生物学报, 2018, 58(2): 264-273. Yang S, Yang T, Lin B, et al. Isolation and evaluation of two phosphate-dissolving fungi[J]. Acta Microbiologica Sinica, 2018, 58(2): 264-273. |
| [7] |
Ahmed A, Hasnain, S. Auxin-producing Bacillus sp[J]. Pure and Applied Chemistry, 2010, 82(1): 313-319. DOI:10.1351/PAC-CON-09-02-06 |
| [8] |
Shanmugam V, Kanoujia N. Biological management of vascular wilt of tomato caused by Fusarium oxysporum f[J]. Biological Control, 2011, 57(2): 85-93. DOI:10.1016/j.biocontrol.2011.02.001 |
| [9] |
Rashid S, Charles TC, Glick BR. Isolation and characterization of new plant growth-promoting bacterial endophytes[J]. Applied Soil Ecology, 2012, 61(10): 217-224. |
| [10] |
Nadeem SM, Shaharoona B, Arshad M, et al. Population density and functional diversity of plant growth promoting rhizobacteria associated with avocado trees in saline soils[J]. Applied Soil Ecology, 2012, 62(12): 147-154. |
| [11] |
Chithrashree, Udayashankar AC, Nayaka SC, et al. Plant growthpromoting rhizobacteria mediate induced systemic resistance in rice against bacterial leaf blight caused by Xanthomonas oryzae pv[J]. Biological Control, 2011, 59(2): 114-122. DOI:10.1016/j.biocontrol.2011.06.010 |
| [12] |
Turan M, Gulluce M, Karadayi M, et al. Role of soil enzymes produced by PGPR strains in wheat growth and nutrient uptake parameters in the field conditions[J]. Current Opinion in Biotechnology, 2011, 22(9): 133-140. |
| [13] |
席琳乔, 李德锋, 王静芳, 等. 棉花根际促生菌固氮和分泌生长激素能力的测定[J]. 干旱区研究, 2008, 25(5): 690-694. |
| [14] |
韩梅, 罗培宇, 肖亦农, 等. 玉米内生固氮菌的分离鉴定及其促生长作用研究[J]. 沈阳农业大学学报, 2010, 41(1): 94-97. Han M, Luo PY, Xiao YN, et al. Isolation of endophytic N2-fixing bacteria of corn rice and their function for promoting growth[J]. Journal of Shenyang Agricultural University, 2010, 41(1): 94-97. |
| [15] |
《中国植物志》编辑委员会主编. 中国植物志[M]. 北京: 科学出版社, 1988.
|
| [16] |
姚丽, 易红, 高慧敏, 等. 野生与栽培苦参生物碱含量的比较研究[J]. 中国中药杂志, 2016, 41(21): 3968-3974. Yao L, Yi H, Ma HW, et al. Comparison of alkaloids in roots of cultivated and wild Sophora flavsecens[J]. China Journal of Chinese Material Medica, 2016, 41(21): 3968-3974. |
| [17] |
雷海英, 侯沁文, 白凤麟, 等. 八种不同产地苦参的染色体数目及核型分析[J]. 植物生理学报, 2019, 55(7): 967-974. Lei HY, Hou QW, Bai FL, et al. Chromosome number and karyotype analysis of Sophora flavescens Ait[J]. Plant Physiology Journal, 2019, 55(7): 967-974. |
| [18] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. Dong XZ, Cai MY. Manual for systematic identification of common bacteria[M]. Beijing: Science Press, 2001. |
| [19] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogentic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796. DOI:10.1128/AEM.61.2.793-796.1995 |
| [20] |
吴伟, 张鹏飞, 张桂萍, 等. 连翘根际高效解有机磷细菌的筛选鉴定及促生长特性研究[J]. 西南林业大学学报, 2018, 38(3): 93-100. Wu W, Zhang PF, Zhang GP, et al. Screening, identification and growth promoting characteristics of high efficient organic phosphate-mineralizing bacterium from rhizosphere soils of forsythia suspense[J]. Journal of Southwest Forestry University, 2018, 38(3): 93-100. |
| [21] |
孙建光, 张燕春, 徐晶, 等. 高效固氮芽孢杆菌筛选及其生物学特性[J]. 中国农业科学, 2009, 42(6): 2043-2051. |
| [22] |
Chebotar VK, Malfanova NV, Shcherbakov AV, et al. Endophytic bacteria in microbial preparations that improve plant development (review)[J]. Applied Biochemistry and Microbiology, 2015, 51(3): 271-277. DOI:10.1134/S0003683815030059 |
| [23] |
林启美, 赵小蓉, 孙焱鑫, 等. 四种不同生态系统的土壤解磷细菌数量及种群分布[J]. 土壤与环境, 2000, 9(1): 34-37. Lin QM, Zhao XR, Sun YX, et al. Community characters of soil phosphobacteria in four ecosystems[J]. Soil and Environmental Sciences, 2000, 9(1): 34-37. |
| [24] |
董夏伟.烟草青枯病拮抗真菌的筛选、鉴定及活性产物研究[D].扬州: 扬州大学, 2011. Dong X. Screening and identification of antagonistic fungi against ralstonia solanacearum and research on the active products[D].Yangzhou :Yangzhou University, 2011. |
| [25] |
Sukweenadhi J, Kim YJ, Choi ES, et al. Paenibacillus yonginensis DCY84T induces changes in Arabidopsis thaliana gene expression against aluminum, drought, and salt stress[J]. Microb Res, 2015, 172(3): 7-15. |
| [26] |
Ahmed A, Hasnain, S. Auxin-producing Bacillus sp[J]. Pure and Applied Chemistry, 2010, 82(1): 313-319. DOI:10.1351/PAC-CON-09-02-06 |
| [27] |
王楠, 李刚强, 李云龙, 等. 固氮类芽孢杆菌的分离鉴定及其促生、抑菌活性的测定[J]. 中国农业科技导报, 2019, 21(5): 95-103. Wang N, Li GQ, Li YL, et al. Isolation and identification of nitrogen-fixing Paenibacillus spp[J]. Journal of Agricultural Science and Technology, 2019, 21(5): 95-103. |
| [28] |
张丹雨, 杨萍, 郭英, 等. 野大豆多功能根际促生菌的筛选鉴定和促生效果研究[J]. 生物技术通报, 2018, 34(10): 108-115. Zhang DY, Yang P, Guo Y, et al. Screening, identification and growth-promoting effect of multifunction rhizosphere growthpromoting strain of wild soybean[J]. Biotechnology Bulletin, 2018, 34(10): 108-115. |