土壤有效磷是农业生态系统中制约植物生长发育的重要限制因子,缺磷会导致植物生长缓慢,产量降低和植株矮小[1-2]。土壤中磷素蕴藏丰富,但主要以难溶性的矿物态磷存在,其主要为Ca-P,难以被植株吸收利用[3]。据全国土壤普查估算,我国约3/2的土壤缺磷,土壤有效态磷仅占全磷量的2%-3%[1]。在生产中,提高土壤磷素的有效性途径主要是施用化学磷肥,而长期使用化肥会造成土壤板结、保水能力下降以及土壤微生物多样性和活性降低等一系列生态环境问题[4]。土壤溶磷微生物作为土壤生态系统中的一部分,与难溶性磷活化与转化有着密切关系,其能在生长代谢中分泌有机酸类物质进而降低局部环境pH值,并与磷酸盐中的Ca2+、Fe3+、Al3+等金属阳离子结合,使磷离子被释放出来,从而提高土壤中有效磷含量,以供植物吸收利用[5]。截止目前,国际公认的溶磷微生物有巨大芽孢杆菌(Bacillus megaterium)、蜡状芽孢杆菌(Bacillus cereus)、假单胞菌(Pseudomonas)、农杆菌(Agrobacterium)、肠杆菌(Enterobacter)、黄褐假单胞菌(Cinnamon aeruginosa)等[6-8]。因不同溶磷微生物的生长代谢能力不同,分泌的有机酸种类和数量有很大差异,且不同的有机酸与磷酸盐中的阳离子的结合能力不一样,因而不同的溶磷微生物对磷酸盐的溶解能力有所不同,这是由微生物自身的特性决定的[9]。如刘文干等[10]的研究结果表明Paraburkholderia cepacia C5-A的溶磷机制主要是通过分泌乙酸,而萧龙珍等[11]的研究结果表明柠檬酸、乳酸是影响菌株B. megaterium XS2溶磷的重要有机酸。张英等[12]发现不同有机酸促进溶解磷酸三钙作用基本符合柠檬酸、丁二酸 > 草酸、酒石酸、苹果酸 > 乙酸。另外,微生物生长发育以及分泌代谢产物易受外界环境的影响,即使对于同种溶磷微生物,在不同环境因子下(如碳源、氮源、pH和C/N等)也会影响其生长代谢,进而影响溶磷能力[7]。因此,将溶磷菌研发成生物菌肥就得筛选适应不同环境因子的微生物。
马尾松(Pinus massoniana Lamb.)作为我国南方重要的山地造林先锋树种和工业用材树种,其种植面积正逐年增加。在马尾松幼苗培育过程中,为提高幼苗产量和品质,过量使用无机磷肥已成为了普遍现象,进而导致了马尾松苗圃土壤理化性质及结构恶化、微生物种群结构失衡、土壤难溶性磷富集,这已严重抑制了马尾松产业的健康发展[13]。虽然已有许多应用外生菌根菌通过溶磷作用对马尾松促生的研究,但外生菌根菌往往需要在形成菌根之后才能发挥促生作用,另外因其自身特性容易受外界环境影响,进而导致效果受限[14-15]。而根际溶磷细菌通常具有更强的繁殖能力,对环境的要求相对较低,且溶磷能力更强。因此,本研究从马尾松根际土壤中筛选溶磷细菌,在明确其分类地位的基础上,研究其在不同培养条件下的溶磷特性以及在不同时期对不同难溶性磷酸盐的溶解能力,并通过盆栽试验考察溶磷菌株在土壤中的溶磷效果以及对马尾松幼苗的促生能力,为开发溶磷微生物肥料提供优质菌株资源,为溶磷菌的科学应用和维持马尾松产业可持续发展提供理论依据。
1 材料与方法 1.1 材料供试种子:从贵州省都匀马尾松国家林木良种基地收集马尾松(Pinus massoniana Lamb.)种子。
土壤样品:2019年5月于贵阳市花溪区选择一片生长良好的马尾松林(26.44° N,106.65° E),从中随机取5棵林龄为20年左右的健康马尾松收集其根际土壤。采样时,铲去马尾松表层土,深挖30 cm左右后截取马尾松根系(根系直径 < 0.5 cm)5段,抖落根系外围土,再用毛刷将粘在根上的根际土壤(根附近2 mm范围内)收集于无菌袋中,装入冰盒内带回实验室分离。
解无机磷培养基:葡萄糖10.0 g,硫酸铵0.5 g,氯化钠0.3 g,氯化钾0.3 g,七水合硫酸亚铁0.03 g,四水合硫酸锰0.03 g,七水合硫酸镁0.3 g,磷酸三钙10.0 g,蒸馏水1 000.0 mL,pH 7.0-7.2;用于解磷微生物菌株的分离和筛选。LB培养基:胰蛋白胨10.0 g,酵母提取物5.0 g,氯化钠10.0 g,蒸馏水1 000.0 mL,pH 7.0-7.2;用于菌株的纯化和种子液培养。上述培养基添加2.0%的琼脂即得到相应的固体培养基,在湿热灭菌锅121℃高压灭菌30 min备用。
1.2 方法 1.2.1 溶磷菌的分离称取根系土壤采用稀释涂布平板法依次配备浓度为10-3、10-4、10-5的土壤稀释液,分别取0.1 mL均匀涂布于无机磷固体培养基上。每个稀释度重复3次,置于28℃下培养2 d。待菌体长出后挑取四周有明显透明圈的菌株,于LB固体培养基上采用划线法进行多次纯化直至获得纯培养物,4℃条件下斜面保存,备用。
1.2.2 溶磷菌的筛选采用三点接种法将1.2.1分离获得的溶磷菌分别接种于无机磷固体培养基上,28℃下培养5 d后,测量各菌株的透明圈直径(D)和菌落直径(d)。每个处理设3次重复,通过计算D/d值的大小初步确定菌株溶磷能力;将初筛得到的溶磷菌接种到盛有50 mL已灭菌LB液体培养基的三角瓶中,28℃下120 r/min摇床培养48 h后,取培养液于8 000 r/min离心10 min弃上清液,无菌蒸馏水洗涤菌体3次后稀释、调制菌重悬液(菌体量1×108 CFU/mL)。250 mL三角瓶中装入100 mL无机磷液体培养基,121℃条件下高压灭菌25 min。待冷却后,将菌悬液(1×108 CFU/mL)按2%的接种量接入已灭菌的无机磷液体培养基中,以接入等量灭活菌悬液的培养基作为对照。每个处理设3次重复,28℃下120 r/min摇床培养5 d后,收集培养液于8 000 r/min离心10 min,取上清液采用钼锑抗比色法测定培养液中有效磷含量[10]。菌株溶磷量为接菌培养液有效磷含量减去对照有效磷含量,用mg/L表示。
1.2.3 溶磷菌的鉴定细菌的形态学观察及甲基红、接触酶、V-P反应试验等生理生化指标的测定参照《常见细菌系统鉴定手册》[16]。菌株DNA提取以及16S rDNA PCR扩增测定参照《精编分子生物学实验指南》[17]。将扩增产物送到成都新百基生物科技有限公司进行纯化测序。将16S rDNA测序结果通过NCBI网站Blast程序与GenBank数据库(http://www.ncbi.nlm.nih.gov/genbank)中核酸序列进行比对分析,并从NCBI中下载与之相似性高的相关基因序列,利用MEGA 7.0软件采用Neighbor-joining法构建系统发育树。
1.2.4 溶磷菌对4种难溶性磷酸盐的溶解效果在无机磷液体培养基的基础上,分别以磷酸三钙Ca3(PO4)2(分析纯,P含量19.97%)、磷酸氢钙CaHPO4·2H2O(分析纯,P含量18.10%)、磷酸铁FePO4·2H2O(分析纯,P含量16.60%)和磷酸铝(分析纯,P含量25.40%)为唯一磷源,添加量分别为10.00 g/L、11.03 g/L、12.03 g/L和7.90 g/L,使各培养液中的P含量一致。将待测菌株(1×108 CFU/mL)按2%的接种量接入已灭菌的各培养基中,以接入等量灭活菌悬液的培养基作为对照。28℃下120 r/min摇床培养7 d,每隔1 d收集1次培养液离心并测定其溶磷量和pH值,每个处理3次重复。
1.2.5 不同条件对菌株溶解磷酸三钙的影响以无机磷液体培养基为基础,分别设置不同碳源(以葡萄糖、半乳糖、蔗糖、乳糖、可溶性淀粉作为唯一碳源,添加量分别为10.00、10.00、9.50、9.50和9.00 g/L,使各处理C含量一致)、氮源(以(NH4)2SO4、KNO3、NH4Cl、CO(NH2)2和NH4NO3作为唯一氮源,添加量分别为0.50、0.76、0.41、0.23和0.30 g/L,使各处理N含量一致)、C/N比(葡萄糖浓度为10.0 g/L,(NH4)2SO4添加量分别为1.00、0.40、0.25、0.17 g/L,即C/N比为10:1、25:1、40:1和60:1)、NaCl含量(分别设置培养基NaCl终浓度为0、2.5、5、10和20 g/L处理)以及初始pH(用0.5 mol/L盐酸溶液和0.5 mol/L氢氧化钠溶液调节培养基初始pH值,分别设置pH为4、5、6、7、8、9、10处理)。按照1.2.4相同操作接菌并培养5 d后,收集各处理下的培养液离心并测定其溶磷量,每个处理3次重复。
1.2.6 菌株对盆栽马尾松幼苗的促生作用盆栽试验的土壤基质来自贵州大学西校区马尾松林,土壤为铝质常湿淋溶土。选择采土点后,去除枯枝落叶层,深挖约20 cm后取样,于实验室过筛、灭菌备用。将马尾松种子浸入30℃温水浸泡12 h,选取沉入水底的籽粒饱满、大小均匀的种子,表面消毒采用0.4% KMnO4溶液浸种20-30 min,无菌蒸馏水洗涤5次以上,将种子埋入装有灭菌蛭石的托盘中,于28℃保温箱中催芽培养2周,选择长势一致的幼苗进行盆栽试验考察溶磷菌对马尾松的促生效果。设接种细菌处理,每盆装土0.5 kg,种植马尾松3株,接菌量为每盆5 mL菌悬液(108 CFU/mL),以接种等量灭活菌悬液的幼苗为对照,每处理设36个重复。生长期间不施肥,马尾松生长60 d后收获,测量马尾松的株高、根长、植株鲜重、干重,测定植株全磷量及根际土壤中有效磷的含量[1]。
1.2.7 数据处理数据处理及画图采用Microsoft Excel 2010软件进行,采用SPSS 19.0软件进行独立样本t检验和单因素ANOVA方差分析,多重比较采用Duncan检验,相关性分析采用Pearson法,进化树采用MEGA 7.0软件构建。
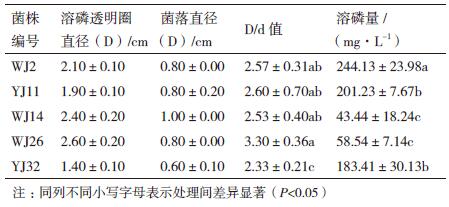
2 结果 2.1 溶磷菌的筛选由无机磷固体培养基上初步纯化获得产生明显溶磷透明圈且形态、颜色不同的菌落20个。其中,溶磷圈直径(D)与菌落直径(d)的比值(D/d) ≥ 2.00的菌株有5株(表 1)。溶磷菌在固体培养下的D/d与菌株代谢物的种类、释放快慢、蔓延程度等有关,透明圈法只能作为溶磷菌的初步筛选指标。因此,采用无机磷液体培养基对这5株细菌进行复筛,液体摇瓶培养5 d后的溶磷结果显示(表 1),5株细菌的溶磷量范围在43.44-244.13 mg/L之间,各菌株间的溶磷能力存在显著差异,其中以菌株WJ2的溶磷量最高,为244.13 mg/L,显著高于其他4株菌株。
菌株WJ2在无机磷固体培养基上培养72 h后,菌落呈乳白色,油脂状,不透明,边缘整齐,中心凹陷,表面湿润、光滑(图 1-A);革兰氏染色结果表明该菌株属革兰氏阴性细菌(图 1-B);扫描电镜下的个体形态为短杆状(图 1-C);生理生化检测结果显示该菌株可以利用α-D-葡糖、D-果糖、D-天冬氨酸等多种碳、氮源,淀粉水解试验为阴性,接触酶反应为阳性,葡萄糖发酵产酸产气,甲基红反应为阴性,V-P测定为阳性,能产生明胶酶使明胶分解为氨基酸,温度在40℃时不能生长,NaCl浓度在3%时不能生长(表 2)。

|
| A:无机磷培养基上WJ2菌落形态及透明圈;B:革兰氏染色结果(40×);C:扫描电镜图片(12 000×) 图 1 菌株WJ2的菌落形态、溶磷圈及个体形态 |
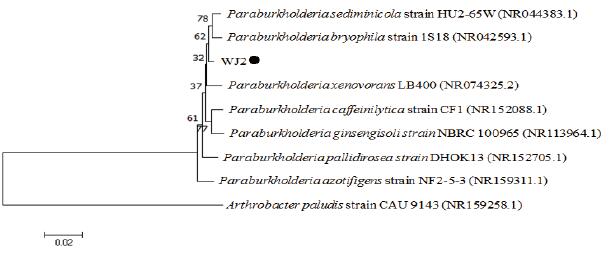
利用通用引物27F和1492R引物扩增获得WJ2的16S rDNA序列的长度为1 352 bp。将该序列进行BLAST比对结果显示,菌株WJ2的16S rDNA核苷酸序列与Paraburkholderia caffeinilytica(NR152088.1)和P. sediminicola (NR044383.1)的16S rDNA核苷酸序列同源性最高,分别为99.18%和99.04%。由多个细菌16S rDNA序列构建的系统发育树可以看出菌株WJ2与外源菌株Arthrobacter paludis不在一个分支,亲缘关系较远,而与多个Paraburkholderia sp.菌株聚为一个分支,表明菌株WJ2与Paraburkholderia sp.属的亲缘关系更近(图 2)。因此,结合菌株WJ2生理生化特性、菌落特征、菌体个体形态以及菌株16S序列的比对结果和系统进化分析,将菌株WJ2鉴定为伯克霍尔德氏菌Paraburkholderia sp.。菌株WJ2的16SrDNA序列提交至GenBank的登录号为MT065821。
|
| 分支上的数值代表在经过1 000次重复抽样后,此分支的自展支持率 图 2 菌株WJ2及其近缘种的系统进化树分析 |
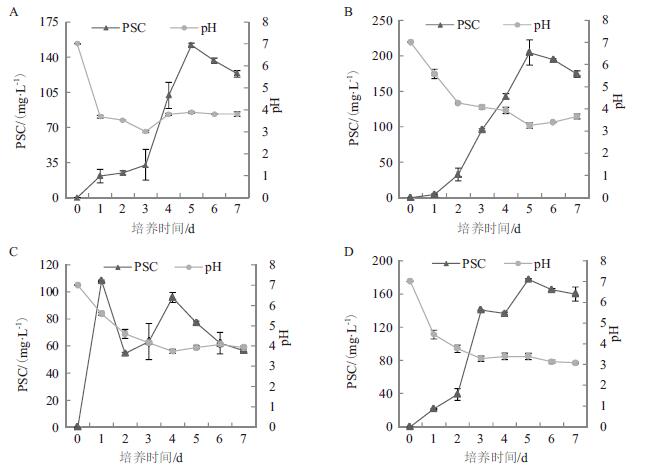
结果表明菌株WJ2对4种磷酸盐均有一定的溶解能力,表现出该菌株具有广谱的溶磷性(图 3)。其中,对磷酸三钙的溶解量最大,磷酸铝和磷酸铁次之,磷酸氢钙最差,其最大溶磷量分别为204.42 mg/L、177.70 mg/L、151.82 mg/L和108.19 mg/L。此外,Pearson相关分析表明,菌株WJ2分别在磷酸铁(r=-0.500,P < 0.05)(图 3-A)、磷酸三钙(r=-0.844,P < 0.01)(图 3-B)、磷酸氢钙(r=-0.533,P < 0.01)(图 3-C)和磷酸铝(r=-0.787,P < 0.01)(图 3-D)培养液中的溶磷量与pH变化之间均呈显著负相关关系。
|
| A:磷酸铁FePO4·2H2O;B:磷酸三钙Ca3(PO4)2;C:磷酸氢钙CaHPO4·2H2O;D:磷酸铝AlPO4 图 3 不同磷源培养液中溶磷量(PSC)和pH的动态变化 |
菌株WJ2在不同碳源中对磷酸三钙的溶解能力差异显著(图 4)。以乳糖、葡萄糖为碳源时该菌株的溶磷量最高,分别为252.93 mg/L和244.61 mg/L,显著高于在其他碳源条件下的溶磷量:以蔗糖为碳源时的溶磷量次之,为197.87 mg/L;以可溶性淀粉为碳源时的溶磷量最低,为20.14 mg/L。这表明该菌株对碳源的利用可能主要以单糖和双糖为主,对多糖的利用率较低。
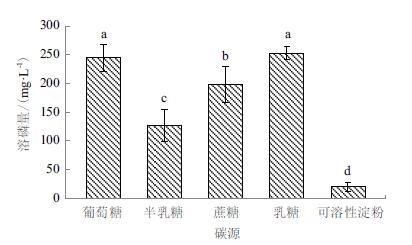
|
| 不同小写字母表示处理间差异显著(P < 0.05),下同 图 4 碳源种类对溶磷菌WJ2溶解磷酸三钙的影响 |
不同氮源对菌株WJ2溶解磷酸三钙的影响差异显著(图 5)。以尿素为氮源时该菌株的溶磷量最大,为238.19 mg/L;以硫酸铵、硝酸铵为氮源时的溶磷量次之,但与尿素无显著差异,分别为211.70 mg/L和207.00 mg/L;其次是以硝酸钾为氮源,溶磷量为160.26 mg/L;以氯化铵为氮源时的溶磷量最低,为100.48 mg/L。
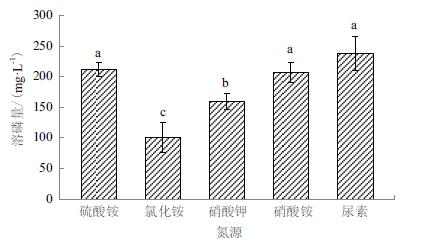
|
| 图 5 氮源种类对溶磷菌WJ2溶解磷酸三钙的影响 |
C/N比对菌株WJ2溶解磷酸三钙的影响结果显示,培养液中C/N能显著影响菌株WJ2的溶磷能力,且回归分析表明两者间的关系符合线性模型(R2=0.924,P < 0.05)(图 6)。以C/N比为10:1时菌株WJ2的溶磷量最大,为283.32 mg/L,显著高于其他3组C/N比处理;当C/N比为25:1时的溶磷量次之,为204.70 mg/L;C/N比为60:1和40:1时溶磷量最低,分别为74.30 mg/L和84.93 mg/L,且两者间的差异不显著。
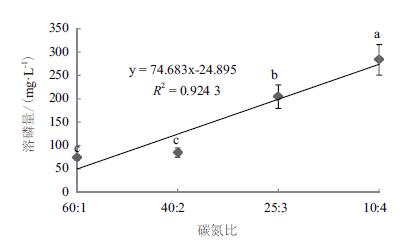
|
| 图 6 氯化钠浓度对溶磷菌WJ2溶解磷酸三钙的影响 |
不同NaCl浓度对菌株WJ2溶解磷酸三钙的影响差异显著,且回归分析表明两者间的关系符合线性模型(R2=0.844,P < 0.05)(图 7)。当培养基中NaCl浓度为0 g/L时,菌株WJ2的溶磷量最大,为234.78 mg/L;随着NaCl浓度的增加,菌株的溶磷量呈下降趋势,当NaCl浓度分别为2.5 g/L、5 g/L、10 g/L和20 g/L时,其溶磷量依次为141.00 mg/L、105.59 mg/L、54.74 mg/L、2.18 mg/L。
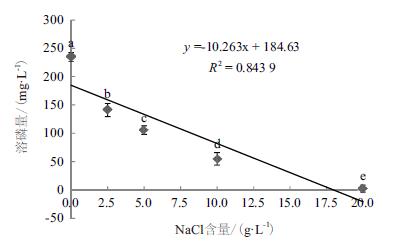
|
| 图 7 氯化钠浓度对溶磷菌WJ2溶解磷酸三钙的影响 |
菌株WJ2在不同初始pH中对磷酸三钙的溶解能力差异显著,且回归分析表明两者间的关系符合二次模型(R2=0.807,P < 0.05)(图 8)。当培养基的初始pH为8.0时,菌株WJ2的溶磷量最大,显著高于其他初始pH处理,为218.33 mg/L;当初始pH为7.0和6.0时,菌株WJ2的溶磷量仍维持在较高水平,分别为183.73 mg/L和177.61 mg/L,仅次于初始pH为8.0的处理;但当初始pH > 8.0和pH < 6.0时菌株WJ2的溶磷能力受到显著影响,溶磷量发生骤减。表明该菌株适应于在中性偏碱性的环境中进行溶磷活动。

|
| 图 8 初始pH对溶磷菌WJ2溶解磷酸三钙的影响 |
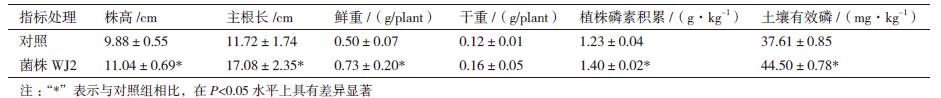
培养60 d后,接种菌株WJ2的马尾松幼苗与对照相比,其株高、主根长度和鲜重都显著增加,增加量分别达11.74%、45.73%、46.00%,其干重也增加了33.33%。此外,接种菌株WJ2也显著提高土壤中有效磷含量和植株磷素含量,与对照比,分别增加了18.32%、13.82%(表 3)。表明菌株WJ2能够提高土壤中有效磷含量,促进马尾松幼苗的生长。
溶磷微生物的溶磷能力主要受自身遗传特性的影响,不同溶磷微生物的溶磷能力差异很大,溶磷微生物对不同难溶性磷也有选择性,通常菌株能溶解的难溶性磷源越广,则说明其溶磷特性越好[18-19]。刘文干等[10]筛选的洋葱伯克霍尔德氏菌(Paraburkholderia cepacia)对磷酸三钙、磷酸铁、磷酸铝、磷矿粉的溶解量分别为125.79 mg/L、60.02 mg/L、227.34 mg/L和321.15 mg/L。萧龙珍等[11]筛选得到的巨大芽孢杆菌(B. megaterium)对磷酸三钙的溶解量为189.20 mg/L。薛冬等[20]从牡丹根际分离到的白网链霉菌(Streptomyces albireticuli)在不同磷源培养液中溶磷量依次为磷酸钙(158.5 mg/L) > 磷酸铝(139.9 mg/L) > 磷酸铁(127.7 mg/L) > 卵磷脂(45.6 mg/L)。樊晶晶等[21]在连续监测黑曲霉(Aspergillus niger)溶解磷酸三钙时,其溶磷量在36 h后达到稳定值,为4.7 mg/L。本研究从马尾松根际筛选出的伯克霍尔德菌WJ2对磷酸三钙、磷酸铁、磷酸氢钙和磷酸铝的溶解能力分别达到204.42 mg/L、151.82 mg/L、108.19 mg/L和177.70 mg/L,表现出良好的溶磷能力。由于磷酸三钙较磷酸铁、磷酸铝、磷酸氢钙相比更易被解离,故多数研究结果表明,溶磷菌对磷酸钙的溶解能力大于磷酸铝、磷酸氢钙和磷酸铁,这与本实验得出的结果相似[7, 20, 22]。此外,大部分研究认为,溶磷菌溶磷过程中的溶磷量和培养液pH间存在显著相关关系[7, 22]。在本研究中,对伯克霍尔德菌WJ2在不同磷源中的溶磷动态进行监测时,发现其在磷酸铁、磷酸三钙、磷酸氢钙和磷酸铝培养液中的溶磷量与培养液pH呈显著负相关关系,表明分泌有机酸类物质导致培养液pH值的下降可能是该菌株溶解难溶性磷酸盐的重要因素之一。
因碳、氮源作为微生物的能源物质,其种类会影响溶磷微生物的生长代谢,进而影响其溶解磷酸盐的能力[23]。故本研究设置了不同碳源、氮源探究伯克霍尔德菌WJ2的溶磷特性,结果表明其在以乳糖、葡萄糖为碳源和尿素、硫酸铵、硝酸铵为氮源时均能正常利用并发挥较好的溶磷能力。这与乔志伟等[22]和萧龙珍等[11]的结果相似。同时,溶磷菌的溶磷能力也受碳氮比的影响,且通常碳氮比越低,菌株的溶磷能力越强[23]。在本研究中,随着培养基碳氮比的降低,菌株WJ2对磷酸三钙的溶解能力随之增强,在碳氮比为10:1时,溶磷量达到了最大值。不同溶磷微生物溶解难溶性磷酸盐所需最适初始pH值有所不同,pH过高或过低都影响溶磷能力。Zeng等[5]的研究表明,中性环境更有利于弗雷德里克斯堡假单胞菌(Pseudomonas frederiksbergensis)溶解磷酸盐。李豆豆等[7]发现,初始pH为7-8时更适宜草酸青霉菌PSF1的生长,同时溶磷能力最强。本研究中,菌株WJ2在初始培养液pH值为8时的溶磷能力最高,随着初始pH的升高或降低,其溶磷能力会随之降低。此外,大部分研究表明,溶磷菌的溶磷能力在一定程度上会随着培养液NaCl的含量增加而降低,这与本实验得出的结果相似[5]。溶磷微生物能活化土壤中难溶性磷,提高土壤中有效磷水平,进而提高植物对磷素的吸收率并促进其生长[19, 24-26]。在本实验中,接种伯克霍尔德菌WJ2的马尾松幼苗与对照相比,其株高、主根长、鲜重等生物量均得到显著提高,以及植株磷素含量、根际土壤有效磷含量也显著增加。
4 结论从马尾松根际筛选到一株高效溶磷细菌,鉴定为伯克霍尔德菌WJ2。该菌株对磷酸三钙、磷酸铝、磷酸铁和磷酸氢钙等多种难溶性磷酸盐有较好的溶磷能力; 菌株WJ2在以乳糖、葡萄糖作为碳源,尿素、硫酸铵、硝酸铵等作为氮源、在C/N为10:1、NaCl含量为0 g/L、pH为8.0的条件中都能表现出较强的溶磷能力; 在盆栽试验中,菌株WJ2可提高土壤有效磷含量,促进植株对磷素的吸收,促进马尾松幼苗的生长。
| [1] |
梅新兰, 闪安琪, 蒋益, 等. 适应玉米的溶磷细菌筛选及其对玉米生长的影响[J]. 土壤学报, 2016, 53(2): 502-509. Mei XL, Shan AQ, Jiang Y, et al. Screening of phosphate-solubilizing bacteria adaptable to corn and effects of the bacteria on the growth of corn[J]. Acta Pedologica Sinica, 2016, 53(2): 502-509. |
| [2] |
Chakdar H, Dastager SG, Khire JM, et al. Characterization of mineral phosphate solubilizing and plant growth promoting bacteria from termite soil of arid region[J]. 3 Biotech, 2018, 8(11): 463-467. DOI:10.1007/s13205-018-1488-4 |
| [3] |
安卫红, 张淑民. 石灰性土壤无机磷的分级及其有效性的研究[J]. 土壤通报, 1991, 22(1): 35-37. An WH, Zhang SM. The classification of calcareous soil inorganic phosphorus and its effectiveness[J]. Chinese Journal of Soil Science, 1991, 22(1): 35-37. |
| [4] |
郭斗斗, 黄绍敏, 张珂珂, 等. 有机无机外源磷素长期协同使用对潮土磷素有效性的影响[J]. 植物营养与肥料学报, 2018, 24(6): 1651-1659. Guo DD, Huang SM, Zhang KK, et al. Effects of long-term synergistic use of organic and inorganic exogenous P on phosphorus availability in fluvo-aquic soil[J]. Journal of Plant Nutrition and Fertilizers, 2018, 24(6): 1651-1659. |
| [5] |
Zeng QW, Wu XQ, Wen XY. Identification and characterization of the rhizosphere phosphate-solubilizing bacterium Pseudomonas frederiksbergensis JW-SD2 and its plant growth-promoting effects on poplar seedlings[J]. Annals of Microbiology, 2016, 66(4): 1343-1354. DOI:10.1007/s13213-016-1220-8 |
| [6] |
Zaidi A, Khan MS, Ahemad M, et al. Plant growth promotion by phosphate solubilizing bacteria[J]. Acta Microbiologica Et Immunologica Hungarica, 2009, 56(3): 263-284. DOI:10.1556/AMicr.56.2009.3.6 |
| [7] |
李豆豆, 尚双华, 韩巍, 等. 一株高效解磷真菌新菌株的筛选鉴定及解磷特性[J]. 应用生态学报, 2019, 30(7): 2384-2392. Li DD, Shang SH, Han W, et al. Screening, identification, and phosphate solubilizing characteristics of a new efficient phosphate solubilizing fungus[J]. Chinese Journal of Applied Ecology, 2019, 30(7): 2384-2392. |
| [8] |
Vassileva M, Azcon R, Barea JM, et al. Application of an encapsulated filamentous fungus in solubilization of inorganic phosphate[J]. Journal of Biotechnology, 1998, 63(1): 67-72. DOI:10.1016/S0168-1656(98)00074-1 |
| [9] |
钟传青.解磷微生物溶解磷矿粉和土壤难溶磷的特性及其溶磷方式研究[D].南京: 南京农业大学, 2004. Zhong CQ. Studies on solubilizing effects on phosphate rock powder and insoluble phosphorus in soil of P-solubilizing microorganisms and their mechanism[D]. Nanjing : Nanjing Agriculture University, 2004. |
| [10] |
刘文干, 何园球, 张坤, 等. 一株红壤溶磷菌的分离、鉴定及溶磷特性[J]. 微生物学报, 2012, 52(3): 326-333. Liu WG, He YQ, Zhang K, et al. Isolation, identification and characterization of a strain of phosphate-solubilizing bacteria from red soil[J]. Acta Microbiologica Sinica, 2012, 52(3): 326333. |
| [11] |
萧龙珍, 崔俊涛, 刘淑霞, 等. 玉米根际溶磷菌Bucillus megaterium XS2的筛选鉴定与溶磷特性分析[J]. 吉林农业大学学报, 2018, 40(1): 71-79. Xiao LZ, Cui JT, Liu SX, et al. Screening, identification and phosphate-solubilizing property analysis of inorganic phosphatesolubilizing bacteria Bucillus megaterium XS2 isolated from maize rhizosphere soil[J]. Journal of Jilin Agricultural University, 2018, 40(1): 71-79. DOI:10.13327/j.jjlau.2017.3611 |
| [12] |
张英, 芦光新, 谢永丽, 等. 溶磷菌分泌有机酸与溶磷能力相关性研究[J]. 草地学报, 2015, 23(5): 1033-1038. Zhang Y, Lu GX, Xie YL, et al. The relationship between organic acid secreted from phosphorus-solubilizing bacteria and the phosphate-solubilizing ability[J]. Acta Agrestia Sinica, 2015, 23(5): 1033-1038. |
| [13] |
唐敏.磷对不同种源马尾松种子及幼苗影响的研究[D].贵阳: 贵州大学, 2007. Tang M. Study on effect of phosphorus to germination and seedling of different provenances[D]. Guiyang : Guizhou University, 2007. |
| [14] |
郭飞.促生菌对马尾松生长效应研究[D].南宁: 广西大学, 2012. Guo F. Study on inoculated plant growth-promoting rhizobacteria on growing effect of Pinus massoniana[D]. Nanning : Guangxi University, 2012. |
| [15] |
徐冰, 李白, 秦岭, 等. 不同外生菌根真菌对难溶性磷的活化[J]. 吉林农业大学学报, 2000, 22(4): 76-80. Xu B, Li B, Qing L, et al. Solubilization of rock phosphate by different ectomycorrhizal fungi(in solution culture)[J]. Journal of Jilin Agricultural University, 2000, 22(4): 76-80. |
| [16] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. Dong XZ, Cai MY. Manual for systematic identification of common bacteria[M]. Beijing: Science Press, 2001. |
| [17] |
奥斯伯 FM. 精编分子生物学实验指南[M]. 北京: 科学出版社, 2005. Ausubel FM. Short protocols in molecular biology[M]. Beijing: Science press, 2005. |
| [18] |
赵小蓉, 林启美, 李保国. 溶磷菌对4种难溶性磷酸盐溶解能力的初步研究[J]. 微生物学报, 2002, 42(2): 236-241. Zhao XR, Lin QM, Li BG. The solubilization of four insoluble phosphates by some microorganisms[J]. Acta Microbiologica Sinica, 2002, 42(2): 236-241. |
| [19] |
史发超, 殷中伟, 江红梅, 等. 一株溶磷真菌筛选鉴定及其溶磷促生效果[J]. 微生物学报, 2014, 54(11): 1333-1343. Shi FC, Ying ZW, Jiang HM, et al. Screening, identification of P-dissolving fungus P83 strain and its effects on phosphate solubilization and plant growth promotion[J]. Acta Microbiologica Sinica, 2014, 54(11): 1333-1343. |
| [20] |
薛冬, 黄向东, 杨瑞先, 等. 牡丹根际溶磷放线菌的筛选及其溶磷特性[J]. 应用生态学报, 2018, 29(5): 1645-1652. Xue D, Huang XD, Yang RX, et al. Screening and phosphatesolubilizing characteristics of phosphate-solubilizing actinomycetes in rhizosphere of tree peony[J]. Chinese Journal of Applied Ecology, 2018, 29(5): 1645-1652. |
| [21] |
张丽珍, 樊晶晶, 牛伟, 等. 盐碱地柠条根围土中黑曲霉的分离鉴定及解磷能力测定[J]. 生态学报, 2011, 31(24): 7571-7578. Zhang LZ, Fan JJ, Niu W, et al. Isolation of phosphate solubilizing fungus(Aspergillus niger)from Caragana rhizosphere and its potential for phosphate solubilization[J]. Acta Ecologica Sinica, 2011, 31(24): 7571-7578. |
| [22] |
乔志伟, 洪坚平, 谢英荷, 等. 石灰性土壤拉恩式溶磷细菌的筛选鉴定及溶磷特性[J]. 应用生态学报, 2013, 24(8): 2294-2300. Qiao ZW, Hong JP, Xie YH, et al. Screening, identification and phosphate-solubilizing characteristics of Rahnella sp[J]. Chinese Journal of Applied Ecology, 2013, 24(8): 2294-2300. |
| [23] |
赵小蓉, 林启美, 李保国. C、N源及C/N比对微生物溶磷的影响[J]. 植物营养与肥料学报, 2002, 8(2): 197-204. Zhao XR, Lin QM, Li BG. Effect of C, N sources and C/N ratio on the solubilization of rock phosphate by some microorganisms[J]. Plant Natrition and Fertilizen Science, 2002, 8(2): 197-204. |
| [24] |
王誉瑶, 韦中, 徐阳春, 等. 溶磷菌株组合的溶磷效应及对玉米生长的影响[J]. 植物营养与肥料学报, 2017, 23(1): 262-268. Wang YY, Wei Z, Xu YC, et al. Dissolving capacity of phosphate dissolving bacteria strains combination and their effects on corn growth[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(1): 262-268. |
| [25] |
张云霞, 雷鹏, 许宗奇, 等. 一株高效解磷菌Bacillus subtilis JT-1的筛选及其对土壤微生态和小麦生长的影响[J]. 江苏农业学报, 2016, 32(5): 1073-1080. Zhang YX, Lei P, Xu ZQ, et al. Screening of a high-efficiency phosphate solubilizing bacterium Bacillus subtilis JT-1 and its effects on soil microecology and wheat growth[J]. Jiangsu Journal of Agricultural Sciences, 2016, 32(5): 1073-1080. |
| [26] |
赵龙飞, 徐亚军, 曹冬建, 等. 溶磷性大豆根瘤内生菌的筛选、抗性及系统发育和促生[J]. 生态学报, 2015, 35(13): 4425-4435. Zhao LF, Xu YJ, Cao DJ, et al. Screening, resistance, phylogeny and growth promoting of phosphorus solubilizing bacteria isolated from soybean root nodules[J]. Acta Ecologica Sinica, 2015, 35(13): 4425-4435. |