黄瓜是我国重要的栽培作物,其栽培面积和产量位居世界首位[1]。随着需求量的增加及栽培面积的不断扩大,连作现象严重,导致土传病害日益加重。由尖镰孢黄瓜专化型(Foc)引起的黄瓜枯萎病是影响黄瓜产量的主要土传病害之一,一般可减产15%- 25%,严重时产量减半甚至绝产,已严重制约了设施栽培黄瓜的可持续生产[2]。防治黄瓜枯萎病是黄瓜作物种植中亟待解决的重要产业问题之一。目前生产上的防治方法以化学防控为主,结合抗病品种,田间轮作、嫁接等措施达到防治目的,但化学药剂的使用易造成病原菌抗药性的产生、同时还存在农药残留和生态环境破坏等问题[3]。生物防治主要通过有益微生物调节植物根部微生态环境,修复土壤微生物群落结构和功能,从而抑制土传病原真菌的繁殖,是一种的安全、环保的防治措施[4]。
蚯蚓粪是蚯蚓消化有机废弃物进行生物降解而产生的生物有机肥料[5],具有良好的团粒结构和较高透气性,被广泛应用于有机肥、土壤改良剂和盆栽基质等方面[6]。Ravindran等[7]研究证明,蚯蚓粪堆肥中含有丰富的细菌、放线菌和真菌,对部分植物病害有一定的抑制作用。而且越来越多的研究表明许多具有开发前景的抑菌活性物质由蚯蚓堆肥微生物产生,其防治土传病害的作用也逐步成为现阶段应用研究所关注的热点[8]。
目前应用于黄瓜枯萎病防治的生防菌大部分都是从土壤或植物根际分离所得,从蚯蚓粪中筛选用于黄瓜枯萎病害的防治研究较少。菌株具有拮抗作用的原因之一是能分泌代谢活性物质,同时拮抗作用发挥强弱的关键是其产量的多少,而培养基成分、发酵条件是影响其产量的重要因素。鉴于此,以尖镰孢黄瓜专化型枯萎病菌(Foc)为靶标菌,从蚯蚓粪中分离筛选获得一株具有较强抑制尖镰孢黄瓜专化型病菌活性的解淀粉芽孢杆菌WQ-5,通过单因素筛选和响应面分析法优化菌株WQ-5培养条件,通过防效试验验证拮抗细菌WQ-5对尖镰孢黄瓜专化型引起的黄瓜枯萎病的防治效果,以期为枯萎病的生物防治提供新的菌种资源。
1 材料与方法 1.1 材料病原菌株:尖镰孢黄瓜专化型(Fusarium oxyporum f. sp. cucumerinum)编号为37374和尖镰孢西瓜专化型(Fusarium oxyporum f. sp. niveum)编号为36367的菌种购自中国工业微生物菌种保藏中心;尖镰孢甜瓜专化型(Fusarium oxyporum f. sp. melonis)由宁夏大学园艺实验室保存。
菌株筛选来源:蚯蚓粪采集自宁夏万辉生物环保科技有限公司蚯蚓养殖园,是由活蚯蚓消解新鲜牛粪所得。有机质含量30.6%,氮、磷和钾含量分别为1.6%、1.3%和1.0%,pH 6.9,水分38.5%。
培养基:LB营养琼脂和LB肉汤用于拮抗细菌的分离及培养[9];PDA培养基用于病原真菌的活化及培养[9];KMB培养基用于拮抗细菌的发酵[10]。
供试作物:黄瓜(品种为“德尔99”)。
1.2 方法 1.2.1 蚯蚓粪中拮抗细菌的分离及筛选称取10 g蚯蚓粪样品放入装有90 mL无菌水的三角瓶中,震荡20 min,获得蚯蚓粪悬浮液。将悬浮液稀释后,得到10-4、10-5、10-6系列浓度梯度,然后依次吸取0.1 mL涂布在LB营养琼脂平板上,置于30℃恒温箱中培养24 h,挑取形态各异的菌落进行数次划线纯化,编号并保存于4℃冰箱中备用。
采用平板对峙法在直径为9 cm的PDA平板中心打孔后将直径为5 mm的尖镰孢黄瓜专化型枯萎病病原菌饼放入孔内,把纯化后的菌株用无菌牙签点接至病原菌2.5 cm处,对照为单独接种病原菌的平板,重复3次,在28℃恒温培养箱中培养,于6 d、9 d和12 d时测量病原菌的菌落直径,并计算抑菌率,抑菌率(%)=对照菌落直径-处理菌落直径/(对照菌落直径-5)×100[10]。纯化、保留抑制效果最佳的菌株。同时测定抑制效果最佳菌株对尖镰孢西瓜专化型枯萎病菌和尖镰孢甜瓜专化型枯萎病菌的抑菌效果。
1.2.2 拮抗菌株的鉴定 1.2.2.1 形态学和生理生化鉴定将筛选出的菌株接种于LB平板上,放入恒温培养箱内30℃培养24 h,观察其菌落形态特点以及进行常规革兰氏染色。菌株的生理生化鉴定参考《常见细菌系统鉴定手册》[11]。
1.2.2.2 16S rRNA序列分析及系统发育树的构建将菌株送至北京奥科鼎盛生物技术有限公司,使用细菌16S rRNA基因通用引物27F (5'-AGAGTTTGATCCTGGCTCAG-3')和1492R (5'-CTACGGCTACCTTGTTACGA-3')扩增细菌16S rRNA基因。PCR反应体系:基因组DNA 1.0 μL,10×Buffer 5.0 μL,extaq 0.25 μL,dNTP 2.0 μL,ddH2O 39.75 μL,通用引物各1 μL。PCR反应条件:98℃ 30 s预变性,30个循环(98℃10 s;55℃ 30 s;72℃ 90 s),72℃ 5 min。反应停止后对PCR产物进行回收及测序。在GenBank中进行测序结果BLAST相似性比对,通过MEGA 7.0的Neighbor-Joining进行序列分析并构建系统发育树,Bootstrap自检值设为1 000,确定该菌株的分类地位。
1.2.3 拮抗菌株的最适培养条件优化 1.2.3.1 拮抗菌株的培养条件单因素优化发酵培养基组分优化:在KMB培养基中原有组分不变的前提下,采用不同的碳源(葡萄糖、蔗糖、淀粉、柠檬酸钠和果糖),浓度为20 g/L,接种量2%(接种液浓度为1×108 CFU/mL),装液量20%,pH 7.0,于30℃,180 r/min震荡培养24 h后,测定拮抗菌株发酵液的OD600值;采用不同的氮源(硝酸钾、酵母粉、氯化铵和尿素)替换KMB培养基的蛋白胨,浓度为20 g/L,培养条件与碳源相同,测定拮抗菌株发酵液的生长量(OD600);在KMB培养基中原有组分不变的前提下,采用不同的无机盐(硫酸镁、氯化钠、硫酸锌、硫酸亚铁、硫酸锰),浓度为1.5 g/L,培养条件与碳源相同,测定拮抗菌株发酵液的生长量(OD600)。
发酵条件优化:发酵培养基组分不变,分别在不同接种量(1%-5%)、不同装液量(10%-50%)、不同发酵温度(27-39℃)、不同发酵初始pH值(5- 9)、不同振荡器转速(150-270 r/min)的条件下,测定拮抗菌株发酵液的生长量(OD600)。
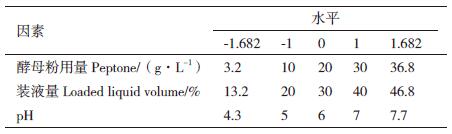
1.2.3.2 响应面分析法优化试验设计基于单因素试验,用OD600作为响应值并以酵母粉用量、装液量和pH为因变量设计出3因素5水平的响应面试验(表 1)。
用抑制菌丝生长速率法[12]测定拮抗菌的抑菌率。将菌悬液1 mL(1×108 CFU/mL)接种于LB液体培养基中制备种子液,30℃、180 r/min振荡培养24 h后将种子液接入优化后的发酵培养基中,在优化条件下培养24 h,10 000 r/min离心10 min,0.22 μm的微孔滤膜过滤上清液后,得到无菌发酵滤液。取45 mL冷却至45℃左右的PDA培养基与5 mL的无菌发酵滤液混匀制成带药平板,中间接种病原菌菌饼(d=5 mm),以不加发酵滤液的PDA培养基平板为对照,28℃培养6 d,用十字交叉法测其生长直径,计算其抑菌率。
1.2.5 拮抗菌株的防效试验种子消毒处理完后,待用。制备尖镰孢黄瓜专化型枯萎病菌孢子悬液:250 mL锥形瓶中加入50 mL PDA液体培养基,接种病原菌,在180 r/min、28℃条件下培养7 d后,用灭菌纱布过滤孢子悬液,再用无菌水稀释,直到浓度为1×107 CFU/mL。拮抗菌株发酵液的制备:将菌株在优化条件下摇瓶发酵,用无菌水稀释浓度至1×108 CFU/mL。
1.2.5.1 室内防效试验种子培养皿发芽试验处理:CK1:无菌水;CK2:尖镰孢黄瓜专化型枯萎病菌孢子悬液;T1:拮抗菌株发酵液;T2:黄瓜枯萎病原菌孢子悬液+拮抗菌株发酵液,CK1、CK2和T1处理用尖镰孢黄瓜专化型枯萎病菌分别浸种30 min,T2处理是先用病原菌孢子悬液浸种30 min,然后用拮抗菌株发酵液浸种30 min。取直径9 cm的培养皿,用无菌双层滤纸覆盖培养皿底部并注入5 mL无菌水润湿,每皿均匀地放入10粒种子,每个处理重复3次[13]。将处理后的培养皿放入设置为湿度60%,光照/黑暗(16 h/8 h)的光照培养箱内。3 d后,测定发芽率、发病率;7 d后,计算活力指数。发芽率(%) =(发芽的种子数/供试种子数)×100,发病率(%) =(发病的种子数/供试种子数)×100,活力指数= (根长+茎长)×发芽率[14]。
1.2.5.2 盆栽防效试验将消毒、催芽后的种子播种于装有灭菌基质的育苗钵中,待植株长至两叶一心时,挑选长势较一致的植株,灌根接种处理液30 mL。处理1:黄瓜枯萎病原菌孢子悬液,处理2:尖镰孢黄瓜专化型枯萎病菌孢子悬液+拮抗菌株发酵液。每处理10盆,随机排列。在灌根后第15天调查和记录各个处理的病株数、发病症状,计算发病率、病情指数和防治效果,病情指数及防病效果的计算参考吕恒[15]的方法。病情指数(%)= Σ (各级病株数×相对级数值)/(调查总株数×最高病级代表值)× 100;防治效果(%)=(空白对照病情指数-处理区病情指数)/对照组病情指数× 100。
1.2.6 数据分析选择SPSS Statistics 17.0软件进行数据统计分析及邓肯氏新复极差法进行差异显著性检验;Origin 8.0软件用于绘图;16S rRNA序列分析和系统发育树构建采用MEGA 7.0软件;响应面试验设计选用Design-Expert 8.0软件。
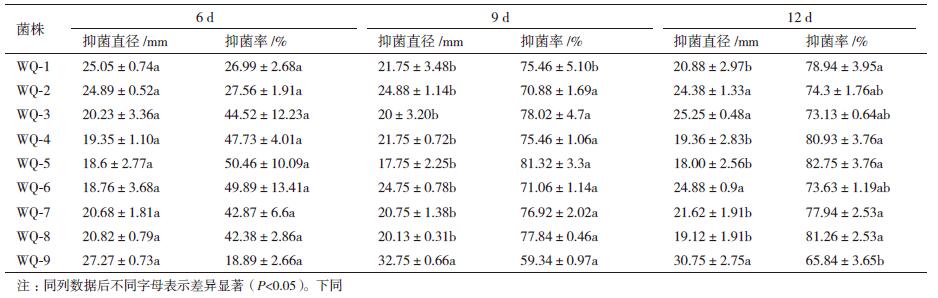
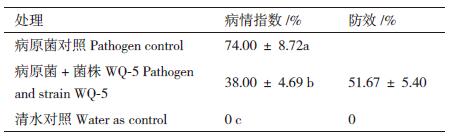
2 结果 2.1 蚯蚓粪中拮抗细菌的分离纯化利用稀释平板法,共分离纯化到352株细菌,运用平板对峙法对这352株细菌进行枯萎病菌抑制性试验,其中56株细菌对尖镰孢黄瓜专化型枯萎病菌有抑制作用。重复试验获得9株对尖镰孢黄瓜专化型枯萎病菌明显抑制作用的拮抗菌(编号为WQ1-9)。其中WQ-5在6 d、9 d和12 d时的抑菌直径和抑菌率均高于其他拮抗菌。同时WQ-5对尖镰孢西瓜专化型枯萎病菌和尖镰孢甜瓜专化型枯萎病菌也具有明显的抑制作用,抑菌率分别是51.48%和41.74%(6 d),故将菌株WQ-5作为后续研究目标(表 2,图 1)。
|
| 图 1 菌株WQ-5对尖镰孢黄瓜专化型枯萎病菌的拮抗作用 |
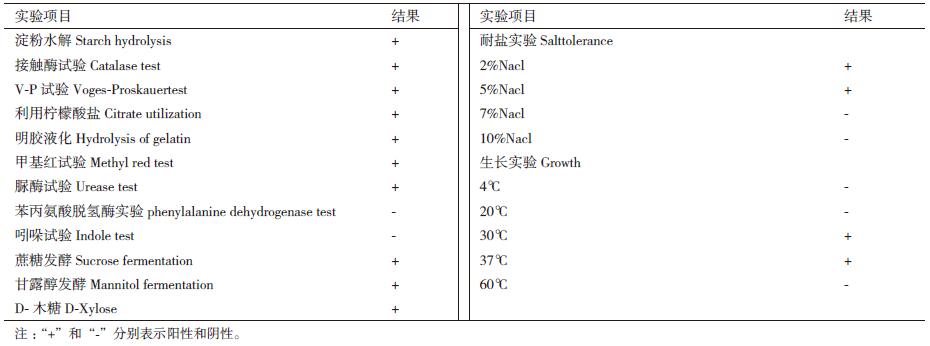
菌株WQ-5在LB平板上培养24 h,其菌落形状接近圆形且边缘不规则,菌落表面干燥、粗糙(图 2-A)。镜检后发现,菌株WQ-5是革兰氏阳性细菌,形态呈杆状,且产芽孢(图 2-B),结合菌株WQ-5的生理生化测定(表 3),初步鉴定拮抗菌WQ-5为芽孢杆菌属(Bacillus spp.)。

|
| 图 2 菌株WQ-5在LB平板培养基(A)及光学显微镜下(B)的形态特征 |
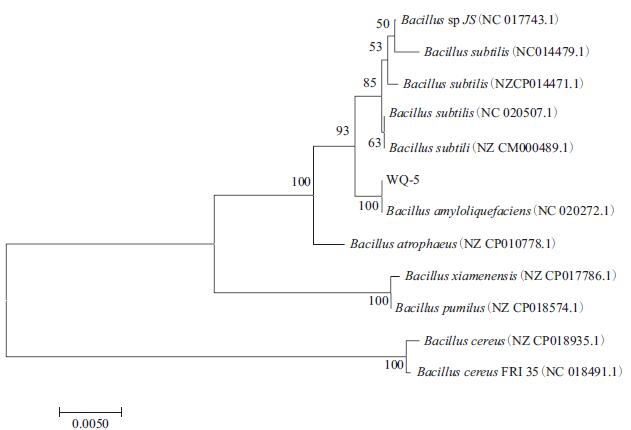
将菌株WQ-5基因序列(1 423 bp)提交至GenBank数据库进行BLAST相似性比对,登录号为MN736614,并构建系统发育进化树。结果显示,菌株WQ-5与Bacillus amyloliquefaciens一致性达到100%(图 3),生理生化指标也与之相符,故菌株WQ-5被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
|
| 图 3 菌株WQ-5基于16S rRNA基因序列的系统发育进化树 |
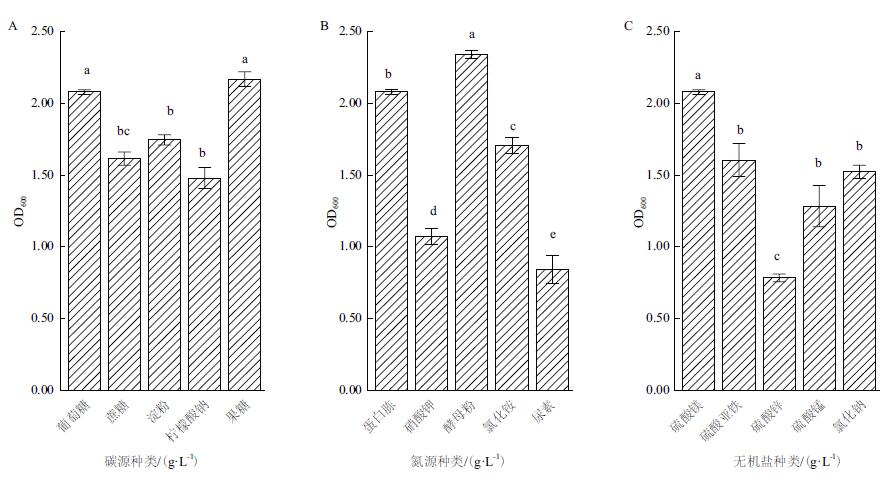
当基础培养基内的碳源被果糖代替后,菌株WQ-5的生长量高于其他组,OD600为2.170;当氮源替换为酵母粉时效果最好,菌株WQ-5的OD600为2.341;当无机盐使用硫酸镁时,显著提高了菌株WQ-5的生长量(图 4)。因此,选用果糖+酵母粉+硫酸镁作为优化培养基组分。
|
| 图 4 不同碳源(A)、氮源(B)和无机盐(C)对菌株WQ-5生长量的影响 |
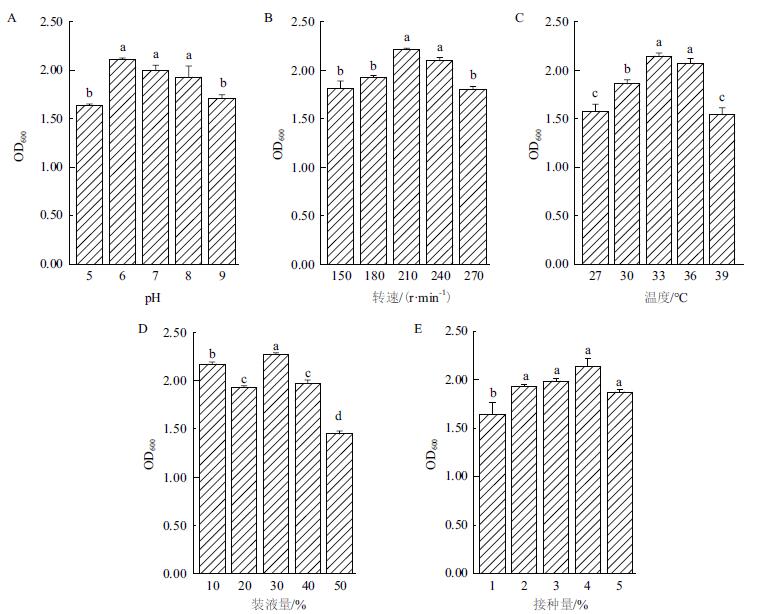
发酵条件优化结果如图 5所示。整体来看,对所有发酵因素而言,菌体生长量呈现“正态分布”特征,即“两头低,中间高”,说明每个发酵因素均存在一个最适条件。当pH为6.0时,生长量最高(图 5-A)。因此,以6.0为最适初始pH;当摇床转速为210 r/min时菌体生长量最大。继续增大摇床转速,菌体自溶,菌体生长量下降。因此,选择210 r/min作为菌株WQ-6的最适摇床转速(图 5-B)。对WQ-5进行梯度温度培养,结果表明菌株生长量在温度为33℃时获得最大值(图 5-C)。菌株WQ-5在装液量为30%时,生长量最大。因此选择30%作为菌株WQ-5的最适装液量(图 5-D)。菌株WQ-5的接种量在1%-4%之间,其菌体量随接种量的增大而增加,4%时菌体量最大。因此选择4%作为菌株WQ-5的最适接种量(图 5-E)。
|
| 图 5 不同初始pH(A)、转速(B)、温度(C)、装液量(D)和接种量(E)对菌株WQ-5生长量的影响 |
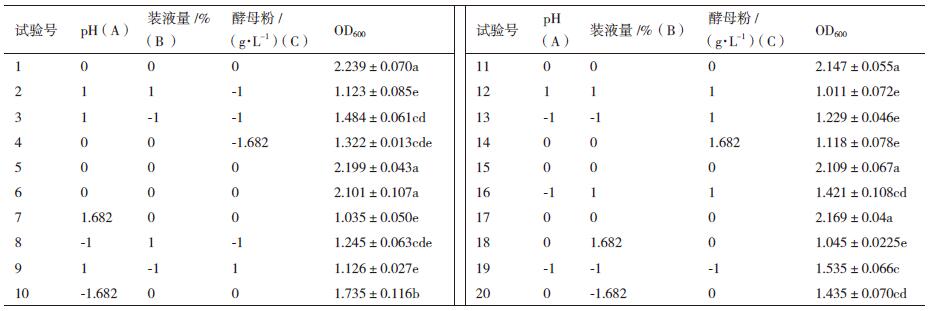
利用中心组合试验设计,在单因素基础上进一步优化发酵条件,以装液量、酵母粉用量和pH为响应变量,OD600 为响应值,进行响应面试验(表 4),回归分析结果如表 5。得到回归方程:
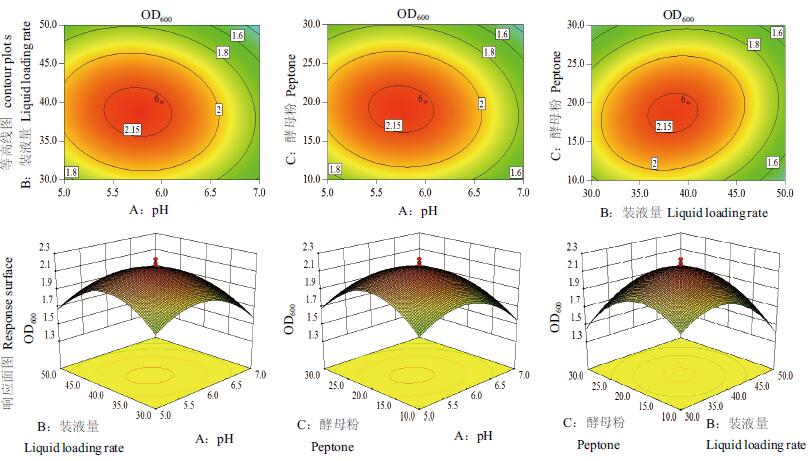
响应面图和等高线图反映了pH、装液量和酵母粉用量3个因素的交互作用对菌体量的影响。等高线形状密集成椭圆形,响应面坡度越陡、表示两因素的交互作用越显著,而圆形表示不显著[16]。如图 6所示,酵母粉用量与装液量对OD600的交互作用显著(P < 0.05),pH与酵母粉用量和pH与装液量之间的交互作用不显著(P > 0.05),与方差分析结果一致。在上述模型的基础上,计算回归方程的极值(Design Expert 8.0软件),由二次多项回归方程得出3个因素的最佳值分别是装液量38.6%、pH 5.8和酵母粉用量18.9 g/L。在上述条件下,预测的OD600的最大值为2.185。在最佳培养条件下进行3次平行实验,获得OD600的平均值为2.214,接近于预测值,该模型可以良好地反映菌株WQ-5实际的发酵情况。
|
| 图 6 各因素交互作用的响应面与等高线图 |
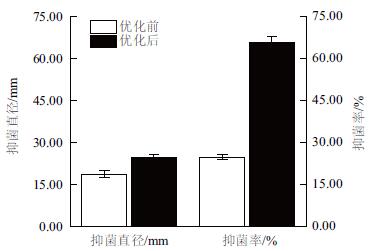
将菌株WQ-5在斜面培养基上活化后分别接种到不同的发酵培养基(未优化/优化)中开始发酵试验。与优化前进行对比,抑菌直径和抑菌率分别提高了24.8%和抑菌率30.39%(图 7)。
|
| 图 7 发酵条件优化处理对菌株WQ-5抑菌直径和抑菌率的影响 |
如图 8所示,菌株WQ-5发酵液处理黄瓜种子的根长、茎长和Ⅵ指数明显高于清水(CK1)和病原菌(CK2)对照,同时降低了发病率。与病原菌对照(CK2)处理相比,T2处理的种子发芽率由20%提高到50%,发病率由20%降低到0,种子的根长、茎长和活力指数分别由68.47 mm、23.21 mm和18.34%提高到73.26 mm、27.65 mm和50.45%,提高了7.0%、19.09%和175.14%。综合以上,拮抗菌株WQ-5可以有效降低种子发病率并提升发芽率,同时使种子的根、茎加速生长,且提高了活力指数。
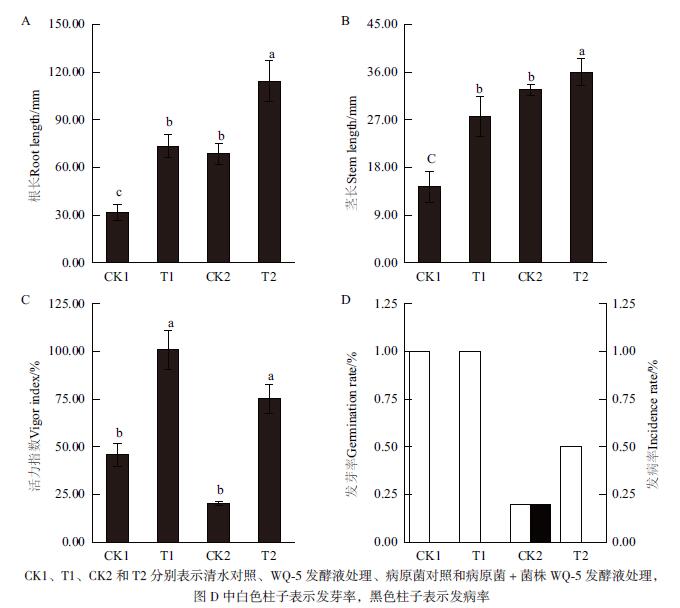
|
| 图 8 菌株WQ-5发酵液对黄瓜种子根长(A)、茎长(B)、活力指数(C)、发芽率和发病率(D)的影响 |
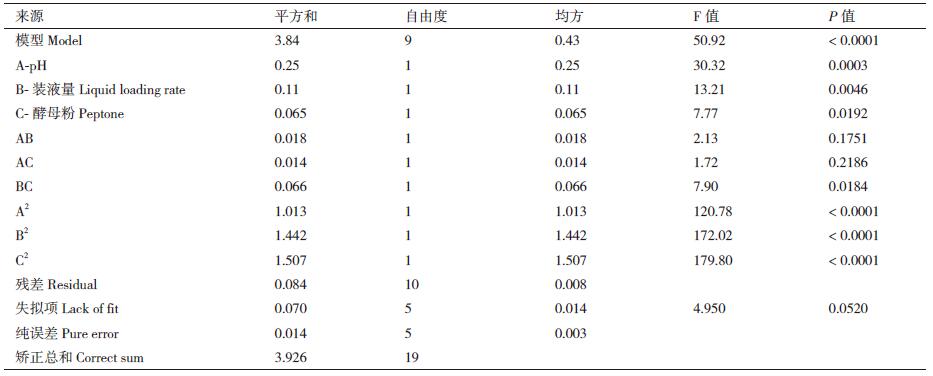
盆栽防效试验结果表明菌株WQ-5在温室条件下能有效地防治尖镰孢黄瓜专化型引起的黄瓜枯萎病的发生(表 6)。培养15 d后,对照组幼苗的发病率达到74%,施加WQ-5菌液处理组发病率为38%,病情指数下降48.65%,防治效果为51.67%,因此拮抗菌WQ-5有较好的生防潜力。
近年来,芽孢杆菌属因能耐受高温、强紫外线和干旱等极端环境已成为理想的生防菌筛选对象[17]。芽孢杆菌属被研究用来作为生防菌剂防治植株病害的菌种有很多,被报道比较多的是枯草芽孢杆菌(B.subtilis)[18]、解淀粉芽孢杆菌(B.amyloliquefaciens)[19]、多粘芽孢杆菌(B.polymyxa)[20]和蜡样芽孢杆菌(B.cereus)等[21]。本实验室从蚯蚓堆肥中分离筛选获得一株解淀粉芽孢杆菌WQ-5,平板对峙试验试验和防效试验结果表明WQ-5对黄瓜枯萎病具有较强的抑制作用。
代谢产物是生防菌发挥生物防治作用的重要物质基础,其产量的高低直接影响生防菌株的应用效果[22]。发酵是获得大量微生物活性代谢产物的基础,不同的培养基营养成分和发酵条件可显著影响微生物细胞的生命活动,进而影响菌株代谢产物的产率[23]。许多研究表明,优化生防菌培养液组成成分和培养条件,可以促进菌体的生长量增加,并提高抗菌活性物质的产量及防效[22, 24]。关于生防菌株解淀粉芽孢杆菌发酵工艺优化的研究报道很多:如梁艳琼等[25]对解淀粉芽孢杆菌(B.amyloliquefaciens) JNC2菌株的发酵条件及最适发酵培养基成分进行优化,优化后的发酵条件为初始pH 6.0,发酵温度34℃,转速200 r/min,装液量为60 mL/250 mL,接种量7%,发酵时间72 h[25];最佳培养基为蛋白胨0.4%,酵母粉0.8%,木糖2%,氯化铵0.6%,硫酸镁0.2%,优化后发酵滤液的抑菌活性显著提高了32.61%[25];卢彩鸽等[26]针对番茄灰霉病菌筛选获得的菌株MH71的最佳产抗菌物质的培养基组份为玉米粉36.6 g/L,葡萄糖14 g/L,牛肉膏3.2 g/L,蛋白胨7 g/L,碳酸钙8 g/L,氯化钠1.33 g/L,K2HPO4 0.8 g/L和MgSO4 0.4 g/L[26];最适发酵条件为发酵温度30℃,转速200 r/min,起始pH 7.0,接种量3%,装液量100 mL/500 mL,发酵时间为72 h,优化后菌株的抑菌活性提高了37.4%[26]。李娟等[27]采用单因素试验和正交试验优化解淀粉芽孢杆菌LJ1发酵工艺,优化后的摇瓶发酵条件为温度30℃,初始pH 5,转速200 r/min,装液量50 mL/250 mL;优化后的发酵培养基为马铃薯200 g,黄豆粉20 g,蔗糖10 g,氯化镁1.5 g,蒸馏水1 000 mL[27]。优化后的菌株LJ1发酵液对Botrytis cinerea盆栽实验防效达51.08%。由此可以看出,不同菌株所需的养分组成和发酵条件存在差异,可能是菌株的来源不同和菌株本身的生物学特性,每个菌株都有其独特的营养需求和生长条件,所以其发酵工艺不能一概而论,但经发酵工艺优化后的菌株其生防效果较之前均有提高,所以需选择选择适合菌株自身生长的培养基成分和发酵条件。
响应面分析法通过局部试验回归拟合因素与结果间的全局函数关系,得到准确有效的试验结论,能在整个考察区域上确定各个因素的最佳组合及最优响应值,可信度高[28-29]。当前,采用响应面法优化黄瓜枯萎病拮抗菌培养条件的报道较少。本研究以菌株WQ-5的生长量作为考量指标,通过单因素和响应面分析法对菌株WQ-5的培养条件进行了优化,优化后的培养条件明显促进了菌体生长量,优化后的抑菌直径和抑菌率较优化前分别提高了24.8%和30.39%。种子发芽和盆栽防效试验结果表明菌株WQ-5发酵液使种子发病率降低了20%,发芽率提高了150%,种子的根长、茎长和活力指数显著提高,植株病情指数下降了48.65%,对黄瓜幼苗的防治效果达到了51.67%,说明拮抗菌WQ-5具有较强的生防潜力。但本研究未检测菌株WQ-5在植株体内不同部位的定殖动态,同时对其防御病害机理未做探究,如其与植株的防御基因表达、酶活性变化等植物诱导抗性的相关关系等,这些问题还需进一步研究,从而全面揭示解淀粉芽孢杆菌WQ-5对黄瓜枯萎病的防治机制。
4 结论从蚯蚓粪中筛选得到的能有效抑制尖镰孢黄瓜专化型枯萎病菌的拮抗菌株WQ-5,鉴定为解淀粉芽孢杆菌。使用单因素分析结合响应面分析法优化该菌培养条件后,得到最佳培养条件为果糖30 g/L,酵母粉18.9 g/L,硫酸镁3 g/L,磷酸氢二钾1.5 g/L甘油1 g/L,接种量4%,装液量38.6%,转速210 r/min,温度33℃,pH 5.8。与优化前进行对比,菌株WQ-5的抑菌直径和抑菌率分别提高了24.8%和抑菌率30.39%。防效试验表明,菌株WQ-5能有效促进种子生长且提高活力指数,降低了黄瓜种子和植株的发病率,使植株的病情指数下降了48.65%,防治效果为51.67%,生防效果良好。
| [1] |
徐彦刚, 贺振, 李瑞, 等. 黄瓜枯萎病研究进展[J]. 中国瓜菜, 2018, 31(6): 1-6. Xu YG, He Z, Li R, et al. Research progress of cucumber fusarium wilt[J]. China Cucurbits and Vegetables, 2018, 31(6): 1-6. |
| [2] |
杨侃侃, 刘晓虹, 陈宸, 等. 黄瓜枯萎病研究进展[J]. 湖南农业科学, 2019(6): 121-124. Yang KK, Liu XH, Chen C, et al. Research progress of cucumber fusarium wilt[J]. Hunan Agricultural Sciences, 2019(6): 121-124. |
| [3] |
李欢, 曹雪梅, 陈茹, 等. 海洋多黏类芽孢杆菌 L_1-9 菌株粉剂对黄瓜的促生防病作用[J]. 河南农业科学, 2017, 46(12): 65-69. Li H, Cao XM, Chen R, et al. Effect of Marine Paenibacillus Polymyxa L_1-9 powder on cucumber growth and disease occurrence[J]. Journal of Henan Agricultural Sciences, 2017, 46(12): 65-69. |
| [4] |
蒲子婧, 张艳菊, 刘东, 等. 黄瓜枯萎病生物防治策略研究进展[J]. 中国蔬菜, 2011(6): 9-14. Pu ZJ, Zhang YJ, Liu D, et al. Research progress in biological control strategies for fusarium wilt of cucumber[J]. China Vegetables, 2011(6): 9-14. |
| [5] |
徐宪斌. 蚯蚓粪配施化肥对玉米根际土壤生物学特征的影响[J]. 水土保持通报, 2017, 37(1): 78-82. Xu XB. Effects of vermicompost co-applied with inorganic fertilizer on soil biological characteristics in rhizosphere of maize[J]. Bulletin of Soil and Water Conservation, 2017, 37(1): 78-82. |
| [6] |
Parastesh F, Alikhani HA, Etesa H. Vermicompost enriched with phosphate-solubilizing bacteria provides plant with enough phosphorus in a sequential cropping under calcareous soil conditions[J]. Journal of Cleaner Production, 2019, 221: 27-37. DOI:10.1016/j.jclepro.2019.02.234 |
| [7] |
Ravindran B, Wong WC, Selvam A, et al. Influence of microbial diversity and plant growth hormones in compost and vermicompost from fermented tannery waste[J]. Bioresource Technology, 2016, 217: 200-204. DOI:10.1016/j.biortech.2016.03.032 |
| [8] |
汪学军, 闫双林, 闵长莉, 等. 蚯蚓粪中放线菌分离及其抗菌活性研究[J]. 中国中药杂志, 2015, 40(4): 614-618. Wang XJ, Yan SL, Min CL, et al. Isolation and antimicrobial activities of actinomycetes from vermicompost[J]. China Journal of Chinese Materia Medica, 2015, 40(4): 614-618. |
| [9] |
杨革. 微生物学实验教程[M]. 北京 : 科学出版社, 2004. Yang G. Microbiology experiment course[M]. Beijing : Science Press, 2004. |
| [10] |
方中达. 植病研究方法[M]. 北京 : 中国农业出版社, 1998. Fang ZD. Plant pathology research methods[M]. Beijing : China Agriculture Press, 1998. |
| [11] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京 : 科学出版社, 2001. Dong XZ, Cai MY. Common bacterial system identification manual[M]. Beijing : Science Press, 2001. |
| [12] |
牛世全, 李渭娟, 李海云, 等. 河西走廊盐碱土壤中抗马铃薯干腐病放线菌的筛选鉴定[J]. 西北师范大学学报 :自然科学版, 2017, 53(2): 94-98. Niu SQ, Li WJ, Li HY, et al. Screening of Actinomyces on antagonism to Fusariun spp isolated from saline-alkali soils in Hexi corridor[J]. Journal of Northwest Normal University :Natural Science, 2017, 53(2): 94-98. |
| [13] |
张璐, 丁延芹, 杜秉海, 等. 黄瓜枯萎病病原拮抗细菌 DS-1 菌株鉴定及其生防效果研究[J]. 园艺学报, 2010, 37(4): 575-580. Zhang L, Ding YQ, Du BH, et al. IIdentification and biocontrol effects of antagonistic bacterium DS-1 Strain against Fusarium oxysporum. sp. cucumebrium Owen[J]. Acta Horticulturae Sinica, 2010, 37(4): 575-580. |
| [14] |
Fan PF, Chen T, He YA, et al. Alleviating salt stress in tomato seedlings using Arthrobacter and Bacillus megaterium isolated from the rhizosphere of wild plants grown on saline-alkaline lands[J]. International Journal of Phytoremediation, 2016, 1549-7879. |
| [15] |
吕恒 . 内生真菌对黄瓜土传病害的抑制作用[D]. 洛阳 :河南科技大学 , 2015. Lv H. Inhibitory effect of endophytic fungi on cucumber soilborne diseases[D]. Luoyang :Henan University of Science and Technology, 2015. |
| [16] |
杨晓平, 孙乾, 孔令明. 响应面法优化巴旦木粕蛋白的提取工艺研究[J]. 农产品加工, 2017, 10: 30-37. Yang XP, Sun Q, Kong LM. Study on optimization of extraction technology of sweet almond protein by response surface method[J]. Farm Products Processing, 2017, 10: 30-37. |
| [17] |
陈志杰, 谢江辉, 陈宇丰, 等. 一株植物病原拮抗细菌的分离筛选及拮抗物质[J]. 生态学杂志, 2018, 37(5): 1595-1604. Chen ZJ, Xie JH, Chen YF, et al. Isolation and screening of a plant pathogen-antagonistic bacterium and antagonistic substance[J]. Chinese Journal of Ecology, 2018, 37(5): 1595-1604. |
| [18] |
郝慧娟, 刘洪伟, 尹淑丽, 等. 枯草芽孢杆菌 BSD-2 的 GFP 标记及其在黄瓜上的定殖研究[J]. 华北农学报, 2016, 31(4): 106-111. Hao HJ, Liu HW, Yin SL, et al. GFP-Marking and colonization on cucumber of Bacillus subtilis BSD-2[J]. Acta Agriculturae Boreali-Sinica, 2016, 31(4): 106-111. |
| [19] |
崔宁 . 拮抗细菌的分离鉴定及其对苦瓜枯萎病生防潜力的研究[D]. 泰安 :山东农业大学 , 2017. Cui N. Isolation and identification of antagonistic bacteria and their biocontrol potential for fusarium wilt[D]. Taian :Shandong Agricultural University, 2017. |
| [20] |
陈香, 唐彤彤, 孙星, 等. 对黄瓜枯萎病具防效的海洋源芽孢杆菌 Y3F 的鉴定[J]. 微生物学通报, 2017, 44(10): 2370-2379. Chen X, Tang TT, Sun X, et al. Identification of marine bacillus isolate Y3F suppressing fusarium wilt of cucumber[J]. Microbiology China, 2017, 44(10): 2370-2379. |
| [21] |
祝久香 . 黄瓜枯萎病拮抗细菌的筛选、发酵及生防机理研究[D]. 长沙 :中南林业科技大学 , 2019. Zhu JX. Screening, fermentation and biocontrol mechanism of antagonistic bacteria against cucumber fusarium wilt[D]. Changsha :Central South University of Forestry and Technology, 2019. |
| [22] |
张梦君, 黎继烈, 申爱荣, 等. 亚麻立枯病拮抗菌的筛选、生防效果及发酵条件优化[J]. 微生物学通报, 2017, 44(5): 1099-1107. Zhang MJ, Li JL, Shen AR, et al. Screening, biocontrol effect and optimization of fermentation conditions of an antagonistic bacteria against Flax rhizoctonia solani[J]. Microbiology China, 2017, 44(5): 1099-1107. |
| [23] |
臧超群, 安福涛, 刘长远, 等. 生防细菌 SY286 发酵条件优化[J]. 中国农学通报, 2015, 31(25): 157-163. Zang CQ, An FT, Liu CY, et al. Optimizing fermentation condition for SY286 strain[J]. Chinese Agricultural Science Bulletin, 2015, 31(25): 157-163. |
| [24] |
唐彤彤, 孙星, 董元华, 等. 对番茄枯萎病具防效的海洋源赤杆菌 YH-07 的发酵条件探究[J]. 中国生物防治学报, 2018, 34(5): 753-761. Tang TT, Sun X, Dong YH, et al. Optimization of fermentation conditions for Erythrobacter sp. YH-07 Suppressing fusarium wilt of tomato[J]. Chinese Journal of Biological Control, 2018, 34(5): 753-761. |
| [25] |
梁艳琼, 吴伟怀, 习金根, 等. 解淀粉芽胞杆菌 JNC2 摇瓶发酵条件优化[J]. 草业科学, 2019, 36(8): 2159-2167. Liang YQ, Wu WH, Xi JG, et al. Optimizing fermentation condition for Bacillus amyloliquefaciens JNC2 in flask[J]. Pratacultural Science, 2019, 36(8): 2159-2167. |
| [26] |
卢彩鸽, 董红平, 张殿朋, 等. 解淀粉芽胞杆菌 MH71 摇瓶发酵培养基及发酵条件优化[J]. 中国生物防治学报, 2015, 31(3): 369-377. Lu CG, Dong HP, Zhang DP, et al. Optimization of fermentation medium components and cultural conditions for Bacillus amyloliquefaciens MH71 in flask[J]. Chinese Journal of Biological Control, 2015, 31(3): 369-377. |
| [27] |
李娟, 夏凯丽, 王远宏, 等. 解淀粉芽孢杆菌 LJ1 摇瓶发酵条件优化[J]. 生物技术通报, 2015, 31(12): 214-220. Li J, Xia KL, Wang YH, et al. The optimization of fermentation condition in flask for Bacillus amyloliquefaciens LJ1[J]. Biotechnology Bulletin, 2015, 31(12): 214-220. |
| [28] |
Marcosa B, Ricardo E, Eliane P, et al. Response surface methodology(RSM)as a tool for optimization in analytical chemistry[J]. Talanta, 2008, 76(5): 965-977. DOI:10.1016/j.talanta.2008.05.019 |
| [29] |
张荣胜, 梁雪杰, 刘永锋, 等. 解淀粉芽胞杆菌 Lx-11 生物发酵工艺优化[J]. 中国生物防治学报, 2013, 29(2): 254-262. Zhang RS, Liang XJ, Liu YF, et al. Optimization of fermentation process of Bacillus amyloliquefaciens Lx-11[J]. Chinese Journal of Biological Control, 2013, 29(2): 254-262. |