2. 山东省盐碱地植物-微生物联合修复工程技术研究中心,泰安 271018
2. Shandong Engineering Research Center of Plant-Mircrobe Restoration for Saline-alkali Land, Tai'an 271018
马铃薯(Solanum tuberosum)是茄科茄属的一年生草本植物,是继水稻、小麦、玉米之后第四大粮食作物[1],自2014年以来,我国马铃薯总产量约占世界总产的1/4,种植面积占世界总种植面积的29%[2]。
植物根际促生细菌(Plant growth promoting rhizobacteria,PGPR)是指有一类存在于植物根际周围的细菌,该细菌能促进植物对养分的吸收和利用,同时通过激素促进植物生长、成熟,从而达到提高农作物产量的目的[3]。
吲哚-3-乙酸(IAA)是一种能够作用于植物生长、发育全过程的一种生长激素,IAA会影响植物细胞的分裂、伸长、分化和种子萌发、根系的发育以及营养生长过程[4]。在双子叶植物中,IAA能够促进侧根的生成;在单子叶植物中,能够促进不定根的形成。IAA对植株的响应受到光照、重力、植株花期和结实期的影响,对于植物光合作用、色素的形成、各种代谢物的合成以及抗逆性方面具有重要意义[5]。
本研究从黑龙江采集的马铃薯根际土壤中获得多株具有产IAA能力的菌株如HL379、HL343、HL344等,通过对HL379进行拟南芥促生试验、马铃薯盆栽试验等促生效果研究,发现HL379具有明显的促生能力。
1 材料与方法 1.1 材料 1.1.1 土壤样品2018年10月于黑龙江齐齐哈尔、双鸭山、大庆等多地区的马铃薯产地采集的马铃薯根际土壤,采集时除去地块表层5 cm浮土,取耕作层土壤,4℃保存。
1.1.2 供试材料马铃薯品种为大丰三号。拟南芥品种为Col-0拟南芥野生型。
1.1.3 培养基LB固体培养基:蛋白胨10.0 g,酵母膏5.0 g、NaCl 10.0 g,蒸馏水1 000 mL,pH=7.0。
IAA初筛培养基:蛋白胨10.0 g,酵母膏5.0 g、NaCl 10.0 g,L-色氨酸0.2 g,蒸馏水1 000 mL,pH=7.0[6]。
Salkowski比色剂:50 mL 35%高氯酸中加入1 mL 0.5 mol/L FeCl3。TSA(胰蛋白胨大豆琼脂培养基):胰酪胨15 g,大豆木瓜蛋白酶水解物5 g,氯化钠5 g,琼脂15 g,去离子水1 000 mL,pH7.3。
MS培养基:大量元素:NH4NO31650 mg/L、KNO3 1 900 mg/L、CaCl2·2H2O 440 mg/L、MgSO4·7H2O 370 mg/L、KH2PO4 700 mg/L;微量元素:KI 0.83 mg/L、H3BO3 6.2 mg/L、MnSO4·4H2O 22.3 mg/L、ZnSO4·7H2O 8.6 mg/L、Na2MnO4·2H2O 0.25 mg/L、CuSO4·5H2O 0.025 mg/L、CoCl2·6H2O 0.025 mg/L、FeSO4·7H2O 27.8 mg/L、Na2-EDTA·2H2O 37.3 mg/L、有机成分:肌醇100 mg/L、烟酸0.5 mg/L、盐酸吡哆醇(维生素B6)0.5 mg/L、盐酸硫胺素(维生素B1)0.5 mg/L、甘氨酸2 mg/L、琼脂7 000 mg/L。
1.2 方法 1.2.1 产IAA芽孢杆菌的筛选 1.2.1.1 芽孢杆菌的分离取1 g土壤样品,加入至99 mL无菌水中,37℃,180 r/min,震荡30 min后充分混匀,制作成10-2浓度的土壤悬浊液,后将土壤悬浊液置于80℃水浴锅水浴20 min。取1 mL稀释的土壤悬浊液加入至9 mL无菌水中,依次稀释至10-3、10-4、10-5、10-6浓度。使用稀释平板法将稀释的土壤悬浊液取100 μL涂布至LB固体培养基中涂至LB平板变干,分离土壤中的芽孢杆菌,每个梯度3个平行,至37℃恒温摇床培养24 h,挑取形态、颜色、大小不同的菌株进行分离,分离获得的菌种划线纯化后获得单菌落,置于LB斜面37℃培养,于4℃冰箱保藏。
1.2.1.2 产IAA芽孢杆菌初筛将斜面保藏的菌体重新活化至LB固体培养基中以恢复菌体活性,后用接种环挑取1环单菌落接种到含L-色氨酸的LB液体培养基中。30℃培养48 h。取1 mL发酵液4 000 r/min离心10 min,取100 μL上清液滴加在白色陶瓷板中,加入同体积的Salkowski比色剂,混匀,同时取100 μL 20 mg/mL的IAA标准溶液与同体积Salkowski比色剂混合作为空白处理。在常温避光反应30 min后观察颜色变化。若产生红色反应则说明有IAA的产生且红色越深说明IAA产量越高。
1.2.1.3 产IAA芽孢杆菌复筛(1)IAA标准曲线的制备:取IAA标准品与蒸馏水配置成10 mg/L、20 mg/L、30 mg/L、40 mg/L、50 mg/L的IAA标准溶液,与Salkowski比色剂1:1比例混合后,避光常温静置30 min,以蒸馏水与Salkowski比色剂混合为空白对照,在OD530处使用紫外分光光度计测得各浓度的吸光度。以IAA浓度为横坐标以吸光度为纵坐标绘制IAA标准曲线。
(2)IAA含量测定:将菌株接种到LB液体培养基中,30℃培养48 h。取2 mL发酵液4 000 r/min离心10 min,取1mL上清液加入等量的Salkowski比色剂于石英比色皿中,在OD530紫外分光光度计测该菌株的吸光度。将获得菌株上清液吸光度代入IAA标准曲线获得该菌株的IAA产量。
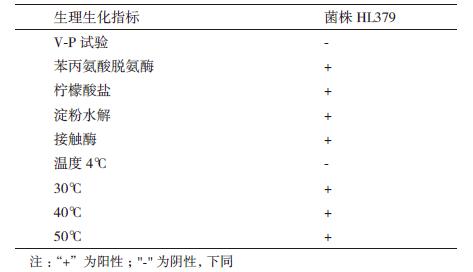
1.2.2 产IAA芽孢杆菌生理生化与鉴定 1.2.2.1 细菌的形态学及生理生化鉴定参照《常见细菌系统鉴定手册》通过菌种在LB固体培养基培养24 h后观察菌种的形态(包括形态、颜色、边缘、表面、透明度等,通过对菌种进行革兰氏染色并用油镜进行观察确定菌株类型。对其进行柠檬酸盐利用、V-P试验、酶活测定、生长温度测定。
1.2.2.2 Biolog系统分析将在LB固体培养基活化好的菌株接种到TSA培养基中,37℃培养24 h,用无菌棉棒蘸取少量菌体,混入IF-B接种液中,使用浊度仪将浊度调至90%-98%T,接种液倒至V型加样槽,使用排枪每孔100 μL依次打入GENE Ⅲ板中,反应24-36 h后,通过微生物检定系统进行比对,确定菌属。通过GENE Ⅲ板对目的菌株进行生理生化鉴定。
1.2.2.3 16S rDNA鉴定分离得到的菌株通过天根生物科技公司提供的细菌基因组试剂盒进行提取16S rDNA并进行PCR扩增反应,扩增引物为细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')与1492R(5'-GGTTACCTTGTTACGACTT-3')。反应条件为95℃ 5 min;94℃ 60 s;55℃ 60 s;72℃ 90 s;延伸72℃ 10 min循环30次。PCR扩增完成后通过1%琼脂糖凝胶检测是否PCR成功,将获得的特异性DNA送往上海生工生物工程技术服务公司进行测序,测序结果在NCBI网站进行Blast比对,使用mega7.0建立发育树并获得目的菌株亲缘远近关系。
1.2.3 促生效果实验 1.2.3.1 拟南芥促生实验拟南芥种子用70%酒精消毒40-60 s后,再使用2%浓度的次氯酸钠浸泡消毒6 min,用无菌水洗涤6-8次,接种到1/2MS培养基中。4℃暗置春化2 d,取出置于24℃光照培养箱中,昼夜比为2:1。生长7 d后,加入装有106 CFU/L HL379菌体的无菌水,在1/2MS培养基中进行划线后培养7 d后测量生物量。
1.2.3.2 马铃薯盆栽促生实验取当季新鲜的大丰三号脱毒马铃薯种薯,0.001 g/L赤霉素与0.2 g/L的磷酸二氢钾浸泡30 min,将马铃薯种薯盖于湿润的厚纱布保持湿润催芽7 d后移栽至蛭石与土体积比为1:1的花盆中,待马铃薯出苗后灌入目的菌株发酵液,浓度稀释至106 CFU/mL,每盆灌根200 mL,空白处理为加入同体积的液体培养基。待生长40 d后测其生物量,测量马铃薯植株的株高、鲜重、干重、根总长等促生指标。90 d收获时测其产量。
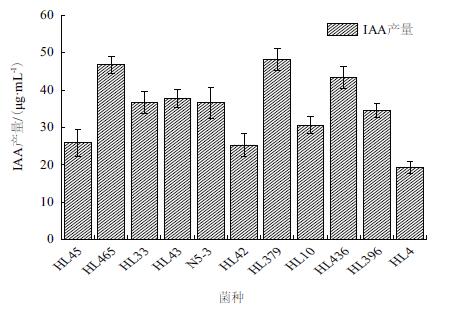
2 结果 2.1 产IAA芽孢杆菌的筛选从黑龙江齐齐哈尔、双鸭等地采集的根际土样中筛选出11株产IAA的芽孢杆菌测得HL379、HL465和HL436的IAA产量较高,其产IAA量分别达到47.8 mg/L、46.5 mg/L和44.8 mg/L。其他产IAA菌种的IAA产量也在10-40 mg/L的产量区间内,也有一定的促生潜力。取产IAA量最高的菌株HL379进行后续实验(图 1,图 2)。

|
| 图 1 部分菌株产IAA初筛结果 |
|
| 图 2 部分菌株IAA产量 |
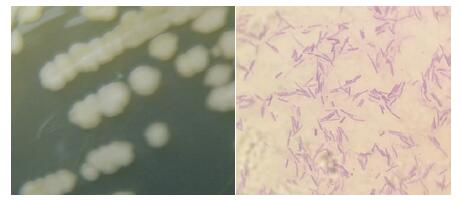
目的菌株HL379在LB培养基中培养24 h后,菌体呈白色、菌落圆形,边缘凸起,表面呈光滑干燥状态。经革兰氏染色后油镜进行观察,HL379为革兰氏阳性菌。对HL379进行生理生化检测,菌株HL379能够分解利用淀粉、柠檬酸盐,在接触酶反应和苯丙氨酸脱氨酶反应中呈阳性,V-P试验中呈阴性,符合芽孢杆菌属生理生化特性(图 3,表 1)。
|
| 图 3 HL379菌落形态(左)与革兰氏染色实验结果(右) |
以HL379菌株的DNA为模板获得1.4 kb的特异性DNA片段。经16S rDNA测序获得HL379菌株16S rDNA序列,通过在NCBI网站进行Blast序列比对。比对结果经mega7.0构建系统发育树。
在NCBI通过Blast序列比对得到HL379与阿耶波多氏芽孢杆菌(Bacillus aryabhattai)(MK517594.1)的一致性达到100%,通过建立系统发育树显示HL379与阿耶波多氏芽孢杆菌(Bacillus aryabhattai)(EF114313.2)自展值达到99%,确认HL379菌株为阿耶波多氏芽孢杆菌(Bacillus aryabhattai)(图 4)。

|
| 图 4 HL379 16S rDNA系统发育树 |
利用Biolog鉴定系统对菌株HL379进行生理生化鉴定,结果表明HL379菌株能够利用葡萄糖、果糖等单糖类物质,也能利用山梨醇、甘露醇等醇类物质(表 2)。
待拟南芥生长7 d后,测其鲜重、干重、根长。研究表明HL379处理后的拟南芥相对于空白组干重变化不明显。在根长方面增加了11%但没有显著性变化(表 3,图 5)。

|
| 图 5 拟南芥促生实验 |
对40 d的马铃薯进行生物量测定发现,HL379处理过的马铃薯植株在株高、鲜重、干重、根总长等方面分别相比于空白组增加了13%、32%、107%、20.8%。鲜重、干重、根总长等方面具有显著性差异(P < 0.05)(表 4)。
通过盆栽实验将施有HL379且生长90 d成熟马铃薯的进行产量测定,处理组相比对照组在马铃薯产量上增加38%。这说明HL379对马铃薯有一定增产效果(表 5,图 6)。

|
| 图 6 马铃薯90 d产量 |
PGPR的作用机制大致分为两类,一类直接促生作用,另一类为间接促生作用。直接促生作用包括提高植物对营养物质的可得性,增强对营养元素如氮源、磷源、钾源等离子的利用来促进植物的生长及增产[7];另一方面直接促生作用还包括了一类植物激素等信号因子,如吲哚乙酸、赤霉素、细胞分裂素、乙烯等物质对植物体生长、果实成熟等方面具有良好的促生作用[8]。另一类为间接促生作用,间接促生包括抑制病原菌的生长、激活自身的免疫系统机制等方面,通过抵御外界病菌的侵害[9]以及激发植物本身的免疫系统来促进植株生长[10]。
吲哚乙酸(IAA)是一类植物内源生长激素,作为信号因子能够促进植物根系的伸长和增加,从而增加植物养分的摄取[11]。已报道文献中发现多种菌属具有分泌IAA的能力[12]。自1978年[13]首次发现细菌能够产生IAA后,40年来发现了大量的产IAA菌株,其中以假单胞菌(Pseudomonas sp.)[14]、芽孢杆菌属(Bacillus sp.)[15]、克雷伯氏菌属(Kle-bsiella sp.)为主[16]。目前,我国农业化学肥料使用量巨大[17],但化学肥料使用过度导致的土壤有机质含量降低、酸化、土壤板结等不利影响也逐年加重[18],因此近年来对于促生菌来促进植物生长越来越受到人们关注。PGPR在番茄[19]、玉米[20]、水稻[21]等多种作物中检测出有良好的促生能力。田洪先[22]等报道了利用马铃薯内生菌来促进马铃薯植株的生长及产量的增加,Kesaulya等[23]报道马铃薯根际菌株筛选来促进马铃薯的生长。
国内在马铃薯根际细菌方面文献报道以抗病机制为主[24-26],而关于马铃薯根际细菌促生效果的研究报道较少。本研究从黑龙江齐齐哈尔筛选出一株产IAA能力较强的菌株HL379,其IAA产量达到47.8 mg/L。通过马铃薯盆栽试验验证其促生、增产能力。通过16S rDNA序列分析结果结合Biolog微生物鉴定系统将其鉴定为阿耶波多氏芽孢杆菌(Bacillus aryabhattai)。
阿耶波多氏芽孢杆菌(Bacillus aryabhattai)是于2009年首次在印度通过高空采集发现的新菌种[27],目前在深海[28]、高原[29]、根际土壤[30]发现阿耶波多氏芽孢杆菌。同时阿耶波多氏芽孢杆菌在大分子降解[31]、植物促生[32]方面的作用都有所报道。
近年来,阿耶波多氏芽孢杆菌应用在促生抗逆方面的报道较多,杨莹等[33]通过一株具有解磷抗旱功能的阿耶波多氏芽孢杆菌。刘军生等[34]筛选出一株具有抗镉能力的阿耶波多氏芽孢杆菌并对小麦进行验证发现其具有明显的降低土壤中镉元素的能力。本实验通过对马铃薯根际土壤进行筛选获得一株IAA产量较高的阿耶波多氏芽孢杆菌,为新型微生物肥料的研发提供了良好的菌种资源。但该菌在实际生产中最佳生产用量、最佳使用方法以及对土壤中其他微生物群落影响等方面还需进一步探究验证。
4 结论通过对马铃薯根际土壤进行筛选,获得11株产IAA菌株,其中IAA产量最高的菌株为HL379,将HL379鉴定为阿耶波多氏芽孢杆菌(Bacillus aryabhattai)。HL379的马铃薯促生盆栽实验表明其对马铃薯有较好的促生结果。
| [1] |
王颖慧, 蒙美莲, 陈有君, 等. 覆膜方式对旱作马铃薯产量和土壤水分的影响[J]. 中国农学通报, 2013(3): 147-152. Wang YH, Meng ML, Chen YJ, et al. Effect of different film-covering modes on the yield and soil moisture of dry land tillage potato[J]. Chinese Agricultural Science Bulletin, 2013(3): 147-152. |
| [2] |
杨雅伦, 郭燕枝, 孙君茂. 我国马铃薯产业发展现状及未来展望[J]. 中国农业科技导报, 2017, 19(1): 29-36. Yang YL, Guo YZ, Sun JM. Present status and future prospect for potato industry in China[J]. Journal of Agricultural Science and Technology, 2017, 19(1): 29-36. |
| [3] |
Bais HP, Weir TL, Perry LG, et al. The role of root exudates in rhizosphere interactions with plants and other organisms[J]. Annual Review of Plant Biology, 2006, 57(1): 233-266. DOI:10.1146/annurev.arplant.57.032905.105159 |
| [4] |
Phillips KA, Skirpan AL, et al. Vanishing tassel2 encodes a grass-specific tryptophan aminotransferase required for vegetative and reproductive development in maize[J]. Plant Cell, 2011, 23(2): 550-566. DOI:10.1105/tpc.110.075267 |
| [5] |
Woodward JB, Abeydeera ND, Paul D, et al. A maize thiamine auxotroph is defective in shoot meristem maintenance[J]. Plant Cell, 2010, 22(10): 3305-3317. DOI:10.1105/tpc.110.077776 |
| [6] |
张东艳, 刘晔, 吴越, 等. 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学报, 2016, 38(1): 104-110. Zhang DY, Liu Y, Wu Y, et al. Isolation and identification of IAA-producing strains from peanut rhizosphere and its promoting effects on peanut growth[J]. Chinese Journal of Oil Crop Sciences, 2016, 38(1): 104-110. |
| [7] |
Youry P, Tanja M, Nicola T, et al. Microbial interactions in the rhizosphere :beneficial influences of plant growth-promoting rhizobacteria on nutrient acquisition process. A review[J]. Biology and Fertility of Soils, 2015, 51(4): 403-415. DOI:10.1007/s00374-015-0996-1 |
| [8] |
Fahad S, Hussain S, Bano A, et al. Potential role of phytohormones and plant growth-promoting rhizobacteria in abiotic stresses: consequences for changing environment[J]. Environmental Science and Pollution Research, 2015, 22(7): 4907-4921. DOI:10.1007/s11356-014-3754-2 |
| [9] |
Beneduzi A, Ambrosini A, Passaglia LM, et al. Plant growth-promoting rhizobacteria(PGPR):Their potential as antagonists and biocontrol agents[J]. Genetics and Molecular Biology, 2012, 35(Suppl4): 1044-1051. |
| [10] |
Zamioudis C, Korteland J, Van Pelt JA, et al. Rhizobacterial volatiles and photosynthesis-related signals coordinate MYB72 expression in Arabidopsis roots during onset of induced systemic resistance and iron-deficiency responses[J]. Plant J, 2015, 84(2): 309-322. DOI:10.1111/tpj.12995 |
| [11] |
葛春辉, 孟阿静, 马彦茹, 等. 一株黄瓜根际促生菌的筛选、鉴定及其发酵特性[J]. 生物技术通报, 2014(3): 94-99. Ge CH, Meng AJ, Ma YR, et al. Selection, identification and characteristics of a cucumber growth-promotion strain of rhizobacteria[J]. Biotechnology Bulletin, 2014(3): 94-99. |
| [12] |
Patten CL, Glick BR. Bacterial biosynthesis of indole-3-acetic acid[J]. Canadian Journal of Microbiology, 1996, 42(3): 207-220. DOI:10.1139/m96-032 |
| [13] |
Tien TM, Gaskins MH, Hubbell DH. Plant growth substances produced by Azospirillum brasilense and their effect on the growth of pearl millet(Pennisetum americanum L.)[J]. Applied and Environmental Microbiology,, 1979, 37(5): 1016-1024. DOI:10.1128/AEM.37.5.1016-1024.1979 |
| [14] |
Jiang Y, Wu Y, Xu WS, et al. IAA-producing bacteria and bacterial-feeding nematodes promote arabidopsis thaliana root 2020, 36(9) growth in natural soil[J]. Europ J Soil Biol, 2012, 52: 22-26. |
| [15] |
Shim J, Kim JW, Shea PJ, et al. IAA production by Bacillus sp. JH 2-2 promotes Indian mustard growth in the presence of hexavalent chromium.[J]. Journal of Basic Microbiology, 2015, 55(5): 652-658. DOI:10.1002/jobm.201400311 |
| [16] |
吕泽勋, 宋未. 培养条件对产酸克雷伯氏菌SG-11生物合成IAA影响的研究[J]. 应用与环境生物学报, 2000(1): 66-69. Lv ZX, Song W. Effect of cultural conditions on IAA biosynthesis by klebsiella oxytoca SG-11[J]. Chinese Journal of Applied & Environmental Biology, 2000(1): 66-69. |
| [17] |
杨帆, 孟远夺, 姜义, 等. 2013年我国种植业化肥施用状况分析[J]. 植物营养与肥料学报, 2015, 21(1): 217-225. Yang F, Meng YD, Jiang Y, et al. Chemical fertilizer application and supply in crop farming in China in 2013[J]. Plant Nutrition and Fertilizer Science, 2015, 21(1): 217-225. |
| [18] |
张海亮, 王智博. 西北某地区农村农药化肥污染问题的调查研究[J]. 中国集体经济, 2016(33): 16-17. Zhang HL, Wang ZB. Investigation on the pollution of pesticides and fertilizers in a rural area Northwest China[J]. Collective Economy, 2016(33): 16-17. |
| [19] |
Fan XH, Zhang SA, Mo XD, et al. Effects of plant growth-promoting rhizobacteria and N source on plant growth and N and P uptake by tomato grown on calcareous soils[J]. Pedosphere, 2017, 27(6): 1027-1036. DOI:10.1016/S1002-0160(17)60379-5 |
| [20] |
万兵兵, 刘晔, 吴越, 等. 一株玉米根际多功能促生菌的筛选鉴定及效应研究[J]. 生物技术通报, 2016, 32(8): 169-176. Wan BB, Liu Y, Wu Y, et al. Screening and identification of maize growth-promoting rhizobacteria and its promoting effects on maize[J]. Biotechnology Bulletin, 2016, 32(8): 169-176. |
| [21] |
徐婧, 邵锴, 李东芳, 等. 产IAA菌的筛选、鉴定及其培养基的优化[J]. 苏州科技大学学报:自然科学版, 2018, 35(2): 45-54. Xu J, Shao K, Li DF. Selection, identification of an IAA biosynthesis strain and the optimization of its culture medium[J]. Journal of Suzhou University of Science and Technology :Natural Science, 2018, 35(2): 45-54. |
| [22] |
田宏先, 崔林, 王秀英, 等. 马铃薯内生促生菌的促生长作用[J]. 山西农业科学, 2003(1): 28-30. Tian HX, Cui L, Wang XY, et al. Growth promoting activity of endophytic bacterial isolated from potato[J]. Journal of Shanxi Agricultural Sciences, 2003(1): 28-30. |
| [23] |
Kesaulya H, Baharuddin, Zakaria B, et al. Isolation and physiolog-ical characterization of PGPR from potato plant rhizosphere in medium land of Buru Island[J]. Procedia Food Science, 2015, 3: 190-199. DOI:10.1016/j.profoo.2015.01.021 |
| [24] |
梁允刚, 孟晶, 谭兰玉, 等. 马铃薯晚疫病生防菌的分离鉴定与防治效果[J]. 北方农业学报, 2017, 45(4): 54-57. Liang YG, Meng J, Tan LY, et al. Isolation and identification of biocontrol strain and its effect on the control of potato late blight[J]. Inner Mongolia Agricultural Science and Technology, 2017, 45(4): 54-57. |
| [25] |
高同国, 姜军坡, 郭晓军, 等. 马铃薯疮痂病高效拮抗菌的筛选及鉴定[J]. 江苏农业科学, 2016, 44(12): 157-159. Gao TG, Jiang JP, Guo XJ, et al. Screening and identification of antagonistic bacteria against Potato Scab[J]. Jiangsu Agricultural Sciences, 2016, 44(12): 157-159. |
| [26] |
宋本超, 赵冬梅, 杨志辉, 等. 马铃薯黑痣病菌拮抗菌的筛选鉴定及生防因子分析[J]. 生物技术通报, 2019, 35(8): 9-16. Song BC, Zhao DM, Yang ZH., et al. Screening and identification of an antagonistic bacterium against Rhizoctonia solani and analysis of biocontrol factor[J]. Biotechnology Bulletin, 2019, 35(8): 9-16. |
| [27] |
Shivaji S, Chaturvedi P, Begum Z, et al. Janibacter hoylei sp. nov., Bacillus isronensis sp. nov. and Bacillus aryabhattai sp. nov., isolated from cryotubes used for collecting air from the upper atmosphere[J]. . Int J Syst Evol Microbiol, 2009, 59(12): 2977-2986. DOI:10.1099/ijs.0.002527-0 |
| [28] |
Wen J, Ren C, Huang N, et al. Draft genome of bagasse-degrading bacteria Bacillus aryabhattai GZ03 from deep sea water[J]. Marine Genomics, 2015, 19: 13-14. DOI:10.1016/j.margen.2014.11.004 |
| [29] |
Yan Y, Zhang L, Yu MY, et al. The genome of Bacillus aryabhattai T61 reveals its adaptation to Tibetan Plateau environment[J]. Genes & Genomics, 2016, 38(3): 293-301. |
| [30] |
Paredes-Páliz KI, Caviedes MA, Doukkali B, et al. Screening beneficial rhizobacteria from Spartina maritima for phytoremedia-tion of metal polluted salt marshes :comparison of gram-positive and gram-negative strains[J]. Environmental Science and Pollution Research, 2016, 23(19): 19825-19837. DOI:10.1007/s11356-016-7184-1 |
| [31] |
Pan F, Yu Y, Xu A, et al. Application of magnetic OMS-2 in sequencing batch reactor for treating dye wastewater as a modulator of microbial community[J]. Journal of Hazardous Materials, 2017, 340: 36-46. DOI:10.1016/j.jhazmat.2017.06.062 |
| [32] |
Lee S, Ka JO, Song HG. Growth promotion of Xanthium italicum by application of rhizobacterial isolates of Bacillus aryabhattaiin microcosm soil[J]. Journal of Microbiology, 2012, 50(1): 45-49. |
| [33] |
杨莹, 刘冬雪, 郭英, 等. 2株芽孢杆菌抗旱及解磷能力[J]. 江苏农业科学, 2019, 47(4): 260-263. Yang Y, Liu DX, Guo Y, et al. Drought resistance and phosphate solubilizing ability of two Bacillus Strains[J]. Jiangsu Agricultural Sciences, 2019, 47(4): 260-263. |
| [34] |
刘军生, 解修超, 罗阳兰, 等. 抗镉内生细菌阿耶波多氏芽孢杆菌的分离鉴定及生物学特性[J]. 生物技术通报, 2019, 35(2): 64-72. Liu JS, Xie XC, Luo YL, et al. Isolation, identification, and biological characteristics of a cadmium-resistant endophytic bacteria Bacillus aryabhattai[J]. Biotechnology Bulletin, 2019, 35(2): 64-72. |