随着人们生活水平提高,餐饮行业飞快发展,餐厨废弃物的产生量在持续上升。据相关调查美国目前每年约产生6.1×107 t餐厨废弃物,欧盟每年约产生9.8×107 t餐厨废弃物[1],仅2017年,我国餐厨废弃物产生量约在9.9×107 t[2]。处理餐厨废弃物迫在眉睫。就目前来看,堆肥法处理餐厨废弃物是一种实现餐厨废弃物减量化、资源化和无害化的较为有效的方法[3-5]。但是,餐厨废弃物堆肥过程中产生的恶臭污染物种类一直较为复杂,恶臭强度相对较高,恶臭物质种类主要包括硫化氢、氨、乙醇、甲硫醇、二甲二硫醚、甲硫醚、乙硫醚、乙酸乙酯、乙醛、丁醛和柠檬烯等[6]。恶臭物质在造成环境污染的同时,也威胁人们的身体健康。目前针对畜禽粪除臭菌的筛选研究报道较多[7],许启有等[8]在大庆地区猪场采集猪粪样本,筛选出两株除臭菌,即X-3为短状杆菌属和X-5为副球菌属,H2S去除率分别为6.8%和54.5%;韩保安等[9]在新鲜猪粪和堆肥猪粪中筛选出3株除臭菌,对NH3具有较高的降解作用;简保全等[10]在猪粪中筛选出41株可以直接利用NH3的菌株餐,对41株菌株复筛得到一株松鼠葡萄球菌,其H2S去除率达到85.7%;安然等[11]以蜡状芽孢杆菌、放线菌和酵母菌等有益微生物为除臭菌剂,对家禽粪中的氨气、硫化氢和甲基吲哚等有害毒气体具有明显的去除作用。厨废弃物除臭菌的筛选报道较少,餐厨废弃物处理过程中主要的除臭方法有废气收集、喷淋洗涤、局部喷洒除臭液和吸附措施[12],张景辉等[13]利用活性炭材料对餐厨废弃物处理尾气进行吸附,除臭率可以达到99%;Chen等[14]开发了一种新型两级化学洗涤法去除餐厨垃圾堆肥过程中产生的臭气,洗涤塔中酸性洗涤其中的液体为低氯酸钠,碱性洗涤器中氢氧化钠或者亚硫酸氢钠。物理和化学除臭方法与微生物除臭法相比具有耗资大,操作复杂等特点。因此,本实验从宁夏园林场餐厨废弃物堆肥中分离筛选除臭微生物。以期用于餐厨废弃物堆肥,减少餐厨废弃物发酵过程中产生的恶臭气体。
1 材料与方法 1.1 材料 1.1.1 菌株筛选来源宁夏回族自治区园林场堆肥,分别为餐厨废弃物+木屑(Kitchen waste + wood chips,KW),餐厨废弃物+秸秆+木屑(Kitchen waste + straw + wood chips,KSW),以下简称为KW堆肥和KSW堆肥。KW堆肥pH为8.07,可溶性盐浓度Electrical conductivity,EC)为3.64 ms/cm,全氮为8.22 g/kg,全磷为1.8 g/kg、全钾为26.83 g/kg,有机质为73.65g/kg,速氮为16.61 mg/kg,速磷为59.98 mg/kg,速钾为334.62 mg/kg。KSW堆肥pH为8.14,EC为4.09 ms/cm,全氮为3.56 g/kg,全磷为1.82 g/kg,全钾为32.16 g/kg,有机质为80.89 g/kg,速氮为7.71 mg/kg,速磷为37.88 mg/kg,速钾为146.08 mg/kg,两种堆肥的C/N均为25:1。
1.1.2 培养基脱硫菌液体选择培养基[15]:蛋白胨10 g,牛肉膏2 g,NaCl2 5 g,Na2S.9H2O 2 g,蒸馏水1 L。脱硫菌固体筛选培养基:脱硫菌液体选择培养基加琼脂。菌株保存培养基:LB营养琼脂。菌株活化培养基:LB肉汤。
1.2 方法 1.2.1 富集各取10 g KW堆肥和KSW堆肥分别于100 mL三角瓶中,加入90 mL无菌水,震荡30 min制成菌悬液。将10 mL菌悬液接种于装有100 mL脱硫菌液体选择培养基的三角瓶中,在30℃、120 r/min条件下培养30 d。每隔3 d向三角瓶中加入7%的Na2S·9H2O溶液,以淘汰不能利用硫化物的微生物[16]。
1.2.2 菌株的分离纯化取1 mL富集的菌液做梯度稀释,将10-4、10-5和10-6菌液吸取100 µL分别接种到脱硫菌固体选择培养基平板上,每个梯度3次重复,于30℃倒置培养3 d。待菌落长出来,挑取长势较好的菌落进行反复划线纯化,直至显微镜下观察得到纯菌株为止,保存在4℃冰箱里备用。
1.2.3 除臭微生物的筛选 1.2.3.1 菌种的初筛将纯化好的每个菌株接种到LB肉汤培养基中,放在30℃、180 r/min摇床上培养2 d制成菌悬液,将制好的菌悬液按照20%的接种量接入到装有50 g餐厨垃圾的500 mL广口瓶中,同时接种20%的无菌水作为对照,每组处理设置3个重复。放在30℃培养箱中培养,每隔3、5、8、11、15、18和21 d用感官法初步判定菌株除臭效果,将除臭能力明显的菌株留下进行复筛试验。臭味等级按照“0”无臭味、“1”轻微臭味、“2”明显臭味、“3”较强臭味、“4”强烈臭味、“5”极强臭味划分[17-18]。
1.2.3.2 菌种的复筛将初筛出来除臭效果较好的菌株经过液体培养基培养,制成菌悬液,按照20%的接种量接种到装有50 g餐厨垃圾的500 mL广口瓶中,同时接种20%的无菌水作为对照,每组处理的广口瓶中放一个盛有20 mL氢氧化镉-聚乙烯醇磷酸铵吸收液的50 mL小烧杯,广口瓶用双层塑料膜密封,每隔3、5、8、11、15、18和21 d用亚甲基蓝分光光度法检测菌株的除臭效果[19-21]。选出除臭效果好的菌种斜面保存,以待下一步研究。计算公式:
硫化氢去除率(%)=(对照组硫化氢含量-试验组硫化氢含量)/对照组硫化氢含量×100%
1.2.4 菌种的鉴定 1.2.4.1 菌落的形态观察将筛选的菌株接种到菌株保存培养基上,30℃培养3 d,根据文献[22]观察平板上单菌落形状、大小和颜色等特征。挑取菌落置于载玻片上,做革兰氏染色,芽孢染色和鞭毛染色,在光学显微镜观察菌体的形态。
1.2.4.2 生理生化鉴定对除臭菌株进行以下生理生化试验[23]:甲基红(MR)试验、乙酰甲基甲醇(V-P)试验、氧化酶试验、过氧化氢酶试验、葡萄糖发酵试验、淀粉水解试验、纤维素水解试验和明胶液化试验。
1.2.4.3 菌株分子鉴定将除臭菌株送至北京奥科鼎盛生物技术有限公司,使用细菌16S通用引物(27f/1492r)来扩增基因组DNA,将产物测序。将所得测序序列置于NCBI数据库中进行比对,得到最佳匹配的物种分类信息。
1.2.5 菌株除臭条件优化 1.2.5.1 菌株生长曲线在100 mL的液体培养基中,分别以10%(体积比)的接种量接入种子液,在温度为30℃,转速为180 r/min的摇床上恒温培养52 h,分别在4 h、12 h、20 h、28 h、36 h、44 h和52 h测定OD600值,绘制菌株生长曲线图。
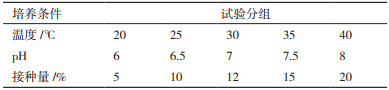
1.2.5.2 菌株除臭条件优化对除臭菌株分别采用不同的培养温度、培养基初始PH值和接种量3个培养条件,按照脱硫菌株复筛的方法,检测菌株对硫化氢气体的去除率,每组设置3个重复,试验设计如表 1所示。
采用Excel 2010进行数据计算与处理,采用SPSS 23.0进行数据分析,利用LSD法在P < 0.05水平下进行单因素显著性分析,采用Origin 2018进行绘图。
2 结果 2.1 脱硫菌株的初筛两种堆肥经过富集、分离、纯化总共得到15株菌,根据不同的来源分别命名为KW1-7;KSW1-8;经过初筛,与对照相比有6株菌具有除臭效果,其结果见表 2。
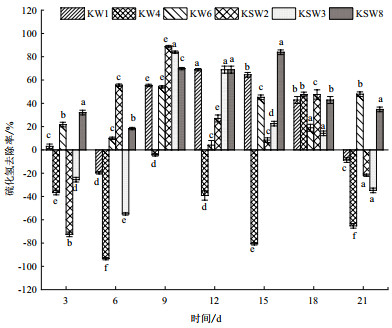
脱硫菌的复筛结果如图 1所示,在21 d的检测当中硫化氢释放量一直在增加,在第6天达到最大值,之后释放量逐渐下降,18 d和21 d时达到最小值。如图 2所示,在整个检测过程中菌KW1、KSW2、KSW3与CK相比,在中期除臭效果较好,KW1在第9、12、15和18天硫化氢去除率分别达到55.4%、68.92%、64.52%和42.82,但是在前期第6天和后期第21天不能除臭,反而会增加硫化氢的释放。KSW2在第6、9、12、15和18天硫化氢去除率分别达到55.57%、88.74%、27.02%、8.39%和47.58%,前期第3天、后期第21天会增加硫化氢的释放。KSW3第9、12、15和18天硫化氢去除率分别达到83.92%、68.92%、22.59%和14.23%,在前期第3天和第6天,后期第21天会增加硫化氢的释放,菌KW4在整个测定过程中除了第18天硫化氢去除率有所增加,前期和后期都会增加硫化氢的释放。整个检测过程中KW6和KSW8的除臭效果一直比较稳定,以KW和KSW8两株菌为主。在7次测定中KW6和KSW8的硫化氢去除率平均为28.25%和50.08%。因此,以下研究都以CM6和CJM8两株菌为主。

|
| 字母不同表示差异显著(P < 0.05),下同 图 1 各菌株对硫化氢释放量的影响 |
|
| 图 2 各菌株对硫化氢的去除率的影响 |
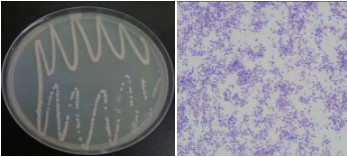
如图 3所示,KW6为奶油状白色圆点,不透明,培养基上菌落直径大于1 mm,表面凸起,边缘完整,革兰氏染色呈阳性。如图 4所示,KSW8为白色圆形,半透明菌落,培养基生上直径约为1 mm,菌落表面凸起有光泽,边缘完整,半透明,柔软易碎,革兰氏染色呈阳性。

|
| 图 3 KW6菌落形态 |
|
| 图 4 KSW8菌落形态 |
对菌株KW6和KSW8进行生理生化试验,结果(表 3)显示,菌株KW6和KSW2革兰氏染色呈阳性,其均可使淀粉水解。在甲基红试验、乙酰甲基甲醇试验、氧化酶试验中两株菌均呈阴性;而在葡萄糖氧化发酵试验中两株菌均呈阳性。在过氧化氢酶试验中KW6呈阳性,KSW8呈阴性;在纤维素试验中KW6不能分解纤维素,KSW8可以分解纤维素;在明胶液化试验中,KW6可以让明胶液化,KSW2不能让明胶液化。
将菌株KW6和KSW8的16S rRNA基因序列测序结果经BLAST比对发现,KW6与Bacillus aryabhattai strain相似性高达99.44%,构建的系统发育树(图 5)显示KW6与Bacillus聚为一支,属于芽孢杆菌属。KSW8与Rhizobium pusense strain菌株的基因序列相似性达到99.02%,构建的系统发育树(图 6)显示KSW8与Rhizobium聚为一支,属于根瘤菌属。
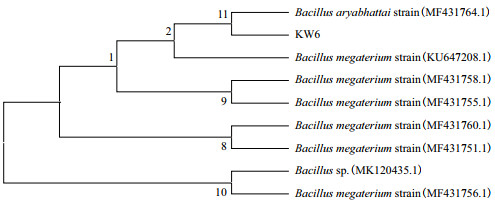
|
| 图 5 KW6的系统发育树 |

|
| 图 6 KSW8的系统发育树 |
在4 h-44 h,菌株KW6和KSW8处于快速生长期,在44 h-52 h,菌株处于稳定生长期(图 7)。
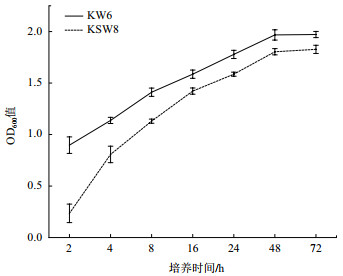
|
| 图 7 菌株生长曲线图 |
将KW6和KSW8分别接入装有餐厨废弃物的烧杯中,放在不同温度下培养21 d,结果(图 8)显示,在20-30℃之间KW6有不同程度的脱硫效果。在30℃时KW6硫化氢去除率最高达到83.5%,温度为35℃和40℃时,KW6的硫化氢去除率开始下降,说明高温条件不适合KW6的生长。在20-35℃之间KSW8有不同程度的脱硫效果,在温度为35℃时,KSW8的硫化氢去除率最高达到85.8%,温度为40℃时,KSW8的硫化氢去除率达到66.3%之后急剧下降。
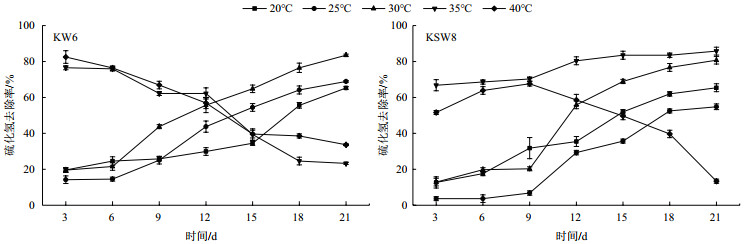
|
| 图 8 不同培养温度对菌KW6和KSW8硫化氢去除率的影响 |
将菌KW6和KSW8的液体培养基pH值分别设为6.0、6.5、7.0、7.5、8.0,分别接入装有餐厨废弃物的烧杯中培养21 d。结果(图 9)显示,KW6和KSW8在不同的pH下都具有除臭效果,KW6在pH为7.5的时候硫化氢去除率最高达到65.3%。在pH为6.5的时候,KSW8的硫化氢去除率最高达到75.8%,高于6.5或者低于6.5都会抑制菌株对硫化氢气体的去除作用。另外,KW6在pH为7.5条件下培养18 d后的硫化氢去除率开始下降,到21 d的时候硫化氢去除率为51.5%,KSW8在pH为6.5的培养条件下培养18 d后硫化氢去除率也下降,到21 d的时候硫化氢去除率为70.75%。

|
| 图 9 不同初始pH值对菌KW6和KSW8硫化氢去除率的影响 |
两株菌分别按照5%、10%、12%、15%和20%等不同的接种量加到餐厨废弃物中,在不同接种量下均可以不同程度的脱硫。KW6在接种量为12%的时候脱硫率一直处于较高的水平,在达到73.8%之后稍有下降,下降至71.5%,KSW8的脱硫率随着接种量的增加而增加,接种量为20%的处理脱硫率达到72.4%(图 10)。
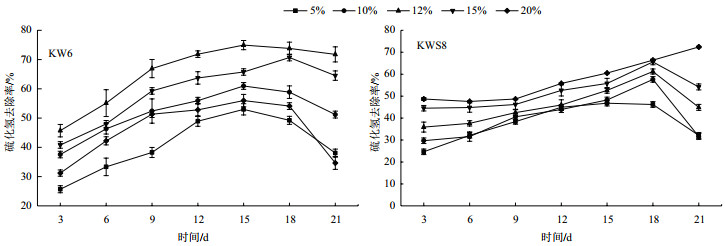
|
| 图 10 不同接种量对菌KW6和KSW8硫化氢去除率的影响 |
徐明明在蚯蚓粪中筛选出的菌株HS5属于芽孢杆菌属,其对H2S的去除率达到43.08%[15];石太莉[19]在华中农业大学试验猪场采集猪粪,在其中筛选出的蜡样芽孢杆菌的H2S去除率为29.3%,解淀粉芽孢杆菌和枯草芽孢杆菌的H2S去除率分别为3.1%和28.1%;余海晨等[24]在垃圾渗滤液中筛选分离出8株有效菌C1-C8,初步鉴定这8株菌均为芽孢杆菌,C1-C8的混合菌群对H2S的去除率达到82%。本实验中的KW6属于芽孢杆菌属,对于H2S的去除作用较好,这与前人研究结果一致。据报道,芽孢杆菌进入猪的肠道后可以增强乳酸菌和双歧杆菌的数量,乳酸菌可以产生乳酸和细菌素使血液中的毒素和氨减少,使肠道内pH值和NH3含量降低[25]。因此释放到空气中的氨气含量也较低[26]。这说明芽孢杆菌有除臭的可能,本试验在开始之前曾做过筛选除氨菌的预试验,并未筛选出除氨菌,可能是堆肥过程中pH逐渐升高,NH3大量损失的原因。
3.2 H2S与根瘤菌属有一定联系KSW8属于根瘤菌属,根瘤菌是豆科植物、牧草、树种生长最重要的共生伙伴之一,其作用是固定大气中的氮气为植物所用,可促进植物生长和作物增产[27]。研究表明,H2S气体分子可以调节根瘤菌的固氮作用。闫小武等[28]在研究H2S信号分子在刺槐-根瘤菌共生固氮体系中的作用中发现,H2S发挥作用可以通过上调植物和根瘤菌中共生基因和许多代谢途径基因的表达,促进根瘤的发育,提高了根瘤中固氮酶的活性,增强固氮的效率。邹杭等[29]在研究H2S信号分子在大豆-根瘤菌共生固氮体系中的调控作用及其机制研究中发现,外源H2S可以促进大豆植株的结瘤和根瘤菌固氮酶的活性,从而提高大豆植物的氮素积累,内源H2S可以作为根瘤中重要的抗氧化剂维持根瘤的固氮活性,同时避免ROS的积累以及氧化损伤的出现。这说明H2S气体分子与根瘤菌之间存在一定的关系,但是根瘤菌对H2S的去除机制尚未明确,还需要进一步研究。也可能是新的菌种有除臭能力,据2016年ICSP根瘤菌和农杆菌分类小组委员会会议统计,仅在2014-2016年间,根瘤菌中共有2个新属83个新种被描述发表,且新的根瘤菌物种也在不断被发现[30-31]。
3.3 恶臭物质除臭方法餐厨废弃物处理常用的除臭方法有物理方法、化学方法和生物方法。王婷等[24]和马梅荣等[25]用生物除臭方法研究表明,用微生物除臭处理具有彻底、无二次污染的优良特性,同样也存在菌株除臭不稳定的情况。在初筛中有6株菌具有除臭效果,但是在复筛过程中只有KW6与KSW8保持稳定的除臭效果,其他4株菌除臭效果极不稳定,这与前人的研究结果一致,说明菌株活性受到多种不确定因素的影响,菌株的除臭能力也受到一定的影响。
本次试验研究结果表明[9, 15, 21, 32],适宜的环境可以不同程度上提高微生物的生长速率,减少硫化氢等恶臭气体的排放。试验中两株脱硫菌KW6和KSW8在培养条件优化中硫化氢的去除率均可以达到60%以上。
4 结论从餐厨废弃物+木屑(KW)和餐厨废弃物+秸秆+木屑(KSW)两种堆肥中筛选得到两株脱硫菌KW6和KSW8,分别使硫化氢释放量与CK相比平均降低了28.83%和50.08%。
经初步鉴定KW6属于芽孢杆菌属,KSW8属于根瘤菌属。菌株培养条件优化表明KW6在温度为30℃、pH 7.5、接种量为12%的时候硫化氢去除率最高,分别为83.5%,65.3%和73.8%。KSW8在温度为35℃、pH6.5、接种量为20%的时候硫化氢去除率最高,分别为85.8%、75.8%和72.4%。优化条件表明在18 d以后菌的脱硫效果会有所下降,出现这种情况可能是是因为检测时间持续长,菌的活性下降所致,在生产中需要及时添加菌株。
| [1] |
Gzirotto F, Alibardi L, Cossu R. Food waste generation and industrial uses: A review[J]. Waste Manag, 2015, 45: 32-41. DOI:10.1016/j.wasman.2015.06.008 |
| [2] |
Zhang C, S u, H, Baeyens J, et al. Reviewing the anaerobic digestion of food waste for biogas production[J]. Renewable & Sustainable Energy Reviews, 2014, 38: 383-292. |
| [3] |
王桂才, 李洋洋. 餐厨废弃物堆肥化处置方式探讨[J]. 再生资源与循环经济, 2013, 6(10): 38-41. Wang GC, LI YY. Discussion on composting disposal of kitchen waste[J]. Regeneration Resources and Circular Economy, 2013, 6(10): 38-41. DOI:10.3969/j.issn.1674-0912.2013.10.011 |
| [4] |
余媛媛. 城市生活垃圾堆肥处理及其前景展望[J]. 有色冶金设计与研究, 2000(3): 52-55. Yu YY. Compost treatment of municipal solid waste and its prospect[J]. Nonferrous Metallurgy Design and Research, 2000(3): 52-55. |
| [5] |
杨柏松, 熊文江, 朱巧银. 好氧堆肥技术研究[J]. 现代化农业, 2016(7): 57-59. Yang BS, Xiong WJ, Zhu QY. Research on aerobic composting technology[J]. Modern Agriculture, 2016(7): 57-59. DOI:10.3969/j.issn.1001-0254.2016.07.037 |
| [6] |
卢志强, 张涛, 王元刚, 等. 餐厨垃圾厌氧处置的恶臭污染物分析[J]. 城市环境与城市生态, 2014, 27(2): 36-39. Lu ZQ, Zhang T, Wang YG, et al. Malodorous pollutants in the anaerobic treatment of kitchen waste[J]. Urban Environment and Urban Ecology, 2014, 27(2): 36-39. |
| [7] |
张昊, 陈芳, 申杰, 等. 畜禽粪便堆肥产臭与生物除臭的研究进展[J]. 家畜生态学报, 2018, 39(1): 84-89. Zhang H, Chen F, Shen J, et al. Odor production and biological deodorization of livestock manure composting[J]. Chinese Journal of Animal Ecology, 2018, 39(1): 84-89. DOI:10.3969/j.issn.1673-1182.2018.01.019 |
| [8] |
许启有, 邹晓, 李诗莹, 等. 大庆地区猪场中除臭菌的分离筛选及初步鉴定[J]. 黑龙江畜牧兽医, 2015(17): 177-179. Xu QY, Zou X, Li SY, et al. Isolation and screening of deodorant bacteria in pig farms in Daqing area[J]. Heilongjiang Animal Husbandry and Veterinary Science, 2015(17): 177-179. |
| [9] |
韩保安, 凌超, 李扬, 等. 猪粪除臭菌的筛选、复配以及培养条件的优化[J]. 家畜生态学报, 2017, 38(12): 55-61, 72. Han BA, Ling C, Li Y, et al. Screening, compounding and culture of pig manure deodorant bacteria[J]. Journal of Animal Ecology, 2017, 38(12): 55-61, 72. DOI:10.3969/j.issn.1673-1182.2017.12.011 |
| [10] |
简保权.猪粪堆肥过程中NH3和H2S的释放特点及除臭微生物的筛选研究[D].武汉: 华中农业大学, 2006. Jian BQ. The release characteristics and deodorization of NH3 and H2S in pig manure composting studies on screening of materials[D]. Wuhan: Huazhong Agricultural University, 2006. http://d.wanfangdata.com.cn/Conference/6315575 |
| [11] |
安然, 杨绍斌, 陈婉玉, 等. 一种菌糠家禽粪便除臭菌剂的研制[J]. 农业灾害研究, 2016, 6(9): 48-50. An R, Yang SB, Chen WY, et al. Development of a deodorizing agent for fungus chaff and poultry excrement[J]. Agricultural Disaster Research, 2016, 6(9): 48-50. |
| [12] |
刘希雯, 陆云平. 餐厨垃圾处置恶臭污染防治研究[J]. 智能城市, 2018, 4(23): 112-113. Liu XW, Lu YP. Research on prevention and control of malodorous pollution in kitchen waste disposal[J]. Intelligence City, 2018, 4(23): 112-113. |
| [13] |
张景辉, 刘朝辉, 杨伟, 等.一种基于活性炭材料作用的餐厨垃圾处理尾气除臭方法: CN102489114A[P]. 2012. Zhang JH, Liu CH, Yang W, et al. A kitchen based on the function of activated carbon material Deodorization method of waste gas treatment: CN102489114A[P]. 2012. http://d.wanfangdata.com.cn/Patent_CN201110434065.3.aspx |
| [14] |
Chen WH. A novel two-stage scrubbing technology for odor control of kitchen waste composting[J]. Aerosol & Air Quality Research, 2012, 12: 1386-1397. |
| [15] |
徐明明.蚯蚓粪中除臭微生物的筛选及培养条件优化[D].哈尔滨: 东北农业大学, 2015. Xu MM. Screening of deodorizing microorganisms in earthworm feces and optimization of culture conditions[D]. Harbin: Northeast Agricultural University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10224-1015396202.htm |
| [16] |
樊杰, 林炜铁. 一株硝化脱氮除臭菌的筛选鉴定及其多途径氮代谢功能的研究[J]. 环境科学学报, 2010, 30(4): 722-728. Fan J, Lin WT. Screening and identification of a nitrodenitrifying and deodorizing bacterium and its multiple approaches[J]. Journal of Environmental Science, 2010, 30(4): 722-728. |
| [17] |
魏良.脱除鸡粪恶臭的微生物分离与筛选[D].雅安: 四川农业大学, 2005. Wei L. Isolation and screening of microorganisms for removing the stench of chicken manure[D]. Ya′an: Sichuan Agricultural University, 2005. http://d.wanfangdata.com.cn/Thesis/Y783606 |
| [18] |
唐微微, 张姝, 李树伟, 等. 两株酵母菌的筛选及其除臭性能[J]. 安全与环境学报, 2013, 13(2): 26-30. Tang W, Zhang S, Li SW, et al. Selection and deodorization of two yeast strains[J]. Journal of Safety and Environment, 2013, 13(2): 26-30. DOI:10.3969/j.issn.1009-6094.2013.02.007 |
| [19] |
石太莉.除臭微生物的筛选及其应用效果的研究[D].武汉: 华中农业大学, 2009. Shi TL. Screening of deodorant microorganisms and study on their application effect[D]. Wuhan: Huazhong Agricultural University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10504-2010011208.htm |
| [20] |
甘晓.鸡粪除臭菌的筛选鉴定、培养条件优化及其应用研究[D].合肥: 安徽农业大学, 2014. Gan X. Screening and identification, optimization of culture conditions and application of chicken manure deodorant bacteria[D]. Hefei: Anhui Agricultural University, 2014. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CDFD&dbname=CMFD&filename=1015403485.nh |
| [21] |
张宏才, 魏荷芬, 汪顺丽, 等. 鸡粪除臭菌的筛选、培养条件优化及其应用[J]. 安全与环境学报, 2017, 17(1): 250-255. Zhang HC, Wei HF, Wang SL, et al. Screening and cultivation of deodorant bacteria in chicken feces[J]. Journal of Safety and Environment, 2017, 17(1): 250-255. |
| [22] |
谷海瀛. 形态学检查方法的标准化及其在细菌鉴定中的作用[J]. 中华检验医学志, 2006(10): 951-953. Gu HY. Standardization of morphological examination and its application in bacterial identification[J]. Chinese Journal of Laboratory Medicine, 2006(10): 951-953. |
| [23] |
梁美生, 苏娟. 脱除养殖臭气中H_2S菌种的筛选及性能测定[J]. 中国矿业大学报, 2012, 41(5): 844-849. Liang MS, Su J. Selection and performance measurement of H_2S bacteria in the removal of cultured odor[J]. Journal of China University of Mining and Technology, 2012, 41(5): 844-849. |
| [24] |
王婷.餐厨垃圾处理及除臭微生物菌剂的制备和应用[D].北京: 北京化工大学, 2018. Wang T. Kitchen waste treatment and preparation and application of deodorizing microbial agents[D]. Beijing: Beijing University of Chemical Technology, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10010-1018323885.htm |
| [25] |
马梅荣, 王光玉, 宣世伟, 等. 利用微生物除臭技术研究与应用[J]. 环境科学与技术, 2003(4): 50-52, 67. Ma MR, Wang GY, Xuan SW, et al. Research and application of microbial deodorization technology[J]. Environmental Science and Technology, 2003(4): 50-52, 67. DOI:10.3969/j.issn.1003-6504.2003.04.020 |
| [26] |
Koizumi I, Suzuki Y, Shimura S. Deodorant effects of champ ignon extract and repressive effects on production of indole and tryp tamine in vivo[J]. Nibon Koshu Eisei Zasshi, 1997, 44(1): 5-11. |
| [27] |
霍云云.根瘤菌属5个新种的多相分类研究[D].杨凌: 西北农林科技大学, 2019. Huo YY. Polyphase classification of five new species of rhizobia[D]. Yangling: Northwest A & F University, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10712-1019845647.htm |
| [28] |
闫小武.硫化氢信号分子在刺槐-根瘤菌共生固氮体系中的作用研究[D].杨凌: 西北农林科技大学, 2019. Yan XW. Hydrogen sulfide signaling molecules in the symbiotic nitrogen fixation system of robinia pseudoacacia and rhizobia[D]. Yangling: Northwest A & F University, 2019. |
| [29] |
邹杭.硫化氢信号分子在大豆-根瘤菌共生固氮体系中的调控作用及其机制研究[D].杨凌: 西北农林科技大学, 2019. Zou H. Modulation of hydrogen sulfide signaling molecules in soybean - rhizobium symbiotic nitrogen fixation system[D]. Yangling: Northwest A & F University, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10712-1020603820.htm |
| [30] |
de Lajudie PM, Young JPW. International committee on systematics of prokaryotes subcommittee for the taxonomy of Rhizobium and Agrobacterium minutes of the meeting, budapest, 25 August 2016[J]. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(7): 2485-2494. DOI:10.1099/ijsem.0.002144 |
| [31] |
陈文新. 根瘤菌系统学研究进展与展望[J]. 微生物学通报, 2016, 43(5): 1095-1100. Chen WX. Progress and prospect of rhizobia systematics Research[J]. Bulletin of Microbiology, 2016, 43(5): 1095-1100. |
| [32] |
曾苏, 李南华, 盛洪产, 等. 微生物除臭剂的筛选、复配及其除臭条件的优化[J]. 环境科学, 2015, 36(1): 259-265. Zeng S, Li NH, Sheng HC, et al. Screening, combination of micro-bial deodorizer and the optimization of its deodorizing conditions[J]. Environmental Science, 2015, 36(1): 259-265. |