水稻(Oryza sativa)作为重要的粮食作物, 其经济性状, 尤其是对胁迫的耐受性受到密切关注。干旱、重金属、盐碱、冷害等非生物逆境胁迫对水稻的生长、发育和结实有严重不良影响, 是水稻减产的重要因素。由于过量使用含有重金属的农药和抗真菌剂等人为活动, 耕种土壤和灌溉水中的重金属污染已成为全球性的农业问题。重金属对植物的毒性及其随着食物链的积累可能对人体健康造成危害。铜(Cu)是植物必需的微量元素, 对植物根系表现出高亲和力, 参与多种生物过程[1], 但过高浓度的Cu2+会产生毒性, 特别是在染色质结构、酶活性、光合作用和呼吸作用等方面[2-3]。因此, 提高水稻的Cu2+胁迫耐受性对于保证粮食稳定供应和农业的可持续发展具有重要意义。
稀土元素是一组具有相似物理化学性质的三价金属元素[4]。稀土在农业上被广泛用于促进植物种子萌发、生长发育和植物生物量的积累等过程[5]。与其他稀土元素相比, 镧(La)在环境和微肥中含量更高, 常被用作稀土微肥的主要成分[6]。多项证据表明, 一定浓度的La3+不仅可以保护植物免受环境污染, 而且可以促进植物的生长发育。d’Aquino等[7]发现低浓度La3+有助于硬粒小麦种子的发芽和幼苗的生长。La3+可以显著提高水稻的光合作用, 尤其是叶绿体的功能[8], 还可通过与活性氧直接反应改善植物的防御系统来保护大豆免受UV-B辐射诱导的氧化胁迫[9]。这些研究均表明La3+对逆境胁迫下的植物具有良好的保护作用。
随着高通量测序技术的高速发展, 植物中基因表达水平的大规模、高速度鉴定得以实现。目前, 在水稻中虽已有关于稀土缓解重金属胁迫的研究, 然而多集中于生理生化水平和单分子水平, 且不同研究结果的重复性较低, 稀土镧对于铜胁迫下水稻的生物学功能也尚未明确, 然而在转录组水平系统地分析La3+对Cu2+胁迫应答中的调控特征更是鲜见报道。本研究采用水培模拟法研究在Cu2+胁迫和不同浓度La3+处理下水稻mRNA的特征表达谱, 筛选得到一系列La3+应答mRNA, 并对其功能及调控通路深入分析, 在转录组水平研究La3+对Cu2+胁迫下水稻保护作用的分子调控模式, 为水稻的抗逆育种提供理论参考。
1 材料与方法 1.1 材料粳稻苏香粳3号(Oryza sativa L. subsp. Japonica cv. Suxiang 3)来源于江苏太湖地区农业科学研究所。POD和CAT试剂盒购于南京建成生物工程研究所, Trizol试剂购于上海Sangon生物工程技术有限公司, ribo-zero rRNA试剂盒购于上海欧易生物科技有限公司, DNaseⅠ购于美国碧云天公司, TruSeq Stranded Total RNA试剂盒购于美国Illumina公司, PCR marker购于赛默飞世尔科技公司, AceQ® qPCR SYBR® Green Master Mix荧光试剂购于美国ABI生物技术有限公司, 凝胶回收试剂盒购于Omega公司。
1.2 方法 1.2.1 水稻的培养与处理粳稻苏香粳3号种子于36℃催芽1 d露白后转至光温培养箱(16 h光照/8 h黑暗, 温度30℃, 1:1:1:100霍格兰营养液)。CuSO4溶液(0、10、20、30、50和100 mg/L)模拟胁迫7 d龄幼苗5 d后取样测试CuSO4的最佳胁迫浓度。用50 mg/L CuSO4和不同浓度La(NO3)3(0、10、20、30、40和50 mg/L)同时处理7 d龄幼苗5 d后取样, 测试La(NO3)3的最佳处理浓度, 每组3个重复。
1.2.2 生理指标测定参照文献[10]进行超氧化物歧化酶(Superoxide dismutase, SOD)活性测定, 运用过氧化物酶(Peroxidase, POD)试剂盒A084-3和过氧化氢酶(Catalase, CAT)试剂盒A007-1测定POD和CAT活性。
1.2.3 RNA提取和RNA-Seq分析提取总RNA, 经DNase I处理后于1%琼脂糖电泳评估RNA完整性, NanoDrop分光光度计分析RNA纯度, 使用TruSeq Stranded Total RNA试剂盒创建cDNA文库, Agilent 2100 Bioanalyzer质检合格后在Illumina Hiseq 4000平台进行测序。每个处理3个重复, 使用Trimmomatic软件对原始数据预处理, 用htseq-count软件获取各样本中比对到蛋白编码基因上的序列数, cufflinks软件计算FPKM值。
1.2.4 差异表达分析和功能注释利用DESeq软件筛选差异表达基因, 用负二项分布检验进行差异显著性检验, 显著表达基因筛选条件为: P < 0.05, 差异倍数 > 2, 且FDR < 0.05。针对基因本体(Gene ontology, GO)和KEGG数据库使用DAVID进行基因功能注释(FDR < 0.05)。
1.2.5 qRT-PCR分析使用Trizol试剂提取总RNA, 反转录获得cDNA后在AceQ® qPCR SYBR® Green Master Mix荧光试剂中, 以cDNA为模板, 以水稻肌动蛋白为内参基因, 分别扩增目标基因和内参基因。在ABI 7500荧光定量PCR仪上进行扩增, 反应条件为95℃ 5 min; 95℃ 10 s, 58℃ 30 s, 40 cycles; 95℃ 15 s, 60℃ 1 min, 95℃ 15 s; 40℃ 5 min。采用2-ΔΔCT法计算各基因表达水平。
2 结果 2.1 最适Cu2+胁迫和La3+处理浓度设置6个浓度梯度CuSO4溶液模拟铜胁迫, 分别测定SOD、POD和CAT抗氧化酶活性(图 1)。当Cu2+浓度为0-20 mg/L时, SOD、POD和CAT活性提高, Cu2+浓度升至50 mg/L以上时, 胁迫强度的提高加剧膜脂过氧化, 抗氧化酶活性显著下降。因此, 选择50 mg/L Cu2+用于后续胁迫处理。

|
| 不同小写字母表明处理组间存在显著差异。下同 图 1 不同浓度CuSO4对水稻抗氧化酶活性的影响 |
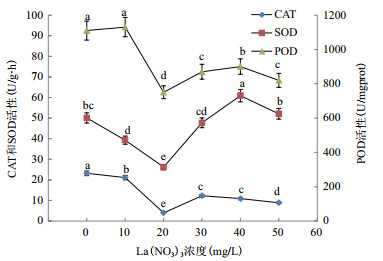
设置6个浓度梯度La(NO3)3处理经50 mg/L Cu2+胁迫7日龄水稻幼苗, 并测定SOD、POD和CAT活性(图 2), 有La3+处理样本的POD和CAT活性均低于单独Cu2+胁迫组, 且在20 mg/L时呈现最大降幅。因此, 重金属防护和缓解效应最适La3+浓度为20 mg/L。
|
| 图 2 不同浓度La(NO3)3对水稻叶片抗氧化酶活性的影响 |
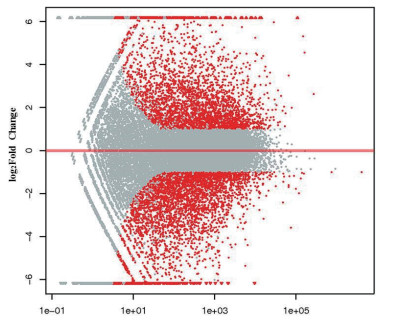
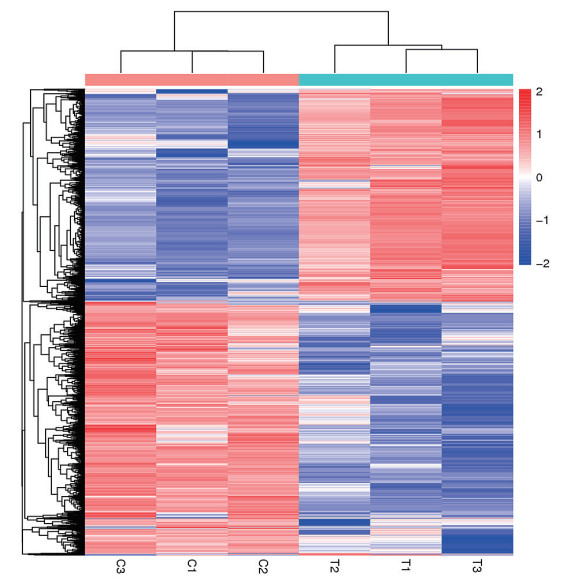
利用RNA-Seq检测20 mg/L La3++50 mg/L Cu2+处理下水稻叶片mRNA表达谱, 50 mg/L Cu2+处理组水稻叶片作为对照。使用Illumina HiSeq 4000平台共获得5.764亿原始读取, 去除低质量和衔接子序列, 共有564.11百万个原始序列(81.28 Gb), 各样品有效数据量分布在12.67-14.00 G之间, Q30碱基分布在93.94%-95.15%, 平均GC含量46.18%。差异表达分析共鉴定获得7 020个差异表达基因(图 3), 其中3 222个(45.90%)上调, 3 798个(54.10%)下调。对差异表达基因进行非监督层次聚类分析, 结果如图 4所示, 对照组和La3+处理组的样品各自聚为一簇, 验证了同组样本间相关性, 聚在同一个簇中的基因可能具有相似的生物学功能, 在La3+诱导的Cu2+胁迫应答中起重要作用。
|
| 红色表示显著性差异基因 图 3 La3+处理的水稻叶片中差异表达基因的MA图 |
|
| 图 4 La3+处理下水稻差异表达基因聚类图 |
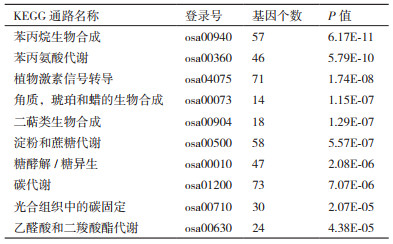
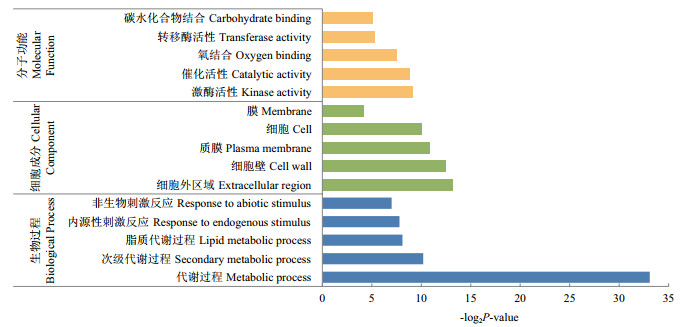
为进一步挖掘La3+诱导的差异基因的生物学功能, 对其进行了GO富集和KEGG通路分析。采用超几何分布检验筛选FDR < 0.05的显著富集GO条目和KEGG通路。分别统计La3+诱导差异基因显著富集的前5条生物学过程、细胞组分和分子功能(图 5)。KEGG通路富集结果表明, 与单一Cu2+胁迫相比, La3+处理可特异性改变112条信号转导通路, 共涉及5 661个差异表达基因。其中富集最显著的3条通路为苯丙烷生物合成、苯丙氨酸代谢和植物激素信号转导, 分别对应47、46和71个差异表达基因。表 1列出了La3+处理下按P值排序排名前10的KEGG通路。
|
| 图 5 水稻中差异表达基因的基因本体(GO)富集分析 |
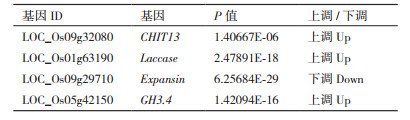
为验证测序结果, 采用Trizol法提取水稻叶片总RNA(图 6-A)。选择4个基因(CHIT13、Laccase、Expansin和GH3.4)进行qRT-PCR(图 6-B), 所设计引物均扩增获得清晰产物条带。由表 2可见, CHIT13、Laccase和GH3.4呈明显上调趋势, 而Expansin表达水平显著下调。分别统计La3+处理前后各基因相对表达量(图 6-C), 发现测序和qRT-PCR所有转录本的表达趋势均一致, 表明测序结果的可靠性。

|
| A:水稻叶片总RNA凝胶电泳图; B:qRT-PCR产物凝胶电泳图; C:qRTPCR与RNA-seq结果对比 图 6 测序结果的qRT-PCR验证 |
稀土元素对重金属胁迫的缓解作用已被广泛报道。在小麦、黄瓜等植物中已有关于稀土镧缓解镉胁迫的研究[11]; 镧还可通过调节AsA和GSH代谢减轻镉诱导的氧化损伤, 从而提高玉米对镉的耐受性[12]。虽然稀土提高植物重金属耐受性的机制研究已取得一定进展, 然而目前多局限于生理生化和单分子水平。随着高通量测序技术的快速发展, 迫切需要在全转录组水平系统地探究稀土元素在植物非生物胁迫应答中的作用机制。目前, 尚无关于稀土La3+诱导下水稻全基因组表达谱的研究报道, La3+调节水稻重金属耐受性的确切生物功能和调控通路并不清楚。
水稻面临Cu2+胁迫时, 抗氧化机制被激活, SOD、CAT、POD等抗氧化酶活性提高, 以降低活性氧基团(ROS)对膜系统的伤害。低浓度的La3+处理可增强ROS清除系统的能力并抑制自由基形成, 从而缓解Cu2+胁迫产生的应激损伤, 而高浓度的La3+比Cu2+更强烈地诱导ROS, 高水平的ROS超出抗氧化剂系统的处理能力, 无法及时从水稻细胞中排出, 从而不断积累引起细胞膜损伤, 反而引起酶活上升。
对Cu2+胁迫和La3+处理下的水稻转录组进行RNA-Seq测序共鉴定获得7 020个La3+应答mRNA。qRT-PCR方法验证了测序结果的可靠性, CHIT13、Laccase和GH3.4明显上调, 而Expansin明显下调。此前报道的水稻重金属胁迫应答基因多为重金属螯合或转运相关的功能基因。本研究通过功能注释发现, La3+调控水稻抵御Cu2+胁迫过程中的关键基因多富集于细胞壁中。通过qRT-PCR验证的4个La3+应答基因均与植物细胞壁有关。细胞壁是植物暴露于重金属的第一个结构, 为植物提供了保护作用和丰富的可再生物质。大多数元素如Zn2+、Cd2+、Fe2+、Mn2+和Cu2+都以二价离子的形式进入植物。因此, 细胞壁可以通过改变化学组成来减少重金属的吸收。CHIT13编码的几丁质酶是植物防御系统中重要的酶, 能水解几丁质并释放寡聚体, 引发一系列植物防御反应[13]。过表达几丁质酶基因的花生对黄曲霉、晚叶斑病和锈病具有更好的抗性[14], 相同结果在番茄中也得到验证。本转录组分析表明, La3+处理强烈诱导几丁质酶基因表达, 通过调节细胞壁的组成, 缓解Cu2+对水稻产生的损害。
Laccase编码的漆酶催化生成的高级木质素参与植物发育和胁迫响应[15]。已知短柄草木质化组织中至少存在两种漆酶参与木质素在细胞壁上沉积的过程[16]。本研究La3+处理大大增强了漆酶前体活性, 漆酶分泌到植物细胞次生壁中, 催化木质素单体氧化聚合, 有助于提高水稻对Cu2+胁迫的抗逆性。
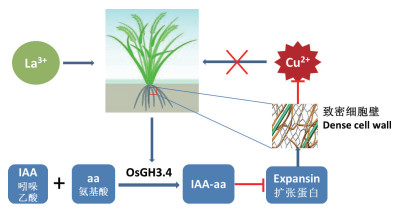
此外, La3+处理后GH3.4编码的吲哚乙酸-酰胺合成酶上调, 同时Expansin编码的扩张蛋白表达水平降低, 根据这种负相关表达模式推测GH3.4在扩张蛋白Expansin表达中起负向调节作用。水稻GH3家族成员可编码吲哚乙酸-酰胺合成酶, 该酶在胁迫下显著上调[17], 可催化植物激素吲哚乙酸(IAA)的酰胺化。扩张蛋白为植物细胞壁糖蛋白, 可诱导细胞壁伸展使之疏松, 在植物生长、发育和抗逆性中发挥重要作用[18], 而其表达取决于IAA水平。据此推测GH3.4可通过催化IAA的酰胺化, 抑制由IAA诱导的扩张蛋白表达, 从而缓解植物细胞壁的疏松状态, 并抑制细胞摄取过量Cu2+引起的损伤, 从而提高水稻对重金属胁迫的抗性(图 7)。
|
| 图 7 La3+诱导的细胞壁防御分子机制 |
GO注释发现La3+应答基因显著富集于95个生物过程、细胞组分及分子功能, 其中富集最显著的有脂质代谢、细胞壁和质膜等, 这与干旱胁迫下云南割手密转录组结果一致[19]。KEGG通路富集结果表明5 661个差异基因富集在氨基酸代谢以及植物激素信号转导等通路, 这与低温胁迫下水稻的通路富集结果相似, 同时印证了水稻在受到非生物胁迫时, 调控代谢和形态的差异基因开始大量表达[20]。
在差异基因显著富集的植物激素信号转导通路(Osa04075)中, 共有71个基因在La3+处理后差异表达, 其中29个表达上调, 42个表达下调, 覆盖了色氨酸代谢、玉米素生物合成、二萜类生物合成、类胡萝卜素生物合成、半胱氨酸和蛋氨酸代谢、油菜素生物合成、α-亚麻酸代谢和苯丙氨酸代谢等8个激素信号转导相关模块。其中色氨酸代谢模块涉及的多个生长素合成途径相关基因在La3+处理后表达均下调。例如, La3+处理能抑制生长素转运蛋白(AUX1)和其下游生长素响应蛋白(TIR1)的表达, 引起由泛素介导的生长素活性诱导基因蛋白(AUX/IAA)水解并释放出转录因子ARF。ARF介导生长素反应蛋白(SAUR)和GH3家族成员表达下调, 从而负向调节水稻细胞扩展生长, 减少重金属离子的吸收。在苯丙氨酸代谢模块中, 与水杨酸合成相关的调节蛋白NPR1正向调控转录因子TGA和PR1表达上调, 从而增加了水稻的抗逆性。上述基因的差异表达从通路层面为本研究提出的La3+诱导的重金属防御模型提供了理论支持。
4 结论一定浓度范围内的La3+能显著提高水稻对Cu2+胁迫的耐受性, 鉴定了一系列La3+响应性mRNA和相关代谢通路, 提出了La3+诱导的细胞壁防御新机制。
| [1] |
Guigues S, Bravin MN, Garnier C, et al. Does specific parameteriz-ation of WHAM improve the prediction of copper competitive binding and toxicity on plant roots?[J]. Chemosphere, 2016, 170: 225-232. |
| [2] |
Xing W, Huang W, Liu G. Effect of excess iron and copper on physiology of aquatic plant Spirodela polyrrhiza(L.)Schleid[J]. Environ Toxicol, 2010, 25(2): 103-112. |
| [3] |
崔玲, 王玉倩, 高阳, 等. 铜胁迫对玉米根系非选择性阳离子通道(NSCCs)钾转移的影响[J]. 分子植物育种, 2018, 16(11): 3704-3709. Cui L, Wang YQ, Gao Y, et al. The effect of copper stress on the potassium transfer of NSCCs in maize root[J]. Molecular Plant Breeding, 2018, 16(11): 3704-3709. |
| [4] |
Brewer A, Chang E, Park DM, et al. Recovery of rare earth elements from geothermal fluids through bacterial cell surface adsorption[J]. Environmental Science and Technology, 2019, 53(13): 7714-7723. DOI:10.1021/acs.est.9b00301 |
| [5] |
Liu D, et al. Lanthanum regulates the reactive oxygen species in the roots of rice seedlings[J]. Sci Rep, 2016, 6: 31860. DOI:10.1038/srep31860 |
| [6] |
Si Y, Wang L, et al. Effects of lanthanum and silicon stress on bio-sequestration of lanthanum in phytoliths in rice seedlings[J]. Environ Sci Pollut Res Int, 2018, 25(11): 10752-10770. DOI:10.1007/s11356-018-1360-4 |
| [7] |
d’Aquino L, et al. Effect of some light rare earth elements on seed germination, seedling growth and antioxidant metabolism in Triticum durum[J]. Chemosphere, 2009, 75(7): 900-905. DOI:10.1016/j.chemosphere.2009.01.026 |
| [8] |
Hu H, et al. Combined effects of simulated acid rain and lanthanum chloride on chloroplast structure and functional elements in rice[J]. Environ Sci Pollut Res Int, 2016, 23(9): 8902-8916. DOI:10.1007/s11356-015-5962-9 |
| [9] |
Wang L, Huang X, Zhou Q. Protective effect of rare earth against oxidative stress under ultraviolet-B radiation[J]. Biol Trace Elem Res, 2009, 128(1): 82-93. DOI:10.1007/s12011-008-8250-4 |
| [10] |
Issam N, Kawther M, Haythem M, et al. Effects of CaCl2 pretreatment on antioxidant enzyme and leaf lipid content of faba bean(Vicia faba L.)seedlings under cadmium stress[J]. Plant Growth Regulation, 2012, 68(1): 37-47. DOI:10.1007/s10725-012-9691-5 |
| [11] |
Yang H, Xu Z, Liu R, et al. Lanthanum reduces the cadmium accumulation by suppressing expression of transporter genes involved in cadmium uptake and translocation in wheat[J]. Plant and Soil, 2019, 441(1): 235-252. |
| [12] |
Dai H, et al. Lanthanum improves the cadmium tolerance of Zea mays seedlings by the regulation of ascorbate and glutathione metabolism[J]. Biologia Plantarum, 2017, 61(3): 551-556. DOI:10.1007/s10535-016-0669-4 |
| [13] |
Zhang X, Huang Y, Harvey PR, et al. Enhancing plant disease suppression by Burkholderia vietnamiensis through chromosomal integration of Bacillus subtilis chitinase gene chi113[J]. Biotechnology Letters, 2012, 34(2): 287-293. DOI:10.1007/s10529-011-0760-z |
| [14] |
Prasad K, Bhatnagar-Mathur P, Waliyar F, et al. Overexpression of a chitinase gene in transgenic peanut confers enhanced resistance to major soil borne and foliar fungal pathogens[J]. Journal of Plant Biochemistry & Biotechnology, 2013, 22(2): 222-233. |
| [15] |
Liu Q, Luo L, Wang X, et al. Comprehensive analysis of rice laccase gene(OsLAC)family and ectopic expression of OsLAC10 enhances tolerance to copper stress in Arabidopsis[J]. Int J Mol Sci, 2017, 18(2): 209-240. DOI:10.3390/ijms18020209 |
| [16] |
Wang Y, Bouchabké-Coussa O, Bris PL, et al. LACCASE5 is required for lignification of the Brachypodium distachyon Culm[J]. Plant Physiology, 2015, 168(1): 192-204. DOI:10.1104/pp.114.255489 |
| [17] |
Zhang SW, Li CH, Cao J, et al. Altered architecture and enhanced drought tolerance in rice via the down-regulation of indole-3-acetic acid by TLD1/OsGH3. 13 activation[J]. Plant Physiology, 2009, 151(4): 1889-1901. DOI:10.1104/pp.109.146803 |
| [18] |
Zhang H, Li J, Wang R, et al. Comparative analysis of expansin gene codon usage patterns among eight plant species[J]. Journal of Biomolecular Structure & Dynamics, 2018, 37(7): 1-19. |
| [19] |
刘洪博, 刘新龙, 等. 干旱胁迫下割手密根系转录组差异表达分析[J]. 中国农业科学, 2017, 50(6): 1167-1178. Liu HB, Liu XL, et al. Transcriptome difference analysis of Saccharum spontaneum roots in response to drought stress[J]. Scientia Agricultura Sinica, 2017, 50(6): 1167-1178. |
| [20] |
Zhang T, Zhao X, Wang W, et al. Comparative transcriptome profiling of chilling stress responsiveness in two contrasting rice genotypes[J]. PLoS One, 2012, 7(8): e43274. |