我国是一个农业大国,废弃的秸秆给我国带来了严重的负面影响,燃烧秸秆的方式不仅造成了能源的浪费,还会对环境造成极大的污染,如果将废弃的秸秆制备成水解液,利用酿酒酵母的分解作用,可将其转化为纤维乙醇,作为生物能源使用。
利用酿酒酵母生产纤维乙醇具有很大的优势,当酿酒酵母大量繁殖时,可以抑制其他有害微生物的繁殖,并且酿酒酵母在发酵过程中启酵快,发酵充分,最终酒精产量高[1]。由于秸秆水解液中含有许多对酵母菌生长抑制的物质,如糠醛、弱酸以及酚类等,其中糠醛的抑制作用很强,它能诱导酵母细胞内ROS的积累,从而损伤细胞线粒体和液泡膜[2]。酵母在将糠醛还原成糠醇时,其转化过程会导致辅酶的大量消耗,从而影响胞内代谢,并会造成抗氧化蛋白的失活,使得酵母细胞受到氧化性破坏[3]。
为提高酵母菌对水解液抑制物的耐受性,科研人员利用了自然选育、驯化、诱变育种、杂交育种、原生质体融合和基因工程等技术。邹姝姝等[4]通过对耐酸酵母菌的自然选育实验,挑取了4个能耐受pH 1.50的酒用酵母菌株。张译之等[5]利用驯化和紫外诱变相结合的手段处理酿酒酵母,再通过分离筛选,获得了3株抑制物耐受能力高于出发菌株的突变菌株。林贝等[6]采用紫外诱变结合驯化对工业酿酒酵母进行选育,在复合抑制剂存在下,优势菌株发酵时间为48 h,乙醇平均产率0.19 g/(L·h),相比原始菌株,优势菌株发酵时间缩短65.22%,乙醇平均产率提高2.17倍。方佩佩等[7]采用大气压等离子体技术对酿酒酵母进行诱变,获得了一株发酵液酒精含量达18.24%的菌株,其产酒精能力提高了27.51%。吴帅等[8]用酿酒酵母AY-15,M1进行杂交育种试验,得到了一株在高渗环境中仍然保持较高产酒精能力的酿酒酵母,其在含盐5%的培养基中,产酒精能力分别比AY-15,M1提高了19.6%和15.4%。苟敏等[9]利用原生质体融合技术选育耐酸絮凝性酿酒酵母,通过对融合子的筛选获得了一株乙醇收率比亲本菌株高9.8%的菌株。Wan等[10]在培养基中加入硫酸锌后,酵母的乙酸耐受能力得到提升,并测得胞内丙氨酸含量是对照培养物含量的3.51倍,随后在培养基中添加0.5 g/L的丙氨酸,发现在乙酸存在的条件下糖耗速率加快,ROS积累减少,说明丙氨酸可作为ROS清除剂。利用基因工程的技术能够定向改造酵母,通过改变胞内的能量代谢、丙氨酸代谢、谷氨酸代谢、甘油代谢、脯氨酸代谢、肌醇代谢以及改变胞内谷胱甘肽抗氧化系统来提高菌体对抑制物的耐受能力。何艳艳等[11]在酿酒酵母中过表达了LCB4基因,其编码的长链鞘氨醇激酶使发酵液中的甘油、海藻糖以及琥珀酸的含量提高,这些物质有利于增强菌株的抑制物耐受性,在3 g/L糠醛的发酵过程中,重组菌株的乙醇发酵产率达到了0.76 g/(L·h),且比对照菌株提高了85.4%,发酵时间缩短了30 h。相瑞娟[12]先通过基因工程改造等手段实现膜转运蛋白基因MDR1和ADP1的过表达来构建抗性提高的酿酒酵母,再通过定向驯化来筛选具有良好抑制物抗性的酵母菌株。张克俞等[13]过表达了IMP环水解酶基因ADE17,使得酵母的最大乙醇生产强度达到了0.669 g/(L·h),较对照菌株提高了42.6%,发酵周期也缩短了23 h。Chen等[14]通过转录组分析方法发现多个基因在糠醛存在条件下表达上调,选择基因ACE2和SFP1进行过表达,使得过表达菌株在糠醛胁迫条件下的乙醇生产强度提高了4倍。Kim[15]过表达了谷胱甘肽合成路径的基因GSH1和GLR1,加强了细胞对糠醛的耐受能力。陈洪奇[16]研究了在10 g/L乙酸胁迫条件下,GLN1基因的表达水平和蛋白水平在添加硫酸锌后均上调,说明GLN1基因在提高酵母菌的抗逆性中起到了一定的作用。GLN1是编码谷氨酰胺合成酶的基因,能促进谷氨酰胺的合成。对于谷氨酰胺合成代谢途径是否能提高酵母糠醛耐受性的问题,目前还鲜有报导。
为克服糠醛对纤维乙醇生产的影响,我们拟将基因GLN1插入载体pESC-URA中,再导入酿酒酵母BY4741,促进胞内谷氨酰胺的合成,进一步转化为谷胱甘肽,使得胞内谷胱甘肽抗氧化系统的水平得到提升,进而降低ROS的含量,使酵母细胞的抗糠醛胁迫能力得到增强,从而使产乙醇的效率得到提升。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒出发菌株为酵母菌BY4741,由本实验室保存;质粒pUC19,由本实验室保存;质粒pESC-URA,由本实验室保存。
1.1.2 主要试剂与仪器氨苄青霉素购自Mersco公司;PCR引物合成由南京金斯瑞生物科技有限公司合成;DL5000 DNA Marker、Yeast RNAiso Kit购自宝生物工程(大连)有限公司;变性鲑鱼精DNA购自北京雷根生物技术有限公司;酵母SC-URA培养基购自上海百风生物科技有限公司;2×Accurate Taq预混液(含染料)、DNA Ligation Kit购自湖南艾科瑞生物工程有限公司;T5核酸外切酶购自新海基因检测有限公司;谷氨酰胺合成酶(GS)活性检测试剂盒检测购自北京索莱宝科技有限公司;NAD+/NADH检测试剂盒购自碧云天公司。
SBA-40D型生物传感分析仪(济南研科实验仪器有限公司),Waters e 2695型高效液相色谱仪(美国Waters公司),mycycler PCR仪(美国Bio-Rad公司),ABI 7500荧光定量PCR仪(美国ABI公司)。
1.1.3 培养基液体培养基:LB液体培养基、YPD液体培养基;固体培养基:LB固体培养基、YPD固体培养基、酵母SC-URA固体培养基;选择培养基:LB培养基加抗生素(50 mg/L氨苄青霉素);糠醛耐受培养基:蛋白胨20 g/L、酵母粉10 g/L、葡萄糖20 g/L、糠醛1.55 g/L;模拟水解液培养基:蛋白胨20 g/L、酵母粉10 g/L、葡萄糖47.8 g/L、糠醛1.1g/L。
1.2 方法 1.2.1 酵母工程菌的构建及验证 1.2.1.1 重组质粒的构建与转化根据GLN1基因序列设计扩增引物P1和P2,如表 1所示,该对引物下划线序列与GLN1基因序列同源,两边各有20 bp与质粒pUC19序列同源的同源臂,将目的基因GLN1与经BamHⅠ和Hind Ⅲ双酶切后的pUC19质粒按照摩尔比为2:1的比例混合,再向离心管中加入T5核酸外切酶,30℃反应40 min,于冰上停止反应,待100 µL感受态细胞解冻后,向其加入5 µL反应液,混匀后置于冰上30 min,然后42℃热冲击60 s,随后放置冰上2 min,加入900 µL的LB液体培养基,于37℃,250 r/min的摇床中培养1h,培养结束后取100 µL菌液涂布于氨苄抗性平板上,于37℃恒温培养12-16 h,对平板上长出的菌落用验证引物P3、P4进行验证,验证成功后,将质粒命名为“pUC-GLN1”。然后用T4 DNA连接酶将质粒pUC-GLN1与质粒pESC-URA进行连接,先将两质粒用限制性核酸内切酶BamHⅠ和Hind Ⅲ分别进行双酶切,随后对酶切体系进行切胶回收,按照2:1的摩尔比加入酶切后的质粒pUC-GLN1与酶切后的质粒pESC-URA,再向离心管中加入T4 DNA连接酶,16℃反应30 min,于冰上停止反应,待100 µL感受态细胞解冻后,向其加入5 µL反应液,混匀后置于冰上30 min,然后42℃热冲击60 s,随后放置冰上2 min,加入900 µL的LB液体培养基,于37℃,250 r/min的摇床中培养1 h,培养结束后取100 µL菌液涂布于氨苄抗性平板上,于37℃恒温培养12-16 h,对平板上长出的菌落用验证引物P5、P6进行验证,验证成功后,将质粒命名为“pESC-GLN1”。
重组质粒pESC-GLN1构建成功后,用醋酸锂转化法[17]将重组质粒转化到BY4741细胞中,将酵母BY4741培养在50 mL液体培养基中,于30℃、200 r/min振荡过夜,用显微镜计数算出酵母的密度,然后接种酵母于50 mL液体培养基中,使得酵母密度为5×106个/mL。将摇瓶置于30℃、200 r/min培养3-5 h,当酵母密度为2×107个/mL时,将菌液倒入50 mL无菌离心管,于2 500 r/min、4℃离心5 min,弃上清,加入25 mL预冷无菌水,重悬菌柄,重复上述离心操作后弃上清,加入1 mL预冷的浓度为100 mmol/L的LiAc,重悬后转移至1.5 mL无菌离心管,于10 000 r/min、4℃离心5 min,用移液器吸尽LiAc,再加入0.4 mL浓度为100 mmol/L的LiAc重悬,随后取50 µL的细胞悬浮液于1.5 mL干净离心管,于10 000 r/min、4℃离心5 min,再用移液器吸尽LiAc,按顺序依次向离心管中加入50%PEG3350 240 µL、1 mol/L LiAc 36 µL、2 g/L变性鲑鱼精DNA 25 µL、预冷无菌水50 µL以及重组质粒10 µg,充分混合后,置于30℃水浴锅中保温30 min,然后在42℃水浴锅中进行热休克20 min,随后6 000 r/min、4℃离心30 s。用移液器吸除转化混合液,将沉淀重新悬浮于0.4 mL无菌纯水中,轻轻吹吸混匀,取200 µL菌液涂布于SC-URA固体培养基上,于30℃恒温培养12-16 h,若在SC-URA固体培养基上长出菌落,则表明重组质粒已成功转化,将重组菌株命名为YEA9。挑取YEA9菌株在SC-URA固体培养基上连续培养8代以上,再保存至甘油管。
1.2.1.2 GLN1基因转录水平差异分析将YEA9菌株接入含20 g/L半乳糖的SC-URA液体摇瓶中,收集发酵24 h的细胞,利用Yeast RNAiso Kit提取总RNA,然后利用PrimeScriptTM RT reagent Kit with gDNA Eraser将提取的总RNA进行反转录合成cDNA。再以cDNA为模板,用SYBR®Premix Ex TaqTM II配置实时定量PCR反应体系,利用定量PCR仪进行实时定量PCR反应。选择β-actin作为参比基因,以β-actin转录水平为1计算GLN1基因的相对转录水平。用于β-actin基因定量的引物为P7和P8,用于GLN1定量的引物为P9和P10。定量PCR反应条件为95℃预变性30 s,95℃变性5 s,46℃退火30 s,72℃延伸20 s,40个循环。其测量结果如表 2所示。
用谷氨酰胺合成酶(Glutamine synthetase,GS)活性检测试剂盒对该酶活进行检测,称取OD600为0.5的酵母细胞0.1 g,再加入1 mL提取液进行冰浴匀浆,在8 000 r/min、4℃的条件下离心10 min,取上清进行检测。
谷氨酰胺的含量用高效液相色谱法[18]来测量,色谱柱Bio-Rad HPX-87H离子交换柱,流动相50 mmol/ L磷酸二氢钾:乙腈=70:30,流速0.4 mL /min,柱温45℃,进样量10 μL,采用215 nm紫外吸收检测器。
1.2.2 菌株耐受性能及发酵的测定 1.2.2.1 原始菌株耐受性能的测定先对酵母菌BY4741的糠醛耐受性进行探索,将酵母菌BY4741接入50 mL的YPD液体摇瓶中,待OD600长到0.5时,以1%的接种量分别转接于150 mL含有0.0、0.5、1.0、1.5和2.0 g/L的糠醛培养基中,在30℃、150 r/min条件下进行培养,每6 h取样测量OD600,绘制生长曲线,以确定能抑制原始菌株BY4741生长的糠醛浓度。
1.2.2.2 重组菌株生长及耐受性能的测定根据1.2.2.1中所确定的糠醛浓度,对重组酵母YEA9进行耐受性能评估,将菌株YEA9和菌株BY4741分别进行摇瓶培养,再将两瓶的OD600均调到0.5,从两瓶中分别取1.5 mL置于含糠醛的150 mL液体培养基中,在30℃、150 r/min条件下进行培养,每12 h取样测量OD600、葡萄糖含量和乙醇含量,绘制细胞的生长曲线、糖耗曲线以及乙醇生产曲线。
1.2.2.3 发酵产物检测分析谷胱甘肽(GSH)的含量用四氧嘧啶法[19]进行测定。取5 mL发酵48 h后的菌液,于8 000 r/min离心3 min后去掉上清液,加入20 mL无菌水重悬并离心,清洗两次后再加入5 mL的无菌水,于100℃沸水中加热5 min,随后置于冰上3 min。细胞悬液经8 000 r/min离心5 min后,取上清液用于测定胞内GSH含量。
使用NADH氧化酶测试盒[20]测定细胞内NADH氧化酶酶活。发酵48 h后取9 mL发酵液,于8 000 r/min离心3 min后收集细胞,用磷酸盐缓冲液(PBS)洗涤2次,根据试剂盒的方法对NADH氧化酶酶活进行测定。
用NAD+/NADH检测试剂盒测定细胞内的NAD+/NADH水平。取9 mL发酵48 h后的发酵液,于8 000 r/min离心3 min,去掉上清后用PBS洗涤2次,超声破碎细胞后将悬浮液煮沸5 min,随后在冰浴中快速冷却。在离心管中先后加入500 μL的样品和500 μL 0.2 mol/L NaOH或0.2 mol/L HCl,将混合物于10 000 r/min离心10 min后,收集上清液,测定其NAD+/NADH的含量。
使用探针2’,7’-二氯二氢荧光素二乙酸酯(H2DCFDA)测定2 g/L糠醛条件下重组菌株和对照菌株细胞内ROS水平[21]。取9 mL发酵6 h后的发酵液,将OD600调为0.25,取4.5 mL发酵液,离心收集菌体,用PBS缓冲液洗2遍菌体,然后用500 μL的PBS缓冲液重悬,再加入40 μL H2DCFDA,在黑暗条件下于30℃,200 r/min反应1 h。离心收集细胞,再用PBS洗去多余的荧光染料,用500 μL的PBS缓冲液重悬细胞,吸取200 μL于96孔板中,使用全波长扫描仪,在485 nm激发光和535 nm发射光下测定其荧光强度,并以荧光强度表示胞内ROS的量。
1.2.3 水解液发酵实验 1.2.3.1 小麦秸秆水解液制备小麦秸秆取自武汉江夏区农田,除去小麦叶部后粉碎,过40目分样筛筛成直径为0.2-0.45 mm的粉末状样品以备用[22]。称取10 g粉碎后的小麦秸秆置于500 mL三角瓶中,按照质量比为1:10的固液比加入2%的H2SO4于121℃灭菌锅水解1 h。处理完毕后,经NaOH调节pH至5.0,按酶用量30 FPU/g加入纤维素酶,在45℃下进行酶解,其工艺条件参照相关文献[23]。水解液制备完成后,检测其葡萄糖、木糖、阿拉伯糖和糠醛含量,用于后续纤维乙醇发酵实验。
1.2.3.2 测量方法用生物传感分析仪测量秸秆发酵液中葡萄糖的含量,用高效液相色谱法测量木糖、阿拉伯糖和糠醛的含量。
木糖和阿拉伯糖[24]:色谱柱为Bio-Rad HPX-87H离子交换柱,流动相4 mmol/LH2SO4,流速0.5 mL/min,柱温40℃,示差检测器。
糠醛[25]:色谱柱Bio-Rad HPX-87H离子交换柱,流动相4 mmol/ L H2SO4,流速0.4 mL /min,柱温45℃,进样量10 μL,采用277 nm紫外吸收检测器。
1.2.3.3 发酵实验参照1.2.3.1中所测得的小麦秸秆水解液中葡萄糖、五碳糖和糠醛的浓度,人工模拟水解液,比较BY4741和YEA9的发酵情况,以探究GLN1基因的过表达对酿酒酵母产纤维乙醇的影响。
2 结果 2.1 酵母工程菌YEA9的构建 2.1.1 重组质粒的鉴定用验证引物P5、P6对重组质粒进行PCR验证,并以空载体质粒pESC-URA作为对照,GLN1基因自身长度为1 113 bp。用验证引物P5、P6经进行PCR,扩增出的片段应为1 264 bp。实验结果如图 1所示,经琼脂糖凝胶电泳检测,扩增片段与预期片段大小基本相符,说明重组质粒构建成功。
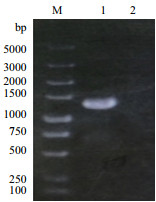
|
| M.分子量标准;1.重组质粒pESC-GLN1的PCR结果;2.阴性对照质粒pESC-URA的PCR结果 图 1 GLN1基因的RCR扩增电泳图 |
在转录水平上对菌株进行分析,比较菌株BY4741和YEA9在无抑制物条件下的基因转录水平情况,并对胞内谷氨酰胺合成酶酶活以及谷氨酰胺的含量进行测定,每个实验重复3次,其测量结果如表 2所示。
由表 2可以看出,在无抑制物的条件下,YEA9的GLN1基因相对转录水平比BY4741提高了1.95倍,谷氨酰胺合成酶的酶活提高了17.1%,谷氨酰胺的浓度提高了22.0%,表明GLN1基因的过表达,增强了谷氨酰胺合成酶的酶活,提高了谷氨酰胺的浓度。
2.2 重组菌株糠醛耐受性能评价 2.2.1 对照菌株BY4741的耐受性实验为考察糠醛抑制对照菌株BY4741生长的效果,将BY4741置于含有0.0、0.5、1.0、1.5和2.0 g/L糠醛的YPD培养基中进行培养,测量并绘制细胞的生长曲线,每个实验重复3次,如图 2所示。
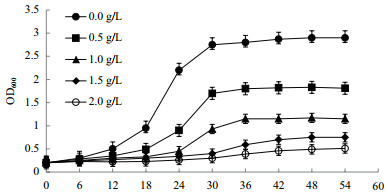
|
| 图 2 对照菌株BY4741在不同糠醛浓度下的生长曲线 |
以上结果表明,随着糠醛浓度的不断提升,菌株BY4741的生长受到抑制,高浓度的糠醛不仅抑制了细胞的生长,还降低了细胞在对数生长期的生长速度。当糠醛浓度达到2 g/L时,菌体的生长完全受到抑制,在54 h后,其OD600仅为0.51。我们将菌株BY4741在不同糠醛浓度下的最高OD600绘成曲线,从而选择具体的糠醛浓度进行后续的耐受性实验。
如图 3所示,我们将菌株BY4741的最大OD600和与之对应的糠醛浓度进行拟合,计算得出糠醛的IC50(半抑制浓度)为0.76 g/L,IC75(75%抑制浓度)为1.55 g/L。为了筛选出耐受性较强的菌株,我们选择1.55 g/L的糠醛浓度来探索重组酵母菌YEA9的生长情况。
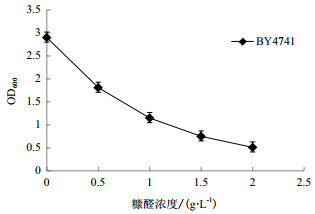
|
| 图 3 对照菌株BY4741在不同糠醛浓度下的最高OD值 |
为探索重组菌株YEA9对糠醛的耐受效果,将BY4741和YEA9在1.55 g/L糠醛浓度下进行葡萄糖单糖发酵,初始糖浓度为20 g/L,每12 h测量菌体的OD600及摇瓶中乙醇和葡萄糖的含量,每个实验重复3次,生长情况的结果如图 4所示,乙醇生产情况及葡萄糖消耗情况的结果如图 5所示。

|
| 图 4 BY4741与YEA9在1.55 g/L糠醛浓度下的生长曲线 |

|
| 图 5 BY4741与YEA9在1.55 g/L糠醛浓度下的乙醇生产及糖耗曲线 |
在菌株生长方面,BY4741菌株和YEA9菌株能达到的最大OD600值分别为0.74和2.74,即在1.55g/L糠醛浓度下,YEA9的生物量较BY4741提高了3.7倍(图 4)。在利用葡萄糖方面,BY4741的平均耗糖率为0.024 g/(L·h),而YEA9的平均耗糖率为0.207 g/(L·h),较BY4741提高了8.6倍;在产乙醇方面,BY4741最终乙醇浓度为0.943 g/L,而YEA9最终乙醇浓度为8.64g/L,较BY4741提高了9.2倍,且BY4741的糖醇转化率为80.2%,YEA9的糖醇转化率为88.7%,较BY4741提高了10.6%;在发酵周期方面,YEA9在84 h发酵结束,而BY4741的葡萄糖并未耗完,残糖量为88.5%(图 5)。
2.2.3 菌株发酵产物的测定 2.2.3.1 谷胱甘肽抗氧化系统的检测按照1.2.2.3中的测量方法,分别测量BY4741和YEA9中的谷胱甘肽含量、NADH氧化酶酶活以及NAD+/ NADH,每个实验重复3次,其测量结果见表 3。
由表 3可知:YEA9的谷胱甘肽含量较BY4741提高了22.4%,NADH氧化酶酶活提高了5.1%,但是NAD+/NADH的数值没有明显变化,说明GLN1基因的过表达有助于谷胱甘肽的合成,能增强NADH氧化酶的酶活,不改变胞内还原力的平衡。
2.2.3.2 胞内活性氧自由基检测由于糠醛能诱导酵母细胞内活性氧(ROS)的积累,为进一步探索GLN1基因的过表达与ROS含量的关系,对BY4741和YEA9的胞内活性氧自由基进行检测,每个实验重复3次,检测结果如图 6所示。

|
| 图 6 BY4741和YEA9的ROS水平测定 |
通过测量过表达前后两菌株的ROS含量,发现重组酵母YEA9的ROS水平较酿酒酵母BY4741降低了32.26%,计算得P值小于0.01,说明该两组数据是有极显著差异性的,表明过表达GLN1基因可以降低胞内的ROS水平,从而减少ROS对细胞的伤害。
2.3 小麦秸秆水解液糖浓度检测结果 2.3.1 小麦秸秆水解液含量的测定对小麦秸秆水解液中葡萄糖、木糖、阿拉伯糖和糠醛的浓度进行检测,每个实验重复3次。
根据检测结果可知,葡萄糖浓度为47.8 g/L,木糖浓度为23.1 g/L,阿拉伯糖浓度为3.0 g/L、糠醛浓度为1.1 g/L,根据此数值模拟水解液,将模拟水解液的培养基定为:蛋白胨20 g/L,酵母粉10 g/L,葡萄糖47.8 g/L,糠醛浓度为1.1 g/L。
2.3.2 重组菌株在水解液中的生长情况为探索重组菌株YEA9在水解液中的耐受情况,将BY4741和YEA9在模拟水解液中进行发酵,每12 h测量菌体的OD600及摇瓶中乙醇和葡萄糖的含量,每个实验重复3次,生长情况的结果如图 7所示,乙醇生产情况及糖耗情况的结果,如图 8所示。
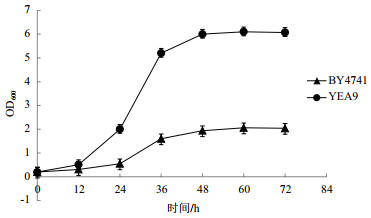
|
| 图 7 BY4741与YEA9在模拟水解液下的生长曲线 |
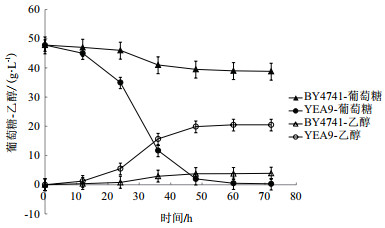
|
| 图 8 BY4741与YEA9在模拟水解液下的乙醇生产及糖耗曲线 |
在菌株生长方面,BY4741菌株和YEA9菌株能达到的最大OD600值分别为2.04和6.07,即在模拟水解液中,重组菌株YEA9的生物量较BY4741提高了2.98倍(图 7)。在利用葡萄糖方面,BY4741的平均耗糖率为0.13 g/(L·h),而YEA9的平均耗糖率为0.79 g/(L·h),较BY4741提高了6.1倍;在产乙醇方面,BY4741最终乙醇浓度为3.9g/L,而YEA9最终乙醇浓度为20.5 g/L,较BY4741提高了5.3倍,且BY4741的糖醇转化率为84.4%;YEA9的糖醇转化率为84.8%,较BY4741提高了0.5%;在发酵周期方面,YEA9在60 h发酵结束,而BY4741的葡萄糖并未耗完,其残糖量为81.2%(图 8)。
3 讨论对比酿酒酵母YEA9和BY4741的发酵情况,我们可以看出,无论是在1.55 g/L的糠醛培养基中,还是在模拟水解液中,YEA9的生长量、葡萄糖消耗速率、最终乙醇浓度以及糖醇转化率都比BY4741高,表明YEA9有更强的抗糠醛胁迫能力,更有利于纤维乙醇的生产。过表达GLN1基因后,酿酒酵母中的谷胱甘肽含量有所提高,NADH氧化酶的酶活也得到了增强,表明胞内的谷胱甘肽抗氧化系统水平提升了,从而降低了胞内ROS的积累,避免了由于糠醛产生的ROS对细胞线粒体和液泡膜的损害,进而提高了酿酒酵母的糠醛耐受性。
方青[26]在酿酒酵母中过表达了编码谷胱甘肽依赖的氧化还原酶基因GRX5,使得谷胱甘肽过氧化物酶的活性提高了158%,且重组菌株在糠醛浓度为0.5 g/L的模拟玉米秸秆水解液中,其糖醇转化率为81%。而在本实验中,重组菌株YEA9在糠醛浓度为1.1 g/L的模拟小麦秸秆水解液中的糖醇转化率达到了85%,表明YEA9在高浓度糠醛存在的条件下,其糖醇转化率依然很高。Wang等[27]通过过表达脯氨酸和甾醇代谢途径的关键基因PRO1和INO1,在0.8 g/L糠醛胁迫的条件下,重组菌株的糖耗速率为0.36 g/(L·h),乙醇产率为0.17 g/(L·h),而本实验通过过表达谷氨酰胺合成酶基因GLN1,使得该菌在1.1 g/L糠醛胁迫下,其糖耗速率为0.79 g/(L·h),乙醇产率为0.43 g/(L·h),通过对比可以看出,重组菌株YEA9在生产乙醇方面具有更好的优越性。
综上,重组菌株YEA9可以在较高浓度的糠醛胁迫下产生更多的乙醇,并能降低胞内ROS水平,利用基因工程的方法来增强胞内的代谢通路,为探索机理提供更多的途径。然而在纤维乙醇的生产过程中,酿酒酵母在水解液中的生长不仅受到糠醛的抑制,还会受到弱酸及酚类的抑制作用,我们可以通过基因工程的手段对酿酒酵母进行进一步的改造,从而增加酿酒酵母对多种抑制物的耐受能力。
4 结论本研究以原始酵母菌BY4741为出发菌株,通过过表达GLN1基因,成功构建了重组菌株YEA9,该菌的糠醛耐受性较原始菌株得到了提升,最终乙醇产量也有所提高,并发现GLN1基因的过表达能降低胞内ROS水平,从而提高胞内的抗氧化能力,以此来增强其对糠醛的耐受性。
| [1] |
范兆军. 果酒酵母的研究[J]. 农产品加工, 2015(1): 69-70. Fan ZJ. Research on fruit wine yeast[J]. Farm Products Processing, 2015(1): 69-70. DOI:10.3969/j.issn.1671-9646(S).2015.01.025 |
| [2] |
赵心清, 张明明, 徐桂红, 等. 酿酒酵母乙酸耐性分子机制的功能基因组进展[J]. 生物工程学报, 2014, 30(3): 368-380. Zhao XQ, Zhang MM, Xu GH, et al. Advances in functional genomics studies underlying acetic acid tolerance of Saccharomyces cerevisiae[J]. Chinese Journal of Biotechnology, 2014, 30(3): 368-380. |
| [3] |
Modig T, Lidén G, Taherzadeh MJ. Inhibition effects of furfural on alcohol dehydrogenase, aldehyde dehydrogenase and pyruvate dehydrogenase[J]. Biochemical Journal, 2002, 363(3): 769-776. DOI:10.1042/bj3630769 |
| [4] |
邹姝姝, 全学军, 周跃钢. 酒用耐酸酵母的自然选育[J]. 重庆理工大学学报, 2003, 17(1): 22-24. Zou SS, Quan XJ, Zhou YG. Natural selection of acid-resistant yeast[J]. Journal of Chongqing Institute of Technology, 2003, 17(1): 22-24. DOI:10.3969/j.issn.1674-8425-B.2003.01.005 |
| [5] |
张译之, 苟敏, 汤岳琴. 紫外诱变驯化提高酿酒酵母木糖发酵的抑制物耐受性[J]. 生物技术通报, 2017, 33(9): 191-199. Zhang YZ, Gou M, Tang YQ. Improvement of inhibitor tolerance of a Xylose-fermenting industrial Saccharomyces cerevisiae strain through UV mutation and acclimation[J]. Biotechnology Bulletin, 2017, 33(9): 191-199. |
| [6] |
林贝, 李健秀, 刘雪凌. 紫外诱变结合驯化提高酿酒酵母对抑制物耐受性[J]. 生物技术, 2018, 28(1): 85-91. Lin B, Li JX, Liu XL. Improvement of inhibitor tolerance of Saccharomyces cerevisiae through UV mutation and adaption[J]. Biotechnology, 2018, 28(1): 85-91. |
| [7] |
方佩佩, 王世清, 李静, 等. 耐酒精酿酒酵母大气压等离子体诱变条件的建立及选育[J]. 酿酒科技, 2016, 9(9): 31-37. Fang PP, Wang SQ, Li J, et al. Establishment of the conditions of atmospheric plasma-inducing mutation of S.cerevisiae and breeding of an ethanol-tolerant strain[J]. Liquor-Making Science Technology, 2016, 9: 31-37. |
| [8] |
吴帅, 陈叶福, 沈楠, 等. 高耐性酿酒酵母的杂交育种[J]. 酿酒科技, 2006(10): 20-22. Wu S, Chen YF, Shen N, et al. Construction of S.cerevisiae with good osmo-tolerance and high ethanol-production characteristic[J]. Liquor-Making Science Technology, 2006(10): 20-22. DOI:10.3969/j.issn.1001-9286.2006.10.002 |
| [9] |
苟敏, 杨白雪, 汤岳琴, 等. 利用原生质体融合技术构建耐酸絮凝性产乙醇酿酒酵母[J]. 生物技术通报, 2016, 32(11): 115-123. Gou M, Yang BX, Tang YQ, et al. Construction of acid-tolerant and flocculating Saccharomyces cerevisiae strain for ethanol production by protoplast fusion[J]. Biotechnology Bulletin, 2016, 32(11): 115-123. |
| [10] |
Wan C, Zhang MM, Fang Q, et al. The impact of zinc sulfate addition on the dynamic metabolic profiling of Saccharomyces cerevisiae subjected to long term acetic acid stress treatment and identification of key metabolites involved in the antioxidant effect of zinc[J]. Metallomics, 2015, 7(2): 322-332. DOI:10.1039/C4MT00275J |
| [11] |
何艳艳, 孜力汗, 张宝会, 等. 过表达长链鞘氨醇激酶基因LCB4提高酿酒酵母抑制物耐受性[J]. 生物工程学报, 2018, 34(6): 906-915. He YY, Zi LH, Zhang BH, et al. Improvement of inhibitors tolerance of Saccharomy cescerevisiae by overexpressing of long chain sphingoid kinases encoding gene LCB4[J]. Chinese Journal of Biotechnology, 2018, 34(6): 906-915. |
| [12] |
相瑞娟.木质纤维素水解液抑制物高抗性酵母的选育[D].大连: 大连理工大学, 2016. Xiang RJ. Breeding of Yeast with improved resistance to lignocellulosic inhibitory compounds[D]. Dalian: Dalian University of Technology, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10141-1016216740.htm |
| [13] |
张克俞, 张明明, 赵心清, 等. 关键基因过表达提高酿酒酵母抑制剂耐受性及乙醇发酵性能[J]. 应用与环境生物学报, 2018, 24(3): 541-546. Zhang FY, Zhang MM, Zhao XQ, et al. Improvement of inhibitor stress tolerance and ethanol fermentation of Saccharomyces cerevisiae by overexpression of novel key genes[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(3): 541-546. |
| [14] |
Chen YY, Sheng JY, Jiang T, et al. Transcriptional profiling reveals molecular basis and novel genetic targets for improved resistance to multiple fermentation inhibitors in Saccharomyces cerevisiae[J]. Biotechnology for Biofuels, 2016, 9(9): 1-18. |
| [15] |
Kim D, Hahn JS. Roles of the Yap1 transcription factor and antioxidants in Saccharomyces cerevisiae's tolerance to furfural and 5-hydroxymethylfurfural, which function as thiol-reactive electrophiles generating oxidative stress[J]. Applied and Environmental Microbiology, 2013, 79(16): 5069-5077. DOI:10.1128/AEM.00643-13 |
| [16] |
陈洪奇.硫酸锌提高酿酒酵母乙酸耐性的机理及关键基因功能分析[D].大连: 大连理工大学, 2017. Chen HQ. Exploration of the mechanisms of improved acetic acid tolerance of Saccharomyces cerevisiae by zinc sulfate addition and analysis of key functional genes[D]. Dalian: Dalian University of Technology, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10141-1017822419.htm |
| [17] |
李骆冰, 王永红, 庄英萍, 等. 乙醇发酵中酿酒酵母辅酶NAD+及NADH测定方法[J]. 食品与生物技术学报, 2011, 30(2): 287-294. Li LB, Wang YH, Zhuang YP, et al. Determination of coenzyme NAD+ and NADH of Saccharomy cescerevisiae cells in ethanol production[J]. Journal of Food Science and Biotechnology, 2011, 30(2): 287-294. |
| [18] |
韩立强, 郭豫杰, 李卫华, 等. 高效液相色谱法检测乳制品中谷氨酰胺的研究[J]. 乳业科学与技术, 2009, 32(6): 263-264. Han LQ, Guo YJ, Li WH. Analysis of glutamine content in milk by HPLC[J]. Journal of Dairy Science and Technology, 2009, 32(6): 263-264. DOI:10.3969/j.issn.1671-5187.2009.06.004 |
| [19] |
Li TK. The glutathione and thiol content of mammalian spermatozoa and seminal plasma[J]. Biology of Reproduction, 1975, 12(5): 641-646. DOI:10.1095/biolreprod12.5.641 |
| [20] |
Shi X, Zou Y, Chen Y, et al. Overexpression of a water-forming NADH oxidase improves the metabolism and stress tolerance of Saccharomyces cerevisiae in aerobic fermentation[J]. Frontiers in Microbiology, 2016, 7: 1427. |
| [21] |
Rowe LA, Degtyareva N, Doetsch PW. DNA damage-induced reactive oxygen species(ROS)stress response in Saccharomyces cerevisiae[J]. Free Radical Biology and Medicine, 2008, 45(8): 1167-1177. DOI:10.1016/j.freeradbiomed.2008.07.018 |
| [22] |
赵蒙蒙, 姜曼, 周祚万. 几种农作物秸秆的成分分析[J]. 材料导报, 2011, 25(6): 122-125. Zhao MM, Jiang M, Zhou ZW. The components analysis of several kinds of agricultural residues[J]. Materials Reports, 2011, 25(16): 122-125. |
| [23] |
黄峰, 王永泽, 周胜德, 等. 水稻脆性秸秆发酵产纤维乙醇的研究[J]. 可再生能源, 2014, 32(2): 211-215. Huang F, Wang YZ, Zhou SD, et al. Study on cellulosic ethanol fermentation of brittle rice straw[J]. Renewable Energy Resources, 2014, 32(2): 211-215. DOI:10.3969/j.issn.1671-5292.2014.02.017 |
| [24] |
丁小云, 顾健健, 王永泽, 等. 产D-乳酸重组大肠杆菌ptsG基因的敲除及其混合糖同步发酵[J]. 生物技术通报, 2015, 31(12): 221-226. Ding XY, Gu JJ, Wang YZ, et al. The knockout of gene ptsG of recombinant Escherichia coli producing D-lactic acid and the simultaneous fermentation of mixed sugars[J]. Biotechnology Bulletin, 2015, 31(12): 221-226. |
| [25] |
Zhang YY, Song Y, Hu XS, et al. Determination of 5-hydroxymeth-ylfurfural and furfural in soft beverages by HPLC[J]. Advanced Materials Research, 2012, 550-553: 159-166. |
| [26] |
方青.过表达关键酶基因对酿酒酵母胁迫耐性的影响[D].大连: 大连理工大学, 2016. Fang Q. Effect of Overexpression of key enzyme genes on stress tolerance of Saccharomyces cerevisiae[D]. Dalian: Dalian University of Technology, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10141-1016216735.htm |
| [27] |
Wang X, Bai X, Chen DF, et al. Increasing proline and myo-inositol improves tolerance of Saccharomyces cerevisiae to the mixture of multiple lignocellulose-derived inhibitors[J]. Biotechnology for Biofuels, 2015, 8: 142. DOI:10.1186/s13068-015-0329-5 |







