2. 中国科学院青岛生物能源与过程研究所 生物基材料重点实验室, 青岛 266101;
3. 云南省烟草公司玉溪市公司元江县分公司, 玉溪 6531005;
4. 中国农业科学院烟草研究所 农业部烟草生物学与加工重点实验室, 青岛 266101;
5. 中国烟草总公司海南省公司海口雪茄研究所, 海口 571100
2. CAS Key Laboratory of Biobased Materials, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Science, Qingdao 266101;
3. Yuxi City Company Yuanjiang County Branch of Yunnan Tobacco Company, Yuxi 653100;
4. Key Laboratory of Tobacco Biology and Processing, Tobacco Research Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101;
5. Cigar Research Institute of Chinese Tobacco Corporation Hainan Province, Haikou 571100
乙偶姻, 又称3-羟基丁酮, 是一种具有奶油香气的重要风味物烟草工业中都具有广泛的应用[3-6]。目前, 乙偶姻的生产方法有化学合成法、酶学转化法及微生物发酵法[1], 其中微生物发酵法以微生物为工具、原料来源丰富、工艺条件温和、其产物具有绿色安全等优点, 并且满足可持续发展理念而日益受到瞩目。范宜晓等[7]在食品中分离得到一株产乙偶姻的枯草芽孢杆菌, 发酵96 h后, 乙偶姻产量可达33.90 g/L。因此, 开发有较好性能的高产乙偶姻的新菌株具有较高的理论研究价值和应用意义。
在微生物的发酵中, 葡萄糖常用为速效碳源。但是大部分微生物对糖浓度耐受有限, 糖浓度过高会使菌株受到高糖渗透应激的影响, 导致菌株生长延滞、发酵时间过长, 从而影响目的产物产量[8]。工业发酵生产中, 常采取分批补料的方法来解决该问题, 以期提高产量, 但因此不仅下生长, 并且提高了产乙醇能力的突变菌株。综上, 筛选出具有高糖耐受度的菌株对细胞的生长, 产物的生产效率, 营养物质的吸收均产生重要的影响, 能简化发酵工业的生产工艺, 对提高产物浓度具有重要意义[12]。
本研究利用筛选培养基从烟田土壤中筛选获得一株全新的耐受高浓度葡萄糖且产乙偶姻的菌株, 然后通过全基因组测序技术和遗传进化16S rDNA序列比对分析对菌株进行鉴定, 并将该菌株的发酵产物进一步进行GC-MS(气相-质谱)分析。此外, 为确定该菌株对葡萄糖的耐受度, 初步探索了菌株对不同浓度的葡萄糖耐受实验。最后, 对该菌株进行初步摇瓶发酵实验, 进一步分析该菌株产乙偶姻的能力, 旨为该菌株的开发利用奠定基础。
1 材料与方法 1.1 材料(1) 烟田土壤: 取自湖南永州白芒烟草试验站烟田。(2)主要试剂: 乙偶姻标品(97%, 上海阿拉丁生化科技股份有限公司), 1-萘酚(99.0%, 上海阿拉丁生化科技股份有限公司), 肌酸(北京索莱宝科技有限公司), 氢氧化钠(上海国药集团化学试剂有限公司), 葡萄糖(上海国药集团化学试剂有限公司), 胰蛋白胨(OXOID), 牛肉膏(上海麦克林生化科技有限公司)等。(3)培养基: 耐糖微生物筛选培养基: 胰蛋白胨10 g/L, 牛肉膏5 g/L, NaCl 5 g/L, 葡萄糖400 g/L, 琼脂1.5%, pH 7.0, 115℃高压蒸汽灭菌30 min。葡萄糖耐受性验证培养基: 胰蛋白胨10 g/L, 牛肉膏5 g/L, NaCl 5 g/L, 葡萄糖设置为100、200、300、400、500 g/L不同浓度, pH 7.0, 115℃高压蒸汽灭菌30 min。LB固体培养基: 胰蛋白胨10 g/L, 酵母提取物5 g/L, NaCl 10 g/L, 琼脂15 g/L。LB液体培养基: 胰蛋白胨10 g/L, 酵母提取物5 g/L, NaCl 10 g/L。
1.2 方法 1.2.1 微生物筛选称取烟田土壤1.0 g, 利用5.0 mL无菌水溶解至50 mL无菌离心管中, 室温放置24 h, 取1.0 mL上清液置于另一含有9.0 mL无菌水的试管中, 混合均匀。利用无菌水进行梯度稀释[13]分别得到100、10-1、10-2、10-3和10-4不同稀释度的土壤稀释液。取不同稀释度的土壤菌液涂布到耐糖微生物筛选培养基中, 37℃培养箱中倒置培养12-16 h, 平板划线法纯化筛选到的微生物。
对于耐糖培养基中筛选得到的微生物利用乙偶姻显色液进行筛选, 将显色液(10% NaOH、5% 1-萘酚、0.5%肌酸的溶液按照1: 1: 1的比例混合)混合熔化的LB固体培养基, 倒入长有目标菌落且含有高浓度葡萄糖的平板上, 静置30 min后观察颜色变化[14], 选择能使显色液呈现粉色的菌株进行保藏鉴定以及发酵产物鉴定。
1.2.2 筛选微生物的葡萄糖耐受性验证挑取单菌落, 接种至LB液体培养基中, 37℃, 150 r/min活化过夜培养, 获得种子液。将种子液按照5%的接种量接种至含有50 mL培养基的250 mL摇瓶中, 培养基中葡萄糖浓度设置为100、200、300、400和500 g/L, 每个葡萄糖浓度设置3个重复, 37℃培养36 h, 利用分光光度法测定菌株的OD(Optical delnsity)值。
1.2.3 筛选微生物鉴定及进化树构建16S rDNA分子鉴定: 利用16S rDNA通用引物: 27F(5' -3'): AGAGTTTGATCCTGGCTCAG; 1492R(5' -3'): ACGGCTACCTTGTTACGACTT。PCR反应体系(表 1)。PCR程序为: 95℃预变性, 3 min; 95℃变性, 30 s, 56℃退火, 30 s, 72℃延伸, 90 s, 30个循环; 72℃后延伸5 min; 4℃, ∞。
PCR产物利用1%琼脂糖电泳检测, 片段大小符合理论大小(1 500 bp)的PCR产物送至华大基因公司(http://www.genomics.cn/index)测序, 测序结果通过BLAST(https: //blast.ncbi.nlm.nih.gov/BLAST.cgi)比对获得鉴定结果, 并利用MEGA7.0(Kumar, Stecher, Tamura 2015), 选择neighbor-joining方法构建进化树, Bootstrap为1 000。
1.2.4 筛选微生物发酵产物检测将发酵结束的发酵液以10 000 r/ min离心3-5 min, 获得发酵液上清, 过0.22 μm水相滤膜, 送气相-质谱(GC-MS)检测进行定性鉴定。气质检测条件: DB-5非极性柱, 检测温度270℃, 气化温度250℃, 柱室初始温度为50℃, 保留2 min, 20℃/min升温到120℃, 再以30℃/min升温到240℃, 保持5 min, 降温到50℃, 完成检测, 检测结果与谱库检索比对。
1.2.5 筛选微生物发酵产物产量测定乙偶姻含量测定所需试剂: 精确称取乙偶姻(88.11 g/mol)标准品0.017 62 g溶于100 mL水制成2 mmol/L的乙偶姻溶液。0.5%肌酸, 4℃保存; 5% 1-萘酚, 4℃保存; 40% KOH, 4℃保存。利用显色法[14]测定。
标准曲线的制备: 将2 mmol/L的乙偶姻溶液梯度稀释成0.25 mmol/L、0.2 mmol/L、0.15 mmol/L、0.1 mmol/L、0.05 mmol/L, 以蒸馏水为对照, 分别取上述溶液200 μL于1.5 mL离心管, 依次加入140 μL肌酸溶液, 200 μL 1-萘酚, 200 μL KOH溶液。每加入一种试剂均需涡旋震荡均匀。所有试剂加完后室温下温育15 min, 测样前再次涡旋震荡, 用分光光度计在560 nm波长下测吸光度值, 得到乙偶姻溶液吸光度变化与浓度间的标准曲线。
乙偶姻样品浓度测定: 取试样200 μL于1.5 mL离心管, 按照上述显色步骤进行显色, 560 nm波长下测吸光度值, 严格控制显色时间。
1.2.6 乙偶姻的发酵挑取单菌落, 接种至LB液体培养基中, 37℃, 150 r/min活化过夜培养, 获得种子液。将种子液按照5%的接种量接种至含有50 mL培养基的250 mL摇瓶中, 初始发酵培养基中葡萄糖浓度为100 g/L, 测定微生物生长量、培养基中的残糖量以及乙偶姻产量。发酵期间根据残糖量结果适当补糖, 使培养基中葡萄糖浓度维持在100 g/L, 发酵至40 h时培养基中葡萄糖浓度一次性补到200 g/L, 直至发酵结束后不再补糖。
2 结果 2.1 微生物筛选在耐糖培养基上不同稀释度的土壤稀释液100、10-1、10-2、10-3和10-4微生物的生长情况也不同。其中, 100和10-1平板的微生物种类及数量较多, 不易挑出单菌落。10-4平板上没有长出微生物单菌落。从稀释度为10-2和10-3的平板上成功筛选到4株单菌落微生物, 再将筛选的微生物利用乙偶姻显色液进行筛选, 得一株产乙偶姻的菌株。
2.2 微生物鉴定结果筛选出的菌体在显微镜下呈现球形或稍椭圆形, 排列成葡萄状, 无鞭毛, 无芽孢。在LB固体培养基表面, 菌体形成不透明的浅黄色小菌落, 菌落干, 边缘整齐。将测序公司的测序结果提交至NCBI(https: //blast.ncbi.nlm.nih.gov/Blast.cgi)数据库进行序列比对, 得到该菌株与金黄色葡萄球菌(Staphylococcus aureus), 相似度99.04%, 命名为PX03。菌种保藏编号为: CGMCC No.10671。对该菌株进行全基因组测序, 序列提交至NCBI(https: //www.ncbi.nlm.nih.gov/)数据库, 序列号为NO. LFOJ00000000(https: //www.ncbi.nlm.nih.gov/nuccore/LFOJ00000000)。利用MEGA7.0构建进化树(图 1), 结果显示, PX03菌株与Staphylococcus aureus strain亲缘关系更近。

|
| 图 1 PX 03进化树构建结果 |
由(图 2)结果可知, 不同浓度的葡萄糖对菌株的生长有较显著的影响, 其中在300 g/L的葡萄糖浓度中菌株生长最好, OD600达到了100, 在500 g/L的葡萄糖浓度中也可以生长。由此可见, 菌株PX03可耐受较高浓度葡萄糖。
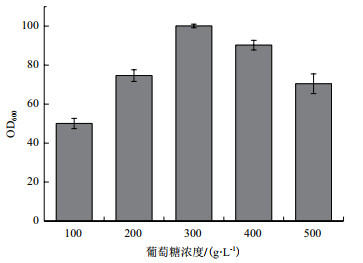
|
| 图 2 PX03菌株对高浓度葡萄糖耐受性结果 |
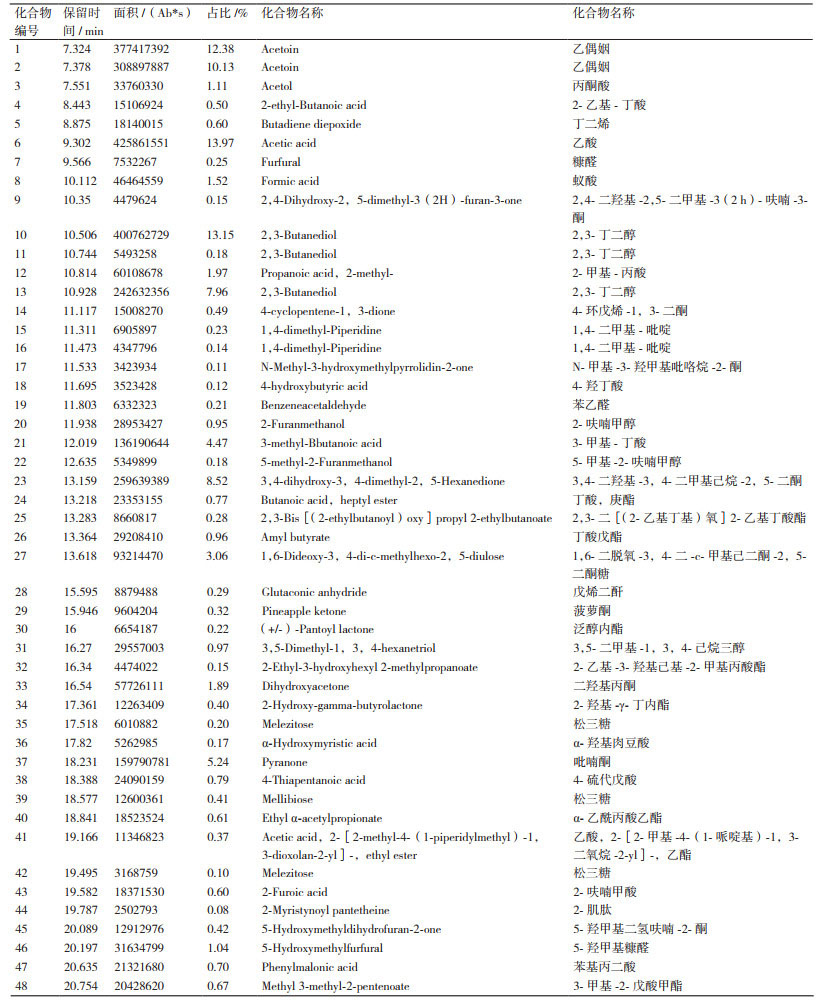
对该菌株发酵产物做GC-MS定性分析结果(图 3, 表 2)显示, 发现可产较丰富的香气物质, 其中主要产物为乙偶姻(22.51%)和2, 3-丁二醇(21.29%)大量的香气成分, 还同时产乙酸(13.97%)、3, 4-二羟基-3, 4-二甲基己烷-2, 5-二酮(8.52%)、吡喃酮(5.24%)、3-甲基-丁酸(4.47%)、2-乙基-丁酸(0.5%)、糠醛(0.25%)、2, 4-二羟基-2, 5-二甲基-3(2 h)-呋喃-3-酮(0.14%)和菠萝酮(0.32%)等少量的香气成分。

|
| 图 3 发酵产物GC-MS定性检测结果 |
绘制乙偶姻标准曲线为: Y=659.907 04×X-0.849 36, R2=0.998.
为了进一步探究菌株PX03的生长和产乙偶姻的情况, 对其进行了摇瓶发酵。发酵结果(图 4)显示, OD600值和乙偶姻产量随着时间的推移是向上升高的趋势, 但是在发酵期间出现了几个下降的点, OD600值分别是在16 h、36 h和44 h时出现了下降, 乙偶姻产量在20 h和44 h时出现了下降。最终, 在发酵72 h后, 菌株OD600值最高可达到66, 乙偶姻产量达到41 g/L。该野生菌株是目前已报道较高产量的乙偶姻发酵菌株。初步发酵结果证明该菌株具有较好的乙偶姻生产潜力。

|
| 图 4 PX03菌株生长及发酵产乙偶姻产量 |
随着人们生活水平的不断提高, 乙偶姻的用量在食品、医药以及烟草工业中不断增长, 微生物发酵生产方法有诸多优点而引起人们的广泛关注。自然界中能以糖质原料天然合成乙偶姻的微生物主要有肠杆菌属、沙雷氏菌属、克雷伯氏菌属、乳球菌属和芽孢杆菌属等[15]。Roncal等[5]利用一株乳球菌亚种突变株CML B4进行乙偶姻发酵, 乙偶姻产量可达到40 g/L, 分批发酵可达59 g/L。Li等[16]将野生型地衣芽孢杆菌WX-02经代谢工程及发酵控制优化, 分批发酵96 h乙偶姻产量达78.79 g/L。Zhang等[17]将阴沟肠杆菌经乙偶姻还原酶和副产物途径失活, 辅助因子工程等策略, 乙偶姻发酵产量达到55.22 g/L。本研究对金黄色葡萄球菌PX03进行摇瓶发酵实验, 在发酵期间由于菌株自身的生长周期的特点以及前期根据残糖量适当补糖至100 g/L, 在发酵到40 h时培养基中葡萄糖浓度一次性补到200 g/L导致OD600出现了多个拐点。由于菌株的浓度和生长活力对产物的产量有较大的影响, 所以随着OD600的变化乙偶姻的产量也出现了变化; 另一方面, 在乙偶姻生物合成中, 乙偶姻可被乙偶姻还原酶/2, 3-丁二醇脱羧酶(AR/BDH)还原为2, 3-丁二醇, 在一定条件下2, 3-丁二醇也会被逆向转化为乙偶姻[18]。通过基因工程平衡两种产物的研究也逐渐深入, 该菌株的获得为乙偶姻的分子操作进一步奠定了基因基础。最终, 初步发酵72 h后菌株OD600值最高可达到66, 乙偶姻产量可达41 g/L, 为高产乙偶姻提供了新菌株, 对乙偶姻的发酵生产具有重要意义。但是乙偶姻发酵产量还有待进一步提高。发酵培养基成分及发酵参数对微生物发酵结果至关重要, Xiao等[19]对产乙偶姻发酵培养基进行了优化, 摇瓶水平上产物产量达37.90 g/L。后期实验中, 对该菌株进行高糖发酵条件优化对提升乙偶姻产量具有重要意义。
葡萄糖是常见的微生物发酵底物, 一般微生物发酵时底物浓度过高会使微生物生长受到限制, 因而高渗微生物在发酵工业中应用前景广泛。李梦琦等[20]筛选得到一株能在550 g/L葡萄糖培养基上生长的耐高糖且产香的鲁氏酵母菌株。目前对高渗微生物的研究主要集中在酵母高糖耐受机制研究中[21-22], 由于酵母菌安全性高且富含多种营养物质而被广泛应用, 但是酵母菌生长缓慢, 发酵周期长。而原核生物有容易培养, 易于改造, 发酵周期短等优势。本研究通过分子鉴定, 确定PX03菌株为金黄色葡萄球菌, 是条件致病菌[23]。PX03菌株在发酵产乙偶姻和高糖耐受性方面具有较明显优势。实验结果证明PX03在500 g/L的葡萄糖浓度中依然能生长, 最适葡萄糖浓度为300 g/L, 能耐受较高葡萄糖浓度。该菌株为进一步提高乙偶姻产量的高糖底物发酵及发酵时的耐糖机制研究奠定菌株基础。菌株测序后, 结合分子生物学的发展, 利用基因操作实现乙偶姻合成代谢途径构建及增强等研究逐渐增多[24-27]。
此外, 基于前期本研究组关于雪茄烟叶发酵中微生物群落演替研究及分离鉴定结果, 葡萄球菌属在雪茄烟叶发酵微生物群落中占有较大比重[28-29], 结合国内关于熏肉及火腿等食品研究发现, 葡萄球菌属在食品的增香提质中起着重要作用[30-31]。另外, 结合本研究中对菌株发酵产物的GC-MS检测结果, 该菌株发酵产物中香气成分丰富, 有望在雪茄烟叶发酵提质增香中发挥作用。
4 结论本研究从烟田土壤中筛选得到菌株PX03, 经过分子鉴定为金黄色葡萄球菌(Staphylococcus aureus), 相似度为99.04%。该菌株对高浓度葡萄糖有较好耐受性, 在300 g/L葡萄糖浓度下生长最好, 在500 g/L的葡萄糖浓度中依然能生长。此外, 对该菌株的发酵产物用GC-MS鉴定出丰富的香气成分, 其中主要香气成分是乙偶姻和2, 3-丁二醇, 最后对该菌株进行初步摇瓶发酵, 乙偶姻产量可达到41 g/L。
| [1] |
徐慧. 生物法生产3-羟基丁酮概述[J]. 山东食品发酵, 2014(1): 37-45. Xu H. Present research situation of acetoin production by biological method[J]. Shandong Food Ferment, 2014(1): 37-45. |
| [2] |
陈洪. 香物质的生物法制备[M]. 北京: 中国轻工业出版社, 2008. Chen H. The overview of the production of 3-hydroxybutanone by biological method[M]. Beijing: China Light Industry Press, 2008. |
| [3] |
韩丽, 赵祥颖, 刘建军, 等. 乙偶姻的性质、生产及应用[J]. 齐鲁工业大学学报, 2007, 2(4): 80-83. Han L, Zhao XY, Liu JJ, et al. The property, production and application of acetoin[J]. Journal of Shandong Institute of Light Industry, 2007, 2(4): 80-83. |
| [4] |
胡明一, 王中. 食用香料乙偶姻[J]. 精细与专用化学品, 2002(1): 22-23. Hu MY, Wang Z. Flavor acetoin[J]. Fine and Specialty Chemicals, 2002(1): 22-23. DOI:10.3969/j.issn.1008-1100.2002.01.009 |
| [5] |
Roncal T, Caballero S, Díaz de Guere?u M, et al. Efficient production of acetoin by fermentation using the newly isolated mutant strain Lactococcus lactis subsp. lactis CML B4[J]. Process Biochemistry, 2017(58): 35-41. |
| [6] |
常爱霞, 贾兴华, 郝廷亮, 等. 特香型烤烟挥发性致香物质的测定与分析[J]. 中国烟草科学, 2002(1): 1-5. Chang AX, Jia XH, Hao TL, et al. Identification and analysis of volatile aroma and flavor constituents of flue-cured tobacco with special flavoring aroma[J]. Chinese Tobacco Science, 2002(1): 1-5. DOI:10.3969/j.issn.1007-5119.2002.01.011 |
| [7] |
范宜晓, 赵祥颖, 张家祥, 等. 产3-羟基丁酮菌株的筛选及产物分析[J]. 食品与发酵工业, 2012(11): 47-51. Fan YX, Zhao XY, Zhang JX, et al. The screening of acetoin-producing strain and identification of metabolite[J]. Food and Fermentation Industries, 2012(11): 47-51. |
| [8] |
吕春微, 徐晴, 陈姣, 等. 耐高糖米根霉菌株的生理特性[J]. 生物加工过程, 2015, 54(3): 36-40. Lv CW, Xu Q, Chen J, et al. Physiological characteristics of a high-glucose resistant Rhizopus oryzae[J]. Chinese Journal of Bioprocess Engineering, 2015, 54(3): 36-40. DOI:10.3969/j.issn.1672-3678.2015.03.007 |
| [9] |
Shimizu H, Araki K, Shioya S, et al. Optimal production of glutathione by controlling the specific growth rate of yeast in fed-batch culture[J]. IFAC Proceedings Volumes, 1991, 24(12): 67-72. DOI:10.1016/B978-0-08-036929-7.50017-6 |
| [10] |
Afschar AS, Bellgardt KH, Rossell CEV, et al. The production of 2, 3-butanediol by fermentation of high test molasses[J]. Applied Microbiology & Biotechnology, 1991, 34(5): 582-585. |
| [11] |
陈英. 耐高糖酿酒酵母菌株的筛选及性状诱发基因的功能研究[D]. 南宁: 广西大学, 2018. Chen Y. Sceening of Saccaromyces cerevsiae strain with high glucose tolerance and study on the fuction of charater diven gene[D]. Nanning: Guangxi University, 2018. |
| [12] |
曹艳, 丁健, 段作营, 等. 在线推定和控制葡萄糖浓度改善谷氨酸发酵性能[J]. 微生物学通报, 2009, 36(10): 173-178. Cao Y, Ding J, Duan ZY, et al. On-line glucose concentration prediction and control for improving glutamate fermentation performance[J]. Microbiology China, 2009, 36(10): 173-178. |
| [13] |
张敬敬, 刘晓颖, 钱开诚. 微生物富集方法及其应用的研究进展[J]. 微生物与感染, 2010, 5(3): 176-180. Zhang JJ, Liu XY, Qian KC, et al. Research on microbial enrichment methods and applications[J]. Journal of Microbes and Infections, 2010, 5(3): 176-180. DOI:10.3969/j.issn.1673-6184.2010.03.011 |
| [14] |
张显. 高产乙偶姻枯草芽孢杆菌的代谢工程改造[D]. 无锡: 江南大学, 2013. Zhang X. Metabolic engineering and modification of acetoin high producing Bacillus subtilis[D]. Wuxi: Jiangnan University, 2013. |
| [15] |
李树波, 高翔, 刘立明, 等. 微生物生产3-羟基丁酮研究进展[J]. 生物加工过程, 2011(6): 63-68. Li SB, Gao X, Liu LM, et al. Progress in microbial production of 3-hydroxybutanone[J]. Chinese Journal of Bioprocess Engineering, 2011(6): 63-68. DOI:10.3969/j.issn.1672-3678.2011.06.014 |
| [16] |
Li L, Wei X, Yu W, et al. Enhancement of acetoin production from Bacillus licheniformis by 2, 3-butanediol conversion strategy: Metabolic engineering and fermentation control[J]. Process Biochemistry, 2017, 57(1): 35-42. |
| [17] |
Zhang L, Liu Q, Ge Y, et al. Biotechnological production of acetoin, a bio-based platform chemical, from a lignocellulosic resource by metabolically engineered Enterobacter cloacae[J]. Green Chemistry, 2016, 18(6): 1560-1570. DOI:10.1039/C5GC01638J |
| [18] |
Nielsen DR, Yoon SH, Yuan CJ, et al. Metabolic engineering acetoin and meso-2, 3-butanediol biosynthesis in E. coli[J]. Biotechnol J, 2010, 5(3): 274-284. DOI:10.1002/biot.200900279 |
| [19] |
Xiao ZJ, Liu PH, Qin JY, et al. Statistical optimization of medium components for enhanced acetoin production from molasses and soybean meal hydrolysate[J]. Applied Microbiology & Biotechnology, 2007, 74(1): 61-68. |
| [20] |
李梦琦, 赵一凡, 郑飞云, 等. 耐高糖产香酵母菌的分离鉴定及其应用[J]. 食品发酵与工业, 2019, 24(45): 45-51. Li MQ, Zhao YF, Zheng FY, et al. Isolation, identification and application of sugar-tolerant and aroma-producing yeast[J]. Food and Fermentation Industries, 2019, 24(45): 100-101. |
| [21] |
徐晓丹, 潘宇, 柯尊丽, 等. 高糖胁迫下槲皮素对酿酒酵母胞内损伤的保护作用与机制[J]. 食品科学, 2016, 38(12): 70-75. Xu XD, Pan Y, Ke ZL, et al. Protective effect and mechanism of quercetin against high glucose -induced intracellular damage in Saccharomyces cerevisiae[J]. Food Science, 2016, 38(12): 70-75. |
| [22] |
王昌魁, 张利莉, 贺江舟, 等. 耐高温耐高糖酵母的筛选与驯化[J]. 江西农业学报, 2008, 20(5): 100-101. Wang CK, Zhang LL, He JZ, et al. Domestication and screening of thermotolerant and high-sugar-tolerant yeast[J]. Acta Agriculture Jiangxi, 2008, 20(5): 100-101. DOI:10.3969/j.issn.1001-8581.2008.05.036 |
| [23] |
王璇, 王娉, 葛毅强, 等. 食品中金黄色葡萄球菌致病性研究进展[J]. 中国人兽共患病学报, 2017, 33(6): 553-558. Wang X, Wang P, Ge YQ, et al. Review on pathogenicity of Staphylococcus aureus in food[J]. Chinese Journal of Zoonoses, 2017, 33(6): 553-558. DOI:10.3969/j.issn.1002-2694.2017.06.016 |
| [24] |
Mohd Yusoff MZ, Akita H, Hassan MA, et al. Production of acetoin from hydrothermally pretreated oil mesocarp fiber using metabolically engineered Escherichia coli in a bioreactor system[J]. Bioresource Technology, 2017(245): 1010-1048. |
| [25] |
Li L, Wei X, Yu W, et al. Enhancement of acetoin production from Bacillus licheniformis by 2, 3-butanediol conversion strategy: Metabolic engineering and fermentation control[J]. Process Biochemistry, 2017, 57(1): 35-42. |
| [26] |
Jang JW, Jung HM, Im DK, et al. Pathway engineering of Enterobacter aerogenes to improve acetoin production by reducing by-products formation[J]. Enzyme & Microbial Technology, 2017(106): 114-118. |
| [27] |
Xiao Z, Lu JR. Strategies for enhancing fermentative production of acetoin: A review[J]. Biotechnology Advances, 2014, 32(2): 492-503. DOI:10.1016/j.biotechadv.2014.01.002 |
| [28] |
张鸽, 梁开朝, 辛玉华, 等. 四个国家雪茄外包皮烟叶表面细菌分离与活性测定[J]. 中国烟草科学, 2018(2): 82-88. Zhang G, Liang KC, Xin YH, et al. Isolation and activity determination of surface bacteria in cigar wrapper leaves from four different countries[J]. Chinese Tobacco Science, 2018(2): 82-88. |
| [29] |
张鸽, 梁开朝, 辛玉华, 等. 基于高通量测序和传统分离研究雪茄外包皮表面细菌多样性及演替[J]. 应用与环境生物学报, 2018, 24(4): 783-788. Zhang G, Liang KC, Xin YH, et al. Diversity and succession of bacteria during the fermentation of a cigar wrapper using high throughput sequencing technology and traditional isolation[J]. Chinese Journal of Applied & Environmental Biology, 2018, 24(4): 783-788. |
| [30] |
王海燕, 马长伟, 李平兰. 传统湖南腊肉中产香葡萄球菌的筛选及鉴定[J]. 食品与发酵工业, 2006, 32(5): 45-49. Wang HY, Ma CW, Li PL, et al. Selection and identification of aroma producing staphylococci from human traditional bacon[J]. Food and Fermentation Industries, 2006, 32(5): 45-49. DOI:10.3321/j.issn:0253-990X.2006.05.012 |
| [31] |
杨勇, 张雪梅, 程艳, 等. 四川香肠中产香葡萄球菌的分离与鉴定[J]. 食品与发酵工业, 2011, 37(6): 29-34. Yang Y, Zhang XM, Cheng Y, et al. Isolation and identification of aroma producing Staphylococci from Sichuan sausage[J]. Food and Fermentation Industries, 2011, 37(6): 29-34. |