2. 锦州医科大学,锦州 121001
2. Jinzhou Medical University, Jinzhou 121001
适配体(Aptamer)是通过指数富集的配体进化系统(Systematic evolution of ligands by exponentialenrichment,SELEX)获得的单链DNA,具有稳定的二级结构[1],典型的结构包括茎、凸环、发夹、假结体,三重体和G-四链体结构等[2]。适配体通过构象变化折叠成三维结构,与目标物通过形状互补、芳香化合物间的堆积作用、碱基堆积作用、静电作用和氢键作用等方式稳定结合[3]。迄今为止,已发现近300个目标的适配体,包括离子(如Hg2+[4])、真菌毒素[5]和分子[6]等。目前快速检测常用的是抗体,由于在生产和纯化过程中需严格控制,并且受操作环境、pH、温度等条件的限制[7-8],使得其对有着相似结构的小分子快速准确识别也存在局限性。相比之下的适配体易于修饰和标记,灵敏度高,特异性好,成本低,亲和力强,在环境监测、医学诊断和食品安全等领域中受到了越来越多的关注。
真菌毒素污染是农产品、中药、食物和饲料中普遍存在的问题[9],毒素通过抑制蛋白质合成、破坏巨噬细胞系统和削弱免疫功能,对人体健康造成危害。例如,黄曲霉毒素B1[5](Aflatoxin,AFB1)是目前人类发现的真菌中毒性最强的毒素,是由黄曲霉和寄生曲霉等产生的次级代谢产物,易对多种农产品,如坚果、花生、玉米、谷物和动物饲料造成污染,被国际癌症研究机构列为一类致癌物[7]。赭曲霉毒素A[1](Ochratoxin A,OTA)是植物源性食品中广泛存在的一种由曲霉和青霉菌产生的真菌毒素。在食品、谷物和葡萄酒中有很高的化学稳定性和热稳定性,对人体有害,易造成肾毒性、肝毒性以及淋巴和胃肠道损伤。近年来,真菌毒素的快速分析与鉴定、多类真菌毒素的同时检测已成为研究人员的研究热点[1, 5, 9-11]。毒素的定量分析目前已经建立的方法包括:薄层色谱[12](Thinlayerchromatography,TLC)、高效液相色谱[11, 13-14](Highperformance liquid chromatography,HPLC)、紫外可见[15](Ultraviolet-visible,UV)、液相色谱-串联质谱法[16](Liquid chromatography-tandem mass spectrometry,LC-MS/MS)、荧光检测器法[17-18](Fluorescencedetector,FLD)等实验室内检测目标物的确证方法。这些分析检测方法需要复杂的样品制备过程、大型仪器的配备和专业的研究人员,因此,不能在现场进行快速检测。开发用于现场检测样品中目标物的含量的便携式、灵敏度高、操作简单的快速检测技术迫在眉睫。表 1总结了适配体侧流层析技术在真菌毒素方面的应用。
侧流层析分析技术响应时间快速、简单性且低成本使其成为现场检测(Point-of-care testing,POCT)的理想选择,已被应用于多种靶标的快速检测,最常见和最成功的侧流层析分析技术的产品是检测尿液中是否存在人绒毛膜促性腺激素的胶体金侧向层析分析技术[28]。核酸适配体侧流层析分析技术具有良好的鲁棒性、特异性、灵敏度,能够实现低成本的快速检测。该技术以硝酸纤维素膜为载体,样品溶液滴加在样品垫上,在毛细管作用下慢慢向吸水垫端渗移,通过适配体与靶标结合,并利用荧光、量子点等标记物质呈现光学反应,可在T线和C线检测到信号值。目前最广泛应用的侧流层析技术主要是基于抗体,但是,抗体的使用也会遇到一些问题,如抗体的生产周期很长,并且稳定性较差,存在交叉反应。适配体比抗体小很多,可以在相同的纳米金粒子或硝化纤维素膜表面被更好地固定。作为一种新型识别分子,核酸适配体为食品安全快速检测技术的开发提供了新思路。以下综述了荧光素、量子点、荧光微球、胶体金和酶等不同信号标记适配体,通过光学、比色、表面增强拉曼散射和基于智能手机等不同的检测方法在侧流层析分析技术中的应用。
1 适配体侧流层析分析技术的不同类型:侧流层析技术既可以用肉眼进行定性检测目标物,也可以用简易的阅读器进行定量检测目标物。根据试纸条的原理不同可以分为夹心型、竞争型两种类型。
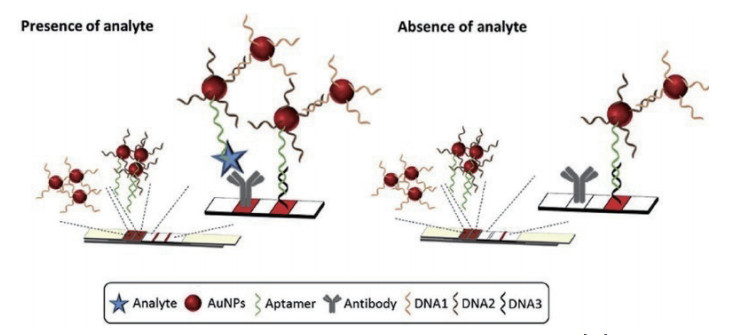
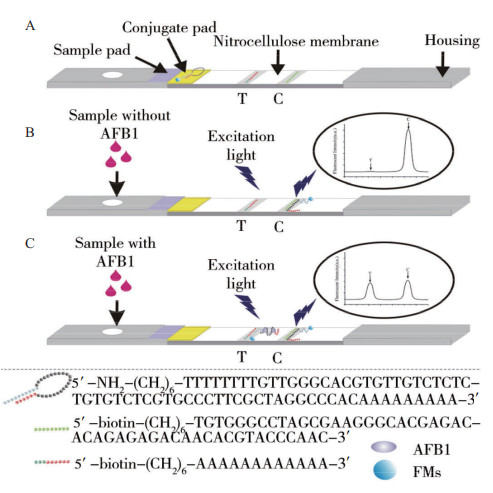
1.1 夹心型采用夹心型测定时,以标记信号物的适配体为信号探针,靶标的另一条适配体或抗体固定在硝酸纤维素膜上为捕获探针,要求信号探针和捕获探针分别以不同的结合位点与靶标结合,在目标物存在的情况下与两个DNA探针形成夹心结构的稳定复合物,随着靶标浓度的增加,检测线(T线)的信号强度不断增强(图 1)。过量的信号探针继续渗移到质控线(C线)并与其互补链结合。目前,采用夹心法的适配体种类很少,如腺苷[22]和OTA[13]等少量的靶标分子有过相关报道。Zhu等[29]利用待检测靶标的两条识别不同表面结合位点的适配体,建立了双适配体夹心型侧流层析分析技术,实现了对腺苷的有效检测。
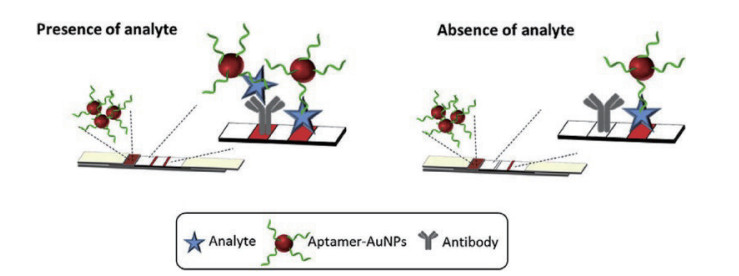
1.2 竞争型采用竞争型测定时,以标记信号物的适配体为信号探针,在T线处固定的捕获探针为适配体的互补链或靶标的半抗原(如AFB1-BSA[31]),靶标与适配体互补链同时竞争适配体,T线处的信号强度与靶标含量成负相关性(图 2)。目前,研究者倾向于采用竞争型侧流层析技术的应用,因为其只需一条合适的适配体就可进行实验研究,降低了实验的难度。2016年,Zhou等[32]成功研发了一种基于竞争法在现场快速检测中药黄芪中OTA的适配体侧流层析技术,通过优化胶体金-适配体结合物浓度的稀释倍数,缓冲液成分和比例,甲醇的浓度等条件,提高试纸条的灵敏度。该胶体金适配体侧流层析检测OTA的检测时间为15 min,检测限为1 μg/L,表明该方法具有较高的选择性和灵敏度,结果准确可靠,可作为一种快速、经济、鲁棒的复杂基质中微量毒素的现场检测技术。
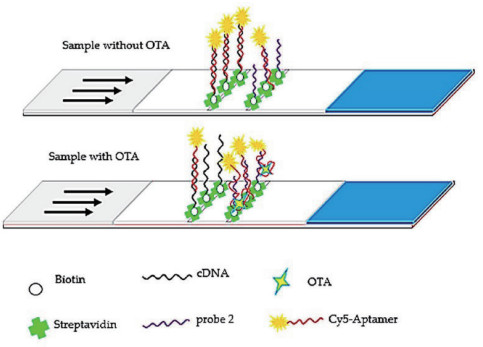
2 基于不同检测方法的侧流层析分析技术 2.1 光学检测的侧流层析生物传感器 2.1.1 荧光侧流层析分析技术基于荧光的适配体侧流层析分析技术具有选择性好、灵敏度高、操作方便、快速等优点。荧光染料存在一些固有的问题,如使用寿命短、稳定性差等,限制了荧光染料在现场分析中的应用。有关标记荧光的适配体侧流层析分析技术检测AFB1的报道中[31],靶标与检测线上的适配体互补链形成竞争关系,当存在AFB1时,适配体先与AFB1结合形成复合物,T线的信号强度与靶标含量呈负相关性,多余的游离Cy5修饰的DNA探针渗流到C线上,被捕获探针捕获,并观察荧光信号;在没有靶标的情况下,Cy5-DNA与检测线上的DNA互补链杂交。Zhang等[33]选择稳定性好、荧光强度高和发射波长范围广的荧光素Cy5作为信号标记物,建立了基于荧光测流层析技术检测玉米中OTA的方法(图 3)。该方法定量检测OTA的线性范围是1 ng/mL-1 000 ng/mL,检测限为0.4 ng/mL,在玉米样品中的加标回收率为96.4%-104.7%,相对标准偏差为4.8%-6.4%,说明该方法具有较好的灵敏度、准确度和稳定性,为谷物中OTA的检测提供了新型快速的检测技术手段。
2.1.2 分子发夹/荧光微球的侧流层析分析技术基于侧流层析分析技术的分子发夹/荧光微球定量检测,结合垫上包被荧光微球标记的DNA分子发夹探针的“环”,检测线处包被一段与DNA分子发夹茎的序列互补的一段碱基序列。一条含AFB1适配体的分子发夹与荧光微球偶联后,形成的标记探针被喷涂在侧流层析的结合垫上[34]。如图 4所示,当待测样本中含有AFB1时,AFB1先与结合垫处标记探针中的AFB1适配体结合,同时,标记探针中的DNA分子发夹“茎”的双链被打开,AFB1与标记探针形成的复合物渗移到检测线时,被检测线上的核苷酸序列捕获,出现亮线反应。周子明等[34]利用该原理,通过“OFF-ON”的光信号,构建了一种AFB1检测的测流层析技术,实现了对AFB1呈良好的线性关系,检测限(S/N=3)达0.05 μg/L,可实现对实际样品中AFB1的含量分析,具有较为重要的实际应用和参考价值。肖理文[35]等研制了一种基于时间分辨荧光纳米微球的玉米赤霉烯酮快速定量检测的侧流层析技术,并在粮食样品中对其检测性能进行了研究。该产品的最低检出限为3.65μg/kg,且该方法具有简便快速、准确可靠、重复性好等特点,可用于不同粮食谷物饲料中玉米赤霉烯酮的快速定量检测分析。荧光微球具有高信号值,线性范围好,批间重复性好,适合待测物的快速定量检测。
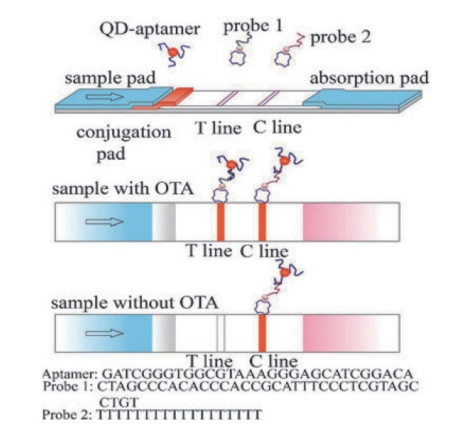
2.1.3 量子点侧向流动层析技术近年来,量子点[36](Quantum dot,QDs)作为荧光标记有半峰宽窄、荧光寿命长、最大发射峰可调控等优点。常见的高效荧光染料供体量子点有CdTe和CdSe/ZnS[37-38]。Richarte等[39]采用CdSe/ZnS/QDs作为标记信号,研发了一种在谷物中同时检测DON、ZEN和T2三种毒素的侧流层析技术,该检测方法具有灵敏度高,经济高效,快速等优点。Wang等[40]设计了一种快速检测OTA的侧流层析分析技术,采用OTA与固定在检测线上的DNA探针(DNA1)同时竞争QDs标记的适配体。在没有OTA的情况下,QDs标记的适配体与DNA1,多余游离的标记适配体与质控线上固定的poly T探针(DNA2)结合;相反,OTA存在时,检测线的信号值将会减弱,质控线的信号值将会增强,LOD达到4.7 nmol/L;与荧光偏振免疫测定方法相一致,但更加节省时间(图 5)。
2.2 比色法检测的侧流层析生物传感器在侧流层析技术中,胶体金侧流层析技术是最为常用的,不需要任何仪器便能实现快速现场检测的技术。胶体金属于惰性金属[41-42],具有稳定好,生物相容性好、低成本等优点。纳米金粒子呈红色,因此肉眼可见成为快速检测的趋势,更加快了胶体金在检测领域的研究[43]。经巯基修饰的适配体与胶体金通过Au-S键形成稳定的复合结构,T线上是一段用生物素修饰的与靶标适配体互补的核酸片段,C线上则是一段用生物素修饰的胸腺嘧啶或腺嘌呤的核酸片段,能与靶标适配体结合。当溶液中无靶标时,迁移到T线时将与适配体互补链产生显色反应,多余的适配体溶液向前迁移与C线核酸片段反应显红色;当溶液中含有靶标时,迁移到T线,反应减少或无反应,显淡红色或不显色,多余的游离适配体与C线核酸片段结合显红色[44]。Wu等[45]提出了一种基于适配体识别ZEN胶体金侧流层析技术。将巯基化的ZEN适配体与胶体金偶联,作为侧流层析的信号探针,硝酸纤维素膜表面的检测线固定适配体的识别序列的互补链,质控线固定适配体的非识别序列的互补链(图 6)。在5-200 ng/mL的检测范围内线性良好,可视化检测限为20 ng/mL。但该检测方法也存在些问题,首先,样本基质效应,即实际样本中总是含有其他杂质分子,在检测过程中可能会产生非特异性信号。第二,纳米金的重现性,复杂的纳米结构,形状和孔隙度很难精准制备。第三,现有免疫检测试纸只能用于定性或半定量检测。

|
| 图 6 基于适配体的侧流层析技术结构与原理示意图 |
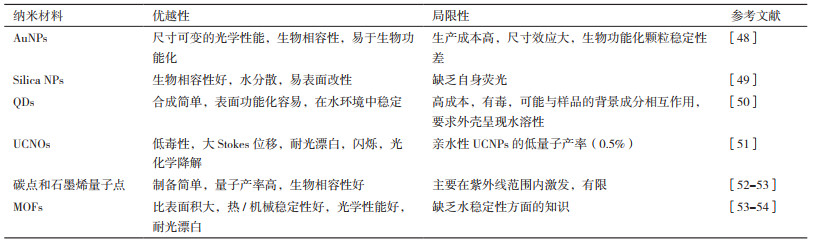
纳米材料有很多种,如AuNPs、CBNs、MNPs、QDs和UCNPs等(表 2)。一种以银核和金壳(AgAu)为标记物的侧流层析分析技术用于食品中AFB1灵敏、快速的检测[46],与金纳米颗粒相比,Ag-Au纳米颗粒增强了测定的灵敏度,重现性和稳定性。随着AFB1浓度的增加,检测线上纳米复合材料的颜色强度增加,AFB1的检测限为0.1 ng/mL。Kolosova等[47]报道了一种胶体金侧流层析分析技术,用于同时检测玉米赤霉烯酮(Zearalenone,ZEN)和脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)。目前,比色法侧流层析技术的优点是灵敏、简单、快速,无需多次标记和分离步骤,但该技术尚未成熟,报道的文章也不多,在食品安全、药物研发和医学诊断等领域的现场快速分析检测方面有着极大的发展空间。
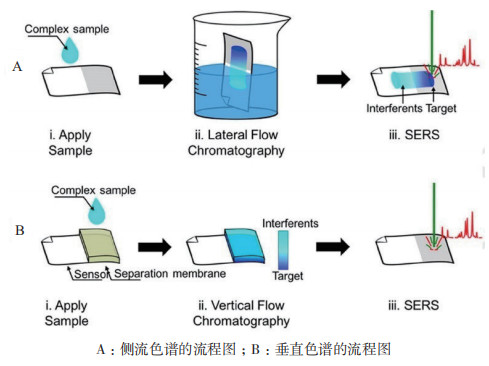
表面增强拉曼散射是一种增强拉曼散射强度的技术,具有灵敏度高、可提供指纹图谱等优点[55],金属纳米材料可以大幅度提高拉曼散射强度,因此基于拉曼散射的NPs技术一直是研究的热点[56],激发光和散射拉曼信号可以被调整到近红外区域[57],该技术能够在实验室中进行高灵敏的定量分析。SERS应用于侧流层析技术的检测方法是基于拉曼散射附加在纳米粒子中,显著提高了实验的灵敏度。
纳米材料有很多种,如AuNPs、CBNs、MNPs、QDs和UCNPs等(表 2)。一种以银核和金壳(AgAu)为标记物的侧流层析分析技术用于食品中AFB1灵敏、快速的检测[46],与金纳米颗粒相比,Ag-Au纳米颗粒增强了测定的灵敏度,重现性和稳定性。随着AFB1浓度的增加,检测线上纳米复合材料的颜色强度增加,AFB1的检测限为0.1 ng/mL。Kolosova等[47]报道了一种胶体金侧流层析分析技术,用于同时检测玉米赤霉烯酮(Zearalenone,ZEN)和脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)。目前,比色法侧流层析技术的优点是灵敏、简单、快速,无需多次标记和分离步骤,但该技术尚未成熟,报道的文章也不多,在食品安全、药物研发和医学诊断等领域的现场快速分析检测方面有着极大的发展空间。
Li等[58]设计并构建了基于适配体识别的磁分离辅助的快速检测AFB1的SERS传感器,在羧基化的磁珠上修饰了生物素标记的AFB1适配体,作为检测探针;合成信号分子(4-MBA)内嵌式金银核壳纳米棒并修饰巯基化互补DNA组装成SERS探针,作为捕获探针。通过DNA碱基互补,将金银核壳纳米棒和磁珠组装构建为AFB1检测传感器(图 7)。当AFB1存在时,AFB1被适配体识别,使磁珠和金银核壳纳米棒分离,SERS的信号将随之减弱,从而通过SERS强度的变化达到快速检测AFB1的目的,该传感器的线性范围为1 pg/mL-1 000 pg/mL,检出限为0.4 pg/mL。作为一种新型的鉴定手段[59],在准确、客观、直接的快速检测目标物方面有着巨大的潜力,有望成为鉴定的强大工具。
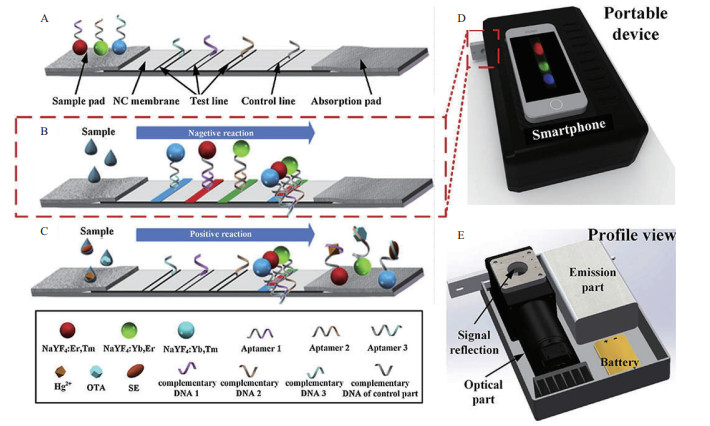
2.4 基于智能手机的适配体侧流层析分析技术基于智能手机的适配体检测装置[60]采用转换纳米粒子修饰的适配体互补链固定在同一侧流层析上的3条检测线,作为检测探针,可以同时对多个不同目标物(如OTA、汞离子和沙门氏菌)进行特异性、灵敏性的快速检测,因此,为多目标检测提供了经济,高效、快速的检测手段。在最佳的条件下,汞离子、OTA和沙门氏菌的检出限分别为5 ng/mL、3 ng/mL和85 CFU/mL[61]。Jin等[62]开发了一种基于成像的侧流层析分析仪,该分析仪将T线和C线的信号成像采集到一张图像中,然后用手机软件对其进行数据处理(图 8)。该分析仪已成功用于肌酸激酶-脑[62](Creatine kinase - brain,CK-MB)的定量分析,LOD值为2 ng/mL,差异性小。手机具有使用方便、便携性好、无所不在和数据传输能力强等优点,可作为即时检验的阅读器,因此,基于智能手机的适配体侧流层析技术有望在食品安全、毒素检测、医学诊断和环境监测等快速检测领域得到广泛应用。
3 结论侧流层析分析技术属于干式化学检测技术,可以兼容裸眼检测或简单的光学电子阅读器,具有灵敏度高、简便快捷、不需要复杂昂贵的仪器设备且价格低廉等特点,在食品安全、生物医药等领域已有应用。核酸适配体侧流层析技术相比于传统的抗原抗体免疫层析法有很多优势,成本低,批次稳定,保存时间长,应用范围广,因此拥有很好的发展前景;同时,可实现现场实时的快速检测。基于不同的标记方式的检测方法具有不同的检测性能,乳胶层和金纳米粒子(gold nanoparticles,AuNPs)可作为可视化定性检测,而荧光、量子点和磁性纳米粒子标记可进行定量分析。目前,适配体侧流层析技术仍停留在实验室研制阶段,在市场上还没有低成本和成熟的检测产品,同时也存在一些问题,例如,样品仍需较复杂的前处理,样品必须是液态均相,基质和环境参数影响大,稳定性差,这些问题将是未来研究的重点。真菌毒素具有种类多、分子结构类似、痕量高等特点,适配体侧流层析技术在现场快速检测真菌毒素领域中具有巨大的潜力。相信在不远的将来,适配体侧流层析技术必将发展成为毒素、重金属、农残和致病微生物等污染物的现场筛查的利器。
| [1] |
Wang C, Sun LL, Zhao Q. A simple aptamer molecular beacon assay for rapid detection of aflatoxin B1[J]. Chinese Chemical Letters, 2019, 30(5): 1017-1020. DOI:10.1016/j.cclet.2019.01.029 |
| [2] |
陈尔凝, 赵新颖, 屈锋. 细菌的核酸适配体筛选的研究进展[J]. 色谱, 2016, 34(4): 389-396. Chen RN, Zhao XY, Qu F. . Research advances of aptamers selection for bacterium targets[J]. Chinese Journal of Chromatography, 2016, 34(4): 389-396. |
| [3] |
Wang Y, Li S, You Y, et al. Application progress of aptamer in biotoxin detection[J]. Journal of Henan Agricultural Sciences, 2018, 47(2): 1-6. |
| [4] |
Liu Y, Cai Z, Sheng L, et al. A magnetic relaxation switching and visual dual-mode sensor for selective detection of Hg2+ based on aptamers modified Au@Fe3O4nanoparticles[J]. Journal of Hazardous Materials, 2019, 388: 121728. |
| [5] |
Yang X, Kong W, Yang M, et al. Application of aptamer identification technology in rapid analysis of mycotoxins[J]. Chinese Journal of Analytical Chemistry, 2013, 41(2): 297-306. |
| [6] |
Van-thuan N, Young S, Man B. Aptamer-based environmental biosensors for small molecule contaminants[J]. Current Opinion in Biotechnology, 2017, 45: 15-23. DOI:10.1016/j.copbio.2016.11.020 |
| [7] |
Xie Y, Yang Y, Kong W, et al. Application of nanoparticle probebased lateral flow immunochromatography technology in mycotoxins detection[J]. Chin J Anal Chem, 2015, 43(4): 618-628. DOI:10.1016/S1872-2040(15)60821-0 |
| [8] |
Li Y, Sun L, Zhao Q. Development of aptamer fluorescent switch assay for aflatoxin B1 by using fluorescein-labeled aptamer and black hole quencher 1-labeled complementary DNA[J]. Anal Bioanal Chem, 2018, 410(24): 6269-6277. DOI:10.1007/s00216-018-1237-x |
| [9] |
张勋.真菌毒素类高灵敏高通量快速检测方法研究[D].无锡: 江南大学, 2014. Zhang X. High-sensitivity, high-throughput and rapid detection immunoassay for mycotoxins[J]. Wuxi : Jiangnan University, 2014. |
| [10] |
Wang L, Ma W, Chen W, et al. An aptamer-based chromatographic strip assay for sensitive toxin semi-quantitative detection[J]. Biosens Bioelectron, 2011, 26(6): 3059-3062. DOI:10.1016/j.bios.2010.11.040 |
| [11] |
郑睿行, 周子焱, 傅晓, 等. HPLC测定玉米中玉米赤霉烯酮和赭曲霉毒素A[J]. 食品研究与开发, 2017, 38(19): 139-142. Zheng RX, Zhou ZY, Fu X, et al. Determination of zearalenone and ochratoxin A in corn by means of HPLC[J]. Food Research and Development, 2017, 38(19): 139-142. |
| [12] |
Michele H, Elisa WJ, Beatriz NI. Photometric procedure for quantitative analysis of aflatoxin B1 in peanuts by thin-layer chromatography using charge coupled device detector[J]. Quimia Nova, 2010, 33(1): 43-47. DOI:10.1590/S0100-40422010000100009 |
| [13] |
张春娥, 刘新保, 廖若宇, 等. 高效液相色谱法测定全麦粉中呕吐毒素含量[J]. 粮油食品科技, 2018, 26(5): 53-57. Zhang CE, Liu XB, Liao RY, et al. Determination of the contents of vomiting toxin(DON)in whole wheat flour by HPLC[J]. Science and Technology of Cereals, Oils and Foods, 2018, 26(5): 53-57. |
| [14] |
Zhao C, Ban X, Liu S, et al. Determination of AFB1 in corns by high performance liquid chromatography without derivations[J]. Journal of Food Safety and Quality, 2014, 5(7): 2198-2203. |
| [15] |
贾海飞, 刘修恒, 吴拥军, 等. 黄曲霉毒素B1胶体金免疫层析法检测试纸条的制备[J]. 职业与健康, 2016, 32(11): 1495-1501. Jia HF, Liu XH, Wu YJ, et al. Preparation of colloidal gold immunochromatographic test strip fpr aflatoxin B1[J]. Occupation and Health, 2016, 32(11): 1495-1501. DOI:10.1016/j.cis.2015.10.010 |
| [16] |
王一晨, 刘奇, 吴学贵, 等. 高效液相色谱-串联质谱法测定花生中的黄曲霉毒素B1[J]. 食品安全质量检测学报, 2019, 10(7): 2059-2063. Wang YC, Liu Q, Wu XG, et al. Determination of aflatoxin B1 in peanut by high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety and Quality, 2019, 10(7): 2059-2063. DOI:10.1007/s12161-017-1113-x |
| [17] |
李红梅, 朱聿元, 韩华, 等. 高效液相色谱-柱后光化学衍生法测定大米粉中黄曲霉B1含量[J]. 安徽农学通报, 2017, 23(15): 135-137. Li HM, Zhu YY, Han H, et al. Separation and identification of aflatoxin B1 in rice meal by high performance liquid chromatography with post-column photochemical reaction[J]. Anhui Agricultural Science Bulletin, 2017, 23(15): 135-137. |
| [18] |
Joseprubert, Carla soler, Jordi manes. Application of an HPLC-MS/MS method for mycotoxin analysis in commercial baby foods[J]. Food Chemistry, 2012, 133(1): 176-183. DOI:10.1016/j.foodchem.2011.12.035 |
| [19] |
张桂兰.基于适配体的赭曲霉毒素和雌激素快速检测方法研究[D].北京: 中国农业科学院, 2018. Joseprubert, Carla soler, Jordi manes. Application of an HPLC-MS/MS method for mycotoxin analysis in commercial baby foods[J].Food Chemistry 2012, 133(1): 176-183. |
| [20] |
易守军, 何盼, 欧宝立, 等. 适配体传感法快速测定啤酒中赭曲霉毒素A[J]. 光谱学与光谱分析, 2019, 39(7): 2283-2287. Yi SJ, He P, Ou BL, et al. A novel aptasensors assay for fast detection of ochratoxin A in beer[J]. Spectroscopy and Spectral Analysis, 2019, 39(7): 2283-2287. |
| [21] |
Zhang X, He K, Fang Y, et al. Preparation and application of ochratoxin A and gibberellone in quantitative colloidal gold immunochromatography strip[J]. Journal of Zhejiang UniversityScience Biomedicine and Biotechnology, 2018, 19(11): 871-883. |
| [22] |
Wang J, Liu B, Hsu Y, et al. Sensitive competitive direct enzyme-linked immunosorbent assay and gold nanoparticle immunochromatographic strip for detecting aflatoxin M1 in milk[J]. Food Control, 2011, 22(6): 964-969. DOI:10.1016/j.foodcont.2010.12.003 |
| [23] |
周伟璐.胶体金适配子试纸条现场快速筛查中药中赭曲霉毒素A研究[D].镇江: 江苏大学, 2016. Zhou WL. An aptamer based colloidal gold tes strip for on-site rapid screening of ochratoxin A in traditional Chinese medicines[J].Zhenjiang : Jiangsu University, 2016. |
| [24] |
Alina V, Alexandr E, Anatoly V, et al. Gold nanoparticles of different shape for bicolor lateral flow test[J]. Analytical Biochemistry, 2019, 568(1): 7-13. |
| [25] |
Shim W, Kim M, Mun H, et al. An aptamer-based dipstick assay for the rapid and simple detection of aflatoxin B1[J]. Biosensors and Bioelectronics, 2014, 62: 288-294. DOI:10.1016/j.bios.2014.06.059 |
| [26] |
Chen L, Wen Fang, Li M, et al. A simple aptamer-based fluorescent assay for the detection of Aflatoxin B1 in infant rice cereal[J]. Food Chemistry, 2017, 215(15): 377-382. |
| [27] |
Kolosova A, Sibanda L, Dumoulin F, et al. Lateral-flow colloidal gold-based immunoassay for the rapid detection of deoxynivalenol with two indicator ranges[J]. Anal Chim Acta, 2008, 666: 235-244. |
| [28] |
杨秀梅, 邢国杰, 徐宽, 等. 胶体金免疫层析技术定量检测人绒毛膜促性腺激素[J]. 上海师范大学学报:自然科学版, 2012, 41(3): 274-279. Yang XM, Xing GJ, Xu K, et al. Quantitative detection of humanchorionic gonadotrophin using colloid gold immunochromatographicassay[J]. Journal of Shanghai Normal University NaturalSciences, 2012, 41(3): 274-279. |
| [29] |
Zhu C, Zhao Y, Yan M, et al. A sandwich dipstick assay for ATP detection based on split aptamer fragments[J]. Analytical and Bioanalytical Chemistry, 2016, 408(15): 1-8. |
| [30] |
Miriam J, Mohammad S, et al. Advances in aptamers-based lateral, flow assays[J]. Trends in Analytical Chemistry, 2017. |
| [31] |
朱超.基于荧光适配体试纸条的黄曲霉毒素B1快速检测技术研究[D].北京: 中国农业科学院, 2017 Zhu C. Development of aptamer-based lateral flow fluorescent assay for fast screening of aflatoxin B1[J]. Beijing : Chinese Academy of Agricultural Sciences, 2017. |
| [32] |
Zhou W, Kong W, Dou X, et al. An aptamer based lateral flow strip for on-site rapid detection of ochratoxin A[J]. Journal of Chromatography B Analytical Technologies in the Biomedical and Life Sciences, 2016, 1022: 102-108. DOI:10.1016/j.jchromb.2016.04.016 |
| [33] |
Zhang G, Zhu C, Huang Y, et al. A Lateral flow strip based aptasensor for detection of ochratoxin a in corn samples[J]. Molecules, 2018, 23(2): 291. DOI:10.3390/molecules23020291 |
| [34] |
周子明, 谢彩玲, 赵斌, 等. 基于分子发夹/荧光微球的侧向层析法定量检测黄曲霉毒素B1[J]. 分析测试学报, 2018, 37(6): 689-695. Zhou ZM, Xie CL, Zhao B, et al. Determination of aflatoxin B1 by lateral flow assay based on molecule beacon/fluorescentmicrosphere[J]. Journal of Instrumental Analysis, 2018, 37(6): 689-695. |
| [35] |
肖理文, 徐秀, 赵皖, 等. 基于时间分辨荧光纳米微球的玉米赤霉烯酮快速定量检测试纸条的研制及性能研究[J]. 粮食加工, 2017, 42(5): 37-39. Xiao LW, Xu X, Zhao W, et al. Development and performance of a fast quantitative detection strip for corn gibberellinone based on time-resolved fluorescent nanospheres[J]. Grain Processing, 2017, 42(5): 37-39. |
| [36] |
沙志聪, 其木格, 贾增艳, 等. 量子点标记免疫层析试纸条检测谷物中赭曲霉毒素A[J]. 食品工业科技, 2019, 40(17): 191-195. Sha ZC, Qi MG, Jia ZY, et al. Quantum dot-labeled immunochromatographic test strip for rapid detection ochratoxin A in cereals[J]. Science and Technology of Food Industry, 2019, 40(17): 191-195. |
| [37] |
Peng J, Huang Q, Liu Y, et al. Photoelectrochemical sensor based on composite of CdTe and nickel tetra-aminedphthalocyanine covalently linked with graphene oxide for ultrasensitive detection of curcumin[J]. Sensors and Actuators B:Chemical, 2019, 294(1): 157-165. |
| [38] |
Thatyara O, Auro A, Flavio S, et al. Photoelectrochemical determination of tert-butylhydroquinone in edible oil samples employing CdSe/ZnS quantum dots and LiTCNE[J]. Food Chemistry, 2017, 227(15): 16-24. |
| [39] |
Richarte A, Bruno J. Aptamer-quantum dot lateral flow test strip development for rapid and sensitive detection of pathogenic escherichia coli via intimin, O157- Specific LPS andshiga toxin 1 aptamers[J]. Current Bionanotechnology, 2015, 1(2): 80-86. |
| [40] |
Wang L, Chen W, Ma W, et al. Fluorescent strip sensor for rapiddetermination of toxins[J]. Chemical Communications, 2011, 47(5): 1574-1576. DOI:10.1039/C0CC04032K |
| [41] |
Duan H, Li Y, Shao Y, et al. Multicolor quantum dot nanobeads for simultaneous multiplex immunochromatographic detection of mycotoxins in maize[J]. Sensors and Actuators B :Chemical, 2019, 291: 411-417. DOI:10.1016/j.snb.2019.04.101 |
| [42] |
Yeon S, Ki mN, Hanun A, et al. Aptamer-based nanobiosensors[J]. Biosensors and Bioelectronics, 2016, 76: 2-19. DOI:10.1016/j.bios.2015.06.040 |
| [43] |
栾云霞, 陈佳伟, 陆安祥, 等. 基于非标记核酸适配体可视化检测黄曲霉毒素B1的方法研究[J]. 食品安全质量检测学报, 2014, 5(3): 736-741. Luan Y, Chen J, Lu A, et al. Colorimetric detection of aflatoxin B1 using aptamer-functionalized gold nanoparticles[J]. Journal of Food Safety & Quality, 2014, 5(3): 736-741. |
| [44] |
Badie B, Danesh N, Karimi G, et al. Ultrasensitive detectio of ochratoxin A using aptasensors[J]. Biosensors and Bioelectronics, 2017, 98: 168-179. DOI:10.1016/j.bios.2017.06.055 |
| [45] |
Wu S, Liu L, Duan N, et al. An aptamer-based lateral flow test strip for rapid detection of zearalenone in corn samples[J]. Journal of Agricultural and Food Chemistry, 2018, 66(8): 1949-1954. DOI:10.1021/acs.jafc.7b05326 |
| [46] |
Liao J, Li H. Lateral flow immunodipstick for visual detection of aflatoxin B1in food using immuno-nanoparticles composed of a silver core and a gold shell[J]. Microchimica Acta, 2010, 171: 289-295. DOI:10.1007/s00604-010-0431-0 |
| [47] |
Kolosova A, Sibanda L, Dumoulin F, et al. Lateral-flow colloidal gold-based immunoassay for the rapid detection of deoxynivalenol with two indicator ranges[J]. Analytica Chimica Acta, 2008, 616(2): 235-244. DOI:10.1016/j.aca.2008.04.029 |
| [48] |
周朴帆, 陈丽丽. 金纳米颗粒的生物检测应用[J]. 中国生物制品学杂志, 2018, 31(7): 729-796. Zhou PF, Chen LL. Application of gold nanoparticles in biological detection[J]. Chinese Journal of Biologicals, 2018, 31(7): 729-796. |
| [49] |
Slowing I, Trewyn B, Giri S, et al. Mesoporous silica nanoparticles for drug delivery and biosensing applications[J]. Advanced Functional Materials, 2007, 17(8): 1225-1236. DOI:10.1002/adfm.200601191 |
| [50] |
Huang H, Zhu J. DNA aptamer-based QDs electrochemiluminescence biosensor for the detection of thrombin[J]. Biosensors and Bioelectronics, 2009, 25(4): 927-930. |
| [51] |
Li W, Dong K, Wang H, et al. Remote and reversible control of in vivo bacteria clustering by NIR-driven multivalent upconverting nanosystems[J]. Biomaterials, 2019, 217: 119310. DOI:10.1016/j.biomaterials.2019.119310 |
| [52] |
颜范勇, 邹宇, 王猛, 等. 荧光碳点的制备及应用[J]. 化学进展, 2014, 26(1): 61-74. Yan FY, Zhou Y, Wang M, et al. Synthesis and application of the fluorescent carbon dots[J]. Progress in Chemistry, 2014, 26(1): 61-74. |
| [53] |
荣杰峰, 许美珠, 吴洪成, 等. 基于石墨烯量子点的检测地表水中六价铬的荧光传感器[J]. 分析试验室, 2017(1): 57-61. Rong JF, Xu MZ, Wu HC, et al. Fluorescent sensor for chromium(VI)in surface water based on graphene quantum dots[J]. Chines Journal of Analysis Laboratory, 2017(1): 57-61. |
| [54] |
Eddaoudi M, Kim J, Rosi N, et al. Systematic design of pore size and functionality in isoreticular MOFs and their application in methane storage[J]. Science, 2002, 295(5554): 469-472. DOI:10.1126/science.1067208 |
| [55] |
Zhang W, Xiao X, Liu X, et al. Preparation and quality of SERS test strips[J]. Chemical Journal of Chinese Universities, 2013, 34: 1385-1388. |
| [56] |
Jia X, Wang C, Zhen R, et al. Dual dye-loaded Au@Ag coupled to a lateral flow immunoassay for the accurate and sensitive detectio of Mycoplasma pneumoniaeinfection[J]. RSC Advances, 2018, 8(38): 21243-21251. DOI:10.1039/C8RA03323D |
| [57] |
Kalachyova Y, Lyutakov O, Kostejn M, et al. Silver nanostructures: From individual dots to coupled strips for the tailoring of SER excitation wavelength from near-UV to near-IR[J]. Electronic Materials Letters, 2015, 11(2): 288-294. DOI:10.1007/s13391-014-4336-7 |
| [58] |
Li A, Tang L, Song D, et al. A SERS-active sensor based on heterogeneous gold nanostar core-silver nanoparticle satellite assemblies for ultrasensitive detection of aflatoxinB1[J]. Nanoscale, 2016, 8(4): 1873. DOI:10.1039/C5NR08372A |
| [59] |
Restaino SM, White IM. A critical review of flexible and porous SERS sensors for analytical chemistry at the point-of-sample[J]. Analytica Chimica Acta, 2019(1060): 17-29. |
| [60] |
Kim H, Awofeso O, Choi S M, et al. Colorimetric analysis of salivaalcohol test strips by smartphone-based instruments using machinelearning algorithms[J]. Applied Optics, 2017, 56(1): 84. DOI:10.1364/AO.56.000084 |
| [61] |
Wei X, Meng X, Fu Q, et al. A portable smart-phone readout device for the detection of mercury contamination based on an aptamerassay nanosensor[J]. Sensors, 2016, 16(11): 1871. DOI:10.3390/s16111871 |
| [62] |
Jin B, Yang YX, He RY, et al. Lateral flow aptamer assay integrated smartphone-based portable device for simultaneous detection of multiple targets using up conversion nanoparticles[J]. Sensorsand Actuators B :Chemical, 2018, 276(10): 48-56. |