2. 清华大学环境学院环境模拟与污染控制国家重点实验室,北京 100084;
3. 嘉兴学院南湖学院,嘉兴 314001
2. State Key Joint Laboratory of Environmental Simulation and Pollutants Control, School of Environment, Tsinghua University, Beijing 100084;
3. Nanhu College, Jiaxing University, Jiaxing314001
近年来,银作为一种抗菌剂在医院得到广泛的使用,特别是在伤口敷料、外用制剂和医疗器械(气管内呼吸管、骨假体等)中。然而,长期接触银和银化合物会导致银质沉淀症及其他症状,如头痛、胃痛、疲劳、皮肤刺激或更严重的神经、肾脏或肝脏并发症。胶体银还可能干扰某些药物的吸收,如培那西拉敏、喹诺酮类、四环素和甲状腺素。由于人类对银的接触越来越普遍,因此需要开发一种简单快速的方法来监测水源和体内的银[1-2]。
大量研究表明,在分子水平上某些重金属离子可与特定的基因序列发生作用,使其空间结构发生改变[3],而这种结构和性能的关系使重金属离子,如Ag+、Hg2+的快速、特异识别有了一条便捷的途径。上述能够发生特异结构变化的DNA或RNA链,被称为功能核酸[4],它们通过3种类型的传感方式实现重金属离子的检测:第一种是利用DNA,基因错配特异性结合重金属离子实现检测[5]。本课题组报道了基于Hg2+与T碱基错配形成T-Hg2+-T复合物的倏逝波定量检测Hg2+的研究,对Hg2+的检测限为2.1nmol/L[6];第二种是与鸟嘌呤(G)-四联体发生特异性反应,G-四联体是由ssDNA(单链DNA)中的多个G-4面互相重叠而产生,重金属离子可进入G-四联体的中心,从而影响其与其他离子结合[7-8];第三种是基于金属依赖性的核酸酶DNAzyme,即在特定重金属离子的存在下,DNAzyme催化发生水解断裂反应,不可逆地将带有荧光标记的核酸片段剪断,从而实现检测[9]。目前依据这些传感设计思路已经用于多种重金属的单指标甚至多指标的同时测定。最常见的传感策略是基于荧光体(供体)和猝灭剂(受体)之间的能量共振转移(FRET)[10]。然而,传统的基于荧光生物传感的方法需要在DNA链上修饰两种或更多的猝灭剂以降低背景信号。因此,寻找不含标记物或含有较少标记物的荧光染料或猝灭材料是适配体的发展方向。
近几年,纳米技术取得飞速发展,纳米材料也成为很有发展前景的生物分析材料。石墨烯是一种单层碳原子通过sp2杂化形成二维蜂窝状点阵结构的二维碳纳米材料[11-12],这种特殊的单层碳原子结构决定石墨烯材料具有特别的物理和化学性质[13-14]。同时石墨烯特殊的结构决定其可与生物大分子尤其是DNA分子相互作用,从而为构建新型化学和生物传感器奠定了基础。研究发现,单链DNA和双链DNA在石墨烯上具有不一样的结合能力,而且石墨烯可以作为优异的能量或电子受体猝灭发光材料的荧光[15-16],由此可以选择性的吸附和猝灭有荧光标记的单链(ss-)DNA探针。其作为猝灭剂的优点包括无需标记到DNA上,长距离荧光猝灭效应,低背景噪声等[17]。因此如果能以石墨烯作为新的信号传导基体,无疑将为目标物的快速、高灵敏和高通量检测提供新的思路。
本实验利用石墨烯对单链DNA和双链DNA不一样的连接能力,以及其优异的荧光猝灭能力,结合适配体错配原理,设计开发了C-Ag+-C和石墨烯的新型荧光传感器用于快速和高灵敏检测Ag+。
1 材料与方法 1.1 材料 1.1.1 材料及来源硝酸银(AgNO3),氢氧化钠(NaOH):分析纯,北京化工厂(北京);氧化石墨烯(GO):先丰纳米科技有限公司(南京);荧光基团FAM修饰的Ag+适配体:DNA探针(SSO-FAM,5'-FAM-CTC TCT TCT CTT CAT TTT TCA ACA CAACAC AC-3',该探针设计参考了Ono等[18],Wen等[19]的研究),上海生工生物科技有限公司(上海);HEPES:4-羟乙基哌嗪乙磺酸;N-(2-羟乙基)哌嗪-N’ -2-乙烷磺酸,1M溶液,Mediatech公司(美国);SDS:十二烷基硫酸钠,≥ 95.0%,拜尔迪生物技术有限公司(北京)。
1.1.2 仪器F-7000荧光分光光度计(Hitachi,日本);pH计(梅特勒-托利多仪器有限公司,中国);CF16RX II离心机(Hitachi,日本);MTC-100恒温混匀仪(南京户川电子,中国);超纯水:Barnstead,NANOpure Dlamond,≥ 18.2MΩ。
1.1.3 溶液配制0.5 g/L的GO溶液:称取0.25 gGO,用超纯水定容至500 mL,以200 W的功率超声4 h以上(控制温度不超过40℃)(溶液在使用前需再超声10 min)。
1 μmol/L的SSO-FAM溶液:先将引物以12 000r/min离心2 min,加入35 μL的超纯水定容,配成100 μmol/L的储备液,使用时再稀释到合适浓度。
100 μmol/L和1 μmol/L的AgNO3溶液:准确称取AgNO3粉末1.698 7 g,加少量超纯水溶解,定容至10 mL,混合均匀,浓度即为100 mol/L。
1 mol/L的NaNO3溶液:称取NaNO3粉末8.499 g,取少量水溶解,定容至100 mL浓度即为1 mol/L。
1 mol/L的HEPES溶液:购得。
1.2 方法 1.2.1 可行性分析分别测试SSO-FAM体系,SSOFAM-GO体系,以及在SSO-FAM-GO体系下加入不同浓度Ag+的荧光强度。
1.2.2 GO超声时间优化GO溶液对SSO的猝灭效率有至关重要的作用,影响Ag+检测的信噪比,是实现Ag+检测的关键因素。本实验将不同浓度的GO溶液在超声0 min、10 min和30 min后加入SSOFAM溶液中,测定其荧光强度,并计算荧光猝灭效率。
1.2.3 SSO-FAM和GO反应时间优化SSO-FAM和GO的反应时间会的荧光信号产生影响,将终浓度为10 nmol/L的SSO-FAM溶液和10 mg/L的GO溶液的反应时间设置为0 min、10 min、20 min、30 min、40 min,检测荧光强度,观察反应时间对GO荧光猝灭效率的影响。
1.2.4 SSO-FAM与GO溶液反应用量的优化选取3组不同比例的SSO-FAM溶液和GO溶液,第1组为终浓度10 nmol/L的SSO-FAM溶液和10 mg/L的GO溶液,第2组为终浓度20 nmol/L的SSO-FAM溶液和10 mg/L的GO溶液,第3组为终浓度20nmol/L的SSO-FAM溶液和20 mg/L的GO溶液,将不同浓度的Ag+加入上述3组溶液中,测定荧光强度。
1.2.5 Ag+的检测方法将20 μL 1 μmol/L的DNA探针溶液与0-800 nmol/L不同浓度梯度的Ag+溶液混合均匀,将10 μL 1 mol/L HEPES溶液和50 μL 1mol/L的NaNO3溶液加入上述溶液中,定容体积为1mL,pH 7.10,37℃下避光反应20 min,生成C-Ag+-C的复合物。然后再加入终浓度为20 mg/L的GO,混合反应10 min,以494 nm的激发波长检测荧光信号。
1.2.6 其他金属离子的干扰测定保持反应条件不变,将1 μmol/L Cd2+、Pb2+、Hg 2+等金属离子作为干扰离子加入样品中,检测各金属离子的荧光强度。
1.2.7 Ag+的加标回收试验使用荧光分光光度计检测200-500 nmol/L不同浓度梯度的Ag+溶液的荧光强度,根据样品浓度与测得的荧光强度建立Ag+标准曲线;使用饮用水配制样品溶液,并将一定浓度的Ag+加入样品中,检测加入Ag+后样品的荧光强度,结果与标准曲线的荧光信号对照,计算样品加标回收率。
2 结果 2.1 可行性分析为了证明该传感器设计的合理性,我们考察了各体系的荧光光谱。如图 1所示,当体系中不存在Ag+时,SSO修饰的FAM荧光被一定量的石墨烯完全猝灭,表明单链DNA与石墨烯之间存在π-π作用力;当Ag+存在时,该体系表现出较强的荧光,说明Ag+能够与两个胞嘧啶碱基结合,使SSO折叠成为稳定的分子内C-Ag+-C双链结构,减弱了与石墨烯之间的作用力,从而使该体系的荧光得到恢复,并且加入浓度越高,荧光恢复强度越大,由此证明Ag+检测的可行性。

|
| 图 1 不同条件下SGI的荧光强度 |
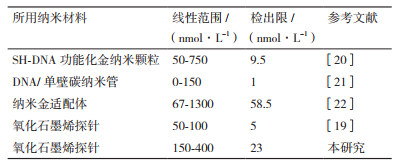
实验对比了不同浓度的GO溶液在不同超声时间下对SSO-FAM的猝灭效率的影响。结果如图 2所示。未经超声处理的GO溶液,即使增加溶液的浓度到30 mg/L时,其猝灭效率依然低于30%;当GO经过分别10 min和30 min超声处理后,10 mg/L的GO添加量就可达到95%的猝灭效率,说明GO在使用前需要进行10 min以上的超声处理。
|
| 图 2 GO超声时间对其荧光猝灭效率的影响 |
将10 nmol/L的DNA探针溶液和10 mg/L的氧化石墨烯溶液设置0-40 min的反应时间,观察荧光猝灭效果,结果如图 3所示。实验结果表明,DNA探针溶液和氧化石墨烯溶液的荧光强度随着反应时间的增加而下降,20 min后荧光强度出现回升,40min与10 min处的荧光强度基本相同,说明Ag+与SSO错配反应充分。因此,本实验的反应时间设定为10 min。

|
| 图 3 反应时间对GO荧光猝灭效率的影响 |
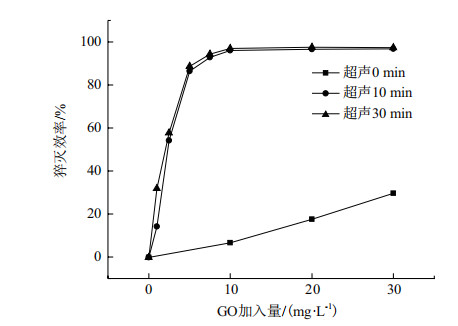
考察了3组比例不同的DNA探针溶液和石墨烯溶液对Ag+荧光测试的影响,结果如图 4所示。其中,曲线1为10 nmol/L的DNA探针溶液和10 mg/L的石墨烯溶液的混合溶液。在加入的Ag+浓度低于100 nmol/L时,检测出的荧光强度出现下降,加入的Ag+浓度超过100 nmol/L时,样品的测试值出现上升,但稳定性差,并且上升缓慢;曲线2为20nmol/L的DNA探针溶液和10 mg/L的石墨烯溶液的混合溶液,在加入的Ag+浓度低于200 nmol/L时,测试出的荧光强度不断下降,这是由于石墨烯的用量不足未能将荧光完全猝灭,当添加的Ag+浓度超过200 nmol/L后,检测出的荧光强度随着Ag+浓度上升;曲线3为终浓度20 nmol/L的DNA探针溶液和20 mg/L的石墨烯溶液的混合溶液,荧光强度从50 nmol/L开始出现逐渐上升的趋势,当Ag+浓度大于800 nmol/L后,检测出的荧光强度逐渐趋于稳定。根据3组实验的实验结果,曲线3的样品信噪比低,且检测的线性范围最宽,因此实验选用20 nmol/L的DNA探针溶液和20 mg/L的石墨烯溶液作为最佳比例的反应用量。
|
| 图 4 SSO浓度对Ag+检测的影响 |
在最优的条件下,荧光增强强度与Ag+浓度在150 nmol/L-400 nmol/L浓度范围呈线性相关(图 5),校正曲线方程为F= 0.917 3CAg-80.006,相关系数为0.991,按照IUPAC定义的检出限(LOD)计算方法求得检出限(3 σ)为23 nmol/L。

|
| 图 5 不同浓度Ag+对应的荧光强度 |
为了验证本方法适用于复杂水体中的Ag+浓度的测试,通过实验测试了几种常见的金属离子在本方法下的荧光强度响应。将1 μmol/L的Fe3+、Zn2+、Mg2+、Pb2+、Co2+、Ni2+、Cd2+、Hg2+、Ca2+、Mn2+和Cu2+加入DNA探针与石墨烯的混合体系中,保持其他的方法不变,检测不同金属离子的荧光强度,结果如图 6所示。200 nmol/L的Ag+的样品荧光强度为240,其他金属离子的荧光强度都低于50,不足Ag+的1/10。结果显示,本方法对于Ag+具有特异性,适用于复杂水体。

|
| 图 6 选择性分析 |
进一步将该探针用于自来水中Ag+的检测,该样品中未检测出Ag+,向这些样品中加入300 nmol/L的Ag+,其回收率为96.6%,证明该方法对于实际样品分析具有一定的指导意义。
3 讨论有些核酸探针的信号单元同时包括了染料分子和纳米材料,这类探针称为核酸-染料/纳米探针[23]。该探针多数是通过染料分子和纳米材料之间的FRET效应实现的。以石墨烯纳米材料为例,如Yang课题组首先利用石墨烯对单链DNA和双链DNA吸附能力的不同,实现了DNA分子的检测[16]。检测机理如下:染料标记的单链DNA探针可以通过π-π作用力与石墨烯结合,从而拉近染料和石墨烯之间的距离,导致二者发生能量共振转移,染料荧光发生猝灭,当目标物DNA存在时,可以与探针分子杂交形成双链DNA,从而减弱了核酸与石墨烯之间的作用力,阻碍了能量共振转移的发生,体系荧光得以恢复[24]。本研究传感原理,如图 7所示,重金属离子可与特定的基因序列发生作用[25],当体系中无Ag+存在时,由于碱基与石墨烯之间的π-π作用力,单链DNA与石墨烯形成石墨烯/单链DNA复合物,此时FAM与石墨烯之间发生共振能量转移或电子转移,其荧光猝灭。当体系中加入Ag+时,由于Ag+能够选择性的与两个胞嘧啶碱基结合,使得DNA发生构型变化折叠成为稳定的分子内C-Ag+-C双链结构[26],由于空间位阻的存在,此时加入的石墨烯不会与产物发生相互作用,因此FAM的荧光不能被有效猝灭,因此可以通过传感器的荧光增强程度对体系中加入的Ag+进行定量检测[27]。

|
| 图 7 利用GO和SSO-FAM检测Ag+的原理示意图 |
将本研究结果与利用纳米材料和富C碱基DNA探针检测Ag+的部分已报道研究进行对比,结果如表 1所示。可以看出,本实验方法的线性范围和检出限与其他方法相比各有优劣,与同样使用氧化石墨烯的方法相比,本研究所建立的核酸传感器对Ag+的检测线性范围更大。
本实验基于核酸适配体错配反应的原理,利用SSO-FAM和GO建立了一种对Ag+检测的方法。使用本方法,在150-400 nmol/L范围内Ag+浓度和荧光强度检测值呈线性关系,Ag+的检测限可达23nmol/L。该方法在饮用水的实验样品中Ag+加标检测的回收率达到96.6%,对饮用水中Ag+含量的检测具有一定的指导意义。但是该方法线性范围较窄,并未达到预期结果,在方法设计和实际检测方面还有待进一步的改进。
| [1] |
Tan SS, Teo YN, Kool ET. Selective sensor for silver ions built from polyfluorophores on a DNA backbone[J]. Organic Letters, 12, 21: 4820-4823. |
| [2] |
Lansdown A. Silver in health care:antimicrobial effects and safety in use[J]. Curr Probl Dermatol, 2006, 33: 17. DOI:10.1159/000093928 |
| [3] |
Ellington AD, Szostak JW. In vitro selection of RNA molecules that bind specific ligands[J]. Nature, 1990, 346(6287): 818-822.. DOI:10.1038/346818a0 |
| [4] |
韩世同.基于功能核酸的Hg2+和Pb2+倏逝波生物传感检测技术研究[D].北京: 清华大学, 2016 Han ST. Research on detection of Hg2+ and Pb2+ using evanescent wave biosensing technology based on functional nucleic acid[D]. Beijing: Tsinghua University, 2016. |
| [5] |
Ono A, Togashi H. Highly selective oligonucleotide-based sensor for mercury(II)in aqueous solutions[J]. Angew Chem Int Ed Engl, 2004, 43: 4300-4320. DOI:10.1002/anie.200454172 |
| [6] |
Li T, Wang E, Dong S. Potassium lead-switched g-quadruplexes: a new class of DNA logic gates[J]. Journal of the American Chemical Society, 131(42): 15082-15083. DOI:10.1021/ja9051075 |
| [7] |
Long F, Gao C, Shi HC, et al. Reusable evanescent wave DNA biosensor for rapid, highly sensitive, and selective detection of mercury ions[J]. Biosensors & Bioelectronics, 26(10): 4018-4023. |
| [8] |
杨越.基于核酸适配子技术检测环境中重金属离子的研究[D].长春: 吉林大学, 2012 Yang Y. Research on detection of heavy metal ions in environment based on nucleic acid aptamer technology[D]. Changchun: Jilin University, 2012. |
| [9] |
Li J, Lu Y. A highly sensitive and selective catalytic DNA biosensor for lead ions[J]. ournal of the American Chemical Society, 122(42): 10466-10467. DOI:10.1021/ja0021316 |
| [10] |
张崇华.基于核酸放大技术和纳米材料的生物传感新方法的研究[D].长沙: 湖南大学, 2016 Zhang CH. Research on new methods of biosensing based on nucleic acid amplification technology and nanomaterials[D]. Changsha: Hunan University, 2016. |
| [11] |
Novoselov KS, Geim AK, Morozov SV, et al. Electric field effect in atomically thin carbon films[J]. Science, 2004, 306(5696): 666-669. DOI:10.1126/science.1102896 |
| [12] |
桑园.金属颗粒纳米切割石墨烯的调控及其应用研究[D].合肥: 中国科学技术大学, 2018 Shang Y. Study on the regulation and application of metal particle nano-cut graphene[D]. Hefei : University of Science and Technology of China, 2018. |
| [13] |
Nair RR, Blake P, Grigorenko AN, et al. Fine structure constant defines visual transparency of graphene[J]. Science, 320(5881): 1308-1308. DOI:10.1126/science.1156965 |
| [14] |
Lee C, Wei X, Kysar JW, et al. Measurement of the elastic properties and intrinsic strength of monolayer graphene[J]. Science, 2008, 321(5887): 385-388. DOI:10.1126/science.1157996 |
| [15] |
Varghese N, Mogera U, Govindaraj A, et al. Binding of DNA nucleobases and nucleosides with graphene[J]. Chemphyschem, 2009, 10(1): 206-210. DOI:10.1002/cphc.200800459 |
| [16] |
Lu CH, Yang HH, Zhu CL, et al. A graphene platform for sensing biomolecules[J]. Angewandte Chemie International Edition, 2009, 48(26): 4785-4787. DOI:10.1002/anie.200901479 |
| [17] |
Loh KP, Bao Q, Eda G, et al. Graphene oxide as a chemically tunable platform for optical applications[J]. Nature Chemistry, 2(12): 1015-1024. DOI:10.1038/nchem.907 |
| [18] |
Ono A, Cao S, Togashi H, et al. Specific interactions between silver (I)ions and cytosine-cytosine pairs in DNA duplexes[J]. Chem Commun(Camb), 2008, 39: 4825-4827. |
| [19] |
Wen Y, Xing F, He S, et al. A graphene-based fluorescent nanoprobe for silver(I)ions detection by using graphene oxide and a silver-specific oligonucleotide[J]. Chem Commun(Camb), 2010, 46(15): 2596-2598. DOI:10.1039/b924832c |
| [20] |
Saran R, Kleinke K, Zhou W, et al. A silver-specific DNAzyme with a new silver aptamer and salt-promoted activity[J]. Biochemistry, 2017, 56(14): 1955-1962.. DOI:10.1021/acs.biochem.6b01131 |
| [21] |
Zhao C, Qu K, Song Y, et al. A reusable DNA single-walled carbon-nanotube-based fluorescent sensor for highly sensitive and selective detection of Ag+ and cysteine in aqueous solutions[J]. Chemistry, 2010, 16(27): 8147-8154. DOI:10.1002/chem.201000306 |
| [22] |
Wen G, Lin C, Tang M, et al. A highly sensitive aptamer method for Ag+ sensing using resonance Rayleigh scattering as the detection technique and a modified nanogold probe[J]. RSC Adv, 2013, 3(6): 1941-1946. DOI:10.1039/C2RA22542E |
| [23] |
卿志和.新型光学核酸探针的制备及其在生化分析中的应用研究[D].长沙: 湖南大学, 2014 Qing ZH. The manufacture of new optical nucleic acid probes and its application in biochemical analysis[D]. Changsha: Hunan University, 2014. |
| [24] |
陆畅. DNA和二维纳米材料的界面作用行为及其在荧光生物传感中的应用[D].杭州: 浙江大学, 2017 Lu C. Interaction between DNA and two-dimensional nanomaterials and its application in fluorescence biosensing[D]. Hangzhou: Zhejiang University, 2017. |
| [25] |
Zhan S, Wu Y, Wang L, et al. A mini-review on functional nucleic acids-based heavy metal ion detection[J]. Biosensors & Bioelectronics, 2016, 86: 353-368. |
| [26] |
曹阳.基于功能核酸的水中重金属检测技术研究[D].西安: 长安大学, 2013 Cao Y. Research on detection technology of heavy metals in water based on functional nucleic acids[D]. Xi'an: Changan University, 2013. |
| [27] |
Huang JH, Su XF, Li ZG. Metal ion detection using functional nucleic acids and nanomaterials[J]. Biosensors & Bioelectronics, 2017, 96: 127-139. |