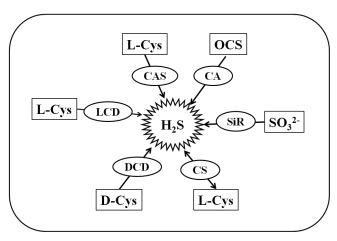
近年来,关于硫化氢(Hydrogen sulfide,H2S)的研究已从毒性分子转向信号作用,并已初步证实其在种子的萌发、植物的生长、发育,以及响应逆境胁迫中起着重要的信号作用[1-4]。植物中,H2S通过合成和分解途径控制其在细胞中的动态平衡。这些途径中的关键酶包括L-/D-半胱氨酸脱巯基酶(L-/D-cysteine desulfhydrase,L/DCD)、亚硫酸还原酶(Sulfite reductase,SiR)、氰丙酸合成酶(Cyanoalanine synthetase,CAS)、O-乙酰丝氨酸硫醇裂解酶[O-acetylserine(thiol)lyase,OAS-TL]、碳酸酐酶(Carbonic anhydrase,CA)等(图 1)[1-4]。此外,为了维持动态平衡,防止过多的H2S对细胞的毒害作用,植物中多余的H2S可以气体的形式散失到空气中[1-4]。
|
| 植物可分别以L-/D-半胱氨酸(L-/D-Cys)、硫化羰(OCS)和亚硫酸(SO32-)为底物,通过L-/D-半胱氨酸脱巯基酶(L/DCD)、氰丙酸合成酶(CAS)、半胱氨酸合成酶(CS)、碳酸酐酶(CA)和亚硫酸还原酶(SiR)合成H2S 图 1 植物中硫化氢(H2S)的动态平衡 |
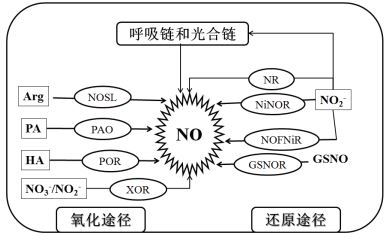
目前,一氧化氮(Nitric oxide,NO)也被认为是植物中的重要第二信使,与H2S、氨气(Ammonia,NH3)、一氧化碳(Carbone monoxide,CO)等一起被称为气体信使[5-8]。这些气体信使参与种子的萌发到植物的衰老的整个生理过程。在植物中,NO的动态平衡也受多条途径的调控,这些途径包括氧化途径和还原途径。前者的关键酶包括NO合成酶(Nitric oxide synthase,NOS)类似蛋白(Nitric oxide synthase-like proteins,NOSL)、多胺氧化酶(Polyamineoxidase,PAO)、多胺氧化还原酶(Polyamine oxidoreductase,POR)、黄嘌呤氧化还原酶(Xanthine oxidoreductase,XOR)等(图 2)[5-8]。还原途径的关键酶主要包括硝酸还原酶(Nitrate reductase,NR)、质膜结合的亚硝酸:NO还原酶(Plasma membrane-bound nitrite:NO reductase,NiNOR)和NO形成亚硝酸还原酶(NO-forming nitrite reductase,NOFNiR)(图 2)[5-8]。
|
| 植物可通过氧化途径和还原途径合成NO。氧化途径中,植物分别以精氨酸(Arg)、多胺(PA)、羟氨(HA)和硝酸盐/亚硝酸盐(NO3-/NO2-)为底物,在NO合成酶类似蛋白(NOSL)、多胺氧化酶(PAO)、多胺氧化还原酶(POR)和黄嘌呤氧化还原酶(XOR)的催化下合成NO。在还原途径中,植物分别以NO2-和亚硝基谷胱甘肽(GSNO)为底物,在硝酸还原酶(NR)、质膜结合的亚硝酸:NO还原酶(NiNOR)、NO形成亚硝酸还原酶(NOFNiR)和GSNO还原酶(GSNOR)的催化下合成NO。此外,植物也可通过呼吸链和光合链还原NO2-为NO 图 2 植物中一氧化氮(NO)的动态平衡 |
已有研究表明,信号分子H2S和NO在植物中存在交互作用,参与多种生理过程,如种子的萌发、根形态建成、气孔运动、果实的成熟、耐逆性等[3, 6-7]。但在这些生理过程中,有关H2S和NO交互作用的确切机理仍鲜见报道。本文根据H2S和NO的最新研究进展,对二者的交互作用(化学反应、作用于共同的靶分子、调节彼此代谢酶和其他信号途径等)进行了讨论,以期待及推动该领域的迅速发展。
1 H2S在植物中的稳态由于高浓度的H2S易与亚铁离子结合,因此对含有亚铁离子的蛋白质(如细胞色素氧化酶、血红蛋白、肌红蛋白等)的结构进行修饰,继而抑制其活性和功能,从而表现出对细胞的毒害作用[1-4]。所以,同其他信号分子[如Ca2+、活性氧(Reactive oxygen species,ROS)和NO]一样,H2S在植物细胞中必须进行严格的控制,保持其动态平衡。通常,植物细胞中H2S的稳态受合成和清除共同调节。H2S的合成有多条途径,主要受关键酶LCD、DCD、SiR、CAS、OAS-TL等的调节[1-4]。LCD、DCD和SiR分别以L-/D- 半胱氨酸(L-/D-cysteine,Cys)和亚硫酸为底物,催化H2S的合成[1-4]。此外,CAS以L-Cys为底物,合成H2S,此途径在合成H2S和氰丙酸的同时,清除细胞中过多的氰化氢(HCN)(图 1)[1-4]。研究也表明,植物中或通过气孔从空气中吸收的硫化羰(Carbonyl sulfide,COS)又称氧硫化碳、羰基硫,可被细胞中的碳酸酐酶(Carbonic anhydrase,CA)转变为CO2和H2S(图 1)[9-10],反应式如下:
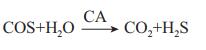
植物中清除H2S的主要方式是将其迅速地转变为半胱氨酸,此过程主要由半胱氨酸合成酶(cysteine synthetase,CS,EC 4.2.99.8)来承担。CS又称O-乙酰丝氨酸硫醇裂解酶(O-acetylserine(thiol)lyase,OAS-TL),此酶催化的是可逆反应,在合成Cys的同时,也可以Cys为底物合成H2S(图 1)[1-4]。此外,植物体内过多的H2S也可以气体的形式散失到植物体外,从而维持细胞中H2S的动态平衡[1-4]。研究表明,H2S也可与含有半胱氨酸残基(巯基)的蛋白质(Proteins,Pr)结合,对蛋白进行一种新的翻译后修饰——硫巯基化(S-sulfhydrylation,SSH),也称过硫化(Persulfidation,-SnH)[11-16],从而调控其活性和功能。
2 NO在植物中的稳态与其他信号分子一样,过多的NO对植物细胞也有毒害作用,特别是当它与超氧阴离子自由基(Superoxide radical,·O2-)结合后,产生的过氧亚硝酸根离子(Peroxynitrite,ONOO-)破坏作用更强,可使蛋白质、脂质、核酸等生物大分子发生硝基化[5]。因此,维持植物细胞中NO的动态平衡也很重要。植物中,NO的合成包括氧化途径和还原途径。氧化途径合成NO的关键酶主要包括NOSL、PAO、POR和XOR[5-8]。NOSL以精氨酸(Argenine,Arg)为底物,氧化形成NO。NO合成酶(Nitric oxide synthase,NOS)是动物体中合成NO的关键酶,此酶在植物体内尚未完全证实。PAO和POR分别以多胺(Polyamines,PA)和羟氨(Hydroxylamine,HA)为底物,合成NO。此外,硝酸盐/亚硝酸盐(NO3-/NO 2-)在XOR的作用下,也可合成NO(图 2)[5-8]。
此外,NO产生的还原途径主要包括NO2--分别在NR、NiNOR和NOFNiR的作用下,合成NO的过程(图 2)[5-8]。研究表明,NO 2-也可在线粒体和叶绿体中,接受电子传递链的电子,被还原为NO。此外,NO可与还原型谷胱甘肽(Reduced glutathione,GSH)结合,形成亚硝基谷胱甘肽(Nitrosoglutathione,GSNO)。GSNO可作为NO的储存形式,在GSNO还原酶(GSNO reductase,GSNOR)的作用下,GSNO可释放NO,同时产生氧化型谷胱甘肽(Oxidized glutathione,GSSG)和另一个信号分子NH3(图 2)[5-8]。研究表明,NO也可与含有半胱氨酸残基(巯基)、酪氨酸残基和金属离子的蛋白质结合,对蛋白进行另一新的翻译后修饰——亚硝基化(S-nitrosylation,SNO)(图 3)[17-21],继而调控蛋白质的活性和功能。
|
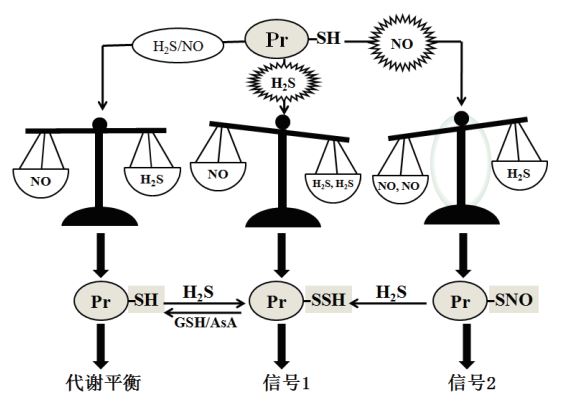
| 正常生理条件下,植物中H2S和NO的产生处于动态平衡,蛋白质(Pr)巯基(-SH)处于还原状态(Pr-SH),细胞代谢平衡。当H2S产量大于NO时,蛋白质巯基发生硫巯基化(-SSH),引发一种新的信号(信号1);当NO产量大于H2S时,蛋白质巯基发生亚硝基化(-SNO),引发另一种信号(信号2)。此外,含有巯基的蛋白质(Pr-SH)和巯基发生亚硝化的蛋白质(Pr-SNO)可被H2S转变为硫巯基化的蛋白质(Pr-SSH),而硫巯基化的蛋白质又可被谷胱甘肽(GSH)或抗坏血酸(AsA)还原为巯基蛋白质 图 3 植物中硫化氢(H2S)和一氧化氮(NO)的交互作用 |
在正常情况下,植物中H2S、NO和代谢保持动态平衡,当内外因引发H2S信号或NO信号时,这种动态平衡就会被打破,通过H2S和NO信号的交互作用(化学反应、作用于共同的靶分子、调节彼此代谢酶和其他信号途径等),引发新的信号途径,建立新的动态平衡(图 3)。
3.1 H2S与NO反应作为具有较强化学活性的H2S和NO,除了修饰上述所陈述的蛋白质外,二者也可以发生反应,产生HSNO(Thionitrous acid)[22-23]。由内外因子引发的H2S和NO信号,二者可通过化学反应,削弱或消除H2S和NO信号;或将这两种信号转化为另一种信号HSNO,进而转换和完成信号传导途径,最终调节各种生理过程。研究表明,在NO供体硝普钠(Sodium nitroprusside,SNP)中加入H2S供体(NaHS),可降低NO的释放量或阻断NO的释放,暗示H2S可能与NO发生直接的反应。进一步研究表明,H2S在生理pH条件下以H2S/-SH的反式磁酸/碱基对的形式存在,而NO具有顺式磁性质,因此,H2S和NO直接反应的可能性不大,所以推测H2S和NO的反应,相当于硫醇和NO的直接反应[22]。目前,研究显示,在NO供体中加入H2S,可改变预期基于NO的生理功能,然而用HgCl2或CuCl2处理这些反应混合物,会产生亚硝酸盐或NO,并恢复预期的生物学功能,暗示H2S和NO的反应,可产生S-亚硝基硫醇、HSNO、HNO等中间产物[22-23]。用SNP和NaHS的混合物处理细胞,没有增加环鸟苷酸单磷酸(cGMP)水平,这表明NaHS通过中间产物的形成阻断了NO的释放。此外,向这些细胞中添加HgCl2(促进S-亚硝基硫醇分解生成硝酸盐),可显著提高cGMP水平,进一步支持中间产物S-亚硝基硫醇存在的说法[22-23]。
作为中间产物的S-亚硝基硫醇,能与H2S进一步发生反应[23-24]。GSNO与GSH混合,产生不同数量的亚硝酸盐、N2O和NH3,且亚硝酸盐和N2O的含量与GSH成正比,NH3的含量与GSH成反比。在有氧条件下,氧的存在可能会使NO氧化生成能够与H2S反应的亚硝化物质,并形成作为中间产物的HSNO,HSNO进一步反应可以生成NO和HNO,可以恢复细胞中NO的含量,维持NO的动态平衡和生物学功能[23]。此外,用H2S直接取代HSNO,可生成HNO和HSSH,这也有力的支持了中间产物HNO的存在 [24]。H2S与过氧亚硝酸盐反应,可生成亚硫酰基硝酸盐(HS(O)NO),以此可作为NO供体。同时,H2S可与GSNO通过反硝化反应生成HSNO,HSNO可进一步生成NO和HNO,并且HSNO可自由地跨过细胞膜扩散,进一步行使其信号功能[23]。
3.2 H2S与NO作用于共同的靶分子除了发生化学反应外,H2S和NO也可作用于共同的靶分子,特别是含有巯基和金属离子的蛋白质分子,对其巯基分别进行硫巯基化和亚硝基化,继而对蛋白质分子,特别是酶蛋白的结构进行修饰,从而调节酶蛋白的活性,完成信号转换和传递[11-21]。在模式植物拟南芥中,蛋白组学的研究表明,大约2 330个蛋白(约占整个蛋白组的5%)可被硫巯基化修饰,927个蛋白可被亚硝基化修饰,可同时被硫巯基化和亚硝基化修饰的蛋白大约639个[11]。NO对蛋白质的翻译后修饰主要包括对含有半胱氨酸残基的蛋白质(如过氧化氢酶、抗坏血酸过氧化物酶、NADPH氧化酶等)和金属蛋白(如鸟苷酸环化酶、血红蛋白、顺乌头酸酶等)的亚硝基化和酪氨酸残基的硝基化(nitration)(如鸟苷酸环化酶、O-乙酰丝氨酸硫解酶、铁氧化还原蛋白-NADP氧化还原酶等)[17]。更深入的研究表明,H2S和NO可对硫代谢关键酶谷氨酰胺合成酶(Glutamine synthetase,GS)、糖代谢关键酶甘油醛3-磷酸脱氢酶(Glyceraldehyde-3- phosphate dehydrogenase,GAPDH)、乙烯(Ethylene,ETH)代谢关键酶1-氨基环丙烷1-羧酸合成酶[1-(Aminocarbonyl)-1-cyclopropanecarboxylic acid synthetase,ACS]和1-氨基环丙烷1-羧酸氧化酶[1-(Aminocarbonyl)-1- cyclopropane-carboxylic acid oxidase,ACO],以及活性氧(Reactive oxygen species,ROS)代谢关键酶过氧化氢酶(Catalase,CAT)、抗坏血酸过氧化物酶(Ascorbic acid peroxidase,APX)等进行翻译后修饰,继而调控相应的代谢过程[16-19]。
谷氨酰胺合成酶(Glutamine synthetase,GS)是谷氨酰胺(Glutamine,Gln)合成的关键酶,可将谷氨酸(Glutamate,Glu)和氨(Ammonia,NH3)转变为Gln,继而维持植物细胞中的Glu、Gln、NH3的动态平衡[25]。H2S可对GS进行翻译后修饰,即硫巯基化,抑制其活性,进而调节硫代谢过程[17-20]。许多研究表明,Glu和NH3是植物体内2种重要的第二信使,参与硫代谢和其他代谢过程。H2S信号的产生,可导致GS的抑制,继而促进Glu和NH3的积累,故将H2S信号转变为Glu信号和NH3信号2条信号通路[17-20, 25]。Glu信号可通过与谷氨酸受体类似蛋白(Glutamate receptor-like,GLR)结合,激活Ca2+通道,继而将Glu信号转变为Ca2+信号途径[17-20, 25]。NH3信号也可引发Ca2+信号级联下游的生物学事件[25]。
GAPDH和磷酸丙糖异构酶(Triosephosphate isomerase,TPI)是糖酵解的关键酶,前者催化3-磷酸甘油醛转变为1,3-二磷酸甘油酸;后者主要催化磷酸二羟丙酮(Dihydroxyacetone phosphate,DHAP)向3-磷酸甘油醛(3-phosphoglycerate,PGA)的转变,此反应是可逆反应[16]。H2S信号的引发,可导致GAPDH和TPI硫巯基化作用,继而激活其活性,促进糖酵解过程,从而减少或削弱另一个第二信使甲基乙二醛(Methylglyoxal,MG)的积累(MG是糖酵解代谢的副产物,特别是当TPI和GAPDH活性受到抑制后,其积累尤为显著),削弱MG信号途径[17]。相反,NO可引发GAPDH亚硝基化,从而抑制其活性,阻碍糖酵解过程,引发MG信号。这些暗示H2S和NO在糖酵解过程中的交互作用,继而调节MG信号途径。同样,苹果酸脱氢酶(Malic dehydrogenase,MDH)、乙醇酸氧化酶(Glycolate oxidase,GOX)和乳酸脱氢酶(Lactate dehydrogenase,LDH)的活性受H2S和NO调控,硝基化抑制MDH和GOX活性,而硫巯基化则激活MDH、丙酮酸脱氢酶(Pyruvate dehydrogenase,PDH)和LDH活性,从而推动糖代谢过程[18]。
此外,ETH是重要的气体信使,其代谢关键酶ACS和ACO也受H2S和NO调控。信号分子H2S和NO可竞争ACS和ACO上的巯基,使其发生硫巯基化作用或亚硝基化作用后,抑制其活性,从而抑制的ETH的合成,削弱ETH信号途径及相关的生理过程[19]。更有意思的是,已发生亚硝基化的靶蛋白(包括ACS和ACO),在H2S信号引发时,可将亚硝基化的ACS和ACO转变为硫巯基化的ACS和ACO,即基团-SNO转变为-SSH,同样可起抑制这两个酶活性的作用(图 3)[18-19]。
同样,抗氧化酶CAT、APX、谷胱甘肽还原酶(Glutathione reductase,GR)、单脱氢抗坏血酸还原酶(Monodehydroascorbate reductase,MDHAR)、脱氢抗坏血酸还原酶(Dehydroascorbate reductase,DHAR)、过氧化还原蛋白(Peroxiredoxin,Prxs)、谷胱甘肽硫S-转移酶(Glutathione S-transferase,GST)、超氧化物歧化酶(Superoxide dismutase,SOD)、NADPH氧化酶(NADPH oxidase,NOX)等是植物细胞内维持ROS动态平衡的关键酶,这些酶分别承担ROS的清除和产生,从而维持细胞中的ROS平衡[16-17]。此外,这些酶活性仍然受信号分子NO的修饰。当NO信号引发时,可导致这些酶发生亚硝基化。亚硝基化会抑制NOX和CAT活性,并激活APX、GR、DHAR、MDHAR、SOD、GST和苯丙氨酸裂解酶(Phenylalanine ammonia- lyase,PAL)[18-19]。另外,CAT、APX和NOX活性也受H2S调控,硫巯基化抑制CAT和NOX活性,而激活APX[11-16]。因此,H2S和NO通过转录后修饰(主要是硫巯基化和亚硝化)在维持植物细胞内ROS稳态中起着重要的作用。
此外,光合作用关键酶1,5-二磷酸核酮糖羧化/加氧酶(1,5-ribulose diphosphate carboxylation/oxygenase,Rubisco)和细胞凋亡关键酶半胱天冬蛋白酶(Metacaspase -9)的活性受NO的调控,亚硝基化可抑制二者的活性,从而减少植物的光合作用和细胞凋亡[19]。在小麦幼苗中,渗透胁迫可引发H2S信号,继而提高甜菜碱醛脱氢酶(Betaine aldehyde dehydrogenase,BADH)的活性,进一步提高甜菜碱的水平;而在玉米幼苗中,NO也可提高BADH活性,从而促进幼苗中甜菜碱的积累,最终提高植物的耐逆性[26]。以上结果表明,在逆境胁迫下,NO和H2S都可激活BADH活性,合成甜菜碱,暗示BADH可能是NO和H2S共同作用的靶分子之一。
3.3 H2S和NO对彼此代谢酶的调节 3.3.1 H2S对NO代谢酶的调控在黄瓜幼苗中,过量的硝酸盐对黄瓜幼苗有毒害作用,这种毒害作用可被外源H2S处理所缓解,并且这种缓解作用可能与H2S触发的MAPK/NO信号有关[27]。进一步的研究表明,在番茄幼苗中,H2S可激活NR活性,继而提高幼苗中NO水平,最终缓解过量的硝酸盐对幼苗的毒害作用,而H2S清除剂HT则降低NR活性,从而导致NO含量的减少[28],暗示H2S可调控NO产生酶NR的活性。此外,H2S可促进大麦根部NO的积累,继而通过调NO控离子平衡而缓解盐胁迫伤害,而NO清除剂cPTIO则消除H2S对大麦耐盐性胁迫的缓解作用[29]。最新研究表明,H2S可激活XOR活性,继而提高内源NO水平,最终调节生理过程[30]。这些实验暗示,H2S可通过调控NO代谢酶的活性,实现对NO信号的调控。
在气孔运动中,NO已被证实是H2S调控气孔运动的介导者。H2S供体NaHS和GYY4137处理,均可导致NO荧光水平小幅升高,表明这两种H2S供体,可刺激保卫细胞中NO的产生,或减少保卫细胞中NO的清除,从而增加保卫细胞中NO的含量[31]。更重要的是,当NaHS或GYY4137与脱落酸(Abscisic acid,ABA)同时处理时,其荧光强度明显低于ABA的独立作用,这表明NaHS或GYY4137可减少由ABA引起的NO的积累[31]。此外,H2S清除剂亚牛磺酸(Hypotaurine,HT)对NO的积累也有抑制作用[31]。
3.3.2 NO对H2S代谢酶的调控正如上所述,L-/D-DES、SiR、CAS、OAS-TL、碳酸酐酶(Carbonic anhydrase,CA)和CS是H2S代谢的关键酶。活体研究表明,NO处理可提高玉米幼苗中的H2S合成关键酶LCD的活性,继而提高玉米幼苗中H2S的水平,从而提高玉米幼苗的耐热性[32]。类似地,在H2O2诱导的玉米幼苗耐热性形成中,H2O2首先引发NO信号,继而诱导内源H2S的产生,最终诱发耐热性的形成[33]。这些暗示,在植物耐热性形成中,H2S在NO的下游发挥其信号分子作用。
渗透胁迫下,在小麦幼苗中,NO处理幼苗,可增强LCD、DCD和OAS-TL活性,从而引起H2S含量的增加和Cys的动态平衡[34]。此外,在渗透胁迫下,NO的积累可刺激下游信号分子H2S含量的增加,继而激活细胞的氧化防御系统,即APX、GR、过氧化物酶(Peroxidase,POD)、SOD和CAT的活性,继而降低氧化损伤[34]。
在镉胁迫下,外源施加NO供体SNP或H2S供体NaHS,均能改善镉胁迫下狗牙根的耐受性[35]。此外,NO诱发的内源H2S的积累和镉胁迫耐性被H2S合成抑制剂炔丙基甘氨酸(DL-propargylglycine,PAG)和清除剂HT所阻断[5]。类似地,NO清除剂2-(4-羟基-2-苯基-4,4,5,5-四甲基咪唑-1-氧基-3-氧化物(2-(4-carboxy-2-phenyl)-4,4,5,5-tetramethylinidazoline -1-oxyl-3-oxide,cPTIO)处理镉胁迫的植株,内源H2S含量明显降低[35]。以上结果表明,在镉胁迫耐性形成中,NO在H2S的上游发挥信号作用。
在番茄幼苗侧根生长的研究中,NO和H2S都参与番茄侧根的生长,而SNP与HT或PAG同时处理番茄幼苗,则抵消NO促进的侧根生长。NaHS和cPTIO同时处理番茄幼苗,则不影响NaHS对侧根生长的促进作用[36-37]。结果表明,H2S作用于NO的下游,促进番茄幼苗的侧根生长。
此外,在气孔运动中,ETH能提高LCD和DCD活性,进一步提高模式植物拟南芥保卫细胞中的H2S水平,继而激活NO合成关键酶NR的活性,从而提高保卫细胞中的NO含量,最终导致气孔的关闭,暗示在气孔运动中NO在H2S的下游发挥信号作用[38]。
3.4 H2S和NO调控其他信号途径除了上述化学反应、作用于共同的靶分子和调节彼此代谢酶外,H2S和NO的交互作用也可通过调节其它的信号途径来实现。在对草莓幼苗耐热性研究中,NaHS不仅可以诱导GSH和抗坏血酸(Ascorbate acid,AsA)合成酶基因的表达和对应抗氧化剂含量的提高,也可触发APX、CAT、SOD和GR的基因表达和对应抗氧化酶活性的增加,缓解高温胁迫下生物膜的过氧化产物丙二醛、H2O2和NO的积累,继而减少植株内NO的含量,最终提高草莓幼苗对高温胁迫的抵抗能力[39],暗示H2S和NO可共同调控植物耐热性形成途径。研究也表明,在玉米幼苗和烟草细胞中,H2S和NO分别处理都可提高幼苗[32, 40-41]和细胞[42]的耐热性,并且这种耐热性的获得与抗氧化系统活力的增强密切相关,也进一步支持H 2S和NO可共同调控植物耐热性形成途径的猜想。此外,H2S和NO都可引发Ca2+、ROS、cAMP、MAPK等信号,进一步调控植物的生长发育及响应和适应环境胁迫[27, 43-46]。
4 展望作为重要信号分子的H2S和NO,对植物生长发育和环境胁迫的响应和适应,起着重要的作用。在这些生理过程中,不仅涉及H2S和NO信号的独立作用,而且涉及二者的交互作用。H2S和NO信号的交互作用常常表现为累加作用或拮抗作用。这种累加或拮抗作用,通常通过H2S与NO的反应、作用于共同的靶分子、调节彼此代谢酶及其它信号途径等来实现。H2S和NO信号的交互作用主要来源于活体试验和离体试验,但二者的交互作用在活体内和离体条件下,是否完全一致,需要进一步的证实。此外,H2S和NO信号的交互作用对植物生长发育及环境胁迫的响应和适应的生理生化及分子机理,有待于进一步阐明。再者,随着组学(包括基因组、转录组、蛋白组、代谢组和表型组等)和测序技术的发展,H2S、NO及二者的交互作用引发的转录组、蛋白组、代谢组和表型组的响应,需要进一步的解析。虽然许多研究表明,H2S和NO可通过多条途径发生交互作用,但由于信号途径的复杂性和信号网络的形成,信号分子之间的交互作用在不同植物、不同植物器官类型、不同环境条件下、不同的信号强度,以及植物的不同环境经历,可能表现不同的累加或拮抗效应,这些仍需进一步剖析。
| [1] |
Corpas FJ. Hydrogen sulfide :a new warrior against abiotic stress[J]. Trends in Plant Science, 2019, 24: 983-988. DOI:10.1016/j.tplants.2019.08.003 |
| [2] |
Hancock JH. Hydrogen sulfide and environmental stresses[J]. Environmental and Experimental Botany, 2019, 161: 50-56. DOI:10.1016/j.envexpbot.2018.08.034 |
| [3] |
Hancock JT, Whiteman M. Hydrogen sulfide signaling :interactions with nitric oxide and reactive oxygen species[J]. Annals of New York Academy of Sciences, 2016, 1365: 5-14. DOI:10.1111/nyas.12733 |
| [4] |
Li ZG, Min X, Zhou ZH. Hydrogen sulfide :a signal molecule in plant cross-adaptation[J]. Frontiers in Plant Science, 2016, 7: 1621. DOI:10.3389/fpls.2016.01621 |
| [5] |
Buadouin E, Hancock JT. Nitric oxide signaling in plants[J]. Frontiers in Plant Science, 2014, 4: 553. |
| [6] |
Mukherjee S. Recent advancements in the mechanism of nitric oxide signaling associated with hydrogen sulfide and melatonin crosstalk during ethylene-induced fruit ripening in plants[J]. Nitric Oxide, 2019, 82: 25-34. DOI:10.1016/j.niox.2018.11.003 |
| [7] |
Sami F, Faizan M, Faraz A, et al. Nitric oxide-mediated integrative alterations in plant metabolism to confer abiotic stress tolerance, NO crosstalk with phytohormones and NO-mediated post translational modifications in modulating diverse plant stress[J]. Nitric Oxide, 2018, 73: 22-38. DOI:10.1016/j.niox.2017.12.005 |
| [8] |
Santolini J, Andre F, Jeandroz S, et al. Nitric oxide synthase in plants :Where do we stand?[J]. Nitric Oxide, 2017, 63: 30-38. DOI:10.1016/j.niox.2016.09.005 |
| [9] |
Kolupaev YE, Karpets YV, Beschasniy SP, et al. Gasotransmitters and their role in adaptive reactions of plant cells[J]. Cytology and Genetics, 2019, 53: 392-406. DOI:10.3103/S0095452719050098 |
| [10] |
Yamasaki H, Cohen MF. Biological consilience of hydrogen sulfide and nitric oxide in plants :gases of primordial earth linking plant, microbial and animal physiologies[J]. Nitric Oxide, 2016, 55. DOI:10.1016/j.niox.2016.04.002 |
| [11] |
Aroca A, Benito JM, Gotor C, et al. Persulfidation proteome reveals the regulation of protein function by hydrogen sulfide in diverse biological processes in Arabidopsis[J]. Journal of Experimental Botany, 2017, 68: 4915-4927. DOI:10.1093/jxb/erx294 |
| [12] |
Aroca A, Gotor C, Romero LC. Hydrogen sulfide signaling inplants :emerging roles of protein persulfidation[J]. Frontiers in Plant Science, 2018, 9: 1369. DOI:10.3389/fpls.2018.01369 |
| [13] |
Aroca A, Serna A, Gotor C, et al. S-sulfhydration :a cysteine posttranslational modification in plant systems[J]. Plant Physiology, 2015, 168: 334-342. DOI:10.1104/pp.15.00009 |
| [14] |
Ju Y, Fu M, Stokes E, et al. H2S-mediated protein S-sulfhydration : a prediction for its formation and regulation[J]. Molecules, 2017, 22: 1334. DOI:10.3390/molecules22081334 |
| [15] |
Kimura H. Hydrogen sulfide and polysulfides as signaling molecules[J]. Proceedings of the Japan Academy, Series B, 2015, 91: 131-159. DOI:10.2183/pjab.91.131 |
| [16] |
Lamotte O, Bertoldo JB, Besson-Bard A, et al. Protein S-nitrosylation :specificity and identification strategies in plants[J]. Frontiers in Chemistry, 2015, 2: 114. DOI:10.1039/C4QO00278D |
| [17] |
Astier J, Lindermayr C. Nitric oxide-dependent posttranslational modification in plants :an update[J]. International Journal of Molecular Science, 2012, 13: 15193-15208. DOI:10.3390/ijms131115193 |
| [18] |
Feng J, Chen L, Zuo J. Protein S-Nitrosylation in plants :current progresses and challenges[J]. Journal of Integrative Plant Biology, 2019, 61: 1206-1223. DOI:10.1111/jipb.12780 |
| [19] |
Huang D, Huo J, Zhang J, et al. Protein S-nitrosylation in programmed cell death in plants[J]. Cellular and Molecular Life Sciences, 2019, 76: 1877-1887. DOI:10.1007/s00018-019-03045-0 |
| [20] |
Ortega-Galisteo AP, Rodriguez-Serrano M, Pazmino DM, et al. S-nitrosylated proteins in pea(Pisum sativum L.)leafperoxisomes :changes under abiotic stress[J]. Journal of Experimental Botany, 2012, 63: 2089-2103. DOI:10.1093/jxb/err414 |
| [21] |
Zhang J, Liao W. Protein S-nitrosylation in plant abiotic stresses[J]. Functional Plant Biology, 2020, 47: 1-10. DOI:10.1071/FP19071 |
| [22] |
Bruce KS. Potential biological chemistry of hydrogen sulfide(H2S) with the nitrogen oxides[J]. Free Radical Biology and Medicine, 2013, 55: 1-7. DOI:10.1016/j.freeradbiomed.2012.11.005 |
| [23] |
Ivanovic-Burmazovic I, Filipovic MR. Saying NO to H2S :a story of HNO, HSNO, and SSNO-[J]. Inorganic Chemistry, 2019, 58: 4039-4051. DOI:10.1021/acs.inorgchem.8b02592 |
| [24] |
Kimura H. Hydrogen polysulfide(H2Sn)signaling along with hydrogen sulfide(H2S)and nitric oxide(NO)[J]. Journal of Neural Transmission(Vienna), 2016, 123(11): 1235-1245. DOI:10.1007/s00702-016-1600-z |
| [25] |
Qiu XM, Sun YY, Ye XY, et al. Signaling role of glutamate in plants[J]. Frontiers in Plant Science, 2020, 10: 1743. DOI:10.3389/fpls.2019.01743 |
| [26] |
Ullah S, Kolo Z, Egbichi I, et al. Nitric oxide influences glycine betaine content and ascorbate peroxidase activity in maize[J]. South African Journal of Botany, 2016, 105: 218-225. DOI:10.1016/j.sajb.2016.04.003 |
| [27] |
Qi Q, Guo Z, Liang Y, et al. Hydrogen sulfide alleviates oxidative damage under excess nitrate stress through MAPK/NO signaling in cucumber[J]. Plant Physiology and Biochemistry, 2019, 135: 1-8. DOI:10.1016/j.plaphy.2018.11.017 |
| [28] |
Liang Y, Zheng P, Li S, et al. Nitrate reductase-dependent NO production is involved in H2S-induced nitrate stress tolerance in tomato via activation of antioxidant enzymes[J]. Scientia Horticulturae, 2018, 229: 207-214. DOI:10.1016/j.scienta.2017.10.044 |
| [29] |
Chen J, Wang WH, Wu FH, et al. Hydrogen sulfide enhances salt tolerance through nitric oxide-mediated maintenance of ion homeostasis in barley seedling roots[J]. Scientific Reports, 2015, 5: 12516. DOI:10.1038/srep12516 |
| [30] |
Pardue S, Kolluru GK, Shen X, et al. Hydrogen sulfide stimulates xanthine oxidoreductase conversion to nitrite reductase and formation of NO[J]. Redox Biology, 2020, 34: 10447. |
| [31] |
Lisjak M, Srivastava N, Teklic T, et al. A novel hydrogen sulfide donor causes stomatal opening and reduces nitric oxide accumulation[J]. Plant Physiology and Biochemistry, 2010, 48(12): 931-935. DOI:10.1016/j.plaphy.2010.09.016 |
| [32] |
Li ZG, Yang SZ, Long WB, et al. Hydrogen sulfide may be a novel downstream signal molecule in nitric oxide-induced heat tolerance of maize(Zea mays L.)seedlings[J]. Plant Cell and Environments, 2013, 36: 1564-1572. DOI:10.1111/pce.12092 |
| [33] |
Li ZG, Luo LJ, Sun YF. Signal crosstalk between nitric oxide and hydrogen sulfide may be involved in hydrogen peroxide induced thermotolerance in maize seedlings[J]. Russian Journal of Plant Physiology, 2015, 62: 507-514. DOI:10.1134/S1021443715030127 |
| [34] |
Khan MN, Mobin M, Abbas ZK, et al. Nitric oxide-induced synthesis of hydrogen sulfide alleviates osmotic stress in wheat seedlings through sustaining antioxidant enzymes, osmolyte accumulation and cysteine homeostasis[J]. Nitric Oxide, 2017, 68: 91-102. DOI:10.1016/j.niox.2017.01.001 |
| [35] |
Shi H, Ye T, Chan Z. Nitric oxide-activated hydrogen sulfide is essential for cadmium stress response in bermudagrass(Cynodon dactylon(L). Pers[J]. Plant Physiology and Biochemistry, 2014, 74: 99-107. DOI:10.1016/j.plaphy.2013.11.001 |
| [36] |
李艳军.番茄硫化氢合成酶基因OASTL/LCD的克隆及硫化氢介导一氧化氮诱导番茄幼苗侧根发育研究[D].南京: 南京农业大学, 2014. Li YJ. Molecular cloning of a novel OASTL/LCD gene from tomato and hydrogen sulfide is involved in itric oxide-induced tomato lateral root formation[D]. Nanjing : Nanjing Agricultural University, 2014. |
| [37] |
吴雪霞, 朱月林, 朱为民, 等. 外源一氧化氮对NaCl胁迫下番茄幼苗生理影响[J]. 中国农业科学, 2006, 39(3): 579-581. Wu XX, Zhu YL, Zhu WM, et al. Physiological effects of exogenous nitric oxide intomato seedlings under NaCl stress[J]. Scientia Agricultura Sinica, 2006, 39(3): 579-581. |
| [38] |
Liu J, Hou L, Liu G, et al. Hydrogen sulfide induced by nitric oxide mediates ethylene-induced stomatal closure of Arabidopsis thaliana[J]. Chinese Science Bulletin, 2011, 56: 3547-3553. DOI:10.1007/s11434-011-4819-y |
| [39] |
Christou A, Filippou P, Manganaris GA, et al. Sodium hydrosulfide induces systemic thermotolerance to strawberry plants through transcriptional regulation of heat shock proteins and aquaporin[J]. BMC Plant Biology, 2014, 14: 42. DOI:10.1186/1471-2229-14-42 |
| [40] |
Li ZG, Yi XY, Li YT. Effect of pretreatment with hydrogen sulfide donor sodium hydrosulfide on heat tolerance in relation to antioxidant system in maize(Zea mays)seedlings[J]. Biologia, 2014, 69: 1001-1009. |
| [41] |
Li ZG, Long WB, Yang SZ, et al. Involvement of sulfhydryl compounds and antioxidant enzymes in H2S-induced heat tolerance in tobacco(Nicotiana tabacum L.)suspension-cultured cells[J]. Plant Physiology, 2015, 51: 428-437. |
| [42] |
Li ZG, Gong M, Xie H, et al. Hydrogen sulfide donor sodium hydrosulfide-induced heat tolerance in tobacco(Nicotiana tabacum L)suspension cultured cells and involvement of Ca2+ and calmodulin[J]. Plant Science, 2012, 185. |
| [43] |
Lamotte O, Courtois C, Dobrowolska G, et al. Mechanisms of nitricoxide-induced increase of free cytosolic Ca2+ concentration in Nicotiana plumbaginifolia cells[J]. Free Radical Biology and Medicine, 2006, 40: 1369-1376. DOI:10.1016/j.freeradbiomed.2005.12.006 |
| [44] |
Honda K, Yamada N, Yoshida R, et al. 8-Mercapto-cyclic GMP mediates hydrogen sulfide-induced stomatal closure in Arabidopsis[J]. Plant and Cell Physiology, 2015, 56: 1481-1489. DOI:10.1093/pcp/pcv069 |
| [45] |
Karpets YV, Kolupaev YE, Yastreb TO. Signal mediators at induction of heat resistance of wheat plantlets by short-term heating[J]. The Ukrainian Biochemical Journal, 2015, 87(6): 104-12. DOI:10.15407/ubj87.06.104 |
| [46] |
周志豪, 王月, 闵雄, 等. 硫化氢信号与其它信号交互作用调控植物的耐旱性[J]. 生物技术通报, 2017, 33(6): 1-9. Zhao ZH, Wang Y, Min X, et al. Crosstalk between hydrogen sulfide signal and other signals regulates drought tolerance of plants[J]. Biotechnology Bulletin, 2017, 33(6): 1-9. |




