杉木人工林已成为亚热带森林的重要组成部分, 它具有可持续的自然更新能力, 是决定杉木林群落演替方向和维持杉木林大面积存在的基础[1], 杉木是我国南方重要的速生用材树种, 广泛分布于我国17个省份[2]。由于杉木树干通直, 不翘不裂, 材质优良, 是房屋建造和制作家具的上等木材。全国第八次森林资源清查结果表明, 杉木林面积达1.096×107 hm2, 木材蓄积量为7.260×108 m3, 分别占乔木林总面积和木材总蓄积量的6.66%和4.91%[2]。杉木木材用量占我国木材总用量的1/3左右[3-4]。
在我国杉木种植广泛的地区, 也是土壤中营养元素缺乏的地方, 尤其是有效磷的含量。目前缺磷的现状严重的已经严重影响了植物的生长发育[5], 植物缺乏磷时, 导致植物叶绿素减少, 植物变得矮小等。除此之外, 磷元素也是影响木质素生物合成的因素, 王艳丽等[6]发现, 烟草木质素的含量和磷浓度显著性相关, 磷浓度越高木质素含量越高, 说明磷影响了烟草纤维素和木质素含量的比例。于琳等[7]发现磷肥能够使得亚麻茎杆增粗, 促进纤维素细胞数量增加, 有利于纤维素束的形成。在木本植物研究方面, 磷元素与木质素生物合成的关系还比较少, Thomas等[8]研究发现, 桉树在磷元素缺乏的情况下, 其木质素的生物合成受到严重了抑制。但是磷影响木质素生物合成的分子机制在很大程度上仍不清楚。
KptA/Tpt1是一类磷酸转移酶[9], 是催化ADP-核糖基化ART超级家族中的H-H-h家族的成员[10], 通常存在于编码该家族的生物体的单一个体中, KptA/Tpt1在真核细胞中有很强的保守序列, 在细菌群中KptA/Tpt1可以修饰RNA以外的底物[11]。研究发现, 在真核生物tRNA剪接过程中, KptA/Tpt1将tRNA 2’-磷酸转移到NAD+上[12], 释放出成熟的tRNA和形成ADP-核糖1’-2’环磷酸(Appr > p)[13]。然而, KptA/Tpt1蛋白的功能具有生物差异性, 因此不同生物的KptA/Tpt1蛋白调控的网络机制需要进一步的挖掘。在杉木中, 磷酸转移酶KptA/Tpt1>是否能调控木质素的合成尚未明晰, 因此本论文克隆了杉木磷酸转移酶ClKptA/Tpt1基因, 解析杉木ClKptA/Tpt1基因的表达是否受磷调控, 进而影响木质素的生物合成, 为杉木育种以及合理施肥提供理论依据。
1 材料与方法 1.1 材料一年生的杉木茎材料采自实验室盆栽的杉木, 大肠杆菌DH5α和BL21 star(DE3), 原核表达载体pCold-TF均为本实验室保存。限制性内切酶和T4 DNA连接酶均购自TaKaRa公司。
1.2 方法 1.2.1 RNA的提取及其逆转录用Invitrogen公司的RNA提取试剂盒提取了杉木茎的总RNA, 然后用(TaKaRa)公司的逆转录试剂盒逆转录成cDNA。
1.2.2 ClKptA/Tpt1基因克隆根据杉木转录组测得的序列, 采用Primer 5.0引物设计软件设计出扩增磷酸转移酶基因ClKptA/Tpt1的全长CDS的引物序列, 并在5’端和3’带上BamH Ⅰ和Hind Ⅲ两种酶的酶切位点。以上述逆转录后cDNA为模板, 进行PCR扩增, 1%琼脂糖凝胶电泳观察结果。PCR反应体系为: 10×PCR buffer 2 µL, ddH2O 14 µL, dNTPs 2 µL, 上下游引物各0.5 µL, rTaq聚合酶0.5 µL, cDNA 0.5 µL, 总体积20 µL。PCR反应条件: 94℃ 5 min; 94℃ 30 s, 66℃ 30 s, 72℃ 1 min, 35个循环; 72℃ 5 min, 4℃保存。
1.2.3 磷酸转移酶基因ClKptA/Tpt1生物信息学分析在NCBI中下载已报道物种KptA/Tpt1的氨基酸序列, 应用MEGA5.0软件构建了ClKptA/Tpt1与已报道物种KptA/Tpt1的系统进化树。用GENEDOC软件对已报道物种KptA/Tpt1和ClKptA/Tpt1的氨基酸序列进行对比分析。用TMHMM Server v.2.0在线分析软件分析了ClKptA/Tpt1的跨膜结构。用SWISS-MODEL工具预测了ClKptA/Tpt1蛋白的三级结构。
1.2.4 表达载体的构建PCR产物经胶回收后用BamH I和Hind III两种酶进行双酶切, 同时将pCold-TF载体用BamH I和Hind III两种酶进行双酶切, 酶切后用天根生物技术有限公司(TIANGEN)的回收试剂盒纯化, 将纯化得到的pCold载体和PCR产物用T4 DNA连接酶4℃连接过夜。将连接产物通过热激转化的方法转化到DH5α感受态中, 在转化后的产物中加入LB液体培养基在37℃震荡培养箱中170 r/min摇45 min, 6 000 r/min离心1 min后, 倒掉上清液, 取200 µL涂在含100 µg/mL氨苄固体培养基上, 37℃培养过夜。
1.2.5 磷酸转移酶基因ClKptA/Tpt1原核表达工程菌的获得挑出阳性克隆菌斑, 接种于含有100 µg/mL的氨苄液体培养基中, 37℃培养过夜, 用天根(TIANGEN)质粒提取试剂盒提取质粒, 将质粒转化到宿主菌BL21 star(DE3)中, 涂布于含有100 µg/mL氨苄青霉素LB固体培养基上, 37℃倒置过夜培养, 随机挑选单菌落, 进行菌落PCR鉴定。
1.2.6 目的蛋白的诱导表达将阳性工程菌在含有(100 µg/mL)的氨苄青霉素LB液体培养基中培养至OD600值达到0.6左右时, 加入终浓度为0.1 mol/L ITPG, 在15℃诱导24 h, 超声处理后取上清液进行SDS-PAGE电泳鉴定表达情况。
IPTG浓度的优化选定诱导时间为24 h, 温度为15℃。加入使终浓度分别为0、0.4、0.6、0.8 mmol/L IPTG诱导表达, SDS-PAGE电泳鉴定表达情况。
1.2.7 磷酸转移酶基因ClKptA/Tpt1表达模式研究用Invitrogen公司的RNA提取试剂盒分别提取一年生杉木根、茎、叶、花、果的总RNA, 然后用TaKaRa公司的逆转录试剂盒逆转录成cDNA, 以上述不同的cDNA为模板做RT-PCR, 反应体系为: SYBR premis E×Taq(2%)5 µL, 上下游引物各0.2 µL, cDNA 0.8 µL, ddH2O 3.8 µL, 总体积为10 µL。反应程序: 95℃ 30 s; 95℃ 10 s, 60℃ 30 s, 40个循环; 95℃ 15 s, 60℃ 1 min; 95℃ 15 s。
分别以不同浓度的磷处理一年生杉木苗, 处理浓度分别为: 0.067 mmol/L、0.133 mmol/L、0.20 mmol/L, 处理时间间隔为60 d, 提取不同浓度磷处理后的杉木RNA, 逆转录成cDNA做RT-qPCR, 反应体系同上。
1.2.8 木质素的提取用Klason法测木质素含量, 切取一年生杉木的下面主茎, 烘干后研磨成均匀粉末, 过筛(40-60 µm)。甲醇提取后, 烘干, 取约200 mg样品, 用72% H2SO430℃抽提1 h, 加入112 mL H2O沸煮1 h, 注意保持总体积恒定, 该混合液经(40-60 µm)筛过滤, 并用500 mL热水冲洗, 烘干后称重。木质素含量以最后获得木质素占原始样品重量的百分数计算[14]。
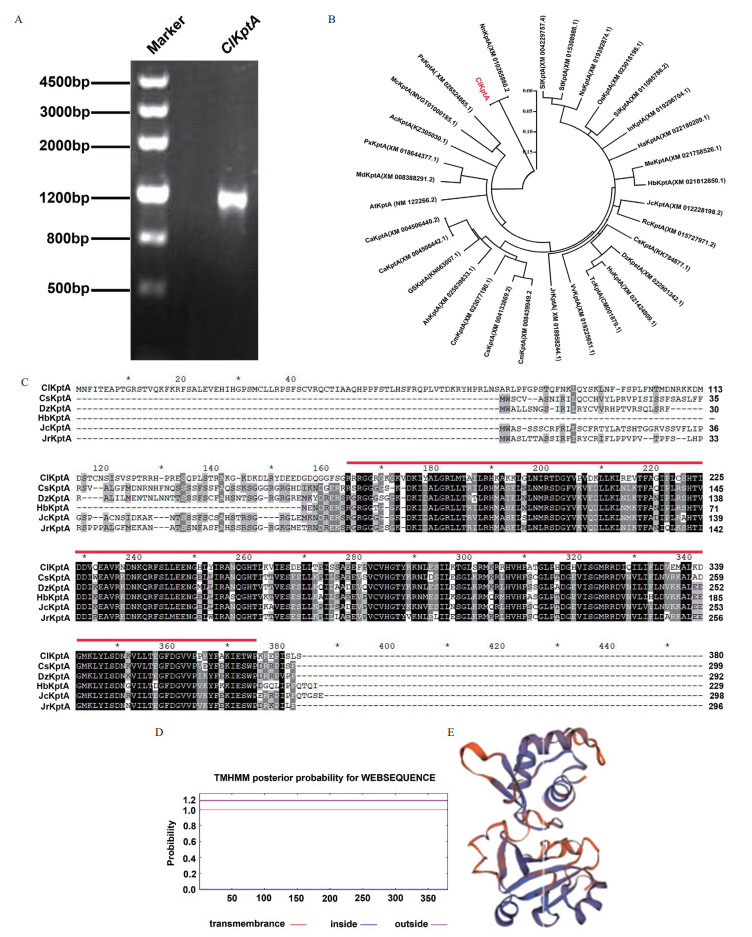
2 结果 2.1 ClKptA/Tpt1的克隆与生物信息学分析提取一年生杉木茎的总RNA, 逆转录成cDNA。以该cDNA为模板, 经PCR扩增和电泳检测, 得到大小1 100 bp左右的特异性条带(图 1-A), 说明克隆得到了目的基因ClKptA/Tpt1。胶回收ClKptA/Tpt1的PCR产物, 用BamHI和HindIII酶切ClKptA/Tpt1的PCR产物和pCold-TF载体, 采用酶切连接的方式将PCR产物和pCold-TF载体连接成重组质粒, 将重组质粒转化大肠杆菌DH5α, 涂布于含有氨苄青霉素(100 µg/mL)LB固体培养基中37℃过夜培养, 对长出的菌斑进行菌液PCR, 经琼脂糖凝胶电泳检测后, 有1 100 bp左右的目的基因条带, 既为阳性克隆菌斑。挑选3个阳性克隆送去上海生工生物工程有限公司测序。测序结果显示ClKptA/Tpt1的CDS长1 143 bp。将序列正确的ClKptA/Tpt1用primer primer 5.0翻译成氨基酸序列, 总共编码380个氨基酸。用MEGA 5.0软件构建ClKptA/Tpt1和已报道物种KptA/Tpt1氨基酸序列的系统进化树, KptA/Tpt1进化树分析表明, 杉木的ClKptA/Tpt1氨基酸亲缘性与荷花的KptA/Tpt1相似性最高, 而与番茄的KptA/Tpt1相似性最低(图 1-B)。利用GENEDOC软件对比ClKptA/Tpt1与已报道物种KptA/Tpt1氨基酸序列, 研究结果表明ClKptA/Tpt1的氨基酸序列与其它物种都有相同的保守序列NADAR domain(图 1-C)。蛋白的跨膜区分析结果分析得到ClKptA/Tpt1不存在跨膜氨基酸(图 1-D), 利用SWISS-MODEL在线软件对ClKptA/Tpt1蛋白三级结构进行预测。结果发现ClKptA/Tpt1主要由α链和β链组成, 都含有配体, 但是配体的数量不同(图 1-E)。
|
| A:ClKptA/Tpt1基因的克隆; B:ClKptA/Tpt1与其他物种的KptA/Tpt1进化关系, 图中标红的是目的基因ClKptA/Tpt1; C:不同物种KptA/Tpt1蛋白的氨基酸序列对比, 其中红线部分代表的是NADAR domain所在的区域; ClKptA/Tpt1:杉木(C. lanceolata); CsKptA/Tpt1:橙子(Citrus sinensis); DrKptA/Tpt1:榴莲(Durio zibethinus Murr); HbKptA/Tpt1:橡胶树(Hevea brasiliensis); JcKptA/Tpt1:麻风树(Jatropha curcas); JrKptA/Tpt1:核桃(Juglans regia); D:ClKptA/Tpt1氨基酸跨膜预测; E:ClKptA/Tpt1蛋白三级结构的预测 图 1 ClKptA/Tpt1的克隆与生物信息学分析 |
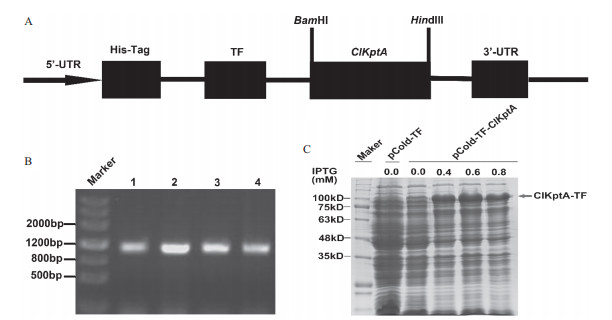
将上述测序结果与之前已有序列进行比对分析完全相同, 说明已经成功构建了杉木磷酸转移酶ClKptA/Tpt1原核表达载体, 对测序正确的菌株进行扩大培养, 用质粒提取试剂盒提取质粒, 转化大肠杆菌BL 21 star(DE3)菌株的感受态细胞, 涂布于含有氨苄青霉素(100 µg/mL)的LB固体培养基, 37℃培养过夜, 对长出的菌斑进行菌液PCR, 能看到1 100 bp左右的目的条带(图 2-B), 说明重组质粒已经成功转入了原核表达菌株BL 21 star(DE3)中。将阳性工程菌在含有(100 µg/mL)的氨苄青霉素LB液体培养基中培养至OD600值达到0.6左右时, 加入终浓度分别为0.0、0.4、0.6、0.8 mmol/L ITPG, 在15℃诱导24 h, 超声处理后取上清液进行SDS-PAGE电泳检测。结果显示, 在超声波破碎后的液体中含有大量的目的蛋白, 与pCold-TF空载体相比, 在大约100 kD处有大量的蛋白富集(图 2-C), 图 2-C中箭头标注的位置就是目的蛋白的富集区。
|
| A :pCold-TF原核表达载体结构示意图; B : 1-5为5个不同的单克隆; C :诱导ClKptA/Tpt1基因的蛋白表达 图 2 ClKptA/Tpt1的原核表达 |
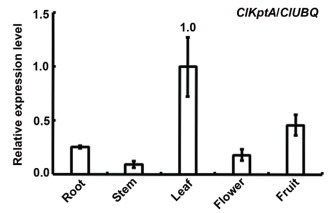
用Invitrogen公司的RNA提取试剂盒提取了杉木根、茎、叶、花、果的RNA, RT-qPCR结果显示, ClKptA/Tpt1基因在杉木叶中的表达量最高, 其次是果中的表达量, 而在茎中的表达量最低(图 3)。
|
| 图 3 ClKptA/Tpt1基因的表达模式检测 |
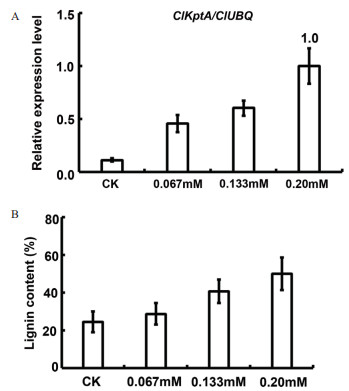
分别用0.0、0.067、0.133、0.20 mmol/L不同浓度的磷处理杉木, 每组浓度设计3组平行组, 提取不同磷浓度处理下的杉木叶片RNA, 逆转录成cDNA, 利用RT-qPCR技术分析磷处理下ClKptA/Tpt1基因的表达量。结果表明, 在0.0-0.20 mmol/L浓度范围内, ClKptA/Tpt1基因的表达量随着磷浓度的增加而增加(图 4-A), 说明磷在某种程度上调控了ClKptA/Tpt1基因的表达。通过Klason法测定木质素含量。结果表明, 在0-0.20 mmol/L不同磷浓度处理下, 杉木木质素的含量也出现了上升的趋势(图 4-B)。综上, 说明磷调控了ClKptA/Tpt1基因的表达量, 进而影响了杉木木质素的生物合成。
|
| A :不同磷浓度处理下ClKptA/Tpt1基因在杉木叶中的表达量; B :不同浓度磷处理下杉木木质素含量测定 图 4 ClKptA/Tpt1基因的表达与木质素合成的关系 |
从ART超级家族进化的历程来看, KptA/Tpt1基因家族是一类独特的RNA处理系统的组成部份, 从原核到生物到真核生物普遍存在[15]。ART超级家族同时促进对ADP-核糖基化在分子水平上的了解。但是, 随着生物学的不断发展进步, 近几年的研究已经提出了新的问题。首先, 除了通过序列和结构分析确定新的ART家族成员之外, 要挖掘ADP-核糖基化过程中蛋白识别的机制, 以及激活相关信号通路中的下游事件。其次, KptA/Tpt1酶蛋白在不同物种中的功能差异性目前还不清楚。
蛋白质的空间结构决定蛋白的功能, 因此, 本论文通过原核表达的方法在大肠杆菌中对该基因进行了蛋白表达, 其分子量为55.5 kD, 该实验表明IPTG诱导浓度对蛋白的表达有一定的影响, 本实验IPTG诱导的最适浓度为0.6 mmol/L。对蛋白序列进行了进化树的构建和蛋白跨膜结构以及蛋白三级结构的预测, 得到初步的结果表明该蛋白不具有跨膜氨基酸, 三级结构主要以α-螺旋、β-折叠的方式存在。通过进化树的比对, 得到该基因氨基酸序列与荷花该基因的氨基酸序列亲缘关系最近, 与番茄该基因氨基酸序列的亲缘关系最远。蛋白序列对比分析发现ClKptA/Tpt1与其他物种的KptA/Tpt1都含有NADAR结构域, 这与原核生物大肠杆菌和病毒的该蛋白具有高度的相似性[16-17], 说明该基因在进化上的保守型。通过对该蛋的表达和分析为后续实验奠定了理论基础。
杉木作为重要的速生用材树种[18-20], 解析木质素生物合成的分子机制具有重要的意义, 但磷对杉木木质素的生物合成的分子机制目前仍不清楚。因此, 本研究通过RT-qPCR分析了ClKptA/Tpt1基因表达模式。结果发现, ClKptA/Tpt1基因在杉木叶中的表达量最高, 在茎中的表达量最低。用不同浓度的磷处理杉木苗, 利用RT-qPCR分析发现, 磷处理后, ClKptA/Tpt1基因在杉木叶中的表达量随着磷浓度的增加而增加, 说明磷调控了该基因在杉木叶中的表达。通过测定木质素含量发现, 随着磷浓度的增加木质素的含量也增加, 说明杉木木质素的生物合成与ClKptA/Tpt1基因有密切的关系。
ClKptA/Tpt1基因怎样影响木质素的生物合成目前仍未完全明晰。但有关研究发现, 拟南芥KptA/Tpt1突变体在叶绿体磷酸三糖转运体(TPT)中存在缺陷[21], KptA/Tpt1基因的突变降低了磷酸三糖转运蛋白的活性, 导致淀粉含量的积累[21]。Kauder等[22]对具有反义抑制三磷酸转运蛋白(KptA/Tpt1-plants)的转基因马铃薯植株与野生型植株进行了比较, 结果表明转基因植物的淀粉含量高于野生型, 但固定CO2含量不变, 说明KptA/Tpt1基因的功能与马铃薯淀粉的转运有关。此外, Englert等[23]发现KptA/Tpt1的N端含有叶绿体转运信号肽, 但尚不清楚是否在叶绿体和质体中, 或KptA/Tpt1蛋白酶仅附着于线粒体外膜或被引入这些细胞器的基质中。在藻类中, 三棱藻的KptA/Tpt1作为质体序列参与叶绿体基因的剪接编码过程[24]。然而, 碳水化合物与木质素生物合成呈负显著性因素, 碳水化合物的增加降低木质素的含量[25]。因此, ClKptA/Tpt1基因可能通过影响杉木叶绿体磷酸三糖转运体蛋白的活性, 进而影响了杉木茎中木质素的生物合成。
4 结论本研究克隆了杉木磷酸转移酶基因ClKptA/Tpt1, 获得了该基因的全长CDS序列。同时对该基因进行的原核表达, 获得了其体外诱导表达蛋白。表达模式分析发现该基因在杉木叶中的表达量最高。此外, 在一定范围内的磷处理下, ClKptA/Tpt1的表达量与磷浓度成正比, 杉木茎中木质素的含量也随着磷浓度的增加而增加, 磷可调控该基因的表达进而影响杉木木质素的生物合成。
| [1] |
朱晨曦, 刘志刚, 于洋洋, 等. 杉木人工林种子雨组成和季节动态[J]. 应用生态学报, 2018, 29(5): 1515-1522. Zhu CX, Liu ZG, Yu YY, et al. Composition and seasonal dynamics of seed rain in Chinese fir(Cunninghamia lanceolata)plantation[J]. Chinese Journal of Applied Ecology, 2018, 29(5): 1515-1522. |
| [2] |
魏晓晓, 王士亚, 陈爱玲, 等. 不同化感型杉木无性系对连栽地的生理响应[J]. 森林与环境学报, 2017, 37(1): 22-28. Wei XX, Wang SY, Chen AL, et al. Physilolgical response of different allelopathic types of Chinese fir clones to continuous cropping obstacles soil[J]. Journal of Forest and Environment, 2017, 37(1): 22-28. |
| [3] |
Humphreys JM, Chapple C. Rewriting the lignin roadmap[J]. Current Opinion Plant Biol, 2002, 5(3): 224-229. DOI:10.1016/S1369-5266(02)00257-1 |
| [4] |
Li M, Su SS, Wu PF, et al. Transcriptome characterization of the Chinese fir(Cunninghamia lanceolata Lamb. Hook.)and expression analysis of candidate phosphate transporter genes[J]. Forests, 2017, 8(420): 2-17. |
| [5] |
张艺严. 我国土壤中磷元素利用现状及生物措施[J]. 中国农业信息, 2013(15): 106. Zhang YY. Utilization status and biological measures of phosphorus in soil in China[J]. China Agricultural Information, 2013(15): 106. |
| [6] |
王艳丽, 刘国顺. 磷肥用量对烟叶细胞壁物质含量和烟叶厚度的影响[J]. 烟草科技, 2005, 50(5): 22-26. Wang YL, Liu GS. Effects of phosphorus fertilizer rates on cell wall matter content and thickness of tobacco leaf[J]. Tobacco Science & Technology, 2005, 50(5): 22-26. |
| [7] |
于琳.氮磷钾肥对亚麻纤维产量及品质的影响[D].哈尔滨: 东北农业大学, 2008. Yu L. Effect of N P K on yield and quality[D]. Harbin: Northeast Agricultural University, 2008. |
| [8] |
Thomas DS, Montagu KD, Conroy JP. Why does phosphorus limitation increase wood density in Eucalyptus grandis seedlings?[J]. Tree Physiology, 2006, 26(1): 35-42. |
| [9] |
Belenky P, Bogan KL, Brenner C. NAD+ metabolism in health and disease[J]. Trends Biochem Sci, 2007, 32(1): 12-19. DOI:10.1016/j.tibs.2006.11.006 |
| [10] |
Boyd EF. Bacteriophage-encoded bacterial virulence factors and phage-pathogenicity island interactions[J]. Adv Virus Res, 2012, 82: 91-118. DOI:10.1016/B978-0-12-394621-8.00014-5 |
| [11] |
Aravind L, Zhang D, de Souza RF, et al. The natural history of ADP-ribosyl transferases and the ADP-ribosylation system[J]. Current Topics in Microbiology & Immunology, 2015, 384: 3-32. |
| [12] |
Sawaya R, Schwer B, Shuman S. Structure-function analysis of the yeast NAD+ -dependent tRNA 2'-phosphotransferase Tpt1[J]. RNA, 2005, 11: 107-113. DOI:10.1261/rna.7193705 |
| [13] |
Culver GM, McCraith SM, Consaul SA, et al. A 2'-phosphotransf-erase implicated in tRNA splicing is essential in Saccharomyces cerevisiae[J]. Journal of Biological Chemistry, 1997, 272(20): 13203-13210. DOI:10.1074/jbc.272.20.13203 |
| [14] |
Atanassova R, Fvaet N, Martz F, et al. Altered lignin composition in transgenic tobacco expressing O-methyltransferase sequence in sense and antisence oritation[J]. Plant J, 1995, 8: 465-477. |
| [15] |
De Souza RF, Aravind L. Identification of novel components of NAD-utilizing metabolic pathways and prediction of their biochemical functions[J]. Mol Biosystem, 2012, 8(6): 1661-1677. DOI:10.1039/c2mb05487f |
| [16] |
Nguyen TX, Yen MR, Barabote RD, et al. Topological predictions for integral membrane permeases of the phosphoenolpyruvate: sugar phosphotransferase system[J]. Mol Microbiol Biotechnol, 2006, 11(6): 345-360. DOI:10.1159/000095636 |
| [17] |
Shi M, Lin XD, Tian JH, et al. Redefining the invertebrate RNA virosphere[J]. Nature, 2016, 540(7634): 1-5. |
| [18] |
苏艳, 张亦弛, 胡德活, 等. 杉木无性系耐旱分析及SRAP种质鉴别[J]. 生物技术通报, 2016, 32(10): 212-218. Su Y, Zhang YC, Hu DH, et al. Drought-tolerance analysis and SRAP-based germplasm identification of Chinese Fir Clones[J]. Biotechnology Bulletin, 2016, 32(10): 212-218. |
| [19] |
路宗岩, 周国英, 陈玉华, 等. 杉木炭疽病拮抗菌HY32的筛选及其应用[J]. 生物技术通报, 2013, 3: 181-185. Lu ZY, Zhou GY, Chen YH, et al. Screening and application of the antagonistic bacterium HY32 against Colletotrichum gloeosporioides[J]. Biotechnology Bulletin, 2013, 3: 181-185. |
| [20] |
杨菁, 周国英, 谭益民, 等. 杉木炭疽病拮抗菌AM53的发酵条件优化[J]. 生物技术通报, 2014, 8: 164-167. Yang J, Zhou GY, Tan YM, et al. Optimization of fermentation conditions of sntagonistic bacterium AM53 against Colletotrichum gloeosporioides[J]. Biotechnology Bulletin, 2014, 8: 164-167. |
| [21] |
Schneider A, Häusler RE, Kolukisaoglu ü, et al. An Arabidopsis thaliana knock-out mutant of the chloroplast triose phosphate/phosphate translocator is severely compromised only when starch synthesis, but not starch mobilisation is abolished[J]. Plant Journal, 2002, 32: 685-699. DOI:10.1046/j.1365-313X.2002.01460.x |
| [22] |
Kauder F, Ludewig F, Heineke D. Ontogenetic changes of potato plants during acclimation to elevated carbon dioxide[J]. Journal of Experimental Botany, 2000, 51(S1): 429-437. |
| [23] |
Englert M, Latz A, Becker D. Plant pre-tRNA splicing enzymes are targeted to multiple cellular compartments[J]. Biochimie, 2007, 89(11): 1351-1365. DOI:10.1016/j.biochi.2007.06.014 |
| [24] |
Kilian O, Kroth PG. Presequence acquisition during secondary endocytobiosis and the possible role of introns[J]. J Mol Evol, 2004, 58(6): 712-721. DOI:10.1007/s00239-004-2593-z |
| [25] |
Wang JP, Matthews ML, Williams CM, et al. Improving wood properties for wood utilization through multi-omics integration in lignin biosynthesis[J]. Nature Communications, 2018, 9(1): 1579. DOI:10.1038/s41467-018-03863-z |




