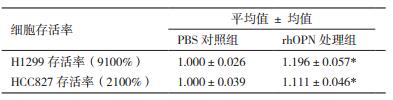
骨桥蛋白(Osteopontin,OPN)是一种分泌型磷酸化糖蛋白[1],在蛋白水平上会进行水解、磷酸化、糖基化等广泛的翻译后修饰。OPN分子量根据其翻译后修饰的程度呈现为30kD到100kD不等[2]。OPN具有许多功能域,包括精氨酸-甘氨酸-天冬氨酸(Arginine-glycine-aspartic acid,RGD)细胞结合序列,肝素结合位点,凝血酶切割位点等(图 1)。RGD域位于OPN中心,该域可与细胞表面的整合素αvβ3、αvβ1和αvβ5结合[3],介导细胞黏附。研究表明,乳腺癌、胃癌、肺癌及前列腺癌等多种恶性肿瘤的进展或转移与OPN的异常高表达相关[4-7]。由于OPN在大多数肿瘤中存在特异性表达且其体内水平与肿瘤恶化程度呈高度相关,OPN已经是肿瘤临床研究中的重要生物标记物之一[8]。
|
| 图 1 人OPN结构及功能域 |
为研究OPN的体外结构和生物学功能,已有研究从牛奶或尿液中分离出天然OPN,尽管此类制备方式所需来源丰富易得,但OPN在天然状态下极易被凝血酶或基质金属蛋白酶裂解,存在不同大小的OPN裂解产物,因此生物来源的OPN片段的纯化程序复杂,难以标准化,不易大规模生产[9-11]。在大肠杆菌中表达并用亲和层析纯化的谷胱甘肽巯基转移酶(Glutathione S-transferase,GST)或6×His标记的OPN已被用于广泛研究[12]。对于分子大小和翻译后修饰而言,OPN不同的生物学特性及活性与其翻译后修饰程度有关[13],而原核细胞缺乏相应的酶,无法进行翻译后修饰。因此,利用真核表达系统开发一种制备近似天然重组OPN蛋白的新方法,以研究OPN的结构、稳定性和生物学功能十分必要。在这项研究中,我们利用聚醚酰亚胺(Polyetherimide,PEI)瞬时转染技术,创建了一种在哺乳动物细胞中高效表达重组人骨桥蛋白(Recombinant human osteopontin,rhOPN)的策略,获得纯度为95%的具备良好生物学活性的rhOPN。由于蛋白质的翻译后修饰在调节生物学功能中起着至关重要的作用,rhOPN可用于体外研究OPN的翻译后修饰机制[14],包括磷酸化、乙酰化和糖基化等。该策略与从牛奶或尿液中纯化OPN相比,简单高效,更易大规模应用于工业生产。
1 材料与方法 1.1 材料大肠杆菌DH5α感受态细胞购自Second Lab公司,HEK293E细胞株由本实验室保存,HT29细胞株由本实验室保存,H1299及HCC827细胞株由苏州大学惠赠,pcDNA3.1-OPN质粒由通用生物系统(安徽)有限公司合成。无内毒素质粒抽提试剂盒购自美国Axygen公司,胎牛血清购自美国Gibco公司,PEI购自美国Polysciences公司,遗传霉素购自美国Invitrogen公司,镍亲和层析柱购自GE公司,TN1购自法国Organotechnie公司,蛋白Marker购自新赛美公司,CCK-8购自日本Dojindo公司,Freestyle培养基、SFM4 HEK293培养基与Mocoy’s 5A培养基均购自美国Gibco公司,BCA蛋白定量试剂盒购自碧云天公司,鼠抗6×His单克隆抗体购自美国Sigma公司,兔抗OPN多克隆抗体、兔IgG抗体和辣根过氧化物酶标记的羊抗兔IgG重链和轻链由实验室保存,细胞计数仪购自上海Countstar公司,0.22 μm滤膜购自美国Corning Life Sciences公司,防细胞结团剂Anti-Clumping Agent购自Invitrogen公司。
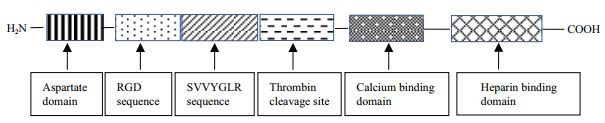
1.2 方法利用pcDNA3.1/His A载体来构建OPN基因真核表达载体,并通过PEI瞬时转染技术,创建了一种在人类胚胎肾细胞(Human embryonic kidney 293E,HEK293E)中高效表达rhOPN的简单高效策略(图 2),并获得了高纯度且具备生物学活性的rhOPN。真核表达系统可以在表达过程中进行蛋白翻译后加工,因此通过本策略可获得接近天然活性的蛋白质,有利于后期对蛋白的生物学活性研究。
|
| 图 2 rhOPN表达纯化策略流程图 |
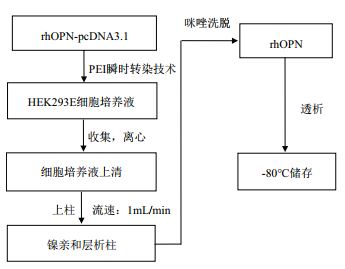
人OPN基因表达载体构建示意图如图 3所示,根据NCBI基因库NM_001040060.1合成人OPN基因序列,选用含Bam HI与Eco R1酶切位点的pcDNA3.1/His A载体,所构建的真核重组质粒命名为pcDNA3.1-OPN。
|
| 图 3 OPN-pcDNA3.1表达载体图谱 |
HEK 293E细胞悬浮培养在含2%胎牛血清(Fetal bovine serum,FBS),100 μg/mL遗传霉素(Geneticin 418,G418)的Freestyle 293与SFM4 HEK293(1: 1混合)培养基中。培养条件为37℃,5% CO2饱和湿度,转速为125 r/min。细胞生长状态和密度由细胞计数仪检测。
结肠癌细胞HT29细胞培养在含有10% FBS的Mocoy’s 5A培养基中。人非小细胞肺癌细胞H1299细胞培养在含有10% FBS的DMEM培养基中。人非小细胞肺癌细胞HCC827细胞在含有10% FBS的RPMI 1640培养基中。3种肿瘤细胞株均采用贴壁培养,均培养在37℃,5% CO2饱和湿度的细胞培养箱中。
1.2.3 PEI法瞬时转染取对数生长期的细胞,以1 000 r/min转速离心5 min后,将细胞密度调整为6×10 6个/mL,使用分子量为25 kD的线性聚乙烯亚胺转染300 μg pcDNA3.1-OPN质粒至100 mL该密度的细胞培养液中。转染4 h后,向锥形瓶中补加100 mL含有200 μg/mL的遗传霉素及3 mmol/L丙戊酸的完全培养基。转染24 h后,加入1:1 000的防细胞结团剂Anti-Clumping Agent和2.5 mL 20%的胰蛋白胨N1。
1.2.4 Western Blot检测rhOPN表达收集转染48h后的细胞培养液,将其离心后,细胞沉淀用相同体积的PBS重悬,分别向细胞上清液及沉淀中加入5×上样缓冲液混匀,置于95℃煮10 min。取15 μL蛋白样品加入至样品孔进行SDS-聚丙烯酰胺凝胶电泳,然后以恒定电流(200 mA,90 min)将蛋白转移到PVDF膜中。5%脱脂奶粉封闭后加入1:2 000稀释的鼠抗6×His标签一抗,4℃孵育过夜。TBST洗涤后用辣根过氧化物酶标记的兔抗鼠IgG重链和轻链抗体(1:20 000稀释)室温孵育1 h。化学发光法进行显色,利用凝胶成像系统收集信号并拍摄图像。
1.2.5 镍柱纯化rhOPN将HEK293E细胞培养液离心并收集上清,上样到镍亲和层析柱(规格1 mL)里。上样前,用pH 7.2的20 mmol/L咪唑缓冲液预平衡层析柱,然后样品以1 mL/min流速上样,上样结束后分别用含有40、60、80、100、200和300 mmol/L咪唑的蛋白洗脱液洗脱蛋白,每个咪唑浓度的洗脱液洗涤10 mL,收集各组分洗脱液。采用SDS-PAGE电泳分析各组分中的目的蛋白水平,用BCA蛋白定量试剂盒测定各组分中的总蛋白含量。纯化出的rhOPN被0.22μm的滤膜除菌后储存于-80℃冰箱。
1.2.6 ELISA法检测rhOPN与抗OPN抗体的结合活性将纯化的rhOPN蛋白以2 μg/mL的浓度包被于ELISA板中4℃放置过夜。弃去包被液后,用3%BSA室温封闭1 h。将兔抗OPN多克隆抗体从20μg/mL倍比稀释至1 ng/mL。在阴性对照中,将兔IgG抗体从20 μg/mL倍比稀释至1 ng/mL,室温孵育1 h。然后加入1: 20 000稀释的辣根过氧化物酶标记的羊抗兔IgG重链和轻链进行结合反应,37℃孵育1 h。最后加入3,3’,5,5’ -四甲基联苯胺显色液在室温下避光反应5 min,并用2 mol/L硫酸终止反应,在酶标仪下读取450 nm吸光度。
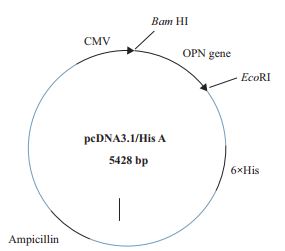
1.2.7 CCK-8测定rhOPN促进结肠癌细胞株增殖水平为进行细胞增殖测定,将HT29细胞以100μL/孔接种到96孔板中,细胞最终密度为3×104个/mL,并生长过夜。然后用无血清HT29培养液处理细胞,其中含有不同浓度的rhOPN(80 μg/mL、53 μg/mL、36 μg/mL、24 μg/mL、10 μg/mL、7 μg/mL和2 μg/mL),每组有3个重复的孔。而在阴性对照中,PBS加入体积与80 μg/mL rhOPN体积一致。在37℃,5%CO2和饱和湿度下孵育48 h后,用CCK-8细胞计数试剂盒分析细胞活力,在450 nm波长下测定其吸光度。然后使用GraphPad Prism软件对细胞存活率进行分析。
1.2.8 CCK-8测定rhOPN促进肺癌细胞株增殖水平为进行肺癌细胞增殖测定,用相应的培养基分别将H1299与HCC827细胞重悬,使细胞最终密度为2.5×104个/mL。将重悬后的H1299及HCC827细胞培养液分别以100 μL/孔接种到96孔板中,并生长过夜。然后用对应的无血清培养基处理细胞,处理组含有终浓度为20 μg/mL的rhOPN,而在阴性对照中,PBS加入体积与rhOPN体积一致,每组设有4个重复的孔。在37℃,5% CO2和饱和湿度下孵育48 h后,用CCK-8细胞计数试剂盒在450 nm波长下测定其吸光度,然后使用GraphPad Prism软件分析细胞活力。
1.2.9 统计学处理采用GraphPad统计软件,组间比较采用t检验分析,以均值±标准差形式表示,以P<0.05为有统计学意义,其中*代表P<0.05,**代表P<0.01。
2 结果 2.1 重组OPN蛋白在哺乳动物细胞中的表达利用Western Blot检测rhOPN蛋白在哺乳动物细胞HEK293E中的表达,结果如图 4所示,在细胞培养液的上清与沉淀中,均检测出rhOPN蛋白的表达,且条带大小与预期一致,表明成功利用聚醚酰亚胺瞬时转染法将OPN融合6×His标签重组蛋白转染到HEK293E细胞中,并表达获得目的蛋白。
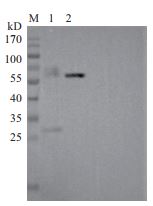
|
| 1:细胞培养液上清;2:细胞培养液沉淀 图 4 Western Blot检测rhOPN表达产物 |
rhOPN经镍亲和层析柱纯化后,各个浓度咪唑洗脱液的SDS-聚丙烯酰胺凝胶电泳结果如图 5所示,分别在40 mmol/L与60 mmol/L浓度咪唑洗脱液中获得了目的蛋白,SDS-聚丙烯酰胺凝胶电泳图显示在65 kD左右有特异性条带,该条带单一清晰,条带大小符合预期,表明成功利用镍亲和层析柱纯化获得高纯度rhOPN融合6×His标签重组蛋白。利用BCA蛋白定量试剂盒测定得蛋白产量为28 mg/L。

|
| A:蛋白纯化洗脱样品SDS-PAGE分析。M:蛋白分子量;1:细胞培养液;2:流穿;3:20 mmol/L咪唑洗脱样品;4:40 mmol/L咪唑洗脱样品;5:60mmol/L咪唑洗脱样品6:80 mmol/L咪唑洗脱样品;7:100 mmol/L咪唑洗脱样品;8:200 mmol/L咪唑洗脱样品;9:300 mmol/L咪唑洗脱样品;10:500 mmol/L咪唑洗脱样品。B:纯化后rhOPN蛋白SDS-PAGE分析 图 5 镍亲和层析柱纯化获得rhOPN |
利用兔抗OPN多克隆抗体对制备的rhOPN进行抗体结合活性测定,结果如图 6所示,与对照组相比,制备的rhOPN与抗OPN抗体有显著的结合活性,且结合活性的大小与抗体的剂量呈正相关。
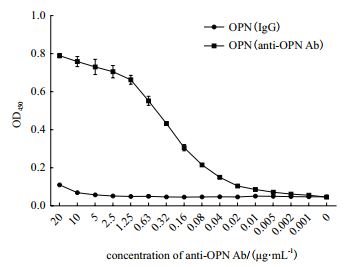
|
| 图 6 OPN重组蛋白与抗OPN抗体具有结合活性 |
CCK-8结果显示,与对照组相比,细胞培养基中含有rhOPN时,48 h后的细胞数量显著增多,并呈现剂量依赖关系。如图 7及表 1所示,rhOPN在36 μg/mL浓度时即可显著促进体外培养的HT29细胞增殖,这些数据表明根据我们的策略表达和纯化的rhOPN具有体外生物活性,可显著促进结肠癌细胞HT29的增殖,为后续研究rhOPN在肿瘤增殖、迁移或侵袭中的生物学功能提供了重要实验材料。
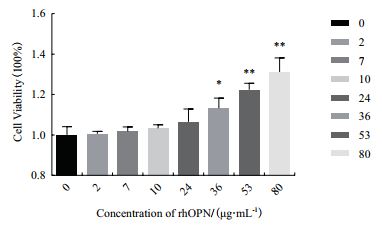
|
| 与对照组(0 μg/mL组)相比,*:P<0.05 **:P<0.01 图 7 镍亲和层析柱纯化获得rhOPN |
体外肿瘤细胞增殖是测定重组蛋白生物学活性的良好模型。如图 8及表 2所示,与对照组相比,细胞培养基中含有20 μg/mL rhOPN时,人非小细胞肺癌细胞H1299与HCC827的数量均显著增多,并呈现剂量依赖关系。表明该策略制备的rhOPN具有良好的体外生物学活性,可显著促进肺癌细胞H1299及HCC827的增殖,为后续研究rhOPN在肺癌细胞增殖,转移等生物学功能奠定了实验基础。
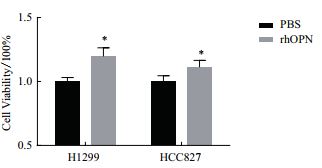
|
| 图 8 rhOPN促进肺癌细胞增殖的剂量反应曲线 |
肿瘤的增殖与转移高度依赖于细胞因子介导的肿瘤细胞与肿瘤基质间的相互作用 [15]。OPN与其受体整合素或细胞分化分类分子44(Cluster of differentiation molecular 44,CD44)结合后,可激活与肿瘤进程相关的信号通路,从而对肿瘤进展产生影响[16]。研究表明,OPN在肿瘤微环境中广泛表达,可与肿瘤细胞中CD44s结合促进肿瘤的生长与侵袭[17]。OPN现已成为肿瘤临床研究中的重要生物标记物之一。
本研究设计构建重组质粒pcDNA3.1-OPN,并采用PEI瞬时转染技术将该重组质粒瞬时转染至HEK 293E细胞中,最终通过镍亲和层析柱纯化获得rhOPN。这是一种利用瞬转技术及镍亲和层析柱表达和纯化rhOPN的简单有效的策略。与常规方法相比,该策略非常新颖高效,可短时间大规模表达具有生物学活性的蛋白。
HEK293E细胞是常用的哺乳动物细胞[18],并且哺乳动物表达系统生产的蛋白无内毒素污染,获得蛋白的稳定性好,产量高,目前技术已趋于成熟[19]。相比于原核表达系统,本研究中表达的蛋白可以进行翻译后修饰,具有类似天然的活性,便于后期对蛋白活性与作用机制进行研究。本研究中仅进行了一步纯化,而在后期优化实验中,可进行多步纯化,也可以尝试改变瞬时转染过程的多种条件如细胞活性、转染质粒数量及培养环境等来进一步提高蛋白产量及质量,利用最优组合获得大量高纯度蛋白。
在人类结肠癌SW480细胞中,转录因子SP1(Transcription factor Sp1,SP1)介导了OPN表达的调控。另外,已有研究证明T细胞因子/淋巴增强子结合因子(T-cell factor /lymphoid enhancerbinding factor,TCF/LEF)诱导OPN在结肠癌中的表达,该转录因子是由果蝇同源无翅/整合(Wingless/Integrated,Wnt)通路激活的,从而推测Wnt信号通路是解释OPN在结肠癌中上调的机制[20]。研究表明,抗OPN中和抗体可阻断OPN-CD44信号通路,使果蝇Zeste基因增强子同源物2(Enhancer of zeste homolog 2,EZH2)转录水平下降,揭示了OPN与CD44的结合会上调EZH2的表达,从而促进结直肠癌细胞的增值。OPN也可通过磷脂酰肌醇3-激酶(Phosphoinositide 3- kinase,PI3K)-丝氨酸/苏氨酸激酶AKT(Serine/threonine kinase AKT,AKT)这一核心信号通路参与对细胞增殖、运动和侵袭等多种生物功能的调控[21]。
生物学活性对于重组蛋白非常重要。上述研究提示rhOPN可以促进结肠癌细胞和非小细胞肺癌的增殖。因此,本研究表达和纯化的rhOPN可以用来研究OPN与对肿瘤细胞生长的影响,深入探讨OPN的调控肿瘤细胞增殖的分子机制。本研究同时也为评价rhOPN生物学活性提供了新的方法。结肠癌细胞系HT29、非小细胞肺癌细胞系HCC827及H1299均可以用于评价rhOPN的生物学活性。本研究获得的rhOPN也可用于免疫特异性抗OPN的抗体,用于开发靶向OPN蛋白的抗体药物。此外,也为进一步的去标签OPN的表达提供参考依据。
4 结论本研究报道了以天然形式表达与纯化rhOPN的有效策略。该策略与从牛奶或尿液中纯化OPN相比,更易于工业中大规模生产,具有简单高效,制备周期短等优势。本研究制备的rhOPN产量高达28mg/L,分子量为65 kD,具有类似天然表达蛋白的生物学活性。rhOPN与抗OPN抗体具有良好的结合活性,活性大小与抗体的剂量呈正相关。我们也证实了该策略表达的rhOPN在一定浓度下具有促进结肠癌细胞系HT29、非小细胞肺癌细胞系HCC827及H1299增殖的生物学活性,与对照组相比均具有显著差异。
| [1] |
Kurzbach D, Platzer G, Schwarz TC, et al. Cooperative unfolding of compact conformations of the intrinsically disordered protein osteopontin[J]. Biochemistry, 2013, 52(31): 5167-5175. DOI:10.1021/bi400502c |
| [2] |
Lindsey Merry L, Zouein Fouad A, Tian Y, et al. Osteopontin is proteolytically processed by matrix metalloproteinase9[J]. Canadian Journal of Physiology and Pharmacology, 2015, 93(10). DOI:10.1139/cjpp-2015-0019 |
| [3] |
Barry ST, Ludbrook SB, Murrison E, et al. Analysis of the alpha 4 beta 1 integrin-osteopontin interaction[J]. Exp Cell Res, 2000, 258: 342-351. DOI:10.1006/excr.2000.4941 |
| [4] |
Kolb A, Kleeff J, Guweidhi A, et al. Osteopontin influences the invasiveness of pancreatic cancer cells and is increased in neoplastic and inflammatory conditions[J]. Cancer Biology and Therapy, 2005, 4(7): 740-746. DOI:10.4161/cbt.4.7.1821 |
| [5] |
Khan SA, Cook AC, Kappil M, et al. Enhanced cell surface CD44 variant(v6, v9)expression by osteopontin in breast cancer epithelial cells facilitates tumor cell migration :novel posttranscriptional, post-translational regulation[J]. Clinical and Experimental Metastasis, 2005, 22(8): 663-673. DOI:10.1007/s10585-006-9007-0 |
| [6] |
Ran W, Ching WJP, Fai KH. Osteopontin-a promising biomarker for cancer therapy[J]. Journal of Cancer, 2017, 8(12): 2173-2183. DOI:10.7150/jca.20480 |
| [7] |
Abdelhamid FS, Abdel GMN, Wadie FM, et al. Plasma osteopontin level in chronic liver disease and hepatocellular carcinoma[J]. Hepatitis Monthly, 2015, 15(9). DOI:10.5812/hepatmon.30753 |
| [8] |
Mazzali M. Osteopontin-a molecule for all seasons[J]. QJM, 2002, 95(1): 3-13. DOI:10.1093/qjmed/95.1.3 |
| [9] |
Rensen S, Justesen SJ, Johnsen AH. Purification and characterization of osteopontin from human milk[J]. Protein Expression and Purification, 2003, 30(2): 238-245. DOI:10.1016/S1046-5928(03)00102-5 |
| [10] |
Christensen B, Schack L, Klaning E, et al. Osteopontin is cleaved at multiple sites close to its integrin-binding motifs in milk and is a novel substrate for plasmin and cathepsin D[J]. Journal of Biological Chemistry, 2010, 285(1): 7929-7937. DOI:10.1074/jbc.M109.075010 |
| [11] |
Bayless KJ, Davis GE, Meininger GA. Isolation and biological properties of osteopontin from bovine milk[J]. Protein Expression and Purification, 1997, 9(3): 309-314. DOI:10.1006/prep.1996.0699 |
| [12] |
Jang JH, Kim JH. Improved cellular response of osteoblast cells using recombinant human osteopontin protein produced by Escherichia coli[J]. Biotechnology Letters, 2005, 27(22): 1767-1770. DOI:10.1007/s10529-005-3551-6 |
| [13] |
Ramaiah SK, Rittling S. Pathophysiological role of osteopontin in hepatic inflammation, toxicity, and cancer[J]. Toxicological Sciences, 2007, 103(1): 4-13. |
| [14] |
Christensen B, Rensen ES. Osteopontin is highly susceptible to cleavage in bovine milk and the proteolytic fragments bind the αvβ3-integrin receptor[J]. Journal of Dairy Science, 2014, 97(1): 136-146. DOI:10.3168/jds.2013-7223 |
| [15] |
Bello IO, Vered M, Dayan D, et al. Cancer-associated fibroblasts, a parameter of the tumor microenvironment, overcomes carcinomaassociated parameters in the prognosis of patients with mobile tongue cancer[J]. Oral Oncology, 2011, 47(1): 33-38. DOI:10.1016/j.oraloncology.2010.10.013 |
| [16] |
Likui W, Hong W, Shuwen Z. Clinical significance of the upregulated osteopontin mrna expression in human colorectal cancer[J]. Journal of gastrointestinal surgery, 2010, 14(1): 74-81. DOI:10.1007/s11605-009-1035-z |
| [17] |
Ahmed M, Sottnik JL, Dancik GM, et al. An osteopontin/CD44 axis in rhogdi2-mediated metastasis suppression[J]. Cancer cell, 2016, 30(3): 432-443. DOI:10.1016/j.ccell.2016.08.002 |
| [18] |
Heffner KM, Wang Q, Hizal DB, et al. Glycoengineering of mammalian expression systems on a cellular level[J]. Advances in Biochemical Engineering Biotechnology, 2018. DOI:10.1007/10_2017_57. |
| [19] |
Aricescu AR, Lu W, Jones EY. A time and cost efficient system for high-level protein production in mammalian cells[J]. Acta Crystallographica Section D, Biological Crystallography, 2006, 62(10): 1243-1250. DOI:10.1107/S0907444906029799 |
| [20] |
Anborgh PH, Caria LB, Chambers AF, et al. Role of plasma osteopontin as a biomarker in locally advanced breast cancer[J]. American Journal of Translational Research, 2015, 7(4): 723-732. |
| [21] |
张辉, 周晓薇, 余奇文, 等. 骨桥蛋白促进结肠癌细胞增殖的机制研究[J]. 现代免疫学, 2014, 34(4): 313-319. Zhang H, Zhou XW, Yu QW, et al. Study on the mechanism by which osteopontin promoting of colorectal cancer cells[J]. Current Immunology, 2014, 34(4): 313-319. |