2. 福建水产研究所 福建省海洋生物增养殖与高值化利用重点实验室,厦门 361000
2. Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian Province, Fisheries Research Institute of Fujian, Xiamen 361012
凡纳滨对虾(Litopenaeus vannamei),属节肢动物门(Arthropoda)、甲壳纲(Crustacea)、十足目(Decapoda)、游泳亚目(Natantia)、对虾科(Penaeidae)及对虾属(Penaeus),滨对虾亚属(Litopenaeus)[1],是全世界养殖产量最高的虾种。凡纳滨对虾因具有生长速度快、育苗时间短、抗病能力强、营养需求低、适应养殖环境能力强和方便运输等优点,自1988年引进我国后,迅速成为我国养殖面积最大、产量最高的虾类[2]。然而随着养殖规模的不断扩大和集约化程度的不断提高,凡纳滨对虾的暴发性疾病也随之而来,给中国乃至全球对虾养殖业带来了巨大的损失[3]。截至目前学者们已经发现众多虾类疾病,病原主要是病毒、细菌和真菌[4-5]。
日本的石川雄介于1968年在日本对虾(Penaeus japonicus,现命名为日本囊对虾Marsupenaeus japonicus)病虾上首次发现了镰刀菌,因可致患病的虾鳃丝变黑而命名为黑鳃病[6]。在凡纳滨对虾、加州对虾( P. californiensis)、中国明对虾(Fenneropenaeus chinensis)、长毛明对虾(F. penicillatus)、斑节对虾(P.monodon)等对虾中已被证实为致病菌[7-10]。镰刀菌在凡纳滨对虾上的传播途径一般是镰刀菌分生孢子或厚膜孢子侵入后,寄生在鳃、头胸甲、附肢、体壁和眼球等处的组织内萌发成菌丝,并有黑色素沉淀而呈黑色。亲虾感染镰刀菌后,活力降低,性腺发育缓慢,鳃组织、甲壳等病灶部位黑化坏死。其中引起虾死亡的主要原因是破坏鳃的呼吸功能,导致对虾呼吸衰竭死亡[11];镰刀菌还可生成真菌毒素,使宿主中毒。
目前大部分的虾类养殖模式还是以粗放型高密度为主,会引起养殖环境和各种水化因子的恶化,给病原的快速传播提供条件。国内对凡纳滨对虾病害的研究多集中在病毒性和细菌性病害,对该养殖品种真菌性病害的研究报道较少。本研究从福建晋江育苗场的患黑斑病的凡纳滨对虾体内分离分离出了真菌,并进行了病原菌的分离鉴定、致病性、耐药性的检测,旨在查明凡纳滨对虾黑斑病的病原菌及其致病力,结合药敏分析结果,以期为该病的有效防控提供理论依据。
1 材料与方法 1.1 材料 1.1.1 患病对虾对虾样品取自晋江厦兴龙育苗场越冬厦兴龙1号凡纳滨对虾亲虾(约50 g/尾)。病虾症状为鳃瓣呈褐色或黑色斑,体表和附肢亦出现黑褐色斑点溃疡,取下发病部位,镜检可发现有真菌菌丝或分生孢子。
1.1.2 试剂马铃薯葡萄糖琼脂(PDA)培养基购于北京陆桥技术股份有限公司。沙堡培养基自配(准确称取蛋白胨10.0 g,葡萄糖40.0 g,琼脂20.0 g,蒸馏水1 000.0 mL,加热煮沸至完全溶解后115℃灭菌30 min)。基因组DNA提取检测试剂盒、PCR相关试剂购自天根生物科技有限公司。
两性霉素B、那他霉素、制霉菌素、伊曲康唑、氟康唑、酮康唑、克霉唑、5-氟胞嘧啶购自麦克林公司,咪康唑、益康唑购自安耐吉公司,特比萘芬购自阿拉丁公司。二甲基亚砜(DMSO)购自上海新睿生物科技有限公司。11种药物纯度为98%-100%。依据M38-A2方案配制上述药物的储存液,其中水溶性药物氟康唑溶于无菌蒸馏水,其他脂溶性药物溶于DMSO。每一批储存液均设溶剂对照。各药物的工作液浓度范围:克霉唑、益康唑、特比萘芬、咪康唑、两性霉素B、氟康唑、伊曲康唑为0.031 3-16 μg/mL;那他霉素、0.061 3-32μg/mL;制霉菌素、酮康唑、5-氟胞嘧啶为0.125-64 μg/mL。
1.2 方法 1.2.1 病原菌分离及形态观察在无菌条件下,用酒精棉球擦拭病虾体表后解剖,从患病部位取样,分别在PDA培养基平板(pH7)上划线培养,28℃恒温培养48 h,观察菌落的颜色、形状及菌丝疏密程度。然后挑取少量菌丝于显微镜下,观察大分生孢子和小分生孢子的形状、隔膜数量及厚膜孢子的有无、形态,并拍照记录。根据菌落特征的不同,挑取单菌落划线分离,数次传代后将纯化的菌株编号保存备用。
1.2.2 真菌DNA提取及ITS-rDNA的PCR扩增菌株基因组的提取以分离纯化培养后的病原菌为原料,采取煮沸法获取真菌的基因组。挑取真菌的菌丝于无菌水中,重悬后金属浴100℃,10 min,然后冰浴20 min,12 000 g/min离心2 min,取上清液于-20℃保存,作为PCR扩增模板。
采用真菌通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3'TCITS4(5'-TCCTCCGCTTATTGATATGC -3'TCCTPCR扩增。25 μL PCR反应体系为:模板DNA 1 μL,引物(0.4 μmol/L)各1 μL,2×Taq PCRMasterMix 12.5 μL,ddH2O补足至25 μL。PCR扩增条件:94℃预变性5 min;94℃变性1 min,54.5℃退火1 min,72℃延伸1 min,30个循环;72℃延伸10 min。扩增产物用2%的琼脂糖凝胶电泳检测。经观察并拍照、割胶回收、连接转化后,挑取阳性克隆进行序列测定。
1.2.3 克隆测序及系统发育树构建测序由英潍捷基生物技术有限公司完成。将所得到的菌株ITSrDNA序列提交至GenBank获得序列号,并在NCBI的GenBank数据库中进行BLAST比对和同源性分析,运用MEGA 6.0软件中的N-J法构建系统发育树。
1.2.4 人工感染实验取健康凡纳滨对虾于室内水族箱中暂养一周,期间水温为(25±1)℃,放养密度为10尾/缸。将分离后的菌株接种于PDA琼脂平板上,28℃培养7-10 d使其产生大量真菌孢子[12],取5 mL的对虾生理盐水[13]加入平板,用一次性无菌吸管轻轻抽吸后,将有孢子和菌丝片断的菌悬液吸到尖端开口并带滤纸的EP管后渗漏至另一无菌EP管[14],使用血球计数板调整菌悬液的浓度为1×108CFU/mL,并将菌悬液梯度稀释至5.0×104CFU/mL(F1组),5.0×105 CFU/mL(F2组),5.0×106CFU/mL(F3组)。随机选取凡纳滨对虾10尾通过腹足基部注射方式进行人工感染试验,每组取3个平行。按照25 μL/尾[(20±3)g]腹足基部注射菌液,同时设立注射等比例生理盐水的对照组(C组),注射后移至新鲜海水中暂养后观察症状。分别于腹足基部注射后0 h、12 h、1 d、2 d、3 d、4 d、5 d、6 d、7 d和8 d观察并记录死亡情况及病理症状。取具有自然发病症状(黑鳃病症)的人工感染虾,在无菌条件下进行病原菌再分离培养,并比较分离得到的病原菌和攻毒所用的病原菌的各项特征,若为同种病原菌则说明攻毒用的菌与原患病亲虾体内的病原菌与为同一病原菌。
1.2.5 药物敏感性分析药物敏感性试验按琼脂稀释法和常量液基稀释法进行,测定最小抑菌浓度,参照NCCLS的M38-A2方案测定药物的最小抑菌浓度(Minimal inhibitory concentration,MIC)[15]。质控菌株选用克柔念珠球菌。
1.2.5.1 药液的制备氟康唑和5-氟胞嘧啶等水溶性药以灭菌蒸馏水溶解;酮康唑、伊曲康唑、两性霉素B、伏力康唑等均用二甲亚砜溶解。两性霉素B、伊曲康唑、特比萘芬制成3.2 mg/mL的储备液,那他霉素制成6.4 mg/mL的储备液,放-20℃备用。
1.2.5.2 真菌菌悬液制备同1.2.4方法制备菌悬液,以RPMI1640培养基将菌液稀释至5.0×103CFU /mL。取部分菌悬液用生理盐水稀释100倍,吸取100μL调好的接种液接种至沙堡氏葡萄糖琼脂平板上,将平板于28℃下孵育并每日观察有无菌落形成。
1.2.5.3 药敏平板制备将配置好浓度梯度的药物取出,各取8 mL于提前配制的沙堡琼脂培养基(72mL)中,混合均匀后倒入4个平板备用。药物平板中接种测试菌液,每点接种2.5 μL,可进行多点接种。并设置生长对照和空白对照,28℃培养48h。以确认生长对照平板菌生长良好,空白对照平板无污染菌生长。逐一观察从高浓度至低浓度药物平板上的生长情况,并拍照记录。
1.2.5.4 药敏试管制备在无菌的15 mm×100 mm试管编号1-10中依次加入0.1 mL倍比稀释的不同浓度药物工作液。依次在试管中加入已配置好的菌悬液工作液0.9 mL,混匀。整个过程均在15 min内完成。在设置空白对照和生长对照的同时进行质控菌株的平行试验,进行质量控制。将试管置于28℃培养48 h观察结果。肉眼观察对照试管混浊(+,有细菌显著生长),判定澄清(-,无肉眼可见菌生长)。
2 结果 2.1 病症观察及镜检患病亲虾的主要症状为鳃丝黑斑,头胸部甲壳、腹部甲壳边缘、游泳足基部和尾扇边缘等多处出现大小不一的焦黑状斑块,部分斑块穿孔,如图 1-A圆圈所示。取病灶部位鳃丝,在显微镜下可观察到菌丝(图 1-B箭头所示)和孢子(图 1-C圆圈所示)。

|
| A:对虾黑斑病;B:鳃上菌丝;C:真菌孢子 图 1 患病对虾 |
通过分离纯化方法获得了1株纯化菌株。该菌株在PDA培养基上28℃培养3 d可见正面观察为白色羊绒状的圆形菌落,中央浓密,外围稀疏(图 2-A)。背面观察为中央淡黄色,边缘白色(图 2-B)。

|
| A:真菌正面照;B:真菌背面照 图 2 真菌菌落形态 |
显微镜下可观察到透明菌丝(图 3-A,箭头所示),分支,有隔膜和大量内容物,菌丝易缠绕。可见分生孢子,小型分生孢子呈椭圆形或卵圆形(图 3-A,圆圈所示);大型分生孢子呈镰刀形,稍弯,有多个隔膜(图 3-B,圆圈所示)。

|
| A:菌丝;B:分生孢子 图 3 真菌菌丝及分生孢子 |
从上述分离的病原菌,通过腹足基部注射的方式进行人工感染实验。经8 d的实验观察,注射孢子悬液的实验结果表明,分离菌株对凡纳滨对虾有致病力,人工感染后出现与自然发病对虾相似的症状:出现黑鳃症状(图 4-A圆圈所示),取鳃丝镜检可观察到鳃丝上有大量菌丝(图 4-C箭头所示),而对照组正常(图 4-B,图 4-D)。在人工感染实验中受试虾的7d致死率为F1组80.00%,F2组53.33%,F3组0.00%(表 1,图 5)。另外,从人工感染发病的虾体中重新分离到的菌株,经分子鉴定表明其与人工感染菌株一致。

|
| A:感染组虾;B:对照组虾;C:感染组鳃部;D:对照组鳃部 图 4 感染真菌组与对照组凡纳滨对虾 |

|
| 图 5 注射不同浓度真菌后凡纳滨对虾存活率-时间曲线 |
对纯化后的真菌提取DNA,利用真菌通用引物ITS1和ITS4进行扩增,在550 bp附近有明显的扩增条带。将PCR产物送至英潍捷基生物技术有限公司测序。
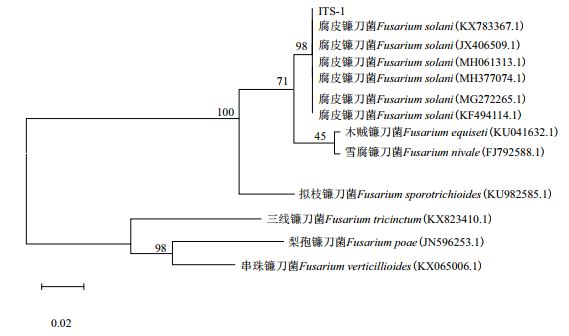
测序后,将所得ITS-rDNA序列(ITS-1)在NCBI数据库中进行Nucleotide BLAST比对,发现该序列和腐皮镰刀菌的序列(Fusarium solani,KX783367.1)的相似性达99%以上,可将本研究获得的对虾黑斑病的病原鉴定为腐皮镰刀菌。
将病原菌的ITS-rDNA序列与腐皮镰刀菌、其他部分镰刀菌种序列一起用MEGA6.0软件构建系统进化树(图 6)。结果发现:病原真菌的序列ITS-1在系统进化树上与腐皮镰刀菌聚在同一分枝中,这与前期形态鉴定和序列比对的结果是一致的,进一步证实了该菌为腐皮镰刀菌。
|
| 图 6 本实验所分离镰刀真菌ITS-rDNA基因序列系统发育树 |
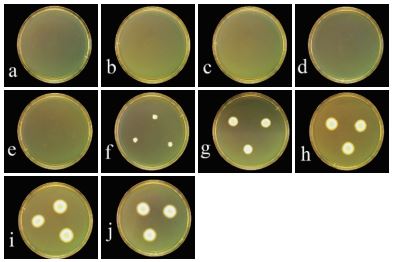
初步筛选采用测试浓度范围的最高浓度以琼脂稀释法进行检验(图 7),通过与生长对照组进行对比,发现镰刀真菌在含有克霉唑(16 μg/mL)、益康唑(16 μg/mL)、特比萘芬(16 μg/mL)、制霉菌素(64 μg/mL)、那他霉素(32μg/mL)、酮康唑(64 μg/mL)的平板中,肉眼观察均未有菌落生长;在含有咪康唑(16 μg/mL)、伊曲康唑(16 μg/mL)、5-氟胞嘧啶(32 μg/mL)、两性霉素B(16 μg/mL)、氟康唑(16 μg/mL)的平板中均观察到有菌落生长。故选用克霉唑、益康唑、特比萘芬、制霉菌素、那他霉素和酮康唑进行后续实验。

|
| a:5-氟胞嘧啶;b:特比萘芬;c:克霉唑;d:两性霉素B;e:咪康唑;f:伊曲康唑;g:益康唑;h:制霉菌素;i:那他霉素;j:氟康唑;k:酮康唑;l:阳性对照 图 7 药物的初步筛选结果 |
琼脂稀释法及常量稀释法结果对比(表 2):二者结果一致,且各药物的最小抑菌浓度分别为:克霉唑8 μg/mL,益康唑1 μg/mL,特比萘芬4 μg/mL,制霉菌素64 μg/mL,那他霉素8μg/mL,酮康唑64 μg/mL,其中益康唑、特比萘芬的琼脂稀释法药敏结分别如图 8和图 9所示
|
| a:16;b:8;c:4;d:2;e:1;f:0.5;g:0.25;h:0.125;i:0.062 5;j:0.031 3(单位:μg/mL),下同 图 8 益康唑药敏结果 |

|
| 图 9 特比萘芬药敏结果 |
镰刀菌的菌属可以利用传统的形态学方法进行鉴定[16],然而镰刀菌的表观形态特征容易受到各种因素的影响,因此,单凭传统的形态学方法来进行分类鉴定常出现误差,不能精准的区分镰刀菌属,尤其是区分一些形态相近的姊妹种和复合种,从而影响后续工作的开展。目前,常用的鉴定病原体的方法之一是分子生物学技术[17],该技术可以避免传统方法培养技术缺陷,为镰刀菌鉴定提供了更加科学的技术手段。常用的分子手段有主效位点基因rDNA-ITS[18-19]、EF1-ɑF1-IN NESSR、ISSR等分子标记技术[19-20]。本研究对虾体病变部位进行病原体的分离纯化,分离出了明显优势菌,通过形态学特征,结合分子生物学技术rDNA-ITS基于ITS序列的系统发育分析[17],确定了引起亲虾黑鳃病的病原菌为腐皮镰刀菌。
在凡纳滨对虾黑鳃病中,由不同病原菌引发类似病症的“一症多病”现象广泛存在。弧菌、丝状细菌、镰刀菌、链壶菌、地霉、水霉、聚缩虫和拟阿脑虫等都能导致对虾患黑鳃病 [22-23]。因此,在生产一线中仅凭经验进行疾病的现场诊治效果往往存在很大偏差,必须通过实验室确诊后方可有针对性地制定相应措施对疾病进行防治。
由于腐皮镶刀菌分布的广泛性,我国几种主要养殖虾类均为其适宜寄主,造成了养殖对虾黑鳃病十分普遍。人工感染腐皮镰刀真菌分生孢子根据注射浓度的不同引起对虾的死亡率也有所不同,在本实验中,设置了3个浓度梯度的菌悬液对凡纳滨对虾进行人工感染实验,人工感染实验结果显示,使用5.0×104 CFU/mL浓度的菌悬液对凡纳滨对虾的8d的存活率为73.33%,使用5.0×105 CFU/mL浓度的菌悬液的存活率为40.00%,使用5.0×106 CFU/mL浓度的菌悬液的存活率为0%,结果与Goncalves[24]和陈波等[7]的研究结果类似。
抗真菌药物敏感实验能够指导抗真菌药物的选择,从1992年起,虽然美国的NCCLS制订了一系列针对抗真菌药物敏感实验的指导性文件,但仍未能适用于所有真菌的检测。目前抗真菌药物敏感实验方法多样化,主要分为药基法和菌基法(琼脂扩散法)。药基法又分为琼脂稀释法、常量液基稀释法、微量液基稀释法;菌基法又分为ROSCO抗真菌药敏纸片法、E试验法等。而镰刀菌属丝状真菌,由于丝状真菌生长较慢,体积较大,给丝状真菌的药物敏感试验带来很多困难。迄今为止,针对丝状真菌的药物敏感试验无论是在选择培养基、确定接种菌浓度还是对重点的判定上,仍未确定标准化的药敏试验方法[15]。因此,试验中采用的是琼脂稀释法以及参照NCCLS的M38-A后使用的常量液基稀释法对分离的腐皮镰刀真菌进行药物敏感性实验,以确定腐皮镰刀真菌的MIC。
本研究的MIC结果显示,在所用11种药物中,该菌株对益康唑的敏感性最高,对克霉唑、特比萘芬、那他霉素也具有较好的效果,特比萘芬、那他霉素的结果与Walther等[25]和刘立春[26]的结果一致;对咪康唑和广谱抗真菌药物伊曲康唑没有表现出较高的敏感性,与Lalitha等[27]的研究一致;其他药物抑制作用较差。
4 结论从福建晋江育苗场的患有黑鳃病的越冬亲虾中分离鉴定到一株腐皮镰刀真菌,对其进行研究显示,了该菌株对凡纳滨对虾有较强的致病力,药物敏感试验表明该菌株对克霉唑、益康唑、特比萘芬和那他霉素等4种药物敏感。综上,可将益康唑和特比萘芬、克霉唑、那他霉素考虑作可供选择的药物。当然,具体的使用应在结合药物敏感性实验结果的同时还需要考虑养殖对虾的耐受情况,以期有效预防治疗和控制镰刀真菌的感染。
| [1] |
唐扬, 孟小菲, 沈瑞福, 等. 凡纳滨对虾家系选育的研究与应用[J]. 水产科学, 2018, 37(4): 555-563. Tang Y, Meng XF, Shen RF, et al. Research and application of family selective breeding in culture of pacific white shrimp Litopenaeus vannamei[J]. Fisheries Science, 2018, 37(4): 555-563. DOI:10.16378/j.cnki.1003-1111.2018.04.020 |
| [2] |
黄永春, 林祥日, 蔡葆青, 等. 凡纳滨对虾高位池反季节健康养殖技术的研究[J]. 中国农学通报, 2012, 28(17): 154-159. Huang YC, Lin XR, Cai BQ, et al. Study on the technology of offseason healthy aquaculture in higher-altitude culture ponds of Litopenaeus vannamei[J]. Chinese Agricultural Science Bulletin, 2012, 28(17): 154-159. DOI:10.3969/j.issn.1000-6850.2012.17.029 |
| [3] |
陈健, 李良玉, 杨壮志, 等. 南美白对虾养殖现状、存在问题及发展对策[J]. 渔业致富指南, 2018(16): 18-20. Chen J, Li LY, Yang ZZ, et al. Present situation, problem and developing countermeasures of Penaeus vannamei[J]. Fishery Guide to be Rish, 2018(16): 18-20. |
| [4] |
Bachère E, Gueguen Y, Gonzalez M, et al. Insights into the antimicrobial defense of marine invertebrates :the penaeid shrimps and the oyster Crassostrea gigas[J]. Immunological Reviews, 2004, 198(1): 149-168. DOI:10.1111/j.0105-2896.2004.00115.x |
| [5] |
Flegel TW. Historic emergence, impact and current status of shrimp pathogens in Asia[J]. Journal of Invertebrate Pathology, 2012, 110(2): 166-173. DOI:10.1016/j.jip.2012.03.004 |
| [6] |
孟庆显, 俞开康. 关于对虾的"黑鳃病"[J]. 山东海洋学院学报, 1982, 12(4): 95-99. Meng QX, Yu KK. Notes on the "black gill disease" of penaeid prawn[J]. Journal of Shandong College of Oceanology, 1982, 12(4): 95-99. |
| [7] |
陈波, 吴友, 吕杨, 等. 中国对虾养成期镰刀菌致病性研究[J]. 东海海洋, 1992, 10(4): 7-15. Chen B, Wu Y, Lv Y, et al. Study on pathogenicity of a species of Fusarium in the cultured adult prawn(Penaeus chinensis)[J]. DongHai Marine Science, 1992, 10(4): 7-15. |
| [8] |
Hose JE, Lightner DV, Redman RM, et al. Observations on the pathogenesis of the imperfect fungus, Fusarium solani, in the California brown shrimp, Penaeus californiensis[J]. Journal of Invertebrate Pathology, 1984, 44(3): 292-303. DOI:10.1016/0022-2011(84)90027-2 |
| [9] |
Hafizi R, Salleh B, Latiffah Z. Morphological and molecular characterization of Fusarium solani and F.oxysporum associated with crown disease of oil palm[J]. Brazilian Journal of Microbiology, 2013, 44(3): 959-968. DOI:10.1590/S1517-83822013000300047 |
| [10] |
Khoa LV, Hatai K, Aoki T. Fusarium incarnatum isolated from black tiger shrimp, Penaeus monodon Fabricius, with black gill disease cultured in Vietnam[J]. Journal of Fish Diseases, 2004, 27(9): 507-515. DOI:10.1111/j.1365-2761.2004.00562.x |
| [11] |
战文斌, 孟庆显, 俞开康. 中国对虾镰刀菌病的症状和病理组织学研究[J]. 青岛海洋大学学报, 1993, 23(3): 125-130. Zhan WB, Meng QX, Yu KK. Studies on the symptoms and histopathology of Fusarium disease of penaeid prawn, Penaeus Chinesis[J]. Journal of Ocean University of Qingdao, 1993, 23(3): 125-130. |
| [12] |
朱磊, 刘凡, 黄云, 李文光.白术镰刀根腐病菌(Fusarium lateritium)生物学特性研究[J].安徽农学通报(上半月刊), 2012, 18(11):45-48. Zhu L, Liu F, Huang Y, et al. The biology characteristics of Fusarium lateritium on root rot of Atractylodis macrocephalae Koidz[J]. Anhui Agricultural Science Bulletin, 2012, 18(11):45-48. |
| [13] |
吴佩佩, 孟阳, 毕建才, 等. 拟诺卡氏菌骨架对凡纳滨对虾生长及免疫功能的影响[J]. 水产科学, 2019, 38(4): 521-526. Wu PP, Meng Y, Bi JC, et al. Effects of Nocardiopsis cell wall skeleton on growth and immunity of pacific white shrimp Litopenaeus vannamei[J]. Fisheries Science, 2019, 38(4): 521-526. |
| [14] |
胡小平, 万喆, 李若瑜. 应用CLSI M38-A2方案测定须癣毛癣菌对抗真菌药物敏感性[J]. 中国真菌学杂志, 2011, 6(3): 149-153. Hu XP, Wan Z, Li RY. Antifungal susceptibilities of 44 isolates of Trichophyton mentagrophytes isolates evaluated with CLSI M38-A2 scheme[J]. Chinese Journal of Mycology, 2011, 6(3): 149-153. |
| [15] |
张丁, 张宏. 改良CLSI M38-A方案应用于红色毛癣菌的研究进展[J]. 中国真菌学杂志, 2008, 3(5): 317-320. Zhang D, Zhang H. Research progress of improved CLSI M38-A protocol for Trichophyton rubrum[J]. Chinese Journal of Mycology, 2008, 3(5): 317-320. |
| [16] |
杜宾. 镰刀菌的分类和研究现状[J]. 太原学院学报:自然科学版, 2017, 35(4): 68-70. Du B. The classification and research status of Fusarium[J]. Journal of Taiyuan University :Natural Science Edition, 2017, 35(4): 68-70. |
| [17] |
徐淑菲, 孔繁德, 苗丽, 等. LAMP技术研究进展及其在动物疫病检测中的应用[J]. 中国动物检疫, 2017, 34(1): 75-80. Xu SF, Kong FD, Miao L, et al. Research progress of lamp technology and its application in animal diseases detection[J]. China Animal Health Inspection, 2017, 34(1): 75-80. |
| [18] |
何斐, 张忠良, 崔鸣, 等. 魔芋根域优势真菌鉴定和化感作用及其生防放线菌的筛选[J]. 西北农林科技大学学报:自然科学版, 2016, 44(4): 157-167. He F, Zhang ZL, Cui M, et al. Identification and allelopathic effect of dominant fungi in root-zone of Amorphophallus konjac and screening of the bio-control actinomycetes[J]. Journal of Northwest A and F University:Natural Science Edition, 2016, 44(4): 157-167. |
| [19] |
王芳, 刘秀杰, 刘继秀, 等. 镰刀菌引起的西瓜猝倒病病原鉴定[J]. 中国瓜菜, 2019, 32(8): 106-108. Wang F, Liu Xi J, Liu JX, et al. Identifying pathogen of watermelon seedling damping off by Fusaruim oxysporum[J]. China Cucurbits and Vegetables, 2019, 32(8): 106-108. |
| [20] |
王世伟, 王卿惠, 李小鹏, 等. 镰刀菌分子鉴定与重要应用的研究进展[J]. 微生物学通报, 20185, 45(4): 907-919. Wang SW, Wang QH, Li XP, et al. Progress in molecular identification in the genus Fusarium and its important applications[J]. Microbiology China, 20185, 45(4): 907-919. |
| [21] |
Hiremani NS, Dubey SC. Phylogenetic relationship among Indian population of Fusarium oxysporum f.sp. lentis infecting lentil and development of specific SCAR markers for detection[J]. 3 Biotech, 2019, 9(5): 1-10. |
| [22] |
王茜, 刘凤岐. 中国对虾黑鳃病病原及病变机理的研究[J]. 动物科学与动物医学, 2000, 17(5): 48-50. Wang X, Liu FQ. Studies on the pathogens and pathogenesis of black gill diseases of Penaeus chinensis[J]. Animal Science and Veterinary Medicine, 2000, 17(5): 48-50. |
| [23] |
杨求华, 杨章武, 曹英昆, 等. 凡纳滨对虾越冬亲虾黑鳃病症的初步研究[J]. 渔业研究, 2017, 39(2): 85-89. Yang QH, Yang ZW, Cao YK, et al. A preliminary study on overwinter diseased broodstock of Litopenaeus vannamei with black-gill[J]. Journal of Fisheries Research, 2017, 39(2): 85-89. |
| [24] |
Goncalves P, Guertler C, Bachère E, et al. Molecular signatures at imminent death :Hemocyte gene expression profiling of shrimp succumbing to viral and fungal infections[J]. Developmental and Comparative Immunology, 2014, 42(2): 294-301. DOI:10.1016/j.dci.2013.09.017 |
| [25] |
Walther G, Stasch S, Kaerger K, et al. Fusarium keratitis in Germany[J]. Journal of Clinical Microbiology, 2017, 55(10): 2983-2995. DOI:10.1128/JCM.00649-17 |
| [26] |
刘立春. 真菌性角膜炎的实验室诊断及药物敏感试验分析[J]. 中国现代药物应用, 2008, 2(20): 75. Liu LC. Laboratory diagnosis and drug sensitivity test of fungal keratitis[J]. Chinese Journal of Modern Drug pplication, 2008, 2(20): 75. |
| [27] |
Lalitha P, Shapiro BL, Srinivasan M, et al. Antimicrobial susceptibility of Fusarium, Aspergillus, and other filamentous fungi isolated from keratitis[J]. Archives of Ophthalmology, 2007, 125(6): 789-793. DOI:10.1001/archopht.125.6.789 |