2. 四川农业大学国家级动物类实验教学示范中心, 成都 611130;
3. 农业部兽用药物与兽医诊断技术四川科学观测实验站, 成都 611130
2. National Teaching and Experiment Center of Animal, Sichuan Agricultural University, Chengdu 611130;
3. Sichuan Science-observation Experimental Station of Veterinary Drugs and Veterinary Diagnostic Technology, Ministry of Agriculture, Chengdu 611130
冠状病毒(Coronaviruses,CoVs)是一种有囊膜的、单股正链RNA病毒,其可分为α、β、γ及δ四个病毒属,其中δ冠状病毒主要以禽类和猪群感染为主。猪δ冠状病毒(Porcine deltacoronavirus,PDCoV)于2012年由Woo等[1]通过流行病学调查发现。随后,Hu等[2]在LLC-PK细胞上分离并鉴定了PDCoV。截至目前,美国、加拿大、中国、韩国、泰国及日本等国相继报道了PDCoV的存在[3-7]。
PDCoV主要引起哺乳仔猪发病,以腹泻、呕吐、脱水为主要特征,而猪源冠状病毒主要包括PDCoV、猪流行性腹泻病毒(Porcine epidemic diarrhea,PEDV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)、猪呼吸道冠状病毒(Porcine respiratory coronavirus,PRCV)、猪血凝性脑脊髓炎病毒(Porcine hemagglutinating encephalomy-elitis,PHEV)以及新报道的猪急性腹泻综合征冠状病毒(Swine acute diarrhea syndrome coronavirus,SADS-CoV)等5种,其中SADS-CoV又被称为猪肠道冠状病毒(Porcine/Swine enteric alphacoronavirus,PEAV/SeACoV)[8]。5种病毒中,除PHEV和PRCV外,其他冠状病毒主要引起腹泻,症状相似难以区分。因此建立高效、准确、快速的抗原诊断方法非常迫切。
PDCoV基因组大小约为25.4 kb,是现今已知最小的冠状病毒[9-10]。PDCoV在基因组排序次序为:5′UTR-ORF1a-ORF1b-S-E-M-NS6-N-NS7-3′UTR[11],其中核衣壳蛋白(Nucleocapsid protein,N)是一种磷酸化的蛋白,丰富的存在于宿主细胞内,在不同的毒株中保守性高,可制备针对N蛋白的抗体用于PDCoV的诊断[12]。因此,本研究对全长N蛋白进行了可溶性原核表达,制备了兔抗N蛋白多克隆抗体,并对其临床诊断应用潜力进行了评估,证实N蛋白抗体不与TGEV及PEDV发生交叉反应,并且可特异性的识别细胞培养和感染猪小肠组织中的PDCoV,在PDCoV的病毒鉴定、诊断方法及N蛋白的功能研究等方面具有很好的应用潜力。
1 材料与方法 1.1 材料 1.1.1 质粒、菌株及实验动物大肠杆菌(Escherichia coli)DH5α、Transetta(DE3)购自北京全式金生物技术有限公司(Transgen,北京);pET28a原核载体、PDCoV四川分离株CHN-SC2015(GeneBank登录号:KY398010)由四川农业大学猪病研究中心分离和保存;两月龄雌性新西兰兔购自简阳达硕动物科技有限公司(成都)。
1.1.2 主要试剂、材料PrimerSTAR® Max DNA聚合酶、PrimeScript RT reagent Kit、EcoR I、Xho I、T4DNA ligase购自大连宝生物工程有限公司(TakaRa,大连);HRP-羊抗兔IgG、HRP-兔抗猪IgG、FITC-羊抗兔IgG购自Abclonal(武汉);弗氏完全佐剂和弗氏不完全佐剂均购自Sigma公司(美国);PVDF膜购自Millipore公司(美国)。
1.2 方法 1.2.1 N蛋白的生物信息学分析DNA Star综合预测N蛋白的B细胞抗原表位,用Protscale程序分析其疏水性(https://web.expasy.org/protscale/);用SignalP4.1(http://www.cbs.dtu.dk/servic.es/SignalP/)分析信号肽及切割位点;TMHMM severv.2.0(http://genome.cbs.dtu.dk/services/TMHMM.2.0/)预测蛋白质的跨膜区个数及拓扑结构,具体方法参照文献[13]。
1.2.2 引物设计参照GenBank中收录的CHN-SC2015 N基因全长序列进行引物设计,引物序列为:上游引物P1:5′-CGGAATTCCGATGGCCGCACCAGTAGTCCCTACTA-3′;下游引物P2:5′- CCTCGAGGCTATTTCGTCCTTAGTCGTCGCATC-3′,下划线为EcoR I与Xho I酶切位点,引物由上海生工生物工程有限公司合成。
1.2.3 N蛋白的原核表达及鉴定 1.2.3.1 原核表达载体的构建以CHN-SC2015株cDNA为模板,应用P1/P2引物扩增N基因,PCR体系为25 μL:2×PrimerSTA® Max DNA聚合酶12.5 μL,cDNA 2 μL,P1、P2(10 nmol/mL)各1 μL,ddH2O 8.5 μL。反应条件为:98℃ 5 min;98℃ 15 s,56℃ 15 s,72℃ 45s,30个循环;72℃延伸10 min,产物回收后与pET-28a(+)分别进行双酶切,回收产物在T4 DNA连接酶的作用下于16℃过夜连接后,转化大肠杆菌DH5α进行氨苄抗性筛选,经菌落PCR和测序鉴定,正确的阳性重组质粒命名为pET28-N。
1.2.3.2 重组N蛋白的诱导表达及纯化提取阳性重组质粒转入E.coli Transetta(DE3)表达菌进行诱导表达,超声破碎法破碎细菌,后收集菌液中含有目的蛋白的上清液,离心后用0.22 μm滤膜过滤、超滤柱浓缩、Ni+柱亲合层析纯化并鉴定,BCA蛋白浓度测定试剂盒测定蛋白浓度。
1.2.3.3 重组N蛋白Western-Blot鉴定参考卓严玲等[14]的方法,以1:500稀释的CHN-SC2015株免疫猪阳性血清为一抗,使用HRP-山羊抗猪IgG作为二抗(1:5 000稀释),进行重组N蛋白Western-Blot鉴定。
1.2.4 兔抗N蛋白多克隆抗体的制备及鉴定 1.2.4.1 兔抗N蛋白多克隆抗体的制备与纯化以纯化的PDCoV N蛋白作为抗原,按照吕其壮等[15]的程序和方法进行多克隆抗体的制备与纯化,以间接ELISA法测定纯化后抗体效价,以免疫前的兔血清为阴性对照,以包被E.coli Transetta(DE3)的总蛋白孔为空白对照,以(样品OD450 -空白OD450)/(阴性OD450 -空白OD450)≥2.1即为阳性为阳性判定标准。
1.2.4.2 兔抗N蛋白抗体的Western-blot鉴定取纯化的N蛋白及PDCoV感染的ST细胞裂解液进行SDS-PAGE分析,随后将蛋白转印到PVDF膜上,用含5%脱脂奶的PBST封闭1.5 h。以制备的兔抗N多抗血清为一抗(1:200稀释),4℃孵育过夜后,TBST洗膜3次。以HRP-山羊抗兔IgG为二抗(1:5 000稀释),37℃孵育1 h,TBST洗膜3次后,通过DAB底物显色。
1.2.5 兔抗N蛋白抗体的应用评价 1.2.5.1 细胞间接免疫荧光检测以PDCoV及TGEV感染ST细胞,以PEDV感染Vero细胞,同时设立未感染病毒的细胞为阴性对照,24 h后弃去培养基,4%的多聚甲醛固定细胞30 min后,PBS洗3次,以0.1% Triton X-100通透细胞30 min,PBS洗3次后,2% BSA封闭1 h,以兔抗N血清(1:100)为一抗检验PDCoV N蛋白抗血清是否与PEDV及TGEV存在交叉反应,以FITC-羊抗兔IgG(1:100稀释)为二抗,进行IFA检测观察结果。同时,以猪抗PEDV、TGEV抗血清为一抗验证病毒是否感染细胞,以FITC-兔抗猪IgG(1:100稀释)为二抗,进行结果观察。
1.2.5.2 流式细胞检测将PDCoV以MOI=1接种至铺满单层的ST细胞,培养48 h后出现病变,收集单细胞悬液,用4%的多聚甲醛固定细胞30 min后,以0.1% Triton X-100通透细胞10 min,加入饱和兔抗N蛋白抗体冰上孵育30 min。PBS洗涤3次后,细胞悬液与FITC-羊抗兔IgG二抗(1:500)孵育。全部样品悬浮于PBS中,并使用流式细胞仪进行检测。以只孵育FITC-羊抗兔IgG二抗的细胞悬液作为对照,流式细胞检测数据使用软件FlowJo software进行分析。
1.2.5.3 组织石蜡切片免疫荧光检测取本实验室保留的PDCoV感染仔猪7 d的空肠前端病变组织的石蜡切片,进行脱蜡至水并用EDTA(pH 8.0)抗原修复缓冲液进行抗原修复,10% BSA封闭,以兔抗N蛋白抗体为一抗(1:500)和以FITC标记羊抗兔IgG为二抗(1:500)孵育4℃过夜,用50%甘油缓冲液封片观察。
2 结果 2.1 PDCoV N蛋白结构与功能预测经DNAStar软件中的Protean分析显示,N蛋白具有较好的抗原性和亲水性,B细胞表位较为分散的分布于整个蛋白序列(图 1);经ProtScale软件分析,该蛋白整体呈亲水性;采用TMPRED工具对N蛋白跨膜区域进行预测,结果显示N蛋白无信号肽也不属于跨膜蛋白。

|
| 图 1 PDCoV N蛋白结构与功能预测 |
重组表达的N蛋白经SDS-PAGE分析与预期目的蛋白大小(44 kD)一致,而未诱导的重组菌和Transetta空载对照无相应条带。蛋白主要存在于上清。Western blot显示,纯化的N蛋白可与猪抗PDCoV阳性血清发生特异性反应(图 2),表明纯化后的蛋白具有良好的反应原性。
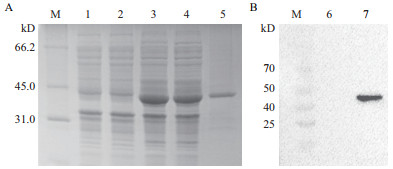
|
| M:蛋白分子量标准;1:pET-28a(+)/ Transetta菌体总蛋白;2:未诱导的pET28-N/ Transetta菌体总蛋白;3:诱导后的pET-28-N/ Transetta菌体总蛋白;4:诱导后pET-28-N Transetta菌体裂解的上清;5:纯化的PDCoV N蛋白;6:pET-28a(+)/ Transetta菌体总蛋白;7:诱导后的pET-28-N/ Transetta菌体总蛋白 图 2 PDCoV重组N蛋白(pET28-N)SDS-PAGE(A)及WB鉴定(B)图 |
用间接ELISA方法测定兔抗N蛋白抗体效价为1:204 800(图 3)。Western-blot结果显示该抗体在44 kD与38 kD处分别重组N蛋白及PDCoV感染的ST细胞裂解液中N蛋白形成特异性的条带(图 3)。
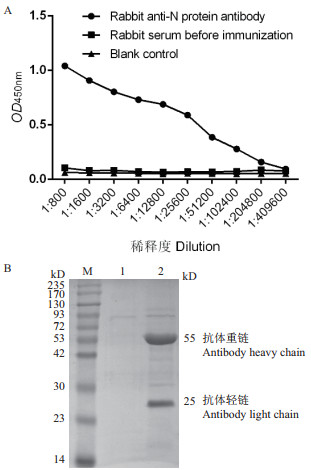
|
| M:非预染蛋白分子量标准;1:未纯化的猪PDCoV N蛋白多克隆抗体;2:纯化的猪PDCoV N蛋白多克隆抗体 图 3 兔抗N蛋白效价测定(A)及纯化PDCoV蛋白抗体的SDS-PAGE分析(B) |
Western-blot结果显示该抗体在44 kD与38 kD处分别重组N蛋白及PDCoV感染的ST细胞裂解液中N蛋白形成特异性的条带(图 4)。

|
| M:蛋白分子量标准;1:pET-28a(+)/ Transetta菌体总蛋白;2:PDCoV感染的ST细胞裂解液;3:纯化的PDCoV N蛋白 图 4 兔抗N蛋白抗体的Western-blot鉴定 |
通过IFA测定兔抗N蛋白抗体对PDCoV感染的ST细胞结合情况,结果表明,PDCoV感染ST细胞的细胞浆可观察到特异性的绿色荧光,而在TGEV感染的ST细胞与PEDV感染的Vero细胞上未见荧光,未接毒组也无荧光信号,同时,以TGEV及PEDV特异性抗血清为一抗,可在相应的细胞上观察到特异性的绿色荧光,表明该N蛋白抗体可与PDCoV特异性结合,与TGEV及PEDV无交叉反应(图 5)。

|
| A:兔抗PDCoV N蛋白抗血清对TGEV及PEDV的交叉识别检验;B:TGEV阳性对照及阴性对照;C:PEDV阳性对照及阴性对照 图 5 细胞的间接免疫荧光结果(600×) |
流式细胞检测结果显示(图 6),利用兔抗N蛋白抗体作为一抗,可以检测出PDCoV感染的ST细胞,并且在接毒量为MOI=1时,可检测出的阳性细胞比例为77.9%,表明该抗体能够较好识别PDCoV感染的细胞。

|
| A:阴性对照;B:阳性细胞的比例 图 6 流式细胞术检测兔抗N蛋白抗体识别PDCoV感染的ST细胞 |
取PDCoV人工感染哺乳仔猪空肠,采用兔抗N蛋白抗体作为一抗,FITC标记的羊抗兔IgG为二抗,结果表明,兔抗N蛋白抗体能特异性的结合空肠中的病毒,显示绿色荧光,可指示组织中PDCoV抗原分布及含量(图 7)。

|
| A:攻毒仔猪空肠组织的免疫荧光检测;B:未攻毒仔猪空肠组织的免疫荧光检测 图 7 仔猪肠道组织切片免疫荧光结果(100×) |
猪δ冠状病毒(Porcine deltacoronavirus,PDC-oV)是一种危害养猪业的新型冠状病毒,该病在全球呈现逐步蔓延的趋势。PDCoV感染猪的临床症状与PEDV、TGEV及SADS-CoV感染极为相似,临床观察难以鉴别诊断必须借助实验室诊断技术才能确诊[4, 16-17]。PDCoV N蛋白在宿主细胞内的表达量较多,是最早刺激机体产生抗体的抗原蛋白[18]。Zhao等[19]通过比对CHN-SC2015株N蛋白氨基酸同源性发现,其在不同的PDCoV毒株中保守性高,为97.1%-100%。因此,依据N蛋白保守性高及在机体中产生早的特性,制备针对PDCoV N蛋白的抗体有利于病毒的早期诊断。
目前制备针对病毒的抗体有3种方法[20]:(1)利用杂交瘤技术制备单克隆抗体;(2)应用基因工程技术将目的抗体基因体外扩增并克隆到表达载体中,并在适当的宿主中表达,成为有抗体功能的基因工程抗体,目前研制的基因工程抗体主要有嵌合抗体、人源化抗体、Fab抗体、Fv抗体和单链抗体等;(3)以纯化的抗原和佐剂混合后免疫动物,获得的多克隆抗体。付嘉钰等[21]制备了PDCoV N蛋白的单克隆抗体,但是单克隆抗体制备时间长且难以大量生产。同时,由于N蛋白的抗原表位报道的缺少,制作较为复杂,基因工程抗体难以实现。多克隆抗体制备方法简便而且经济,因此本研究以原核表达的PDCoV N蛋白免疫新西兰大白兔,制备了兔抗N蛋白多克隆抗体。
猪冠状病毒N蛋白之间可能会存在交叉反应,Xie等[22]通过制备抗N蛋白的多克隆抗体,以IFA试验证实PEDV与TGEV N蛋白之间存在交叉反应。因此,本研究通过IFA试验表明抗PDCoV N蛋白多克隆抗体能与PDCoV病毒特异性结合,与TGEV及PEDV无交叉反应。流式细胞术检测也验证兔抗N蛋白多克隆抗体能够较好的结合PDCoV。以制备的兔抗N蛋白多克隆抗体为一抗,对人工感染PDCoV仔猪肠道组织进行免疫荧光分析,在空肠组织观察到有大量的小肠绒毛上皮细胞出现特异性的绿色荧光,与Hu等[23]人工接种PDCoV于新生仔猪后,通过免疫荧光观察到的结果一致。综上所述,制备的兔抗N蛋白多克隆抗体具有高度的特异性,可用于PDCoV抗原的检测及N蛋白功能的研究。
4 结论本研究通过对PDCoV N蛋白进行生物信息学分析后,构建了全长N基因重组表达质粒pET28a-N,并表达获得大量的可溶性蛋白,将N蛋白作为抗原免疫家兔制备了抗PDCoV N蛋白多克隆抗体,采用间接ELISA测定该多克隆抗体的效价,通过IFA试验、流式细胞术及免疫荧光试验检测了该多克隆抗体的反应特异性,结果表明,制备多抗效价高于1:204 800且具有高度的特异性,可满足后续深入研究N功能和进一步探索PDCoV与其宿主间互作机制的需要。
| [1] |
Woo PC, Lau SK, Lam CS, et al. Discovery of seven novel mammalian and avian coronaviruses in the genus deltacoronavirus supports bat coronaviruses as the gene source of alphacoronavirus and betacoronavirus and avian coronaviruses as the gene source of gammacoronavirus and deltacoronavirus[J]. J Virol, 2012, 86(7): 3995-4008. |
| [2] |
Hu H, Jung K, Vlasova AN, et al. Isolation and characterization of porcine deltacoronavirus from pigs with diarrhea in the United States[J]. J Clin Microbiol, 2015, 53(5): 1537-1548. |
| [3] |
Dong N, Fang L, Zeng S, et al. Porcine deltacoronavirus in mainland China[J]. Emerg Infect Dis, 2015, 21(12): 2254. |
| [4] |
Homwong N, Jarvis MC, Lam HC, et al. Characterization and evolution of porcine deltacoronavirus in the United States[J]. Prev Vet Med, 2016, 123(2): 168-174. |
| [5] |
Lee S, Lee C. Complete genome characterization of Korean porcine deltacoronavirus strain KOR/KNU14-04/2014[J]. Genome Announc, 2014, 2(6): e01191-14. |
| [6] |
Saeng-Chuto K, Stott CJ, Wegner M, et al. Retrospective investigation and evolutionary analysis of a novel porcine deltacoronavirus strain detected in Thailand from 2008 to 2015[J]. Arch Virol, 2017, 162(7): 2103-2108. |
| [7] |
Suzuki T, Shibahara T, Imai N, et al. Genetic characterization and pathogenicity of Japanese porcine deltacoronavirus[J]. Infection, Genetics and Evolution, 2018, 61(1): 176-182. |
| [8] |
Yang YL, Qin P, Wang B, et al. Broad cross-species infection of cultured cells by the bat HKU2-related swine acute diarrhea syndrome coronavirus(SADS-CoV)and identification of its replication in murine dendritic cells highlight its potential for diverse interspecies transmission[J]. J Virol, 2019, 93(24): e01448-19. |
| [9] |
Woo PCY, Huang Y, Lau SKP, et al. Coronavirus genomics and bioinformatics analysis[J]. Viruses, 2010, 2(8): 1804-1820. |
| [10] |
Song D, Zhou X, Peng Q, et al. Newly emerged porcine deltacoronavirus associated with diarrhoea in swine in China:identification, prevalence and full-length genome sequence analysis[J]. Transboundary and Emerging Diseases, 2015, 62(6): 575-580. |
| [11] |
Fang P, Fang L, Liu X, et al. Identification and subcellular localization of porcine deltacoronavirus accessory protein NS6[J]. Virology, 2016, 499(1): 170-177. |
| [12] |
Lee S, Lee C. Functional characterization and proteomic analysis of the nucleocapsid protein of porcine deltacoronavirus[J]. Virus Res, 2015, 208(1): 136-145. |
| [13] |
仇书兴, 殷星, 苏淑娟, 等. 新型H7N9禽流感病毒NA蛋白胞外区片段的生物信息学分析及其多克隆抗体制备[J]. 生物技术通报, 2019, 35(12): 85-93. Qiu SX, Ying X, SU SJ, et al. Bioinformatics analysis of the extracellular region of NA protein in novel H7N9 avian influenza virus and preparation of polyclonal antibodies[J]. Biotechnology Bulletin, 2019, 35(12): 85-93. |
| [14] |
卓严玲, 吕其壮, 邓家华, 等. 猪P58~(IPK)蛋白多克隆抗体的制备[J]. 农业生物技术学报, 2019, 27(11): 2083-2090. Zhuo YL, Lv QZ, Deng JH, et al. Preparation of polyclonal antibody against porcine(Sus scrofa)P58IPK Protein[J]. Journal of Agricultural Biotechnology, 2019, 27(11): 2083-2090. |
| [15] |
吕其壮, 刘畅, 颜秋, 等. 猪热休克蛋白40(Hsp40)的原核表达、纯化及多克隆抗体的制备[J]. 中国兽医学报, 2019, 39(4): 728-734. Lv QZ, Liu C, Yan Q, et al. Prokaryotic expression and purification of porcine heat shock protein 40(Hsp40)and preparation of its polyclonal antibody[J]. Chinese Journal of Veterinary Science, 2019, 39(4): 728-734. |
| [16] |
Chen Q, Gauger P, Stafne M, et al. Pathogenicity and pathogenesis of a United States porcine deltacoronavirus cell culture isolate in 5-day-old neonatal piglets[J]. Virology, 2015, 482(1): 51-59. |
| [17] |
Wang L, Byrum B, Zhang Y. Detection and genetic characterization of deltacoronavirus in pigs, Ohio, USA, 2014[J]. Emerging Infect Dis, 2014, 20(7): 1227-1230. |
| [18] |
Wang L, Hayes J, Sarver C, et al. Porcine deltacoronavirus:histological lesions and genetic characterization[J]. Arch Virol, 2016, 161(1): 171-175. |
| [19] |
Zhao Y, Qu H, Hu J, et al. Characterization and pathogenicity of the porcine deltacoronavirus isolated in southwest China[J]. Viruses, 2019, 11(11): E1074. |
| [20] |
莫发荣, 谢小薰, 罗国容. 抗体制备的新技术[J]. 医学综述, 2007, 13(1): 4-5. Mo FR, Xie XX, Luo GR. New technique of antibody preparation[J]. Medical Recapitulate, 2007, 13(1): 4-5. |
| [21] |
付嘉钰, 陈汭, 黄小波, 等. 1株猪δ冠状病毒N蛋白单克隆抗体制备与鉴定[J]. 微生物学通报, 2020, 47. Fu JY, Chen R, Huang XB, et al. Preparation and identification of a monoclonal antibody against N protein of porcine deltacoronavirus[J]. Microbiology China, 2020, 47(6): 1847-1856. DOI:10.13344/j.microbiol.china.190735 |
| [22] |
Xie W, Ao C, Yang Y, et al. Two critical N-terminal epitopes of the nucleocapsid protein contribute to the cross-reactivity between porcine epidemic diarrhea virus and porcine transmissible gastroenteritis virus[J]. J Gen Virol, 2019, 100(2): 206-216. |
| [23] |
Hui H, Jung K, Vlasova A, et al. Experimental infection of gnoto-biotic pigs with the cell-culture-adapted porcine deltacoronavirus strain OH-FD22[J]. Arch Virol, 2016, 161(12): 3421-3434. |




