棉花是世界上最主要的经济作物之一, 中国是全球棉花种植面积最多的国家。棉花属锦葵科(Malvaceae)、棉属(Gossypium)植物, 通过对棉花形态学、细胞学和地理分布等的研究, 曾对棉花提出了多种分类的方法。Fryxell[1]将棉属分为8个基因组, 9个亚组, 共包括50个种。之后, Wendel等[2]发现了2个野生种, 并命名为艾克曼棉及斯提芬氏棉。因此, 公认棉花共有52个种。中国是亚洲棉次级起源中心之一, 亚洲棉早熟、耐旱和耐瘠能力强, 对枯萎病也有很好的抗性, 但由于栽培棉种质资源遗传多样性较低, 远缘杂交是快速获得新基因型并丰富种质资源遗传多样性的方法, 通过远缘杂交将野生棉的有利性状导入到栽培棉中, 从而改善栽培棉的某些不良性状[3]。经过长期的自然进化与选择, 野生棉通过适应新的环境变化产生了大量的有利变异, 使得其适应环境的能力增强。因此, 野生棉中具有很多潜在的优良基因(如D基因组拟似棉有抗寒、抗旱、抗棉铃虫、高抗枯萎病、耐锈病、无蜜腺的优质潜力)。郭旺珍等[4]利用SSR分子标记技术, 对棉属A、D染色体组的二倍体和四倍体代表种进行了遗传多样性分析, 支持拟似棉是D染色体组最原始的棉种。因此, 研究拟似棉的遗传机理及利用其进行种质创新也显得尤为重要。
远缘杂交是实现棉花种间杂交、基因重组及遗传改良的重要途径。通过远缘杂交将各棉种的优良性状进行重组, 再经过筛选培育出高产、优质、稳产的棉花新种质[5]。许多棉花育种家通过远缘杂交进行了大量试验并取得了一定成果。冯文林等[6]将陆地棉与海岛棉进行正反杂交, 对后代农艺性状及纤维品质的相关性进行测定分析并探究其规律, 为棉花育种提供参考依据。申状状等[7]以陆地棉×斯特提棉组合杂交产生F1, 并对杂种进行加倍, 成功获得异源六倍体种质, 斯特提棉中种子腺体延缓发育性状在异源六倍体中继续表达。Konan等[8]对陆地棉×瑟伯氏棉×长萼棉回交一代的减数分裂行为与育性进行分析, 为提高纤维细度特性提供良好的种质资源。
国内外关于亚洲棉与拟似棉杂交的相关研究鲜有报道, 对拟似棉遗传机理及致死原因的分子机制也鲜有报道。本研究利用亚洲棉与拟似棉进行远缘杂交, 并对获得的F1杂种进行形态学及SSR分子标记鉴定, 验证杂种的真实性, 以期对该新种质进行加倍, 为棉属物种形成、基因组互作和杂交过程中亲本基因组之间发生的染色体重组提供理论依据, 并为研究拟似棉致死机制提供新的种质, 为异源多倍体进化研究提供方向。
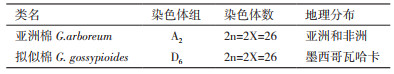
1 材料与方法 1.1 材料所用材料如表 1所示, 拟似棉分别于2014年、2015年、2016年取材于国家种质三亚野生棉圃。
以亚洲棉为母本、野生种拟似棉作父本进行杂交试验, 先将亚洲棉去雄, 再将拟似棉的花粉涂抹到亚洲棉的柱头上, 每天上午进行授粉, 并重复3次, 间隔时间为24 h; 并用滴管滴加0.1%的赤霉素在花柄基部用以保铃。
1.2.2 形态学鉴定收获杂交后的F1种子, 并将其与父母本的种子一同播种在营养钵中, 待幼苗叶片完全展开时, 观察其形态特征和完全成熟的组织或器官, 将亚拟杂种从植株的形态、叶片等与亲本进行对比, 从而初步鉴定杂种的真实性。
1.2.3 SSR分子标记鉴定选取父母本及杂种植株上新鲜且幼嫩的叶片为材料, 通过CTAB法提取叶片中的DNA, 再使用银染法检测。选取SSR引物共12对(表 2), 引物来自CMD数据库(http://www.cottonmarker.org, 由北京赛百盛基因技术有限公司合成)。PCR反应体系为正、反向引物(2.5 μmol/L)各1 μL、10×Buffer(无Mg2+)2 μL、MgCl2 1.6 μL、Taq酶(5 U/µL)0.2 µL、dNTPs(10 mmol/L)0.2 µL, 去离子水补足。PCR扩增程序为94℃ 5 min; 94℃ 50 s, 58℃ 50 s, 72℃ 2 min, 34个循环; 72℃ 10 min, 4℃保存。用8%非变性聚丙烯酰胺凝胶电泳检测。参考申状状等[9]方法进行银染检测。
选择重复性好、条带清晰的引物, 进行重复试验, 选择重复值相同的条带用于统计及分析, 统计杂种中双亲与新出现的条带数。
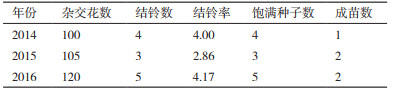
2 结果 2.1 亚拟远缘杂交亚洲棉选择苞叶和花蕾等长且发黄时的花蕾合适。但亚洲棉和拟似棉有生殖隔离不易成铃, 需要采用重复授粉和赤霉素保铃等措施。杂交获得的铃大部分没有种子, 采用增加杂交花数量来保证部分铃有种子。且杂交获得的种子不饱满, 不易成苗, 需采用精细管理保证成苗。由于亚拟远缘杂种幼苗期有死亡现象, 可能与拟似棉的致死基因有关。观察发现强光照射加速杂种的衰老死亡, 所以采用盆栽, 便于管理, 夏天搭建黑色网棚以避免强光照射, 冬天转移进温室, 保证杂种苗长成健壮植株。2014年杂交结果为:亚洲棉×拟似棉杂交花数为100, 结铃数为4, 结铃率为4.00%, 饱满种子数4粒, 成苗1株。2015年杂交结果为:亚洲棉×拟似棉杂交花数为105, 结铃数为3, 结铃率为2.86%, 饱满种子数3粒, 成苗2株。2016年杂交结果为:亚洲棉×拟似棉杂交花数为120, 结铃数为5, 结铃率为4.17%, 饱满种子数5粒, 成苗2株(表 3)。
亚拟杂种生长受阻且生长缓慢, 在杂种植株未开花前就出现死亡现象, 无法正常生长。但经过避强光处理和温室培养, 杂种植株健壮成长, 优于双亲, 但杂种不现蕾不开花(图 1)。

|
| A:亚洲棉母本;B:亚拟杂种;C:拟似棉父本 图 1 亚拟杂种植株与父母本形态学比较 |
对亚拟杂种的叶片与双亲进行比较(图 2)。亚洲棉呈掌状分裂, 叶裂片数在5-7片, 裂刻及叶脉整体表现较父本显著, 各裂片间差异明显, 中间3个裂片较其他裂片大, 且有规则, 叶片表面有细小的茸毛; 拟似棉叶裂数在3-5片, 中间裂片较其他裂片大而长, 呈柳叶状, 叶片表面无茸毛。亚拟杂种叶片整体形态偏向于拟似棉, 大部分形状介于两者之间, 叶裂片数3-5片, 中间裂片呈渐尖细长状, 裂刻较双亲小, 叶脉深浅基于双亲之间。

|
| A:亚洲棉母本;B:亚拟杂种;C:拟似棉父本 图 2 亚拟杂种叶片与父母本的叶片比较 |
高温对杂种的生长影响很大, 会加速杂种的死亡, 并且由于基因互作等关系, 拟似棉与亚洲棉杂种致死基因呈显性, 杂种出现幼苗致死现象。
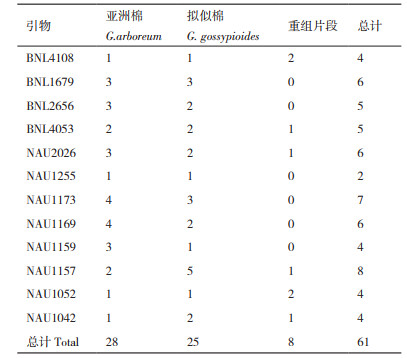
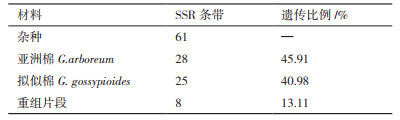
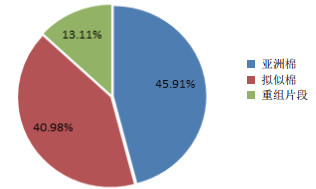
2.3 亚拟杂种SSR分子标记鉴定通过SSR分子标记方法, 利用12对引物对父母本及杂种进行DNA水平上的分析, 共扩增出12组清晰的多态性条带(表 4)。对12组条带进行统计分析(表 5), 在亚拟杂种中共有61条清晰条带, 其中有28条来自母本, 25条来自父本, 8条属于新的重组条带, 遗传比例分别为45.91%、40.98%和13.11%(图 3)。
|
| 图 3 亚拟杂种的SSR多态性来源 |
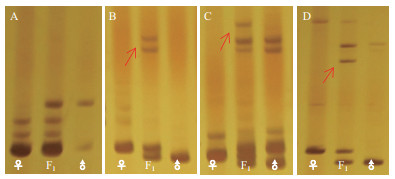
在这些条带组中, 有11组条带扩增出的分子量范围为50-500 bp, 引物NAU1173扩增出的条带分子量大于500 bp。在11组引物条带中, 引物BNL2656扩增出的是双亲的互补贡献带(图 4-A), 在引物BNL4108、BNL4053、NAU2026、NAU1157、NAU1052、NAU1042中除了双亲的互补条带还出现了新的条带(图 4), 表明杂交过程中基因组之间可能出现了基因互作或染色体重组。进一步从分子水平证明了杂种是组合亚洲棉和拟似棉遗传成分的真杂种。
|
| A:BNL2656;B:NAU1052;C:NAU1157;D:NAU2026 图 4 SSR引物在亚拟杂种及父母本中的扩增结果 |
远缘杂交是拓宽种质遗传基础的重要途径之一[10]。为了扩大棉花的遗传多样性, 需要引进野生棉的潜在基因, 通过远缘杂交手段, 培育出适应性强、综合性状优良的棉花新种质。然而, 通过远缘杂交之后的种质并不能马上应用到生产上, 需要经过进一步的选育才能成为生产应用的新品种。肖松华等[11]通过将栽培棉与野生棉杂交培育出了209份有陆地棉遗传背景的种质材料, 并利用其中65份材料, 创制出了抗黄萎病的新品种。郭宝生等[12]对陆地棉与海岛棉、瑟伯氏棉杂交后代进行改良, 经过多年连续定向选择, 获得类型丰富的改良材料493份。并不是所有材料都能成功的进行远缘杂交, 由于棉属不同种在形成进化过程中有不同的遗传背景, 所以常会伴随着杂交不亲和、杂交不育或杂种败育、杂交后代出现疯狂分离等障碍[13]。想要克服这些障碍, 最重要的就是消除种间生殖隔离。生殖隔离包括合子前(如花粉不能在异种柱头上萌发)与合子后(杂种不育及败育)隔离[14]。本研究中选取的亲本都是二倍体, 虽然部分杂交出现合子前不亲和的现象, 但最终成功获得了杂种, 产生合子后不亲和现象即亚拟杂种幼苗致死, 这与基因的互作有关。基因互作是造成亚拟杂种不能成活的重要原因, 不同位点基因互作不亲和(Bateson-dobzhansky-muller incompatibilities, BDM模型)认为由于物种在长期的选择进化过程中积累了大量的遗传变异, 在杂交重组后这些基因会产生不良的互作效应, 造成杂种的败育等不良现象[15]。
亚拟杂种中不仅结合了双亲的条带, 还出现了新的带, 这是杂交过程中发生了基因的互作及染色体重组的结果。杂种生长过程中可以通过植物激素、染色体加倍、嫁接、强制回交等方法来调节其生理状况或恢复其育性。王志龙等[16]研究了海岛棉与拟似棉F1不育原因, 并通过植物激素克服了一些杂交不亲和及杂种不育。基因组互作是促成生物进化的重要原因之一, 本研究为探究拟似棉与亚洲棉基因组互作提供了理论基础, 解释了亚拟杂种败育的重要原因。
3.2 杂种鉴定方法探讨棉花属常异花授粉作物, 所以在杂交过程中需要仔细处理去雄, 去雄不彻底会造成假杂种, 因此, 鉴定杂种的真假具有十分重要的意义。一般鉴定杂种的方法有形态学鉴定、细胞学鉴定以及分子鉴定等。形态学鉴定直观、简单, 对杂种初步鉴定起到重要作用。细胞学鉴定能够通过父母染色体数不同时, 鉴定染色体数目判断真假杂种, 但当父母本染色体数一致时, 这种方法鉴定具有局限性[17]。分子标记鉴定由于其可靠性高, 所以广泛应用于鉴定杂种中, 其中SSR因其操作简单、稳定准确被广泛应用于真假杂种的鉴定及杂种纯度的鉴定[18]。付小琼等[19]利用SSR对亲本未知的F1杂种及其产生的F2群体进行了种质真实度与纯度的鉴定, 并且构建了F1的SSR指纹图谱, 最终验证了F1杂种纯度高, F2出现了分离现象且杂合程度高。申状状等[9]对杂交育成的亚瑟杂种进行SSR分子鉴定, 进一步印证了杂种的真实性。石建斌等[20]采用筛选出的26对SSR引物, 对保存的58份棉花种质资源进行纯度检测和遗传多样性分析, 证明了品种资源的DNA聚类与品种的亲缘关系相关性较高, 表明棉花种质资源遗传的多样性与复杂性。
3.3 杂种致死及半致死杂种致死一般也称为杂种劣势, 指生长旺盛的亲本在杂交后产生的F1往往会有黄化、变色、生长矮小以及生长势降低等现象, 最终导致植株死亡[21]。戴宝生[22]报道了陆地棉与海岛棉杂种节间缩短、植株矮小最终花叶脱落导致死亡; Phillips等[23]报道了陆地棉与拟似棉杂种植株矮小叶片失绿、茎秆变脆导致植株死亡, 又发现了克劳茨基棉与戴维逊氏棉杂种在幼株或胚胎时期形成遗传瘤, 新叶的生长速度与老叶的坏死速度相等, 即半致死现象。本研究亚洲棉与拟似棉的杂种同样是节间缩短、植株矮小、叶片从下方开始变红最终植株无法进行光合作用导致死亡。本研究通过远缘杂交形成亚拟杂种, 为研究拟似棉遗传机理及致死原因提供新种质, 并且后续可以通过测序及生信分析等手段, 确定致死的遗传模式, 从分子水平解释拟似棉遗传规律及致死遗传机制。
3.4 棉属多倍化棉属的四倍体棉种的形成来源于A、D二倍体基因组, Wendel等[24]、Li等[25]认为四倍体棉种中A基因组由亚洲棉提供, 而Wang等[26]、梅磊等[27]支持四倍体中D基因组的供体种是雷蒙德氏棉。但A基因组的供体种(亚洲棉)证据要比D基因组供体种(雷蒙德氏棉)的证据更明确, 所以学术界一直对四倍体供体种的起源争论不断。郭旺珍等[4]利用SSR标记对10个二倍体棉种进行了聚类, 结果表明, 拟似棉是D基因组最原始的棉种。吴玉香[28]通过RAPD+SSR标记对异源四倍体棉种与A、D基因组中可能的供体种进行了遗传相似系数的分析, 结果表明, 拟似棉的平均遗传相似系数仅次于雷蒙德氏棉。因此, 研究亚拟杂种的基因表达可以为研究棉属多倍体化提供一定的方向, 为寻找D亚基因组供体种提供证据, 揭示棉属多倍体进化规律。以期对该新种质进行加倍, 对探究异源四倍体棉种的起源也具有十分重要的意义。
4 结论克服了亚洲棉×拟似棉生殖隔离, 从分子水平证明了F1杂种的真实性, 同时在杂交过程中发生了基因互作及染色体重组。
| [1] |
Fryxell PA. A revised taxonomic interpretation of Gosspium L. (Malvaceae)[J]. Pheedea, 1992, 2(2): 108-165. |
| [2] |
Wendel JF, Grover CE. Taxonomy and evolution of the cotton genus, Gossypium[M]. Fang DD, Percy RG. Cotton American Society of Agronomy Inc., Madison: 2015.
|
| [3] |
冀丽霞, 郭宝德, 雷伟, 等. 棉花特异种质材料的选育研究[J]. 种子科技, 2017, 35(8): 126-128. Ji LX, Guo BD, Lei W, et al. Study on breeding of cotton specific cermplasm materials[J]. Seed Scicence, 2017, 35(8): 126-128. DOI:10.3969/j.issn.1005-2690.2017.08.088 |
| [4] |
郭旺珍, 王凯, 张天真. 利用SSR标记技术研究棉属A、D染色体组的进化[J]. 遗传学报, 2003(2): 183-188. Guo WZ, Wang K, Zhang TZ. A and D genome evolution in gossypium revealed using SSR molecular markers[J]. Journal of Genetics and Genomics, 2003(2): 183-188. |
| [5] |
蔡小彦, 王玉红, 许艳超, 等. 棉花种间远缘杂交及F1真假杂种的SSR鉴定方法研究[J]. 中国棉花, 2018, 45(11): 6-9,44. Cai XY, Wang YH, Xu YC, et al. Identification of cotton interspecific hybrids with SSR markers[J]. China Cotton, 2018, 45(11): 6-9,44. |
| [6] |
冯文林, 陈全家, 曲延英. 棉花海陆棉杂交后代农艺与纤维品质性状相关性研究[J]. 新疆农业科学, 2015, 52(3): 393-401. Feng WL, Chen QJ, Qu YY. Relativity of agronomic traits and fiber quality of sea-land cotton hybrid progeny[J]. Xinjiang Agricultural Sciences, 2015, 52(3): 393-401. |
| [7] |
申状状, 李昱樱, 荣二花, 等. 陆地棉和野生斯特提棉种间异源六倍体的合成与性状鉴定[J]. 作物学报, 2019, 45(4): 628-634. Shen ZZ, Li YY, Rong EH, et al. Allohexaploid synthesis and its characteristic identification between cotton species Gossypium hirsutum and G. sturtianum[J]. Acta Agronomica Sinica, 2019, 45(4): 628-634. |
| [8] |
Konan NO, Mergeai G. Relationship between meiotic behaviour and fertility in backcross-1 derivatives of the[(Gossypium hirsutum × G. thurberi)2 × G. longicalyx]trispecies hybrid[J]. Comparative Cytogenetics, 2020, 14(1): 75-95. DOI:10.3897/CompCytogen.v14i1.47231 |
| [9] |
申状状, 杨娜, 荣二花, 等. 亚洲棉与瑟伯氏棉种间远缘杂种的合成及其性状鉴定[J]. 分子植物育种, 2017, 15(6): 2291-2297. Shen ZZ, Yang N, Rong EH, et al. Synthesis and identification of interspecific hybrid between Gossypium arboreum L. and G. thurberi T.[J]. Molecular Plant Breeding, 2017, 15(6): 2291-2297. |
| [10] |
崔淑芳, 钱玉源, 王广恩, 等. 远缘杂交种冀棉25的选育及其育种利用[J]. 中国棉花, 2018, 45(3): 21-25. Cui SF, Qian YY, Wang GE, et al. Breeding and application of intergeneric hybridization cotton variety Jimian 25[J]. China Cotton, 2018, 45(3): 21-25. DOI:10.3969/j.issn.1003-0662.2018.03.008 |
| [11] |
肖松华, 刘剑光, 赵君, 等. 棉花远缘杂交创制抗黄萎病新种质[J]. 棉花学报, 2015, 27(6): 524-533. Xiao SH, Liu JG, Zhao J, et al. Creation of a new resistant germplasm to verticillium wilt by distant hybridization in upland cotton[J]. Cotton Science, 2015, 27(6): 524-533. |
| [12] |
郭宝生, 韩泽林, 耿军义, 等. 陆、海、瑟棉花远缘杂交后代的遗传改良[J]. 华北农学报, 2007(S2): 85-88. Guo BS, Han ZL, Geng JY, et al. Genetic improvement of distant hybridization offsprings come from G.hirsutum and G.barbadense and G.thurberi[J]. Acta Agriculturae Boreali-Sinica, 2007(S2): 85-88. DOI:10.7668/hbnxb.2007.S2.022 |
| [13] |
陈煜.棉属(Gossypium)种间杂交研究及陆地棉(G. hirsutum)-澳洲棉(G. australe)异附加系的培育[D].南京: 南京农业大学, 2014. Chen Y. Study on the interspecific hybridization in Gossypium and development of alien addition lines from Gossypium australe to Gossypium hirsutum[D]. Nanjing: Nanjing Agricultural University, 2014. |
| [14] |
吕昊敏, 周仁超, 施苏华. 生态物种形成及其研究进展[J]. 生物多样性, 2015, 23(3): 398-407. Lv HM, Zhou RC, Shi SH. Recent advances in the study of ecological speciation[J]. Biodiversity Science, 2015, 23(3): 398-407. |
| [15] |
吕锐玲, 周强, 王欢, 等. 植物远缘杂交中生殖隔离研究进展[J]. 湖北农业科学, 2016, 55(24): 6337-6341. Lv RL, Zhou Q, Wang H, et al. Research progress of reproductive isolation in distant hybridization of plants[J]. Hubei Agricultural Sciences, 2016, 55(24): 6337-6341. |
| [16] |
王志龙, 姜茹琴, 何鉴星, 等. 棉属海岛棉×拟似棉F1不育性研究[J]. 遗传学报, 1997(4): 368-372. Wang ZL, Jiang RQ, He JX, et al. Study on sterility of hybrid between G. barbadense and G. gossypioides[J]. Journal of Genetics and Genomics, 1997(4): 368-372. |
| [17] |
Kwiatek MT, Kurasiak-Popowska D, Mikolajczyk S, et al. Cytological markers used for identification and transfer of Aegilops spp. chromatin carrying valuable genes into cultivated forms of Triticum[J]. Comparative Cytogenetics, 2019, 13(1): 41-59. DOI:10.3897/CompCytogen.v13i1.30673 |
| [18] |
管敏. SSR分子标记在棉花遗传育种中的应用分析[J]. 生物技术世界, 2014(10): 25. Guan M. Analysis on the application of SSR molecular markers in cotton genetics and breeding[J]. Biotechworld, 2014(10): 25. |
| [19] |
付小琼, 叶武威. 亲本未知的棉花F1杂种及其F2单株的SSR分子鉴定[J]. 分子植物育种, 2012, 10(5): 600-606. Fu XQ, Ye WW. Identification of F1 hybrid and F2 individual in cotton with unknown parents[J]. Mol Plant Breed, 2012, 10(5): 600-606. DOI:10.3969/mpb.010.000600 |
| [20] |
石建斌, 周红, 王宁, 等. 棉花SSR标记种质资源纯度鉴定及遗传多样性分析[J]. 生物技术通报, 2018, 34(7): 138-146. Shi JB, Zhou H, Wang N, et al. Purity identification and genetic diversity analysis of cotton germplasm resources using SSR markers[J]. Biotechnology Bulletin, 2018, 34(7): 138-146. |
| [21] |
薛玉前, 庄木, 方智远, 等. 植物杂种致死研究进展[J]. 中国农业科技导报, 2015, 17(2): 1-7. Xue YQ, Zhuang M, Fang ZY, et al. Research progress in plant hybrid lethality[J]. Journal of Agricultural Science and Technology, 2015, 17(2): 1-7. |
| [22] |
戴宝生.棉花海陆种间偏分离与杂种衰败遗传机理及效应研究[D].武汉: 华中农业大学, 2016. Dai BS. The phenotypic effection and genetic mechanism of segreation distortion and hybrid breakdown in the interspecific poplations of G.Hirsutum L and G.Barbadense L[D]. Wuhan: Huazhong Agricultural University, 2016. |
| [23] |
Phillips LL, Reid RK. Interspecific incompatibility in Gosspium: II. light and electron microscopic studies of cell necrosis and tumorigenesis in hybrid of G. klotzschianum[J]. American Journal of Botany, 1975, 62: 790-796. DOI:10.1002/j.1537-2197.1975.tb14117.x |
| [24] |
Wendel JF, Cronn RC. Polyploidy and the evolutionary history of cotton[J]. Advances in Agronomy, 2003, 78: 129-186. |
| [25] |
Li F, Fan G, Lu C., et al. Genome sequence of cultivated upland cotton(Gossypium hirsutum TM-1)provides insights into genome evolution[J]. Nat Biotechnol, 2015, 33: 524-530. DOI:10.1038/nbt.3208 |
| [26] |
Wang K, Wang Z, Li F, et al. The draft genome of a diploid cotton Gossypium raimondii[J]. Nature Genetics, 2012, 44(10): 1098-1103. DOI:10.1038/ng.2371 |
| [27] |
梅磊, 李玲, 肖钦之, 等. 陆地棉植物络合素合酶基因的鉴定与功能预测[J]. 棉花学报, 2018, 30(3): 215-223. Mei L, Li L, Xiao QZ, et al. Genome-wide identification and functional prediction of phytochelatin synthase gene in upland cotton[J]. Cotton Science, 2018, 30(3): 215-223. |
| [28] |
吴玉香.棉属遗传多样性与栽培棉种间杂交研究[D].杭州: 浙江大学, 2007. Wu YX. Study on genetic diversity of gossypium and interspecific hybridization of cultivated cotton[D]. Hangzhou: Zhejiang University, 2007. |