牦牛(Bos grunniens)为青藏高原特有的原始牛种之一,一般分布于3 000 m以上的高海拔寒冷低氧地区[1]。牦牛可顽强地抵抗严寒和饥饿,可作为高原交通运输工具,还可用来耕地,具有“高原之舟”和“冰河之车”的美称[2]。而牦牛繁殖力较低,一般二年一胎或三年两胎[3]。而将胚胎在体外培养至桑椹胚或囊胚后再进行移植能有效地提高繁殖效率,增加经济收益[4]。FAF1(Fas-associated factor-1)于1995年由Chu等[5]以酵母双杂交方法筛选得到,为Fas/CD95死亡信号结合体的成员之一。有研究表明FAF1基因产物是早期胚胎发育所必需的,FAF1基因缺失会导致胚胎发育停滞,FAF1突变则会导致卵裂期胚胎死亡[6]。现已证实,细胞凋亡是生殖调节的机制之一,生殖细胞(精子和卵母细胞)的周期性变化与其凋亡过程密切相关[7]。在细胞凋亡通路中Fas/FasL信号通路起着重要的作用[8]。FAF1作为死亡诱导信号复合物(Death-inducing signaling complex,DISC)重要组成部分,被称为Fas通路的重要调控元件,对于Fas通路活化具有重要的调控作用[9]。除此之外,FAF1还参与卵母细胞的减数分裂恢复[10]。FAF1蛋白的生物学功能与其结构域密切相关,FAF1蛋白含有3个结构域,即Fas相互作用域(FAS-interacting domain,FID)、死亡效应结构域(Death effector domain interacting domain,DEDID)、多泛素相关结构域[10]。FAF1可以与Fas相互作用介导细胞凋亡,还能与FADD、caspase-8和蛋白激酶CK2-β相互作用促进细胞凋亡[11]。此外,有研究表明,FAF1可以与胞质中的RelA(p65)结合,抑制IKK或NF-κB的其他因子来调节NF-κB的活性[12-13]。
FAF1基因在生殖方面存在至关重要的作用,但在牦牛方面暂无相关报道。因此,本研究选择以牦牛为对象,克隆其FAF1基因全长cDNA序列,进一步预测该基因完整开放阅读框编码蛋白的结构、性质和功能,运用qRT-PCR、Western blotting、免疫组织化学等方法对FAF1在牦牛生殖系统中的表达进行定位,阐明表达分布特征,旨为进一步研究FAF1在牦牛生殖方面的功能提供依据。
1 材料与方法 1.1 材料本试验研究所用的主要仪器设备有PCR仪(T100TM Thermal Cycler,Rio-Rad公司,美国);恒温培养箱(松下电器有限公司,日本);实时荧光定量PCR仪(ABI ViiA7,Life technologies公司,美国);显微镜(DP71,Olympus,日本)。本试验所用的主要试剂有TransZol(全式金生物技术有限公司,北京);GoScriptTM Reverse Transcription System(Promega,美国),SYBR® Premix Ex TaqTMⅡ(TaKaRa,大连);Goat anti-rabbit IgG-HPP、Rabbit Anti-FAF1 antibody(均购自Bioss,北京);Rabbit Polyclonal FAF1 Antibody(Novus,美国),SP试剂盒(Bioss,北京);DAB试剂盒(ZSGB-bio,ZILZ-9019);DNA纯化回收试剂盒(天根,北京);pMDTM19-T Vector、E.coli JM109 Competent Cells(TaKaRa,大连);RIPA裂解液(全式金,北京);WB试验所涉及的试剂均来自碧云天生物技术有限公司(南京)。
1.2 方法 1.2.1 样品的采集试验样品于2018年10月采集于青海省西宁市百德屠宰场。挑选年龄相仿且处于不同阶段的健康雌性牦牛各3头,经颈动脉放血致死后,迅速采集卵泡期(卵巢上具有成熟卵泡)、黄体期(卵巢有明显黄体)和妊娠期(子宫有发育的胎儿)的卵巢、输卵管和子宫。经0.9%的生理盐水冲洗后,修剪为约1 cm3的组织块浸泡于4%的中性多聚甲醛溶液中进行固定,以用于后期的免疫组织化学试验。剩余组织用锡箔纸包裹后放入冻存袋内,迅速放入液氮罐中,防止组织降解变质,运回实验室后存于-80℃超低温冰箱中,用于后期的分子试验。
1.2.2 组织总RNA的提取及反转录将处于不同阶段雌性牦牛组织从-80℃超低温冰箱取出,按照TransZol试剂说明书提取组织总RNA。将得到的RNA浓度调一致后参照GoScriptTM Reverse Transcription System说明书反转录为cDNA。-20℃保存备用。
1.2.3 特异性引物设计根据GenBank公布的牛FAF1基因编码区,在NCBI Primer-BLAST中设计特异性引物,试验选择β-actin(肌动蛋白)为内参基因,本试验所涉及引物均由上海生工合成,其中FAF1-F1、FAF1-R1用于FAF1基因的全序列的扩增,FAF1-F2、FAF1-R2用于实时荧光定量PCR,引物序列如表 1。
以牦牛cDNA为模板,β-actin(肌动蛋白)为引物,进行普通PCR,20 μL体系:Taq PCR Master Mix 10 μL,ddH2O 8 μL,模板1 μL,上下游引物各0.5 μL。琼脂凝胶电泳验证。以FAF1-F1、FAF1-R1为引物,扩增出牦牛FAF1的全序列,反应条件:95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸2min(FAF1-F1、FAF1-R1)或8 s(β-actin),共进行40个循环;72℃条件下10 min,然后保存于4℃。用1%琼脂糖凝胶检测条带扩增结果。利用DNA纯化试剂盒将PCR产物纯化后,1%琼脂糖凝胶电泳检测回收结果。取1 μL纯化后的PCR产物加入1 μL pMDTM19-T Vector、3 μL ddH2O、5 μL Solution I,放入PCR仪内,于16℃放置30 min。取2 μL重组质粒加入100 μL JM109感受态细胞中,冰中放置30 min,42℃放置45 s,再在冰中放置2 min,加入事先放入37℃恒温箱的SOC培养基890 μL,37℃条件下225 r/min恒温振荡培养1 h,取100 μL涂布于在含有Amp、X-gal、IPTG的LB固体培养基上,37℃过夜培养。挑取阳性克隆菌于加有Amp、X-gal、IPTG的液体培养基中,37℃扩增过夜后,将菌液送至上海生工测序。
1.2.4.2 牦牛FAF1基因生物信息学分析将得到的FAF1测序序列使用NCBI中的在线软件ORF finde(https://www.ncbi.nlm.nih.gov/orffinder/)进行开放阅读框分析;利用NCBI数据库中的在线软件BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对,分析与其他物种同源性,挑选9种不同物种的FAF1序列,使用软件MEGA 7.0构建系统发育树;使用在线软件SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)预测牦牛FAF1编码蛋白的信号肽;利用ExPASy-Protparam(https://web.expasy.org/protparam/)在线分析牦牛FAF1基因所编码蛋白质的部分理化性质;利用PSORT II Prediction(http://psort.hgc.jp/form2.html)在线分析牦牛FAF1基因所编码蛋白质亚细胞定位;使用PredictProtein(https:∥www.predictprotein.org/)在线软件预测FAF1蛋白质结合位点;使用Protscale(http://web.expasy.org/protscale/)在线分析牦牛FAF1基因所编码蛋白质的疏水性;利用TMHMM Server V 2.0(http://www.cbs.dtu.dk/services/TMHMM/)在线预测牦牛FAF1基因编码蛋白质跨膜区域;使用IBCP(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page= npsa_gor4.html)在线预测牦牛FAF1基因编码蛋白质的二级结构;利用Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index?id=index)在线预测牦牛FAF1基因所编码蛋白质的三级结构;使用NetOGlyc 4.0 Server(http://www.cbs.dtu.dk/services/NetOGlyc/)在线分析牦牛FAF1基因所编码蛋白质的糖基化位点;利用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)在线分析牦牛FAF1基因所编码蛋白质的磷酸化位点。
1.2.5 实时荧光定量PCR以牦牛cDNA为模板,FAF1-F2、FAF1-R2为上下游引物,实时荧光定量PCR反应体系为20 μL,如下:模板cDNA 2 μL,上、下游引物各0.8 μL,2×SYBR GreenⅡ PCR mix 10 μL,Passive Reference Dye Ⅱ 0.4 μL,ddH2O 6 μL。反应条件:95℃预变性10 s,95℃变性10 s,60℃退火10 s,72℃延伸2 min,共进行40个循环。每个模板均重复4次,采用2-ΔΔCt法计算FAF1基因在不同时期各个组织的相对表达量。
1.2.6 蛋白免疫印迹(Western blot,WB) 1.2.6.1 组织蛋白提取先将-80℃保存的样品取出,按照RIPA裂解液说明书提取组织蛋白。将提取的蛋白与4×上样缓冲液按3:1混匀,沸水浴中变性10 min,立即冰浴5 min,-20℃保存备用。
1.2.6.2 Western blot按照SDS-PAGE分离胶和浓缩胶配制体系分别配制8%的分离胶和5%的浓缩胶。电泳完成后,采用湿转的方式将蛋白转印至PVDF膜上,PBST洗去膜上的残留转膜液,5%脱脂奶粉摇床上孵育3 h,PBST洗涤2次,每次30 min,一抗(Rabbit Polyclonal FAF1 Antibody)1:1 000稀释4℃孵育过夜,PBST洗涤6次,每次洗涤5 min,二抗(Goat Anti-Rabbit IgG-HRP)1:1 000稀释摇床上孵育50 min,PBST洗涤4次,每次20 min。将BeyoECL PLUS A液与BeyoECL PLUS B液按1:1配置成工作液,滴加至PVDF膜上并避光作用2 min,使用Amersham Imager 600 System进行化学发光检测。根据成像结果,利用灰度值分析FAF1蛋白相对表达量(目的/内参)。
1.2.7 免疫组织化学(Immunohistochemistry,IHC)将固定于4%多聚甲醛溶液的组织自来水冲洗24 h,经梯度酒精脱水,使用酒苯透明后浸蜡,最后石蜡包埋。利用切片机将组织切为4 μm的连续性切片。烘片机上烘片6 h,下行脱蜡水化,抗原修复采用柠檬酸盐缓冲液微波热修复法(将载玻片放入0.01 mol/L的柠檬酸盐中,高火加热至煮沸,转中火维持10 min),冷却至室温后,使用3%H2O2溶液37℃下10 min进行阻断,室温正常山羊血清工作液封闭(SPA试剂盒A液)15 min,一抗(Rabbit Anti-FAF1 antibody)1:400稀释后4℃孵育过夜,阴性对照则使用PBS作为一抗,生物素标记山羊抗兔IgG(SPA试剂盒B液)37℃条件下孵育15 min,辣根酶标记链霉卵白素工作液15 min,在DAB显色液中进行显色,苏木精复染后盐酸酒精分化,最后在自来水中返蓝10 min。脱水透明封片。在抗原修复、阻断、一抗、B液、C液之后都要用PBS洗涤3次,每次3 min。待晾干后置于显微镜下拍照。
1.2.8 数据分析利用SPSS 25.0对FAF1基因相对表达量和蛋白相对表达量进行单因素方差分析,每组3次重复,计算结果均以“平均值±标准误”表示,当P < 0.05时表示二者差异显著,采用Graphpad prism 8进行绘图。
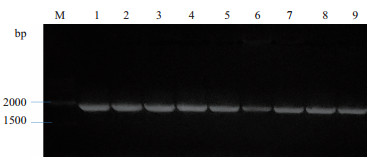
2 结果 2.1 牦牛FAF1基因的克隆经核酸凝胶电泳检测,以β-actin-F、β-actin-R为引物检测cDNA模板的结果如图 1所示,其在143 bp处有清晰单一的条带,符合β-actin基因预期大小,验证反转录cDNA模板为有效模板,可作为模板用于后期的试验;以FAF1-F1、FAF1-R1为引物检测引物特异性的结果如图 2所示,其在1 953 bp处有清晰明亮条带,且与牦牛FAF1基因预期大小一致。并将得到的结果提交至GenBank,登陆号为MK416195。

|
| M:2 000 bp ladder;1-3:模板依次为黄体期子宫、卵巢、输卵管;4-6:模板依次为卵泡期子宫、卵巢、输卵管;7-9:模板依次为妊娠期子宫、卵巢、输卵管 图 1 β-actin在不同阶段子宫、卵巢、输卵管中的扩增结果 |
|
| M:1 kb Plus DNA Ladder;1-3:模板依次为黄体期子宫、卵巢、输卵管;4-6:模板依次为卵泡期子宫、卵巢、输卵管;7-9:模板依次为妊娠期子宫、卵巢、输卵管 图 2 特异性引物FAF1-F1、FAF1-R1扩增结果 |
根据NCBI在线工具ORF finder分析FAF1基因序列,结果显示FAF1基因起始密码子于1 bp处,终止密码子于1 953 bp,最长为1 953 bp,能够编码650个氨基酸。
2.2.2 牦牛FAF1基因编码蛋白理化性质分析FAF1蛋白分子式为C3231H5068N892O1027S29,原子总数10 472,分子量为73.77 kD,理论等电点为4.72。在编码蛋白质的650个氨基酸中,谷氨酸Glu含量最高为10.2%,色氨酸Trp含量最低为1.1%,且该蛋白不含吡咯氨酸Pyl和硒半胱氨酸Sec,其中带负电荷的残基总数(Asp+Glu)为108,带正电荷的残基总数(Arg+Lys)为66。在280 nm的水中,FAF1的消光系数为55 390 mol/cm(在假设所有半胱氨酸残基对形成胱氨酸的条件下)。FAF1蛋白在酵母和大肠杆菌中的半衰期分别为 > 20 h和 > 10 h。FAF1蛋白不稳定指数为52.70,属于不稳定蛋白。
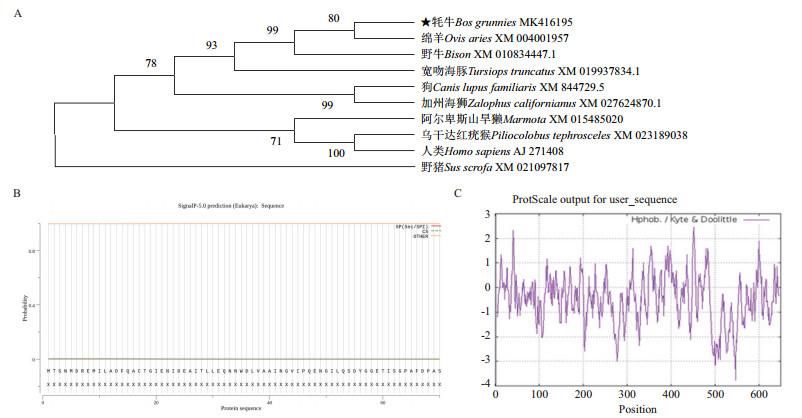
2.2.3 牦牛FAF1基因所编码蛋白同源性分析将牦牛FAF1基因核苷酸序列与绵羊、野牛、宽吻海豚、狗、加州海狮、阿尔卑斯山旱獭、乌干达红疣猴、人类及野猪的FAF1核苷酸序列进行同源比对,结果依次为98.87%、99.84%、96.29%、95.64%、96.29%、95.23%、94.98%、95.03%和96.28%。说明牦牛FAF1基因与野牛亲缘关系最近,与乌干达红疣猴略远。再将牦牛FAF1基因的氨基酸序列与绵羊、野牛、宽吻海豚、狗、加州海狮、阿尔卑斯山旱獭、乌干达红疣猴、人类及野猪的FAF1基因氨基酸序列比对分析,结果显示牦牛FAF1基因与绵羊的同源性最近可达100%,与宽吻海豚、狗、阿尔卑斯旱獭、乌干达红疣猴及人的同源性均为99%,与野牛、加州海狮、野猪的同源性略低为97%。使用软件MEGA 7.0构建FAF1基因系统进化树(图 3-A),表明牦牛FAF1基因与绵羊、野牛的进化水平更近,与野猪、人类的进化水平略远。
|
| A:牦牛FAF1基因系统进化树(★为本试验克隆);B:牦牛FAF1基因编码蛋白信号肽预测;C:牦牛FAF1基因编码蛋白疏水性 图 3 牦牛FAF1基因系统进化树及其编码蛋白信号肽、疏水性预测 |
根据在线软件SignalP-5.0 Server预测FAF1编码蛋白信号肽结果(图 3-B)显示,该蛋白无信号肽。根据软件Protscale预测FAF1基因编码蛋白疏水性结果(图 3-C)表明,位于452位的亮氨酸Leu疏水性最强,分值为2.456,位于547位的谷氨酸Glu亲水性最强,分值为-3.767,该蛋白氨基酸亲水性大于疏水性,所以为可溶性蛋白。根据TMHMM Server V 2.0对跨膜区域的分析(图 4-A),该蛋白无跨膜结构域。

|
| A:牦牛FAF1蛋白跨膜结构预测;B:FAF1蛋白结合位点预测;C:牦牛FAF1蛋白磷酸化位点预测;D:FAF1蛋白二级结构预测 图 4 牦牛FAF1编码蛋白跨膜结构、蛋白结合位点、磷酸化位点、二级结构预测 |
根据在线软件PSORT II Prediction的分析结果显示,该基因编码蛋白质超过1/2(52.2%)位于细胞核,有超过1/4(23.1%)位于线粒体,有一部分(13.0%)位于细胞质,还有一小部分存在于在高尔基体(4.3%)和细胞骨架中(4.3%)。使用在线软件PredictProtein预测FAF1蛋白质结合位点,结果(图 4-B)显示,该蛋白存在5个蛋白结合位点,分别位于第1、176-178、458、567和626位氨基酸。
2.2.6 牦牛FAF1基因编码蛋白质糖基化和磷酸化分析根据在线软件NetOGlyc 4.0 Server预测FAF1糖基化位点结果,第22位天冬酰胺Asn、第26位丙氨酸Ala和第108位精氨酸Arg的O-糖基化位点潜力值均高于阈值,所以上述3种氨基酸可能成为该蛋白的O-糖基化位点。使用在线软件NetPhos 3.1 Server预测FAF1磷酸化位点(图 4-C),结果表明:FAF1蛋白有72个丝氨酸Ser、33个苏氨酸Thr、4个酪氨酸Tyr可能成为该蛋白的磷酸化位点。
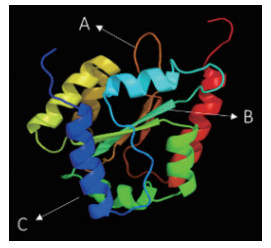
2.2.7 牦牛FAF1基因编码蛋白质二级结构和三级结构预测应用在线软件IBCP预测FAF1蛋白二级结构,结果(图 4-D)表明:该蛋白主要由3种折叠方式构成,300个α-螺旋占比46.15%,83个延伸链占比12.77%,267个无规卷曲占比41.08%。由此可以推测,α-螺旋、无规卷曲及延伸链3种结构是FAF1蛋白二级结构的主体。应用在线软件Phyre2预测FAF1蛋白三级结构,预测结果(图 5)与二级结构预测相符。
|
| A:无规卷曲;B:延伸链;C:α-螺旋 图 5 FAF1蛋白三级结构预测 |
qRT-PCR统计分析结果(图 6)表明FAF1基因的表达普遍存在于不同阶段中的卵巢、输卵管、子宫。卵泡期卵巢、子宫FAF1基因相对表达量显著高于妊娠期,黄体期输卵管FAF1基因相对表达量显著高于卵泡期和妊娠期。FAF1基因的相对表达量在牦牛不同阶段各组织中存在差异化表达。

|
| A:卵巢;B:输卵管;C:子宫 图 6 牦牛FAF1基因在不同阶段的卵巢、输卵管、子宫中的表达 |
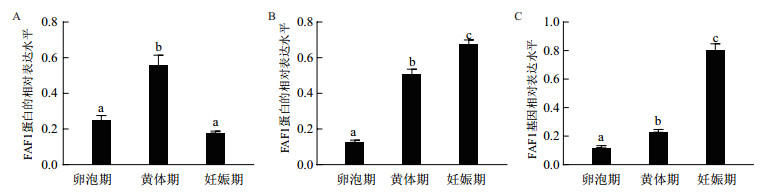
Western blot结果(图 7)显示,FAF1蛋白普遍存在于牦牛不同阶段的卵巢、输卵管和子宫。经统计分析结果显示(图 8),妊娠期输卵管、子宫的FAF1蛋白相对表达量显著高于卵泡期和黄体期,黄体期卵巢中的FAF1表达量显著高于卵泡期和妊娠期,FAF1蛋白在牦牛不同阶段卵巢、输卵管和子宫中的相对表达存在差异性。

|
| 1-3:卵泡期卵巢、输卵管、子宫;4-6:黄体期卵巢、输卵管、子宫;7-9:妊娠期卵巢、输卵管、子宫 图 7 β-actin和FAF1蛋白在牦牛不同阶段中不同组织的检测结果 |
|
| A:卵巢B:输卵管C:子宫 图 8 FAF1蛋白在牦牛不同阶段不同组织中的相对表达量 |
免疫组织化学染色结果(图 9)显示,FAF1蛋白在不同阶段中各组织均存在阳性表达(棕褐色)。在不同阶段的同一组织中表达部位并无明显的差异,在卵巢中主要表达部位为卵巢生殖上皮、颗粒细胞、卵泡膜细胞(图 9-A、图 9-E)和黄体细胞(图 9-B、图 9-F);在输卵管中主要表达部位为黏膜上皮细胞(图 9-C、图 9-G);在子宫中主要表达部位为子宫内膜细胞、子宫腺(图 9-D、图 9-H)。

|
| A-L为免疫组织化学染色。其中A-H为阳性表达,I-L为阴性对照。A、B、E、F、I为卵巢;C、G、K为输卵管;D、H、L为子宫。EM:黏膜上皮;SG:颗粒层;GE:生殖上皮;TF:卵泡膜;CL:黄体细胞;EP:子宫内膜;UG:子宫腺 图 9 FAF1在牦牛不同阶段卵巢、子宫、输卵管的分布 |
本试验成功克隆牦牛FAF1基因(GenBank登录号:MK416195),此前该基因只有在人类[14]、牛和小鼠[15]等动物有相关报道。生物信息学分析结果显示,牦牛FAF1基因所编码的蛋白分子式为C3231H5068N892O1027S29,原子总数10 472,分子量为73.77 kD,理论等电点为4.72。可编码650个氨基酸,其中谷氨酸Glu含量最高为10.2%,色氨酸Trp含量最低为1.1%。由此推断FAF1蛋白表达量过高可能会抑制胚胎的发育甚至是导致胚胎细胞的死亡。同源性对比分析发现,牦牛FAF1基因与野牛同源性最高,可达99.84%,与乌干达红疣猴同源性较远,为94.98%。牦牛FAF1基因所编码的氨基酸序列与绵羊的同源性达100%,因此,牦牛FAF1可能与绵羊的生物学功能一致。同时系统进化树也显示牦牛FAF1基因与绵羊、野牛进化水平更接近,与乌干达红疣猴、人类、野猪的进化水平略远,与进化规律基本保持一致。该基因在整个进化过程中保持高度的保守性,但又在种属之间存在差异性。
卵巢不仅能够产生卵细胞,并且还能分泌多种激素,在生殖中占有十分重要的地位。FAF1基因在黄体期卵巢中的相对表达显著低于卵泡期和妊娠期,FAF1蛋白在卵巢中的相对表达量在卵泡期、黄体期、妊娠期均存在显著差异,黄体期表达最高,卵泡期次之,妊娠期最低。免疫组织化学染色结果显示FAF1蛋白主要分布于卵巢生殖上皮、颗粒细胞、卵泡膜细胞和黄体期黄体细胞。FAF1基因和蛋白在多个组织(包括卵巢和子宫)中检测到[10],这与本研究结果相符。卵巢有许许多多的卵泡,但是它们中的绝大多数都不能发育成熟,而是在各发育阶段中逐渐退化[16],闭锁卵泡超微结构的研究中发现卵泡细胞中存在核固缩、胞浆出现空泡、形成闭锁小体等凋亡形态的改变,这些变化首先发生在颗粒细胞中,现在人们普遍认为卵泡闭锁实质就是卵巢颗粒细胞凋亡的结果[17],生殖上皮是卵细胞形成的必要因素[18],卵泡膜细胞分泌的激素在卵泡的发育和闭锁过程中起着十分重要作用,FAF1为促凋亡因子且在卵泡膜细胞、颗粒细胞、生殖上皮中表达,因此FAF1可能参与卵泡的闭锁。黄体期时由于黄体形成,孕激素浓度上升,此时FAF1基因相对表达量低于卵泡期,但是FAF1蛋白表达量高于卵泡期,此前Peluffo等[19]研究称,在灵长动物黄体溶解过程中,FAS-FASL系统受黄体酮的明显调控。因此推测FAF1在牦牛黄体期卵巢的表达高于卵泡期可能与在灵长动物中一致,FAF1可能受孕激素调节表达量升高。FAF1蛋白是小鼠卵母细胞和植入前胚胎中NLRP2蛋白的特异性结合伴侣,在妊娠期FAF1蛋白的下降可能与NLRP2形成复合物,该复合物的缺失会导致胚胎发育停滞[10]。据此推测,FAF1对卵泡闭锁有十分重要的意义,FAF1蛋白在黄体期可能受孕激素的调节表达量升高,并且在妊娠期时FAF1蛋白可能与NLRP2特异性结合保证胚胎的发育。
输卵管是精子与卵细胞结合受精的部位。FAF1在输卵管的卵泡期、黄体期、妊娠期的相对表达均存在显著差异,其中黄体期相对表达量最高,妊娠期次之,卵泡期最低。在妊娠期FAF1蛋白表达最高,卵泡期最低。免疫组织化学染色结果显示输卵管中主要表达部位为黏膜上皮细胞。有研究认为,输卵管上皮细胞在血浆高雌激素水平作用下增殖,在血浆高孕激素水平下则发生凋亡样退化[20-21],黄体期和妊娠期孕激素浓度上升,FAF1蛋白可能受孕激素调节参与输卵管上皮细胞的凋亡。因此导致妊娠期基因表达量低,而蛋白表达量高的现象。有研究表明输卵管黏膜上皮细胞能够分泌活性物质,而这种活性物质能为早期胚胎发育提供了一个相对有利的生理环境[22],输卵管黏膜上皮为早期胚胎创造有利条件,新陈代谢加快,FAF1可能与输卵管黏膜上皮代谢相关。综上所述,FAF1对受精及早期胚胎的发育具有非常重要的作用。
子宫作为胎儿发育的场所,在胚胎附植和胎儿孕育中具有十分重要的作用。FAF1在子宫的卵泡期、黄体期、妊娠期的相对表达均存在显著差异,FAF1蛋白在妊娠期表达量显著高于卵泡期和黄体期,免疫组织化学染色结果显示FAF1在子宫中主要表达部位为子宫内膜细胞和子宫腺。在妊娠期子宫腺可以分泌多种生物活性物质来调节子宫内膜细胞的生理状态[23],其中分泌的活性物质包括肿瘤坏死因子(TNF)[24],而FAF1属于肿瘤坏死因子受体(TNF-R)家族的一员[25],并且在妊娠早期子宫内膜动态变化中,凋亡占有极其重要的地位[26],由此推测FAF1可能通过与肿瘤坏死因子结合调节子宫内膜的生理状态,为接纳胚胎附植做准备。由此推测FAF1可能与胚胎附植及胚胎早期发育相关。
4 结论本试验成功克隆出牦牛FAF1基因(GenBank登录号:MK416195),牦牛FAF1基因CDS区为1 953 bp,编码650位氨基酸,与野牛核苷酸序列同源性可达99.84%,与绵羊氨基酸序列相似度为100%,与野牛、绵羊亲缘关系较近,与野猪、人类亲缘关系较远。FAF1在牦牛卵巢、输卵管、子宫均有表达,但不同生理周期表达水平存在显著差异,揭示FAF1在牦牛不同阶段中具有重要生物学作用,推测FAF1可能与母牦牛的卵泡闭锁、受精、早期胚胎的发育有关,但其相关机制有待深入研究。
| [1] |
袁青妍.牦牛血红蛋白的基因克隆和同源模建[D].南京: 南京农业大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10307-2005087588.htm
|
| [2] |
雪犁. 中国丝绸之路辞典[M]. 乌鲁木齐: 新疆人民出版社, 1994.
|
| [3] |
才扎西. 母牦牛繁殖力及提升途径[J]. 中国畜牧兽医文摘, 2016, 32(3): 73. |
| [4] |
孙思怡, 李琦, 张帆, 等. 动物早期胚胎体外培养的研究进展[J]. 畜牧与饲料科学, 2018, 39(3): 23-28. |
| [5] |
Chu K, Niu X, Williams LT. A Fas-associated protein factor, FAF1, potentiates Fas-mediated apoptosis[J]. Proc Natl Acad Sci USA, 1995, 92(25): 4-8. |
| [6] |
Adham IM, Khulan J, Held T. Fas-associated factor(FAF1)is required for the early cleavage-stages of mouseembryo[J]. Mol Hum Reprod, 2008, 14(4): 7-13. |
| [7] |
张军强, 丁家桐. 细胞凋亡与生殖[J]. 畜牧与兽医, 2002(7): 41-43. DOI:10.3969/j.issn.0529-5130.2002.07.025 |
| [8] |
Nagata S. Fas ligand-induced apoptosis[J]. Annu Rev Genet, 1999, 33: 29-55. DOI:10.1146/annurev.genet.33.1.29 |
| [9] |
杲修杰. HSP70阻抑应激心肌细胞凋亡Fas通路的FAF1调控机制[D].北京: 中国人民解放军军事医学科学院, 2015. http://cdmd.cnki.com.cn/Article/CDMD-90106-1015382202.htm
|
| [10] |
Peng H, Liu H, Liu F, et al. NLRP2 and FAF1 deficiency blocks early embryogenesis in the mouse[J]. Reproduction, 2017, 154(3): 245-251. DOI:10.1530/REP-16-0629 |
| [11] |
Menges CW, Altomare DA, Testa JR. FAS-associated factor 1(FAF1):diversefunctions and implications for oncogenesis[J]. Cell Cycle, 2009, 8(16): 28-34. |
| [12] |
Park MY, Jang HD, Lee SY, et al. Fas-associated factor-1 inhibits nuclear factor-kappaB(NF-kappaB)activity by interfering with nucleartranslocation of the RelA(p65)subunit of NF-kappaB[J]. J Biol Chem, 2004, 279(4): 4-9. |
| [13] |
Park MY, Moon JH, Lee KS, et al. FAF1 suppressesIkappaB kinase(IKK)activation by disrupting the IKK complex assembly[J]. J Biol Chem, 2007, 282(38): 2-7. |
| [14] |
Ryu SW, Chae SK, Lee KJ, et al. Identification and characterization of human Fas associated factor 1, hFAF1[J]. Biochem Biophys Res Commun, 1999, 262(2): 88-94. |
| [15] |
Kikyo N, Rideout WM, Tada T, et al. Mapping of the Fas-associated factor 1 gene, Faf1, to mouse chromosome 4C6 by FISH[J]. Mamm Genome, 1997, 8(3): 4-5. |
| [16] |
沈霞芬. 家畜组织学与胚胎学[M]. 北京: 中国农业出版社, 2011.
|
| [17] |
谢敏, 姜法贵, 郭燕君. 卵泡发育和闭锁过程中颗粒细胞自噬和凋亡关系的研究[J]. 四川生理科学杂志, 2015, 37(2): 85-88. |
| [18] |
潘玉芝. 破坏小鼠卵巢生殖上皮对卵子生成的影响[J]. 实验生物学报, 1957(3): 3-15, 121-124. |
| [19] |
Peluffo MC, Young KA, Hennebold JD, et al. Expression and regulation of tumor necrosis factor(TNF)and TNF-receptor family members in the macaque corpusluteum during the menstrual cycle[J]. Mol Reprod Dev, 2009, 76(4): 67-78. |
| [20] |
Diaz FJ, Luo W, Wiltbank MC. Effect of decreasing intraluteal progesterone on sensitivity of the early porcine corpus luteum to the luteolytic actions of prostaglandin falpha[J]. Biol Reprod, 2010, 25: 45-60. |
| [21] |
Ebrahimi B, Valojerdi MR, Eftekhari-Yazdi P, et al. In vitro matu-ration, apoptotic gene expression and incidence of numerical chro-mosomal abnormalities following cryotop vitrification of sheep cu-mulus-oocyte complexes[J]. Assist Reprod Genet, 2010, 27(5): 39-46. |
| [22] |
王靖雷, 王萌, 潘阳阳, 等. IL-1β及其受体在雌牦牛主要生殖器官和孤雌激活胚胎中的表达定位[J]. 西北农业学报, 2018, 27(10): 1395-1404. DOI:10.7606/j.issn.1004-1389.2018.10.001 |
| [23] |
Chen JC, Erikson DW, Piltonen TT, et al. Coculturing human endometrial epithelial cellsand stromal fibroblasts alters cell-specific gene expression and cytokineproduction[J]. Fertil Steril, 2013, 100(4): 32-43. |
| [24] |
蒋佳颖.激素—生长因子—黏附因子调节系统在牦牛子宫内膜上皮的相关性研究[D].兰州: 甘肃农业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10733-1018710940.htm
|
| [25] |
Becker K, Schneider P, Hofmann K, et al. Interaction of Fas(Apo-1/CD95)with proteins implicated in the ubiquitination pathway[J]. FEBS Lett, 1997, 412(1): 2-6. |
| [26] |
杨环. P16~(INK4A)在早孕小鼠子宫内膜的表达及作用研究[D].重庆: 重庆医科大学, 2009. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=2009230770.nh
|





