2. 呼和浩特职业学院,呼和浩特 010051
2. Hohhot Vocational college, Hohhot 010051
植物生长过程中会遇到干旱、盐碱、冷等不同环境胁迫,从而影响其正常发育及产量。在面临胁迫时,植物会通过一系列的自身应对机制来适应各种逆境。其中之一是转录因子通过与基因的启动子或增强子区域结合来调控基因表达[1],或通过一个或多个DNA结合域的模块结构调控基因表达[2],从而响应各种逆境胁迫。
NAC转录因子家族是植物特有的、成员数目较多的一类家族。已在不同物种中发现并确定了NAC转录因子成员及数量,如拟南芥(Arabidopsis thaliana)中有117个、水稻(Oryza sativa)中有151个、大豆(Glycine max)中有152个、葡萄(Vitis vinifera)有74个、木豆(Cajanus cajan)中有88个、白菜(Brassica pekinensis)中有204个NAC基因[3-4]。研究证明,NAC转录因子是具有多种生物功能的植物特异转录因子[5]。例如,拟南芥SND1、VND7、NST1(2/3)以及蒺藜苜蓿(Medicago truncatula)MtNST1参与植物次生生长[6-9],拟南芥NTM1参与细胞分裂过程[10],AtNAC2参与激素调控和信号转导[11],水稻OsNAC5调控植株衰老[12]。马铃薯(Solanum tuberosum)StNAC和水稻RIM1等参与生物胁迫中植物的防御响应[13-14]。甜菜NAC家族成员对干旱胁迫有响应[15]。
真核基因表达由位于转录起点上游的启动子调节。启动子调控基因转录的开始以及准确性,是转录调控的中心。启动子序列基本结构特征是,在序列-30-20 bp处,有TATA序列,在-78-70 bp处,有CAAT区[16]。同时,启动子还含有特异顺式作用元件。启动子主要分为3种,分别为组成型、组织特异性和诱导型启动子[17]。启动子对基因的表达调控至关重要,其顺式作用元件种类以及数量会影响基因的表达模式和强度[18]。分析基因启动子顺式元件,有利于了解该基因的表达模式以及功能研究。
中间锦鸡儿(Caragana intermedia)是生长于干旱地区的灌木,有防风固沙的作用[19]。中间锦鸡儿对非生物胁迫有较强的耐受性,已有研究证明,中间锦鸡儿基因在逆境胁迫下有响应。如CiNAC3和CiNAC4过表达拟南芥对盐胁迫有耐受性[20]。转CiPP2C37-Like基因的拟南芥在盐和干旱胁迫下,耐受性明显强于野生型[21]。CiMYB68受干旱、冷胁迫的诱导[22]。转CiDREB1C基因的拟南芥提高了对渗透胁迫和冷胁迫的耐受性[23]。研究中间锦鸡儿的基因功能为对探究响应逆境基因机制奠定基础。
本研究以中间锦鸡儿为植物材料,对CiNAC038启动子进行克隆和顺式作用元件分析。构建ProCiNAC38:GUS表达载体,转化拟南芥。对转基因植株进行GUS组织定位和激素诱导表达特性分析,明确CiNAC038的表达调控模式,旨为CiNAC038功能研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 植物材料中间锦鸡儿采自内蒙古乌兰察布市,野生型拟南芥为Columbia-0生态型。
1.1.2 载体和菌株克隆载体pEASY-T1和Trans1-T1感受态细胞购自全式金公司,克隆载体pMDTM19-T购自TaKaRa公司。表达载体pCambia1305.2由实验室保存。根据韩晓敏[20]方法自制根癌农杆菌GV3101感受态细胞。
1.2 方法 1.2.1 DNA提取采用植物基因组DNA提取试剂盒(天根)提取中间锦鸡儿的gDNA。
1.2.2 启动子的克隆在目的基因cDNA内设计的引物38-SP1、38-SP2和38-SP3与Genome Walking Kit(TaKaRa)提供的通用引物进行3轮半巢式PCR(表 1),回收第三轮得到的产物,与pMDTM19-T载体连接,并测序。测序结果与目的基因的cDNA拼接无误。
以中间锦鸡儿gDNA为模板,以拼接结果设计扩增启动子引物(表 1)。PCR体系按说明书进行。反应程序为98℃ 10 s,58℃ 10 s,72℃ 2 min,35个循环,回收产物,与pEASY-T1载体连接。重组质粒转化到Trans1-T1感受态细胞中,用特异性引物菌落PCR法验证阳性克隆,并送测序。
1.2.3 序列分析由在线软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子元件分析。
1.2.4 表达载体构建及遗传转化用HindⅢ和NcoⅠ限制性内切酶(Thermo)对CiNAC038启动子和pCambia1305.2进行双酶切,回收目的条带,使用In-Fusion方法与pCAMBIA1305.2线性载体连接,构建ProCiNAC038 : GUS过表达载体。In-Fusion连接体系为:酶切后线性载体3 μL、目的基因片段1 μL、5×In-Fusion Enzyme(TaKaRa)2 μL和ddH2O 4 μL。37℃水浴15 min,50℃水浴15 min。然后转化大肠杆菌感受态细胞Trans1-T1,用双酶切进行验证。使用质粒小提试剂盒(天根)将重组质粒从大肠杆菌中提取。将表达载体转化到农杆菌GV3101感受态细胞,浸染野生型拟南芥,收取种子,用含13 mg/L潮霉素的1/2 MS培养基筛选阳性株系。
1.2.5 GUS组织化学染色根据万东莉[24]方法进行GUS组织化学染色。
1.2.6 激素处理将ProCiNAC038 : GUS转基因植株在含潮霉素的1/2 MS培养基平板上竖直生长7 d,然后移入含激素的1/2 MS培养基平板上继续竖直生长48 h,进行GUS组织化学染色分析。
2 结果 2.1 CiNAC038启动子的克隆根据CiNAC038的ORF序列,设计3条反向特异性引物38-SP1、38-SP2和38-SP3(表 1)。使用染色体步移法,以中间锦鸡儿gDNA为模板,扩增CiNAC038的启动子序列(图 1)获得一条约2 000 bp条带,经测序,该条带1 800 bp。

|
| 染色体步移法扩增CiNAC038启动子;1-3:第一次PCR,第二次PCR,第三次PCR;M1:DL5000 bp DNA marker 图 1 CiNAC038启动子的克隆 |
根据扩增获得的CiNAC038启动子序列,设计启动子引物(表 1)。以中间锦鸡儿gDNA为模板,克隆CiNAC038启动子(图 2-A)。将pCAMBIA1305.2载体使用HindⅢ和NcoⅠ内切酶线性化后,用In-Fusion体系与PCR产物连接构建ProCiNAC038 : GUS表达载体。经双酶切后,产生目片段和线性化载体(图 2-B),表明ProCiNAC038 : GUS表达载体构建成功。

|
| A:CiNAC038启动子克隆,1、2分别表示相同的PCR产物;B:酶切验证ProCiNAC038 : GUS;M1:DL5000 bp DNA marker;M:DL2000 bp DNA marker 图 2 CiNAC038启动子的克隆及表达载体酶切验证 |
经PlantCARE网站在线分析,CiNAC038启动子包含多种顺式元件:真核生物常见转录元件CAAT-box和TATA-box;植物光响应元件Box4、G-box、GATA-motif、I-box、MER、TCCC-motif;植物激素脱落酸应答元件ABRE;茉莉酸甲酯应答元件CGTCA-motif;赤霉素应答元件P-box;厌氧诱导顺式元件ARE;分生组织表达元件CAT-box;玉米素代谢调控元件O2-site;MYBHv1结合位点元件CCAAT-box;细胞生长周期调控元件MSA-like等(图 3)。

|
| 图 3 CiNAC038启动子顺式元件分析 |
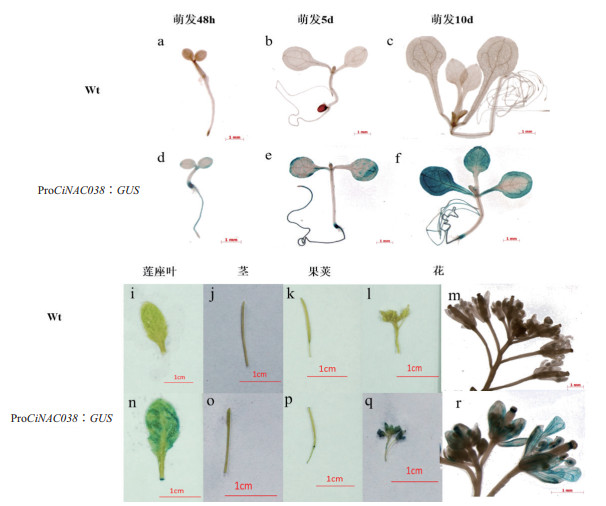
使用浸花法将ProCiNAC038 : GUS重组质粒转化至野生型拟南芥植物。用潮霉素筛选获得8个阳性转基因植物。对不同生长时期的T2代转基因及野生型拟南芥进行染色,观察组织化学染色情况。选择种子萌发48 h、5 d、10 d以及植物生长40 d。植物幼苗时期,染色主要集中在根和根与胚轴的结合部位附近,子叶有不完全染色,胚轴无染色(图 4-a-图 4-f)。植物生长40 d,对植物莲座叶、花、茎及成熟果荚染色分析,染色部分主要集中在叶片叶脉、果荚两端、花瓣、花萼以及花药,茎无染色。野生型植物在不同生长时期及不同组织中均没被染色(图 4-i-图 4-r)。
|
| a-f:幼苗时期组织化学染色;i-r:植物生长40 d成熟期植物各组织化学染色;m:l的放大图;r:q的放大图 图 4 ProCiNAC038 : GUS转基因株系和野生型植物的组织化学染色 |
CiNAC038启动子顺式元件中存在多个与可能与激素应答相关的顺式作用元件,如存在1个MeJA、1个GA和3个ABA应答元件。为了进一步分析CiNAC038启动子对植物激素的响应情况,分别用MeJA、ABA和GA处理生长10 d的ProCiNAC038 : GUS转基因幼苗植物,并进行组织化学染色分析。经50和100 μmol/L的MeJA和GA处理后,CiNAC038启动子染色结果没有明显变化;经50和100 μmol/L的ABA处理后,随着ABA浓度增加染色变浅,说明ABA负调控该基因启动子的转录活性,CiNAC038启动子可能是ABA抑制型启动子(图 5)。

|
| 图 5 不同处理下ProCiNAC038 : GUS转基因植物组织化学染色分析 |
NAC转录因子是植物特有的一类转录因子,在植物生长过程中起重要作用[5, 7, 9, 15]。本研究从中间锦鸡儿中成功克隆出CiNAC038的启动子序列,PlantCARE预测启动子的作用元件,结果显示该启动子含有TATA-box和CAAT-box。TATA-box是RNA聚合酶识别和结合的位点[25]。CAAT-box调控转录起始频率和目的基因转录强度[26]。说明所克隆的片段具有典型启动子的特征。该启动子存在着多种光应答元件,同时还存在激素响应元件和抗逆境应答元件,显示该启动子的功能可能受光信号、植物激素和抗逆境胁迫的调控[27]。如植物激素脱落酸应答元件ABRE、茉莉酸甲酯应答元件CGTCA-motif和赤霉素应答元件P-box等。因此,该启动子会受多种激素诱导驱动下游基因表达。通过PlantCARE分析CiNAC038同源拟南芥基因AtNAC038启动子序列,结果发现该序列也包含多种与激素相关顺式元件,如植物激素脱落酸应答元件ABRE、茉莉酸甲酯应答元件CGTCA-motif、赤霉素应答元件P-box、水杨酸应答元件TCA-element等。包括2个MeJA、1个GA、5个ABA以及2个SA应答元件。说明CiNAC038同源基因可能与激素相关。
本研究成功构建了ProCiNAC038 : GUS融合基因,转入拟南芥,GUS组织化学染色结果显示,该启动子在拟南芥幼苗根部染色较深,胚轴无染色;成熟期转基因拟南芥的叶脉、果荚两端、花瓣、花药等组织染色较深,茎无染色。结果显示,CiNAC038启动子可驱动基因主要在叶片、根和花的组织器官表达。
为验证CiNAC038启动子的诱导表达特性,本研究分别用MeJA、ABA和GA等处理ProCiNAC038 : GUS转基因幼苗植物,并进行组织化学染色分析发现,在MeJA和GA处理后,CiNAC038启动子染色结果没有明显变化。ABA处理下,随着ABA浓度增加染色变浅,说明ABA负调控该基因启动子的转录活性,表明CiNAC038启动子是ABA抑制型启动子。
4 结论从中间锦鸡儿中克隆与激素相关基因CiNAC038上游1 800 bp的启动子序列,CiNAC038启动子主要在叶片、根和花的组织器官表达;CiNAC038受外源激素ABA诱导。
| [1] |
Saidi MN, Mergby D, Brini F. Identification and expression analysis of the NAC transcription factor family in durum wheat(Triticum turgidum L. ssp. durum)[J]. Plant Physiology Biochemistry, 2017, 112: 117-128. |
| [2] |
Huseyin T, Mehmet SS, Guzin K, et al. Transcriptome-wide identication of R2R3-MYB transcription factors in barley with their boron responsive expression analysis[J]. Molecular Genetics and Genomics, 2013, 288((3-/4): 141-155. |
| [3] |
Shen J, Lv B, Luo L, et al. The NAC-type transcription factor OsNAC2 regulates ABA-dependent genes and abiotic stress tolerance in rice[J]. Scientific Reports, 2017, 7: 40641. |
| [4] |
Hussain RM, Ali M, Feng X, et al. The essence of NAC gene family to the cultivation of drought-resistant soybean(Glycine max L. Merr.)cultivars[J]. BMC Plant Biology, 2017, 17(1): 55. |
| [5] |
文锦芬, 赵凯, 邓明华. 转录因子DREB、ERF和NAC在介导植物响应生物和非生物胁迫中的作用[J]. 湖南生态科学学报, 2019, 6(3): 51-59. |
| [6] |
Zhao Q, Gallego-Giraldo L, Wang H, et al. An NAC transcription factor orchestrates multiple features of cell wall development in Medicago truncatula[J]. The Plant Journal:for Cell and Molecular Biology, 2010, 63(1): 100-114. |
| [7] |
Ko JH, Yang SH, Park AH, et al. ANAC012, a member of the plant-specific NAC transcription factor family, negatively regulates xylary fiber development in Arabidopsis thaliana[J]. The Plant Journal:for Cell and Molecular Biology, 2007, 50(6): 1035-1048. |
| [8] |
Zhong R, Lee C, Ye ZH. Functional characterization of poplar wood-associated NAC domain transcription factors[J]. Plant Physiology, 2010, 152(2): 1044-1055. |
| [9] |
Zhong R, Lee C, Ye ZH. Global analysis of direct targets of secondary wall NAC master switches in Arabidopsis[J]. Molecular Plant, 2010, 3(6): 1087-1103. |
| [10] |
Sun Y, Kim SGK, Youn SK, et al. Exploring membrane-associated NAC transcription factors in Arabidopsis:Implications for membrane biology in genome regulation[J]. Nucleic Acids Research, 2006, 35(1): 203-213. |
| [11] |
He XJ, Mu RL, Cao WH, et al. AtNAC2, a transcription factor downstream of ethylene and auxin signaling pathways, is involved in salt stress response and lateral root development[J]. The Plant Journal:for Cell and Molecular Biology, 2005, 44(6): 903-916. |
| [12] |
Sperotto RA, Ricachenevsky FK, Duarte GL, et al. Identification of up-regulated genes in flag leaves during rice grain filling and characterization of OsNAC5, a new ABA-dependent transcription factor[J]. Planta, 2009, 230(5): 985-1002. |
| [13] |
Yoshii M, Yamazaki M, Rakwal R, et al. The NAC transcription factor RIM1 of rice is a new regulator of jasmonate signaling[J]. The Plant Journal:for Cell and Molecular Biology, 2010, 61(5): 804-815. |
| [14] |
Collinge M, Boller T. Differential induction of two potato genes, Stprx2 and StNAC, in response to infection by Phytophthora infestans and to wounding[J]. Plant Molecular Biology, 2001, 46: 521-529. |
| [15] |
徐晓阳, 李国龙, 孙亚卿, 等. 甜菜NAC转录因子鉴定及其在水分胁迫下的表达分析[J]. 植物生理学报, 2019, 55(4): 444-456. |
| [16] |
侯艳玲.天仙子氮甲基腐胺转移酶(PMT)基因启动子的克隆及功能分析[D].重庆: 西南大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10635-1016766965.htm
|
| [17] |
杨国栋.棉花耐盐基因GhNHX1启动子的克隆及功能分析[D].泰安: 山东农业大学, 2007.
|
| [18] |
晁毛妮, 胡海燕, 王润豪, 等. 陆地棉钾转运体基因GhHAK5启动子的克隆与功能分析[J]. 作物学报, 2020, 46(1): 40-51. |
| [19] |
王光霞.中间锦鸡儿响应脱水胁迫的转录组学硏究及部分次生代谢相关基因的表达分析[D].呼和浩特: 内蒙古农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10129-1015427502.htm
|
| [20] |
韩晓敏.中间锦鸡儿3个非生物胁迫相关转录因子的克隆与功能分析[D].呼和浩特: 内蒙古农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016907241.htm
|
| [21] |
赵娜.中间锦鸡儿CiPP2C37-like基因的克隆与功能分析[D].呼和浩特: 内蒙古农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016249614.htm
|
| [22] |
冯宗琪.中间锦鸡儿CiMYB68基因克隆及表达分析[D].呼和浩特: 内蒙古农业大学, 2014. http://www.cnki.com.cn/Article/CJFDTotal-DNYX201406003.htm
|
| [23] |
Liu K, Yang Q, Yang T, et al. , Development of Agrobacterium-mediated transient expression system in Caragana intermedia and characterization of CiDREB1C in stress response[J]. BMC Plant Biology, 2019, 19(1): 237-249. |
| [24] |
万东莉. CBP60g正调控拟南芥对丁香假单胞菌、脱落酸和干旱的响应[D].呼和浩特: 内蒙古农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10129-1013153667.htm
|
| [25] |
李燕.紫花苜蓿MsZFN锌指蛋白基因启动子MsZPP的克隆与序列分析[D].呼和浩特: 内蒙古农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10129-2009131472.htm
|
| [26] |
冯艳芳.花生根特异启动子的克隆及功能分析[D].太原: 山西师范大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10118-1016100356.htm
|
| [27] |
邵宇鹏.大豆GmWRI1a基因启动子克隆及其功能分析[D].哈尔滨: 东北农业大学, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10224-1019173041.htm
|





