2. 中国科学院大学,北京 100049;
3. 南方海洋科学与工程广东省实验室(广州),广州 510301
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Southern Marine Science and Engineering Guangdong Laboratory(Guangzhou)Guangzhou 510301
微藻油具有制备生物柴油的潜力,受到国内外政府和科学家的广泛关注[1],微藻油除了可以作为生物柴油的生产原料外,其特殊的脂肪酸组成也赋予它在抗氧化、损伤修复及提高免疫力等方面的活性[2]。
真眼点藻(Eustigmatos)具有生长速率快、可以积累高含量微藻油和二十碳五烯酸(Eicosapentaenoic acid,EPA)等特性,是一种极具开发潜力的微藻资源[3]。魏氏真眼点藻(Eustigmatos vischeri)的生物质浓度可以达到9.14 g/L、总脂含量达到60.8% DW(Dry weight),波氏真眼点藻(Eustigmatos polyphem)的生物质浓度甚至可以达到11.0 g/L、总脂含量超过50% DW,目前对于真眼点藻的研究主要集中在氮、磷对其生长和油脂积累的影响(室内)[4-5],户外培养与室内培养存在较大差异,如温度、光照、微生物等都难以控制,室内数据可能与户外数据存在较大的偏差[6]。用于微藻培养的光生物反应器有多种类型,包括柱式、管式和平板式等[7],其中,平板式光生物反应器具有比表面积大、光线穿透性率高、加工方便等优点[8],被广泛用于微藻养殖中,Gao等[9]利用室内平板式光生物反应器培养波氏真眼点藻(Eustigmatos cf. polyphem),获得了0.142 g/L·d的生物质产率,可见平板式光生物反应器适于真眼点藻的培养,户外培养条件下是否也可以获得同样的生物质产率,未见相关报道。
微藻油脂属于细胞内油脂,需要采用合适的方法将其提取出来,常用的提取方法包括正己烷/乙醇、氯仿/甲醇等体系[10],如氯仿/甲醇体系需要在50℃的条件下搅拌数小时,才可以获得较高的提取效率[11],作为食品用途的油脂,上述溶剂存在潜在的致毒害风险[12]。因此,寻找一种更加安全无污染的提取溶剂至关重要。乙醇具有亲水性和亲脂性双重特性,细胞穿透性强,是一种常用的有机提取溶剂[13],也有用乙醇进行微藻油脂提取的报道[14],如果可以利用乙醇提取真眼点藻油脂,将大幅降低真眼点藻油脂的提取成本。
本研究利用自行设计的一套平板式光生物反应器,评价一株耐盐真眼点藻(Eustigmatos sp. SCSIO-45821)的户外生产性能,同时研究乙醇提取真眼点藻油脂的可行性,研究结果为真眼点藻油的开发奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 藻种及培养方法真眼点藻(Eustigmatos sp. SCSIO-45821)分离自宁夏固原市罗洼乡(N36°15'28.23″,E106°35'12.76″),现保藏于中国科学院南海海洋研究所海藻资源与生物技术实验室。
利用氮元素减量的BG-11培养基作为真眼点藻户外培养的培养基,培养基含有以下成分为:NaNO3(0.5 g/L),K2HPO4·3H2O(40 mg/L),NaHCO3(2.0 g/L),MgSO4·7H2O(75 mg/L),CaCl2·2H2O(36 mg/L),FeCl3·6H2O(3.15 mg/L),Citric acid(6.0 mg/L),EDTANa2·2H2O(4.36 mg/L),H3BO3(2.86 mg/L),MnCl2·4H2O(1.18 mg/L),ZnSO4·7H2O(0.22 mg/L),Na2MoO4·2H2O(0.39 mg/L),Co(NO3)2·6H2O(0.05 mg/L)和CuSO4·5H2O(0.08 mg/L)。
1.1.2 平板式光生物反应器设计平板光生物反应器利用普通白玻璃(厚度1.0 cm)与硅胶加工而成,不锈钢外框加固反应器,两种规格包括:(1)光径4 cm:高度120 cm(装液高度100 cm),长度120 cm,有效体积为48 L;(2)光径6 cm:高度120 cm(装液高度100 cm),长度120 cm,有效体积为72 L。
采用反应器外表面喷淋的方式降温,藻液温度保持在28℃(环境温度为33-35℃)。
1.2 方法 1.2.1 实验设计 1.2.1.1 户外培养实验选择广州非雨季进行户外评价实验,培养时间为10 d,藻细胞经室内扩种后,直接接入户外4 cm和6 cm平板式光生物反应器中,初始接种OD750为0.5,连续鼓入二氧化碳加富的压缩空气提供碳源和搅拌(1% CO2),培养周期内,白天平均温度在33.4 ± 1.2℃,平均光照强度1 000 ± 280 μmol photons/m2 s,每2 d测定生物质浓度,离心收集藻细胞,冻干后测定总脂含量和脂肪酸组成,每天镜检观察杂藻和原生动物情况。
1.2.1.2 乙醇提油实验(1)不同提取时间对油脂提取率的影响:常温条件下,利用100%乙醇进行搅拌抽提,0.5、1、2、3、4、5、6、12、18、24和36 h取样,利用氮吹仪将乙醇吹干后,利用重量法计算油脂提取率;(2)不同乙醇浓度对油脂提取率的影响:设置乙醇浓度为60%、70%、80%、95%和100%,常温条件下,提取时间为8 h,油脂提取率按(1)计算;(3)不同提取温度对油脂提取率的影响:设置提取温度为20、30、40、50、60和70℃,提取时间8 h,乙醇浓度为100%,油脂提取率下述公式计算。
油脂提取率(%)= m2/(m1 × 32.5%)×100%其中,32.5% DW为本研究所用藻粉的总脂含量(采取改良的Khozin-Goldberg法测定),乙醇提取的油脂重量用m2表示,藻粉重量用m1表示。
油脂品质检测:将乙醇提取得到的油脂进行品质检测,利用硅胶柱层析法测定不同脂类组分的比例,利用气相色谱法测定油脂的脂肪酸组成。
1.2.2 测定方法 1.2.2.1 形体观察利用光学显微镜(Olympus CX41,Olympus Corporation,Japan),观察藻细胞形态特征。
1.2.2.2 分子鉴定及进化树的构建利用CTAB法提取DNA,利用18S rRNA的引物对基因进行扩增(正向引物:5'-CTGGTTGATCCTGCCAGT-3',反向引物:5'-CACCTACGCAAACCTTGTTACGACTT-3'),PCR产物测序后进行序列比对,采用Clustal X 1.8和MEGA7.0软件构建系统进化树。
1.2.2.3 生物质浓度和生物量的测定取10 mL的藻液,用预先80℃烘干至恒重的混合纤维滤膜(0.45 μm)进行抽滤,再将有藻细胞的滤膜放置在80℃烘箱烘至恒重,用减差法得到生物质浓度。
生物量(g)=生物质浓度(g/L)×培养体积(L)
1.2.2.4 总脂含量的测定和分级采取改良的Khozin-Goldberg法测定藻粉中总脂含量[15]。
以一定体积的氯仿-甲醇(1:1,V:V)溶解总脂,利用硅胶层析柱(500 mg Sep-PakTM cartridge of silicagel,Waters)进行总脂分级。上样后,依次利用氯仿、丙酮和甲醇洗脱获得中性脂(主要为TAG),粗糖脂(GLs)和磷脂(PLs),每一组用氮气吹干至恒重,得到不同脂类组分的重量[15]。
1.2.2.5 脂肪酸相对含量的测定参照李涛等[15]的方法,冻干藻粉(或藻油10 mg)在H2SO4的催化作用下,生成脂肪酸甲酯,随后利用气相色谱测定脂肪酸相对含量,利用37种标准样品对脂肪酸种类进行鉴定。
1.2.2.6 产率的计算单位体积生物质产率(g/L·d)=(m2-m1)/Δt
单位面积生物质产率(g/m2·d)=(m2-m1)× h/Δt其中:m2为t2时间的生物质浓度(g/L),m1为t1时间的生物质浓度(g/L),Δt为培养时间(t2-t1),h为反应器的藻液高度(m)。
1.2.3 统计分析本论文中所有图表所示的平均值和标准偏差均由2个生物学重复和3个测定重复计算获得;利用SPSS 18.0进行数据分析(ANOVA);采用S-N-K方法对不同处理组进行多重比较;样品均值之间的差异用最小显著性差异(LSD)进行分析,置信度为0.05。
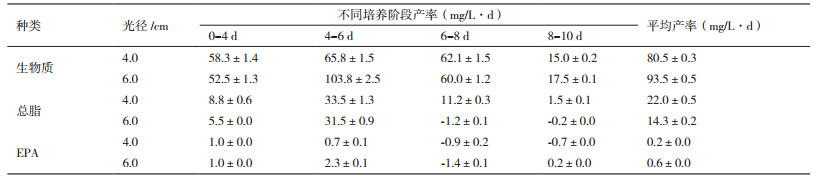
2 结果 2.1 藻种形态及分子进化树图 1-A-D为真眼点藻(Eustigmatos sp. SCSIO-45821)的形态特征,该藻为单细胞球形,直径为8-12 μm,细胞内存在多个震动颗粒,细胞内液泡,存在红色或橙色异质区域,叶绿体呈裂叶状周生,细胞以产生2个D型或4个正四面体的似亲孢子进行繁殖,上述形态特征特征与波氏真眼点藻(Eustigmatos polyphem)特征相符。根据真眼点藻SCSIO-45821的细胞形态(图 1)和系统进化树[16],推测真眼点藻(Eustigmatos sp. SCSIO-45821)属于真眼点藻(Eustigmatophyceae)、真眼点藻目(Eustigmatales)、真眼点藻科(Eustigmataceae)、真眼点藻属(Eustigmatos),因此,Eustigmatos sp. SCSIO-45821可能为波氏真眼点藻(E. polyphem)。
|
| A:正在进行二分裂的细胞;B:二分裂细胞;C:四分裂细胞;D:八分裂细胞 图 1 真眼点藻(Eustigmatos sp. SCSIO-45821)的形态特征 |
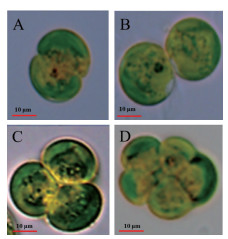
真眼点藻(Eustigmatos sp. SCSIO-45821)在不同光径平板反应器中的生长曲线如图 2所示,培养第0-4天,4 cm光径反应器中真眼点藻的生长速率快于6 cm光径反应器,而4 d后,6 cm光径反应器的生长速率快于4 cm光径反应器,至培养结束(第10天),6 cm光径反应器的生物质浓度达到1.1 g/L,较4 cm光径反应器(1.0 g/L)增加了10.0%。培养体积乘以生物质浓度等于生物量,计算得到6 cm光径反应器的生物量为76.3 g,而4 cm光径反应器仅有46.3 g,6 cm光径反应器比4 cm光径反应器增加了64.8%(P < 0.01),由此可见,6 cm光径反应器更加适合真眼点藻(Eustigmatos sp. SCSIO-45821)生物质的积累,镜检观察确认整个培养过程中两种反应器均未出现杂藻和原生动物污染,保证了结果的可信性。
|
| A:生物质浓度;B:生物量 图 2 真眼点藻(Eustigmatos sp. SCSIO-45821)在不同光径平板光生物反应器的生长情况 |
培养结束时(第10天),两种光径反应器中藻液的颜色如图 3所示:6 cm光径反应器藻液颜色为绿色,而4 cm光径反应器中藻液颜色变为黄绿色,上述现象说明:4 cm光径反应器中藻细胞色素的组成和含量可能与6 cm光径反应器存在差异。

|
| A:4 cm光径反应器;B:6 cm光径反应器 图 3 培养结束时真眼点藻(Eustigmatos sp. SCSIO-45821)在不同反应器中颜色变化 |
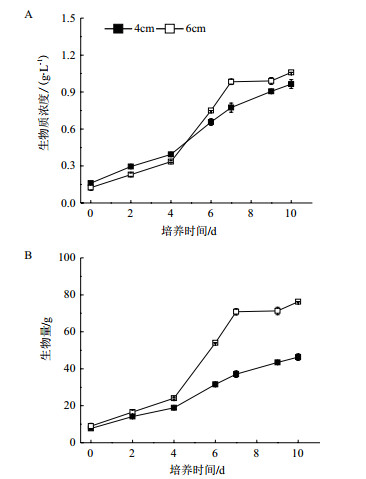
培养0-6 d,随着培养时间的延长,两种光径反应器的总脂含量均呈现增加趋势,4 cm光径反应器的油脂积累速率快于6 cm光径反应器,它们均在第6天达到最大值,4 cm光径反应器培养条件下,真眼点藻SCSIO-45821的总脂含量为30.1% DW,较6 cm光径反应器增加32.0%(P < 0.01),6 d后,两种光径反应器的总脂含量均呈现降低趋势,至培养第10天,6 cm光径反应器降至15.6% DW,4 cm光径反应器降至25.8% DW(图 4)。
|
| 图 4 真眼点藻(Eustigmatos sp. SCSIO-45821)总脂含量的变化规律 |
真眼点藻(Eustigmatos sp.)的主要脂肪酸包括C14:0、C16:0、C16:1、C18:1、C18:2、C20:4和C20:5(EPA),其中,C16:1的相对比例高于其他脂肪酸,随着培养时间,C16:1呈增加趋势,4 cm光径反应器培养条件下,真眼点藻SCSIO-45821最高C16:1含量为57.6% TFA(Total fatty acid),6.0 cm光径反应器培养条件下,最高为56.4% TFA;然而C20:5(EPA)在第4天达到最高值,4 cm光径反应器为8.2% TFA,6 cm光径反应器为8.9% TFA,随后开始降低,4 cm光径反应器EPA含量的降低幅度高于6.0 cm光生物反应器,培养结束(第10天),4 cm光径反应器仅有2.2% TFA,而6 cm光径反应器为4.0% TFA,两者相比存在显著性差异(P < 0.01)(图 5)。
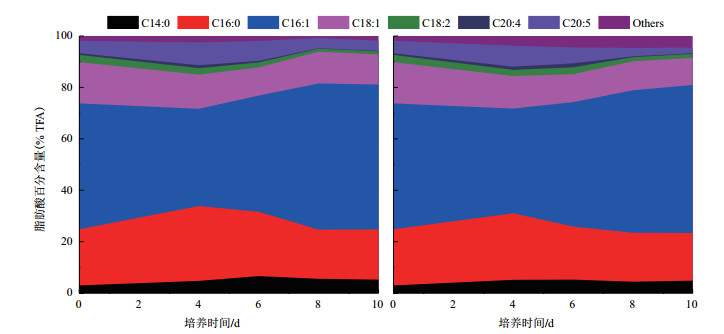
|
| 左图:4 cm光径反应器;右图:6 cm光径反应器 图 5 真眼点藻(Eustigmatos sp. SCSIO-45821)脂肪酸百分含量的变化 |
为了评估利用乙醇提取真眼点藻油的可行性,本论文开展了单因素对油脂提取率影响的研究,包括提取温度、乙醇浓度及提取时间(图 6),结果表明:提取温度对油脂提取率影响较小,提取温度在20-60℃范围内,提取率保持在49.5%,当提取温度为70℃度时,提取率反而降低,为40.0%。乙醇浓度对提取率的影响较大,随着乙醇浓度的提高,油脂提取率增加,100%乙醇浓度时,油脂提取率最大,为48.8%。提取时间明显影响油脂提取率,随提取时间的延长(0.5-48 h),总脂提取率逐渐增加,当提取时间为36 h时,提取率达到94.3%,继续增加提取时间,总脂提取率不再增加。上述结果表明:乙醇可以用于真眼点藻油脂的提取,理想的提取条件为常温条件下,乙醇浓度100%,提取时间36 h。
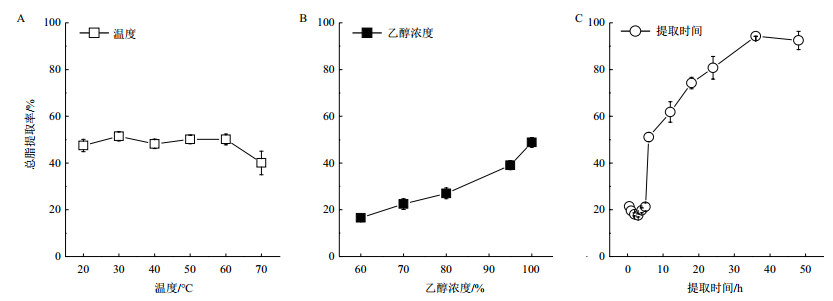
|
| A:提取温度;B:乙醇浓度;C:提取时间 图 6 不同提取条件对真眼点藻(Eustigmatos sp. SCSIO-45821)油脂提取率的影响 |
真眼点藻粗油脂类的组成如图 7所示,结果表明:油脂主要以中性脂为主(主要为三酰甘油),4 cm光径反应器的中性脂比例为71.4% TL,而6 cm光径反应器为66.4% TL,然而,6 cm光径反应器的糖脂和磷脂比例高于4 cm光径反应器,两种油脂的颜色均为黑褐色,具有流动性。
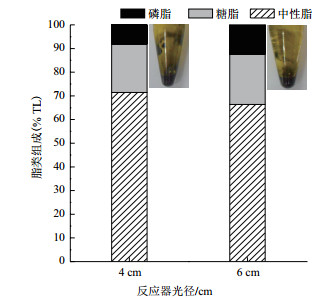
|
| 图中左侧离心管代表 4 cm光径生物反应器的藻油,右侧离心管代表 6 cm光径生物反应器的藻油 图 7 真眼点藻油(Eustigmatos sp. SCSIO-45821)的脂类组成 |
藻油的脂肪酸可以影响其下游应用,由表 1为两种光径生物反应器藻油的脂肪酸组成,4 cm和6 cm光径反应器都可以积累EPA,其中,6 cm光径反应器藻油的EPA相对含量可以达到4.0% TFA,而4 cm光径反应器仅有2.2% TFA,6 cm光径反应器较4 cm提高了81.8%(P < 0.01)。
通过计算真眼点藻(Eustigmatos sp. SCSIO-45821)的生物质、总脂和EPA产率,进而评价其户外生产性能。由表 1可知,两种光径生物反应器的生物质、总脂和EPA产率最高为4-6 d,随后均呈现降低趋势。计算整个周期内的平均产率可知,6 cm光径反应器的平均生物质产率高于4 cm,增加幅度为13.9%,而对于总脂产率而言,4 cm光径反应器的平均总脂产率高于6 cm光径反应器,增加幅度为53.8%,而对于EPA产率而言,6 cm光径反应器的产率高于4 cm光径反应器,6 cm产率达到0.6 mg/L·d,而4 cm仅有0.2 mg/L·d,增加幅度达到200%,可见在生物质和EPA产率上6 cm更加具有优势,而在促进油脂积累方面4 cm更加具有优势。
3 讨论 3.1 真眼点藻SCSIO-45821(Eustigmatos sp. SCS-IO-45821)的鉴定经形态学和分子鉴定,真眼点藻(Eustigma-tos sp. SCSIO-45821)属于真眼点藻纲(Eustigmatop-hyceae)、真眼点藻目(Eustigmatales)、真眼点藻科(Eustigmataceae)、真眼点藻属(Eustigmatos),与波氏真眼点藻(Eustigmatos polyphem CCAP 860/8)具有较近的亲缘关系。本研究藻株分离自宁夏高原地区的土壤表面,这与高保燕等[3]报道的真眼点藻经常分布在土壤表面,特别是高原土壤表面的报道一致,真眼点藻(Eustigmatos sp. SCSIO-45821)是否与已报道的波氏真眼点藻具有相同的生物学特性,还需要后续更多的实验验证。
3.2 不同光径平板式反应器对真眼点藻生长、脂类积累及脂肪酸组成的影响微藻生长受到各种因素的影响,如藻种特性、光照、温度、微生物等。任何一种条件的改变,都将导致微藻生物质产率的改变,因此准确的藻种生产性能评价应该在一年或几年的不同季节进行,进而获得准确的生物质产率。但为了快速了解藻种的特性,可以选择天气较为适宜时间段进行培养,以便快速评断藻种是否具有产业化潜力,如果该藻株不具有产业化潜力,则无需进行更长时间评价,本研究为了快速了解真眼点藻(Eustigmatos sp. SCSIO-45821)的户外生长性能,评价时间设定为10 d,由于整个培养过程的天气条件非常稳定(光照、温度、无污染),因此,培养数据接近该藻株户外培养较理想的产率数值。
光径对微藻生长和脂类积累的影响最终来源于光的穿透效率[17],4 cm光径反应器具有更窄的光径,随着藻细胞密度的增加,其具有较6 cm光径反应器更好的光线穿透率。培养前期(0-4 d),真眼点藻(Eustigmatos sp. SCSIO-45821)在4 cm光径反应器中的生长速率虽然快于6 cm光径反应器,但两种光径反应器最终生物质浓度并无明显差异。但通过计算生物质产量发现,6 cm光径反应器的生物质产量为76.3 g,4 cm光径反应器仅为46.3 g,这一结果证明4 cm光径反应器虽然具有更好的光穿透性,但并不能获得更高的生物质产量,我们推测这可能与真眼点藻(Eustigmatos sp. SCSIO-45821)的强光适应性有关,在培养周期内,白天正午光强最强可以达到约1 200 μmol photons/m2 s,上述强光在短时间内都可能造成藻细胞光系统的损伤,从而抑制微藻生长,布朗葡萄藻(Botryococcus braunii)UTEX 572和UTEX 2441的光饱和点分别为800 μmol photons/m2 s和400 μmol photons/m2 s[18],雨生红球藻712株系游动细胞的光饱和点为320 μmol photons/m2 s[19],1 200 μmol photons/m2 s超过了多数微藻的光饱和点,如果微藻接受的光强长时间处于光饱和点以上,将会导致细胞光损伤[20]。真眼点藻纲微藻常用的培养光强为150-350 μmol photons/m2 s[4-5],目前还没有真眼点藻强光适应性的报道。因此,建议户外条件下利用平板光生物反应器培养真眼点藻,在培养前期应尽量避免日光直射,减少强光对藻细胞的损伤。
本研究表明:4 cm光径反应器较6 cm光径反应器更有利于真眼点藻(Eustigmatos sp. SCSIO-45821)脂类的积累,4 cm光径反应器中藻细胞可以接受更强和更长时间的光照,而高光照有利于微藻脂类的积累[21],Liu等[22]报道栅藻(Scenedesmus spp.)在400 μmol photons/m2 s取得了比50 μmol photons/m2 s和250 μmol photons/m2 s更高的总脂含量,与本研究结果一致。但两种光径反应器的最高总脂含量均出现在第6天,我们推测这可能与强光照射引起的光损伤有关。积累高含量的EPA是真眼点藻受到关注的原因之一,本研究表明6 cm光径反应器更有利于EPA的积累。Gao等[9]报道类波氏真眼点藻(E. cf. polyphem)在高光强条件下不利于EPA的积累,这与本研究结果一致。高光强不利于EPA积累的原因可能为:EPA通常是一种膜脂组成成分[23],当强光照射时细胞倾向于分解膜脂,而大量合成储藏性中性脂,从而导致EPA含量降低。
3.3 利用乙醇提油取真眼点藻油脂油脂提取是微藻油开发中的重要环节,由于微藻细胞体积较小,难以用物理压榨法提取微藻油。常用的微藻油脂提取方法是有机溶剂抽提法[10],氯仿、正己烷、甲醇与丙酮常用于微藻油脂的提取[24],但考虑油脂的安全性,上述溶剂使用残留会导致油脂存在安全风险[12]。乙醇是一种常见的溶剂,广泛应用于各种活性产物提取当中,潜在风险较小[13]。本研究结果表明:乙醇可以用于真眼点藻油脂的提取,提取温度对油脂提取率无明显影响,高浓度乙醇可以获得较高的油脂提取效率,提取时间越长,油脂提取率越高,通过单因子优化实验获得的较优提取工艺为:100%乙醇、常温下浸提36 h,可以获得94.3%的油脂提取率,该技术成本低、安全性高,非常适用于用作食品或保健品原料微藻油脂的提取,乙醇可以提取油脂的原因可能是乙醇导致细胞膜上出现空隙,使细胞内油脂更容易提取[14]。后续我们将开展正交实验或者响应面实验进一步优化油脂提取条件,并尝试利用湿藻泥进行研究,为更大规模油脂提取工艺提供参考依据。
衡量油脂品质的指标有多种,包括脂肪酸组成、脂类种类、油脂、酸值等,本研究乙醇提取的油脂中含有超过70% TL的中性脂和4.0% TFA的EPA,是一种具有潜在价值的食品与保健品原料,但该粗油脂也存在明显的缺点,油脂中含有高含量的叶绿素而呈现暗黑色,较差的颜色将严重影响其下游应用[25]。真眼点藻油需要进行脱色与精炼,提高品质,与油脂品质相关的其他因素(如酸价、流动性、重金属等),我们将在后续的研究中进行分析。
3.4 真眼点藻SCSIO-45821(Eustigmatos sp. SCSIO-45821)的户外生产性能生物质产率是评价微藻是否具有产业化潜力的关键指标,4 cm和6 cm光径反应器的生物质产率分别为80.5 mg/L·d和93.5 mg /L·d,Gao等[9]报道类波氏真眼点藻(E. cf. polyphem)在室内平板式光生物反应器(24 h光照,荧光灯提供光源)中的生物质产率可以达到570 mg/L·d,本研究结果远远小于上述结果,原因可能为:(1)户外光照时间并非24 h,藻细胞受光时间少,特别是在夜晚无光的条件下,藻细胞可能会分解白天积累的物质,而使生物质浓度降低;(2)光照强度不稳定,过量的光照可能抑制藻细胞生长;(3)细菌或真菌的影响。如果获得更加准确的户外评价数据,需要进行长时间、多批次的评价工作。不考虑多组平板式反应器的空间布局问题,根据单组平板式反应器的占地面积为0.3 m2,可以计算4 cm和6 cm光径反应器中单位面积生物质产率仅有24.2 g/m2·d和28.1 g/m2·d,目前未见将真眼点藻进行户外跑道池培养的实例,但同属真眼点藻的拟微绿球藻的户外培养报道较多,Crowe等[26]报道在户外开放池的生物质产率仅有3.3 g/m2·d,可见光生物反应器的培养效率远高于跑道池。如果按照每年300 d计算,4 cm(体积为48 L)和6 cm(体积为72 L)光径反应器每年分别可以生产2.02 kg和1.16 kg藻粉,由此可见,6 cm光径反应器更加适宜真眼点藻的培养。如果促使真眼点藻生产油脂,建议采用两步培养法,首先利用光径较大的平板光生物反应器,获得较高的细胞密度,随后将微藻转入窄光径平板光生物反应器中诱导油脂积累。
4 结论真眼点藻SCSIO-45821可以利用户外平板式光生物反应器进行培养,在生物质和EPA产率上6 cm光径反应器更加具有优势,而在促进油脂积累方面4 cm光径反应器更加具有优势。利用100%乙醇常温下提取真眼点藻油脂可以获得94.3%的提取率,所提油脂含有超过70% TL的中性脂与4.0% TFA的EPA,但藻油颜色需要进一步处理。
| [1] |
Wijffels RH, Barbosa MJ. An outlook on microalgal biofuels[J]. Sci, 2010, 329(5993): 796-799. |
| [2] |
Borowitzka MA. High-value products from microalgae—their development and commercialisation[J]. J Appl Phycol, 2013, 25(3): 743-756. |
| [3] |
高保燕, 张成武, 万凌琳, 等. 真眼点藻纲的系统分类, 生物学特性及应用研究[J]. 水生生物学报, 2014, 38(5): 945-956. |
| [4] |
苏怡, 高保燕, 黄罗冬, 等. 不同氮源及氮浓度对真眼点藻纲微藻生长及油脂积累的影响[J]. 水生生物学报, 2017, 41(3): 677-691. |
| [5] |
何思思, 高保燕, 雷学青, 等. 初始硝酸钠浓度对魏氏真眼点藻的生长, 形态和油脂积累的影响[J]. 水生生物学报, 2015, 39(3): 574-582. |
| [6] |
Hu C, Li M, Li J, et al. Variation of lipid and fatty acid compositions of the marine microalga Pavlova viridis(Prymnesiophyceae)under laboratory and outdoor culture conditions[J]. World J Microb Biot, 2008, 24(7): 1209-1214. |
| [7] |
Singh R, Sharma S. Development of suitable photobioreactor for algae production—A review[J]. Renew Sust Energ Rev, 2012, 16(4): 2347-2353. |
| [8] |
Richmond A, Zhang CW. Optimization of a flat plate glass reactor for mass production of Nannochloropsis sp. outdoors[J]. J Biotechnol, 2001, 85(3): 259-269. |
| [9] |
Gao B, Xia S, Lei X, et al. Combined effects of different nitrogen sources and levels and light intensities on growth and fatty acid and lipid production of oleaginous eustigmatophycean microalga Eustigmatos cf. polyphem[J]. J Appl Phycol,, 2018, 30(1): 215-229. |
| [10] |
贺赐安, 余旭亚, 赵鹏, 等. 微藻油脂提取方法研究进展[J]. 中国油脂, 2012, 37(8): 16-20. |
| [11] |
程蔚兰, 邵雪梅, 宋程飞, 等. 氮胁迫对埃氏小球藻生长及油脂积累的影响[J]. 生物技术通报, 2017, 33(11): 160-165. |
| [12] |
陈志蓉, 裴新荣, 张凤兰, 等. 氯仿的毒理学研究现状及氯仿残留的风险性评估[J]. 中国药事, 2014, 28(2): 190-194. |
| [13] |
陈玉青, 严新, 陈明军, 等. 淡黑巨藻醇提取物降血糖活性及其对小鼠肠道菌群的影响[J]. 生物技术通报, 2017, 33(12): 162-169. |
| [14] |
Yang F, Xiang W, Sun X, et al. A novel lipid extraction method from wet microalga Picochlorum sp. at room temperature[J]. Marine Drugs, 2014, 12(3): 1258-1270. |
| [15] |
李涛, 许瑾, 吴华莲, 等. 不同氮浓度对一株产油绿球藻生长, 脂类积累及脂肪酸分布的影响[J]. 生物技术通报, 2018, 34(5): 154-162. |
| [16] |
赵伟, 李涛, 吴华莲, 等. 不同氮源及氮浓度对耐高盐真眼点藻生长, 脂类积累及脂肪酸组成的影响[J]. 生物技术通报, 2019, 35(6): 62-68. |
| [17] |
Wang SK, Stiles AR, Guo C, et al. Microalgae cultivation in photobioreactors: An overview of light characteristics[J]. Eng Life Sci, 2014, 14(6): 550-559. |
| [18] |
殷大聪, 耿亚红, 梅洪, 等. 几种主要环境因子对布朗葡萄藻(Botryococcus braunii)光合作用的影响[J]. 植物科学学报, 2008, 26(1): 64-69. |
| [19] |
刘建国, 张京清. 雨生红球藻光合和呼吸速率研究[J]. 海洋与湖沼, 2000, 31(5): 490-495. |
| [20] |
Melis A. Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximize efficiency[J]. Plant Sci, 2009, 177(4): 272-280. |
| [21] |
Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances[J]. Plant J, 2008, 54(4): 621-639. |
| [22] |
Liu J, Yuan C, Hu G, et al. Effects of light intensity on the growth and lipid accumulation of microalga Scenedesmus sp. 11-1 under nitrogen limitation[J]. Appl Biochem Biotechnol, 2012, 166(8): 2127-2137. |
| [23] |
Guschina IA, Harwood JL. Algal lipids and effect of the environment on their biochemistry[M]. New York: Springer, 2009.
|
| [24] |
朱孝晨, 孙利芹, 杨红芬, 等. 拟微绿球藻中二十碳五烯酸提取工艺的比较研究[J]. 中国油脂, 2018, 43(5): 95-99. |
| [25] |
Li T, Xu J, Wu H, et al. A saponification method for chlorophyll removal from microalgae biomass as oil feedstock[J]. Marine Drugs, 2016, 14(9): 162-181. |
| [26] |
Crowe B, Attalah S, Agrawal S, et al. A comparison of Nannochloropsis salina growth performance in two outdoor pond designs: conventional raceways versus the ARID pond with superior temperature management[J]. Int J Chem Eng, 2012(6): 469-473. |