重寄生现象(Mycoparasitism)是指自然界一种真菌寄生在另一种真菌上并完成生活史的现象。重寄生菌则是一类寄生在另一种真菌上的真菌[1]。重寄生作用作为植物病害的主要生防机制,越来越受到各国植物病理学家的重视。植物锈病的重寄生现象非常普遍,在生态自然控病和植物锈病生物防治中占有重要地位。以往研究主要集中在锈菌重寄生菌的筛选、鉴定及生物学特性等方面[2-4]。对于重寄生的机制目前认为主要包括酶和毒素两方面[5]。真菌毒素(Mycotoxin)是由植物病原真菌及病原重寄生真菌产生的一类对寄主植物和病原真菌有毒的代谢产物,即真菌与寄主植物,重寄生菌与寄主真菌互作中的重要致病因子[6]。目前对于重寄生菌所产毒素的研究报道较少,多从重寄生菌对植物病原菌能产生很强的拮抗作用来推测其所产毒素的存在[7]。
拟盘多毛孢属(Pestalotiopsis)含有对许多植物内生或致病的真菌。Steyaert[8]于1949年首先提出拟盘多毛孢属,并根据分生孢子的形态特征将其与盘多毛孢属(Pestalotia)分离。自此传统拟盘多毛孢属的分类鉴定主要依靠形态特征。但是依据形态特征对拟盘多毛孢进行分类有很大的局限性,无法明确种间界限及亲缘关系;不同学者对同一物种的形态特征界定和看法不同,且主要以菌株的寄主植物命名,导致一个菌种多个名字,不利于拟盘多毛孢菌株的开发及利用[9]。近年来,分子手段被广泛用于拟盘多毛孢属的鉴定和分类。Jeewon等[10]基于ITS序列分析评估形态特征的系统发育重要性,使用ITS1-5.8S rRNA-ITS2识别物种。建立了一个系统发育树,并显示最终的形态特征是中性细胞的色素沉着和附肢尖端的形态。为进一步解决分类学问题,Liu等[11]使用形态学和ITS1-5.8S rRNA-ITS2和β-tubulin 2基因序列描述了一个新物种Pestalotiopsis hainanensis,并构建了相似的系统进化树。Hu等[12]分析了来自ITS区域和β-微管蛋白基因的组合数据集DNA序列数据,发现组合基因更适合于解决分类学关系。
石楠锈孢锈菌(Aecidium pourthiaea)是石楠(Photinia prionophylla)叶锈病的病原菌,主要危害3年生以下的石楠幼树及幼苗[13]。前期研究从患有锈病的球花石楠叶片上分离得到3株重寄生拟盘多毛孢,对3株菌的形态特征进行了描述并初步确定其为拟盘多毛孢属,同时发现它们对石楠锈孢锈菌的锈孢子有很强的破坏作用[14]。本研究利用单基因及多基因复合分析并结合形态特征,对3株拟盘多毛孢进行种的鉴定,旨在为石楠锈病的生物防治提供菌种资源;同时筛选重寄生拟盘多毛孢的最佳产毒培养基,为石楠锈孢锈病的重寄生拟盘多毛孢毒素的分离鉴定及生物农药的开发提供理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株3株重寄生拟盘多毛孢PG52、PG53和PG90分离自患有锈病的球花石楠叶片上,并保存于4℃[14]。茶藨生柱锈菌锈孢子采自云南省昆明市东川区二二二林场;石楠锈病锈菌孢子采自西南林业大学苗圃中。
1.1.2 培养基6种产毒培养基:PDA培养基、改良Fries培养基、查彼(Czapek)培养基、理查(Richard)培养基、PSKA培养基和改良M-1-D培养基[15]。
1.1.3 引物ITS5(5'-GAAAGTAAAAGTCGTAAC-AAG-3')和ITS4(5'-TCCTCCGCTTATTGATAT-3');LROR(5'-ACCCGCTGAACTTAAGC-3')和LR5(5'-TCCTGAGGGAAACTTCG-3');bt2a(5'-GGTAAACCAAATCGGTGCTGCTTTC-3')和bt2b(5'-ACCCTCAGTGTAGTGACCCTTGGC-3')[14]。
1.2 方法 1.2.1 分子序列测定从已培养8 d的PDA平板菌落边缘挑取直径为0.5 cm的拟盘多毛孢菌块,以3块/瓶的接种量接入50 mL PD培养液中,于25℃下以120 r/min振荡培养5 d。每处理设置3个重复。发酵液双层滤纸抽滤,无菌水清洗菌丝后利用DNA提取试剂盒(上海生工)进行拟盘多毛孢DNA的提取,以ITS5和ITS4为引物扩增ITS基因;以LROR和LR5为引物扩增28S基因;以bt2a和bt2b为引物扩增beta-tubulin基因,对扩增产物依次进行琼脂糖凝胶电泳、胶回收、序列测定和GenBank数据库检索。
1.2.2 三株拟盘多毛孢分类鉴定筛选合适的对比序列[16],利用PAUP.40b10软件,输入paup程序构建系统发育树。通过前期观察得到3株拟盘多毛孢菌落形状、颜色和分生孢子等形态特征[14],对比《中国真菌志:拟盘多毛孢属》[17]和Maharachchikumbura等[16]文章中菌株的形态特征,通过分子鉴定和形态特征判断3株拟盘多毛孢的具体种名。
1.2.3 粗提物的制备将活化后的3株拟盘多毛孢,从各菌落边缘挑取直径0.5 cm的菌块分别接入6种(PDA培养基、改良Fries培养基、查彼Czapek培养基、理查Richard培养基、PSKA培养基和改良M-1-D培养基)中,25℃培养20 d后提取毒素粗提物。对使用不同培养基培养后的3种重寄生拟盘多毛孢菌株及其培养基,分别切成均匀小块,并放入相应标有菌株和培养基的锥形瓶中。然后加入有机溶剂(乙酸乙酯:甲醇:乙酸=80:15:5)100 mL浸泡3 d后过滤,重复3次,过滤后合并滤液。用旋转蒸发仪在60℃下萃取,然后加入12 mL溶解剂二甲亚砜(DMSO)溶解提取物1-2 min既得粗提物,冰箱中低温保存备用。
1.2.4 锈孢子活力检测生物测定采用凹玻片法,即在灭过菌的凹玻片内注入100 μL毒素原液,分别取适量茶藨生柱锈菌和石楠锈孢锈菌锈孢子浸于其中,搅拌使锈孢子与液体充分接触。处理一段时间后,定时取少许锈孢子分别以蒸馏水和0.4%台酚蓝为浮载剂制片,于显微镜下观察孢子的颜色和形态变化。以未接种菌块的培养液处理的锈孢子为对照。
1.2.5 最佳产毒培养基的筛选按上述方法进行生测,以添加锈孢子壁为诱导物的培养基制得的粗提物处理锈孢子作为平行组,以未接入菌块的培养液处理锈孢子为阴性对照,每处理设3个重复。通过台盼蓝染色法测定锈孢子的活性,利用倒置显微镜(LEICA DMi1)拍照纪录。
2 结果 2.1 三株拟盘多毛孢的分子鉴定系统发育分析采用PAUP. 40b10软件,以最大简约(MP)法对3株拟盘多毛孢菌株和来自[14]文章中报道的菌株beta-tubulin(TUB)序列进行分析并构建系统发育树,结果显示(图 1):3株拟盘多毛孢中PG52和PG90聚在同一个分支,支持率为63%,两者又与菌种Pestalotiopsis kenyana和Pestalotiopsis Oryzae在同一个大的分支,支持率为98%;PG53与PG52、PG90分支相距较远,且与Pestalotiopsis telopeae在同一个分支,支持率为59%。表明PG52与PG90亲缘关系近,两者与Pestalotiopsis kenyana和Pestalotiopsis Oryzae的亲缘关系较近,而PG53与Pestalotiopsis telopeae亲缘关系较近。

|
| 1:Neopestalotiopsis surinamensis;2:Neopestalotiopsis saprophytica(下同) 图 1 三株拟盘多毛孢PG52、PG53和PG90的TUB序列建树结果 |
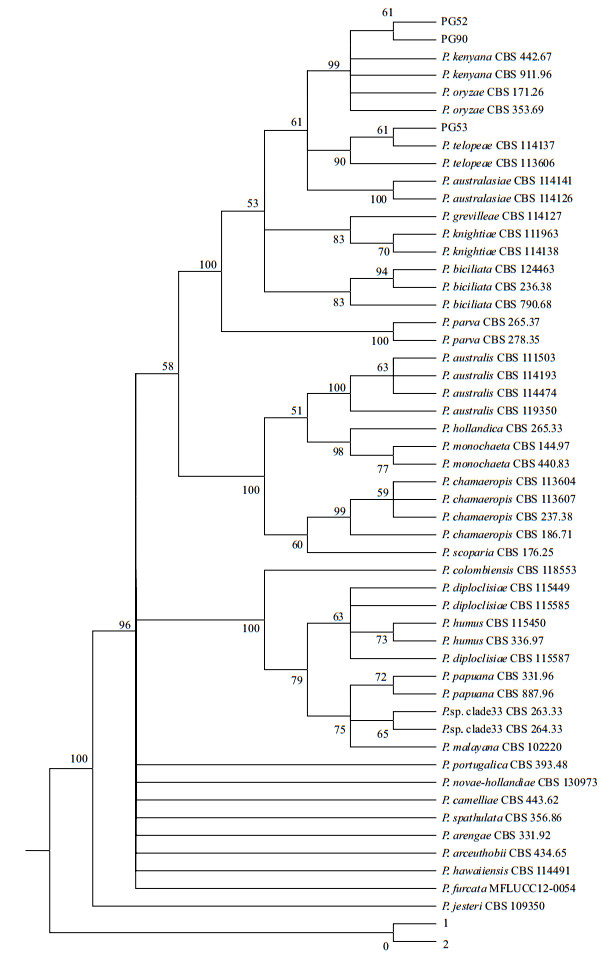
以最大简约(MP)法对3株拟盘多毛孢菌株的ITS、LSU和TUB复合序列进行分析并构建系统发育树,结果显示(图 2):3株拟盘多毛孢中PG52与PG90聚在同一个分支,支持率为61%,又与Pestalotiopsis kenyana和Pestalotiopsis Oryza在同一个大分支,支持率为98%;PG53与PG52、PG90分支相距较远,且与Pestalotiopsis telopeae在同一个分支,支持率为61%。表明PG52与PG90亲缘关系近,两者与Pestalotiopsis kenyana和Pestalotiopsis Oryzae的亲缘关系较近,而PG53与Pestalotiopsis telopeae亲缘关系较近。
|
| 图 2 三株拟盘多毛孢PG52、PG53、PG90的三段序列组合建树结果 |
对比发现ITS、LSU和TUB复合序列构建系统发育树的结果与TUB序列系统发育树的结果相同,又根据3株拟盘多毛孢的菌落形态、分生孢子基附肢的数量、孢子颜色和长度等形态特征对比结果,可知PG53菌株的形态与Pestalotiopsis telopea的形态描述基本一致;PG52和PG90菌株的形态特征与Pestalotiopsis kenyana的形态描述一致。
2.2 三株拟盘多毛孢对石楠锈病锈菌孢子的作用3株拟盘多毛孢均能在锈孢子堆上生长,取处理后的锈孢子(图 3-B-D)用倒置显微镜观察,与未处理的锈孢子(图 3-A)对比,结果发现处理后的锈孢子内含物浓缩,有的锈孢子内含物释放到孢子壁外,形成空壳,但锈孢子壁基本完整,初步判定其为毒素的作用。

|
| A:石楠锈孢子对照;B:PG52菌丝处理孢子后的效果图;C:PG53菌丝处理孢子后的效果图;D:PG90菌丝处理孢子后的效果图 图 3 三株拟盘多毛孢对石楠锈病锈菌孢子的作用 |
PG52菌株:改良Fries培养基(图 4-B)和改良M-1-D培养基(图 4-F)的粗提物效果最好,处理染色后,锈孢子内和锈孢子壁都能染上深蓝色。理查培养基(图 4-D)和PDA培养基(图 4-A)的粗提物效果稍次,PSKA培养基(图 4-E)和查彼培养基(图 4-C)最次。

|
| A:PDA培养基的粗提物效果图;B:改良Fries培养基的粗提物效果图;C:查彼培养基的粗提物效果图;D:理查培养基粗提物效果图;E:PSKA培养基的粗提物效果图;F:改良M-1-D培养基的粗提物效果图 图 4 PG52菌株不同培养基粗提物处理石楠锈病锈菌孢子效果图 |
PG53菌株:改良Fries培养基和改良M-1-D培养基的粗提物效果最好,处理染色后,锈孢子内和锈孢子壁都能染上深蓝色。理查培养基和PSKA培养基稍次,PDA培养基和查彼培养基最次。
PG90菌株:改良Fries培养基、理查培养基、查彼培养基和改良M-1-D培养基的粗提物效果最好,处理染色后,锈孢子内和锈孢子壁都能染上深蓝色。PDA培养基和PSKA培养基效果稍次。
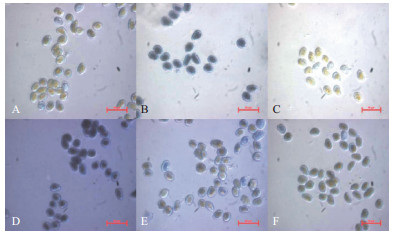
2.3.2 茶藨生柱锈菌孢子PG52菌株:理查培养基(图 5-D)和改良Fries培养基(图 5-B)的粗提物效果最好,处理染色后,锈孢子内和锈孢子壁都能染上深蓝色。PSKA培养基(图 5-E)和改良M-1-D培养基(图 5-F)的粗提物效果稍次。而PDA培养基(图 5-A)和查彼培养基(图 5-C)的粗提物则没有效果,锈孢子仍然呈现黄色。
|
| A:PDA培养基的粗提物效果图;B:改良Fries培养基的粗提物效果图;C:查彼培养基的粗提物效果图;D:理查培养基粗提物效果图;E:PSKA培养基的粗提物效果图;F:改良M-1-D培养基的粗提物效果图 图 5 PG52菌株不同培养基粗提物处理茶藨生柱锈菌锈孢子效果图 |
PG53菌株:理查培养基、改良Fries培养基和改良M-1-D培养基的粗提物效果最好,处理染色后,锈孢子内和锈孢子壁都能染上深蓝色。PDA培养基的粗提物效果稍次,染色颜色不深。而PSKA培养基和查彼培养基的粗提物则没有效果,锈孢子仍然呈现黄色。
PG90菌株:理查培养基、查彼培养基、改良Fries培养基和改良M-1-D培养基的粗提物效果最好,处理染色后,锈孢子内和锈孢子壁都能染上深蓝色。PDA培养基和PSKA培养基的粗提物效果稍次,染色颜色不深。该菌株没有无效果的粗提物。
3 讨论近年将分子系统学方法用于拟盘多毛孢分类中,用多个基因片段分别或共同建立分子系统树,并结合形态学特征可以在一定程度上解决目前在形态分类上所遇到的问题。拟盘多毛孢属的分生孢子在形态上是多种多样的,基于单基因和多基因系统发育,以及形态特征,宿主关联和地理分布等更加准确的鉴定出物种[18]。Jeewon等[19]在对拟盘多毛孢的第一个包容性系统发育研究中利用ITS序列数据,以评估分类学中拟盘多毛孢的形态学特征的系统发生意义。Hu等[12]在区分华山松和Ribes spp.中的内生拟盘多毛孢种类时指出,TUB基因更好地解决了拟盘多毛孢的系统发育。TUB和ITS基因的组合可提供更好的系统发育分辨率,并建议将它们用于解决拟盘多毛孢的系统发育。Maharachchikumbura等[16]在拟盘多毛孢菌中测试了肌动蛋白、钙调蛋白、谷氨酰胺合酶、3-磷酸甘油醛脱氢酶、ITS、LSU、18S nrDNA、RNA聚合酶II、TEF和TUB等,通过比较发现,分子鉴定效果优于形态学方法。在本研究中,基于ITS、TUB和LSU基因区域组合的系统发育物种识别在末端进化枝上提供了强力支持,为更好的鉴定拟盘多毛孢菌株奠定理论基础。
锈菌是一类重要的植物病原菌,每年都给农业、林业生产造成巨大的损失[20-21]。防治锈病的方法包括化学防治、物理防治、生物防治和采用转基因的手段,这些方法各有利弊[22]。近年来,对拟盘多毛孢致病机理的研究包括对其侵入寄主植物产生的相关酶的研究,及其所产毒素及在生产上的应用的前景等方面的研究[23-25]。目前,由石楠锈孢锈菌(Aecidium pourthiaea syd.)引起的石楠叶锈病发病逐年加重,能引起石楠叶片、嫩梢的失绿和枯萎死亡,进而引起一些次生病虫害的发生,昆明因气候温暖,该病害全年都有发生,严重影响了石楠的绿化和观赏价值。从石楠锈孢锈菌孢子分离得到的3株重寄生拟盘多毛孢,通过研究证明,对石楠锈病锈菌孢子和茶藨生柱锈菌孢子均有强寄生作用,结合茶藨生柱锈菌孢子和石楠锈病锈菌孢子的实验结果确定了3株拟盘多毛孢的最佳产毒培养基。研究结果为重寄生拟盘多毛孢在锈病生物防治中的应用及其次生代谢产物的研究奠定了良好的基础。
4 结论本研究分别利用ITS、LSU、TUB以及三者组合构建系统发育树,结果显示,PG52、PG90与Pestalotiopsis kenyana和Pestalotiopsis Oryza菌株在同一个分支,PG53为Pestalotiopsis telopeae菌株;同时结合形态特征,最终鉴定PG52、PG90为Pestalotiopsis kenyana菌株,PG53为Pestalotiopsis telopeae菌株。分离得到的3株石楠锈孢锈菌重寄生拟盘多毛孢,其不仅能破坏石楠叶锈菌的锈孢子,也能破坏茶藨生柱锈菌的锈孢子,均使锈孢子的内含物溢出,导致锈孢子死亡。但因孢子壁基本完整,初步判定其为毒素的作用。PG52菌株的最佳产毒培养基为改良Fries培养基;PG53菌株的最佳产毒培养基为改良M-1-D培养基;PG90菌株的最佳产毒培养基为改良M-1-D培养基。
| [1] |
杨艳红, 陈玉惠. 植物病原菌重寄生菌作用机理的研究进展[J]. 西南林业大学学报:自然科学版, 2004, 24(2): 70-75. |
| [2] |
黄云, 叶华智, 刘紫英, 等. 华中五味子锈病菌及其重寄生菌的鉴定[J]. 植物病理学报, 2004, 34(2): 117-121. DOI:10.3321/j.issn:0412-0914.2004.02.004 |
| [3] |
叶利芹, 吴小芹, 叶建仁. 竹叶锈病重寄生现象及重寄生菌鉴定[J]. 菌物学报, 2011, 30(3): 54-60. |
| [4] |
李利, 高立强, 杨家荣. 白粉菌重寄生真菌的分离鉴定[J]. 陕西农业科学, 2016, 62(10): 38-41. DOI:10.3969/j.issn.0488-5368.2016.10.013 |
| [5] |
杨艳红, 陈玉惠, 朱云峰. 西南地区茶藨生柱锈重寄生菌的分离与鉴定[J]. 浙江农林大学学报, 2005, 22(4): 414-419. DOI:10.3969/j.issn.2095-0756.2005.04.012 |
| [6] |
刘亚光.大豆灰斑病菌毒素组分、致病性及其诱导抗性的研究[D].哈尔滨: 东北农业大学, 2002. http://d.wanfangdata.com.cn/thesis/Y468097
|
| [7] |
贺珍, 胡先文, 付艳苹, 等. 重寄生真菌盾壳霉与核盘菌对峙培养的差异代谢物分析[J]. 华中农业大学学报, 2017, 36(1): 35-41. |
| [8] |
Steyaert RL. Contribution a letude monographique de Pestalotia de not. et Monochaetia sate[J]. Bulletin du Jardin Botanique de 1'Ètat Bruxelles, 1949, 19: 285-354. DOI:10.2307/3666710 |
| [9] |
宋玉.拟盘多毛孢属(Pestalotiopsis)真菌系统学研究及条形码基因的评价[D].贵阳: 贵州大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10657-1015911226.htm
|
| [10] |
Jeewon R, Liew ECY, Simpson JA, et al. Phylogenetic significance of morphological characters in the taxonomy of Pestalotiopsis species[J]. Molecular Phylogenetics and Evolution, 2003, 27(3): 372-383. |
| [11] |
Liu AR, Xu T, Guo LD. Molecular and morphological description of Pestalotiopsis hainanensis sp. nov., a new endophyte from a tropical region of China[J]. Fungal Divers, 2007, 24: 23-36. |
| [12] |
Hu HL, Jeewon R, Zhou DQ, et al. Phylogenetic diversity of endophytic Pestalotiopsis species in Pinus armandii and Ribes spp. : evidence from rDNA and β- tubulin gene phylogenies[J]. Fungal Divers, 2007, 24: 1-22. |
| [13] |
蔡灿, 伍建榕. 球花石楠锈病病原物的初步研究[J]. 北方园艺, 2008(1): 208-210. |
| [14] |
李靖, 谢津, 李向楠, 等. 石楠锈孢锈菌重寄生拟盘多毛孢的分离鉴定及抑菌活性[J]. 生物技术通报, 2017, 33(3): 122-127. |
| [15] |
李靖, 刘风路, 陈玉惠. 茶麃生柱锈菌重寄生拟盘多毛孢产毒培养条件的筛选[J]. 江西农业大学学报, 2017, 39(2): 395-401. |
| [16] |
Maharachchikumbura SSN, Hyde KD, Groenewald JZ, et al. Pestalotiopsis revisited[J]. Studies in Mycology, 2014, 79(79): 121-186. |
| [17] |
葛起新, 陈育新, 徐同. 中国真菌志:拟盘多毛孢属[M]. 北京: 科学出版社, 2009.
|
| [18] |
Liu F, Hou L, Raza M, et al. Pestalotiopsis and allied genera from Camellia, with description of 11 new species from China[J]. Scientific Reports, 2017, 7: 866. DOI:10.1038/s41598-017-00972-5 |
| [19] |
Jeewon R, Liew ECY, Hyde KD. Phylogenetic relationships of Pestalotiopsis and allied genera inferred from ribosomal DNA sequences and morphological characters[J]. Molecular Phylogenetics and Evolution, 2002, 25(3): 378-392. |
| [20] |
Kislev ME. Stem rust of wheat 3300 years old found in Israel[J]. Science, 1982, 216(4549): 993-994. DOI:10.1126/science.216.4549.993 |
| [21] |
谢联辉. 普通植物病理学[M]. 北京: 科学出版社, 2006.
|
| [22] |
Graham PH, Vance CP. Legumes: importance and constraints to greater use[J]. Plant Physiol, 2003, 131: 872-877. DOI:10.1104/pp.017004 |
| [23] |
Stokstad E. Deadly wheat fungus threatens world's breadbaskets[J]. Science, 2007, 315(5820): 1786-1787. DOI:10.1126/science.315.5820.1786 |
| [24] |
蒋继志, 白冰, 郑超, 等. 石楠拟盘多毛孢致病毒素除草作用的初步研究[J]. 河北农业大学学报, 2012, 35(2): 88-92. DOI:10.3969/j.issn.1008-6927.2012.02.025 |
| [25] |
唐瑶.茶褐斑拟盘多毛孢对山茶致病机理的研究[D].成都: 四川农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10626-2010244402.htm
|




