2. 山西省农业科学院生物技术研究中心,太原 030031
2. Biotechnology Research Center,Shanxi Academy of Agriculture Science,Taiyuan 030031
随着马铃薯成为继水稻、小麦、玉米之后的第四大粮食作物和精深加工产业的快速发展, 其种植面积在我国乃至全世界均呈现扩增趋势, 但各种植区由马铃薯早疫病引起的减产现象时有发生, 发生严重时减产可达 70%-80%[1-2].马铃薯早疫病是一种由茄链格孢菌( Alternaria solani)引起的世界性病害, 属气传、土传多循环流行性病害, 发病严重时不仅导致叶片提前枯萎, 严重阻碍光合作用造成减产, 而且其分生孢子适应性较强, 易形成二次为害, 对各地马铃薯产业健康发展具有较大影响[3-5].为有效防治马铃薯早疫病的发生, 研究者已从病原鉴定[6]、种植区病原遗传结构[1-2, 7]、qPCR 快速检测方法[8-9]、致病性[10]、抗药性[11]、抗性品种筛选[12-13]、拮抗微生物筛选[14-15] 和化学防治药剂筛选[16-17] 等方面进行了大量研究, 使得人们在一定程度上明确了该病害的典型症状、发病规律、化学防治药剂、病原检测方法和部分地区抗药性水平 ;了解了生物防治在该病害防治中的应用潜力.然而, 由于抗性品种选育和生物防治技术开发进程缓慢, 目前该病害仍以化学防治为主, 但由于病原抗药性产生和部分产区病害逐年严重[18], 人们不得不加大防治药剂用量或施药次数, 这些化学农药的大量和不合理使用导致化学防治的弊端(农田生态结构破坏、抗病抗药性增强和农药残留等)日益突出[18].
生物防治作为一种以生物体或其活性产物为农药的防治措施, 是缓解化学防治问题的重要途径之一[19].近年来, 为突破该病害生物防治技术, 国外已在植物天然产物[20]、拮抗微生物筛选及制剂[21]和壳聚糖防病[22] 上开展了大量研究工作, 但我国有关马铃薯早疫病的生物防治研究还较为落后, 虽然杨继业等[14]、杨登路等[15] 和王聪[23] 对该病原的拮抗微生物和植物天然抑菌产物室内活性进行了报道, 但相关结果因缺乏田间药效试验环节而不能有效证实其田间应用价值, 而田间防效良好又是其制剂化之前的必要条件.因此, 本研究一方面对前期筛选出的拮抗细菌 ML-3 产抗菌蛋白发酵培养条件进行优化, 旨在为其后期工业化发酵提供参考依据 ;另一方面, 对该抗菌蛋白的抑菌稳定性和田间防效进行测定, 旨在评价该菌株抗菌蛋白的田间应用潜力, 并为其后期制剂化研究和田间应用提供参考依据.
1 材料与方法 1.1 材料 1.1.1 供试菌株拮抗细菌 ML-3(分离自马铃薯植株茎部)和马铃薯早疫病病原(由山西省农业科学院农产品贮藏保鲜研究所采后病理室提供).
1.1.2 供试培养基NA 固体培养基、NB 发酵液和PDA 培养基配制均参照高振峰[24] 描述的方法.
1.2 方法 1.2.1 基于 16S rRNA 序列分析的菌株 ML-3 分子鉴定参照 Gao 等[25] 描述的方法进行菌株 ML-3 的基因组 DNA 提取、16S rDNA 序列扩增测序和序列比对, 随后选择近缘模式菌株16S rDNA序列使用MEGA 5.0构建 NJ 系统发育树.
1.2.2 供菌株 ML-3 抗菌蛋白最佳硫酸铵盐析浓度测定(1)无菌发酵液制备 :菌株 ML-3 经 NB 发酵液于 30℃、160 r/min 振荡培养 72 h 后 终 止 发 酵, 12 000 r/min 离心 10 min 去除菌体收集上清液, 用于抗菌蛋白提取.(2)最佳盐析浓度筛选 :取无菌发酵液 1 000 mL, 参照张晓宇等[26] 描述的方法, 逐级加入不同饱和度硫酸铵, 各级硫酸铵用量分别为114 g/L(20%)、243 g/L(40%)、390 g/L(60%)、561 g/L(80%)和 767 g/L(100%), 并对不同饱和度下的蛋白进行提取、透析、浓缩和冷冻干燥, 获得抗菌蛋白干粉后于 4℃保存备用.(3)各级沉淀蛋白抑菌活性测定 :以马铃薯早疫病菌为靶标, 采用琼脂扩散法[27] 对各级沉淀蛋白的抑菌活性进行测定, 从而筛选出菌株 ML-3 抗菌蛋白的最佳硫酸铵沉淀饱和度.
1.2.3 拮抗细菌 ML-3 胞外产抗菌蛋白培养液配方优化 1.2.3.1 种子发酵液制备于超净工作台中, 用接种环挑取一环使用 NA 平板活化培养 24 h 的菌株ML-3, 并将其接种于装有 100 mL 的 NB 培养液的300 mL 三角瓶中, 于 30℃、160 r/min 培养 24 h, 获得种子发酵液.
1.2.3.2 碳源优化以 NB 为基础培养液, 分别用1% 的可溶性淀粉、蔗糖、甘露醇、葡萄糖、玉米粉、马铃薯作为碳源制备新培养液, 灭菌后按 1% 的接种量, 将已制备的 ML-3 种子液接种于不同碳源培养液中, 于 30℃、160 r/min 震荡培养 72 h, 重复 3 次.以 NB 培养液为对照, 分别采用比浊法[28] 和琼脂扩散法[27] 对菌体生长量和抗菌蛋白抑菌活性进行测定.
1.2.3.3 氮源优化以筛选出的较优碳源作为碳源, 固定无机盐, 分别用 1.5% 的硫酸铵、尿素、酵母浸粉、蛋白胨、花生粉和黄豆粉作为氮源制备新培养液, 同样按 1% 的接种量, 将菌株 ML-3 种子液接种于不同氮源培养液中, 于 30℃、160 r/min 震荡培养 72 h, 3 次重复.以 NB 培养液为对照, 发酵中止后测定经各培养液培养后的菌体生长量和抗菌蛋白抑菌活性.测定方法同 1.2.3.2.
1.2.3.4 无机盐优化以筛选出的较优碳源和氮源 作 为 碳、氮 源, 分 别 用 0.02% CuSO4·5H2O、0.05% MgSO4、0.1% KH2PO4、0.5% NaCl、0.02%ZnSO4·7H2O 和 0.02% FeSO4·7H2O 作为无机盐制备新培养液, 同样按 1% 的接种量, 将菌株 ML-3 种子液接种于不同氮源培养液中, 于 30℃, 160 r/min下震荡培养 72 h, 3 次重复.以 NB 培养液为对照, 发酵中止后测定菌体生长量和抗菌蛋白抑菌活性.测定方法同 1.2.3.2.
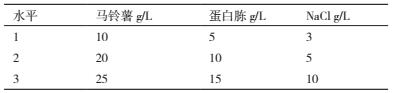
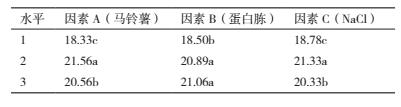
1.2.3.5 发酵液配方正交优化采用正交试验对单因素试验筛选出的较优碳源(马铃薯)、氮源(蛋白胨)和无机盐(NaCl)的用量组合进行三因素三水平正交试验, 筛选出较优配方(表 1).以抗菌蛋白抑菌活性为评价指标, 测定方法同 1.2.3.2.
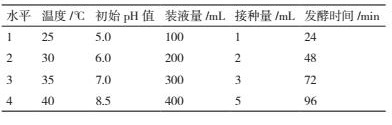
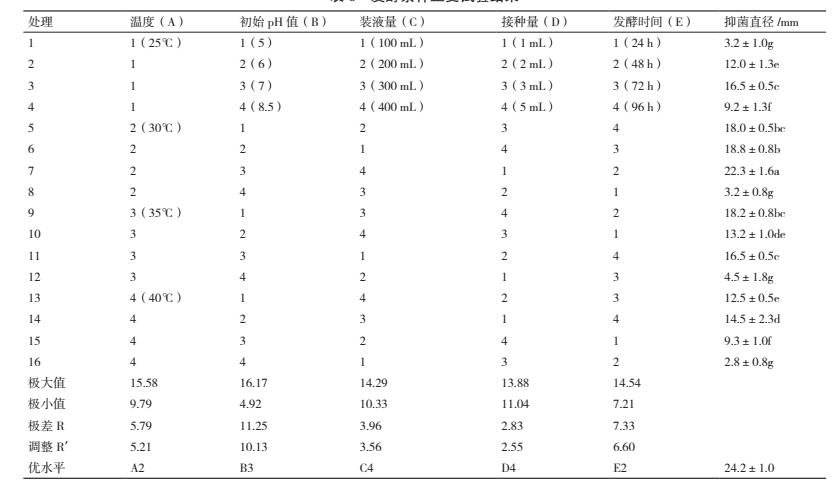
采用正交试验 L16(45)(表 2)对菌株 ML-3 的发酵温度、pH、装液量和接种量进行优化.使用 1 mol/L NaOH 和 1 mol/L HCl 来调节培养液 pH 值, 试验重复 3 次, 发酵结束后测定抗菌蛋白抑菌活性.测定方法同碳源优化.
参照采俊香等[29] 文献中描述的方法对菌株 ML-3 抗菌蛋白的热稳定性、紫外稳定性和酸碱稳定性进行测定.
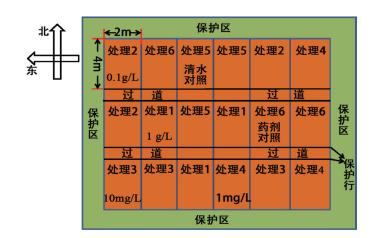
1.2.6 菌株 ML-3 抗菌蛋白的马铃薯早疫病田间防效 1.2.6.1 药前准备称取菌株 ML-3 抗菌蛋白干粉用水稀释后(药液浓度分别为 :1 g/L、0.1 g/L、10mg/L 和 1 mg/L)于五台县茹村田间发病地块(马铃薯开花期)采用叶面喷施进行防效测定, 以清水和80% 代森锌可湿性粉剂作为对照.每处理重复 3 次, 田间试验安排采用随机区组设计, 各小区试验安排见图 1.
|
| 图 1 不同浓度抗菌蛋白马铃薯早疫病田间防效小区排列图 |
(1)每处理随机选择 6 株植株进行药前病情指数调查, 分级标准参照农药田间药效试验准则 GB/T 17980.28-2000 ;(2)于 2019 年 7月 18 日首次喷药, 随后每隔 5 d 用药 1 次, 连续用药 3 次, 并于最后一次用药后 10 d 统计药后病情指数, 统计方法同药前 ;(3)病情指数和田间防效计算方法与赵新贝等[30] 所述方法相同.
2 结果 2.1 拮抗细菌ML-3抗菌蛋白最佳硫酸铵盐析浓度使用不同饱和度硫酸铵对菌株 ML-3 发酵液中的蛋白进行分级沉淀, 并以马铃薯早疫病菌为靶标对各级沉淀蛋白的抑菌活性进行测定后发现, 各级沉淀蛋白仅在硫酸铵质量浓度为 60%-80% 表现出较强抑菌活性, 该级沉淀蛋白的抑菌带直径为 14.5mm, 同对照粗提液抑菌活性(抑菌带为 15.5 mm)相比差异较小(图 2);当硫酸铵质量低于 60% 或高于 80% 所形成的蛋白沉淀均无抑菌活性 ;另外, 对硫酸铵沉淀残留液抑菌活性进行检测后发现, 其残留液无抑菌活性, 再次说明菌株 ML-3 抗菌物质为蛋白类物质, 且说明在硫酸铵饱和度为 60%-80%可使菌株 ML-3 产生的抗菌蛋白完全沉淀, 为该菌株抗菌蛋白提取的最佳硫酸铵饱和度(图 2).

|
| 图 2 不同硫酸铵质量浓度下沉淀蛋白对马铃薯早疫病菌抑菌活性测定 |
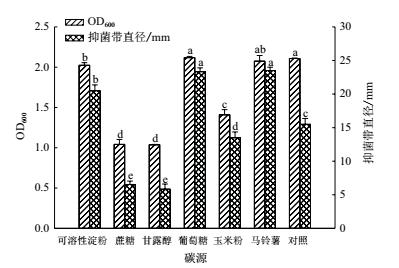
菌株 ML-3 产抗菌蛋白发酵液配方中的碳源进行单因素优化后发现, 在抑菌效果方面, 6 种碳源中以马铃薯和葡萄糖效果较好, 显著高于对照, 且同对照 NB 发酵液相比, 抑菌带直径分别增加了 8.8 mm 和 7.8 mm ;可溶性淀粉提高效果不明显, 同对照相比差异不显著 ;添加蔗糖、玉米粉和甘露醇后抑菌活性反而出现一定程度下降(图 3).在菌株生长方面, 6 种碳源同样表现出不同效果, 添加葡萄糖和马铃薯对菌株生长量无明显影响, 同对照相比差异不显著, 但添加其他碳源后菌株 ML-3的生长则出现不同程度抑制.说明不同碳源对菌株ML-3 抗菌蛋白生物合成存在不同程度影响.综合考虑成本、菌株生长量和抗菌蛋白抑菌活性后, 选择低成本马铃薯作为菌株 ML-3 产抗菌蛋白较优碳源.
|
| 图 3 不同碳源对菌株 ML-3 生长和抗菌物质产生的影响 |
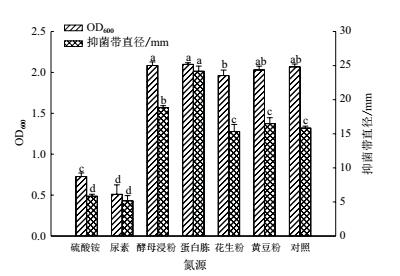
对 NB 发酵液中的氮源(牛肉浸膏 + 蛋白胨)使用其他氮源替换后发现 :在碳源马铃薯介导下, 单独添加氮源蛋白胨便可有效促进菌株 ML-3 抗菌蛋白产生, 其抗菌蛋白抑菌带直径(24.2mm)显著高于对照(15.8 mm);使用其他无机或有机氮源替换 NB 中的氮源后抗菌蛋白抑菌活性则出现不同程度下降, 其中以无机氮活性下降作为明显(图 4).在菌株生长量方面, 单独添加有机氮源(蛋白胨、花生粉、黄豆粉和酵母浸粉)时对菌株 ML-3生长无明显影响, 但单独无机添加氮源(尿素和硫酸铵)时则对菌株 ML-3 生长表现出明显抑制, 其OD600 吸光值分别为 0.509(尿素)和 0.727(硫酸铵)(图 3).因此, 在马铃薯介导下选择蛋白胨作为其较优氮源, 同对照配方相比可提高菌株 ML-3 抗菌蛋白抑菌活性, 而且可有效降低发酵成本
|
| 图 4 不同氮源对菌株 ML-3 生长和抗菌物质产生的影响 |
机盐优化结果(图 5)表明 :虽 然 同 对 照 相 比 无 机 盐 0.5%NaCl、0.1%KH2PO、0.02% ZnSO4·7H2O 和 0.02% FeSO4·7H2O 对 菌 株ML-3 生长无明显影响, 但在抑菌活性方面, 则仅以0.5%NaCl 为无机盐时菌株 ML-3 抗菌蛋白抑菌活性明显高于其他无机盐 ;菌株 ML-3 抑菌活性对 K+、Fe2+和 Zn2+ 稳定, 而 Cu2+ 和 Mg2+ 则对菌株抑菌活性具有明显抑制作用.因此选择 0.5%NaCl 为较优无机盐.
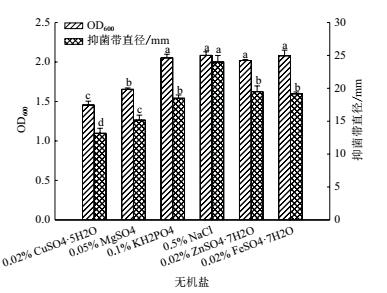
|
| 图 5 不同无机盐对菌株 ML-3 生长和抗菌物质产生的影响 |
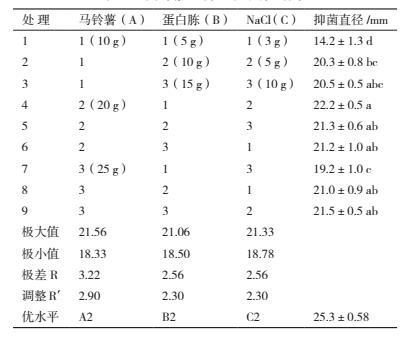
通过单因素试验明确马铃薯、蛋白胨和 NaCl 为菌株 ML-3 的最佳碳源、氮源和无机盐后, 进一步使用正交试验对其进行了三因素三水平正交试验, 正交试验结果(表 3)显示 :组合A2B1C2、A2B2C3、A1B3C3、A2B3C1、A3B2C1 以及 A3B3C2 之间抑菌活性差异不显著, 说明单纯依靠各处理结果很难直接判断出哪个组合为最优组合, 需进一步通过极差、方差以及因素间互作分析.
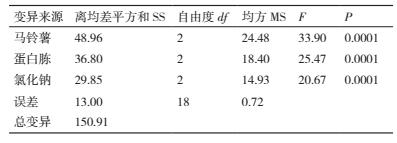
方差、极差和因素间互作分析结果(表 4)显示 :马铃薯、蛋白胨和氯化钠的 F 值均达极显著水平, 可见该假设检验灵敏度高;从极差比较可以看出, 碳源极差 R 值最大, 是影响菌株 ML-3 抗菌蛋白产量的关键因子, 其次为蛋白胨和 NaCl(表 3).从因素各水平间差异显著性分析结果可以看出, 菌株 ML-3产抗菌蛋白的较优配方组合为 A2B2C2(表 5), 且对该水平进行试验验证后发现在该配方下菌株 ML-3抑菌带直径可达 25.3 mm, 明显高于对照, 说明该配方为菌株 ML-3 产抗菌蛋白较优培养液制备配方.
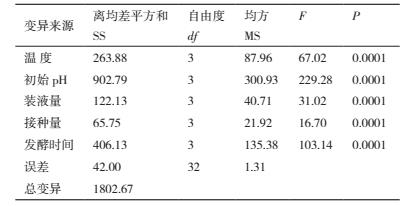
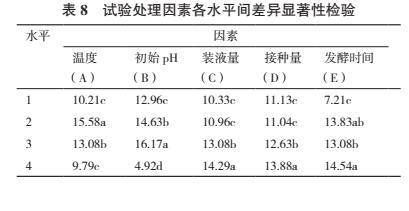
对菌株 ML-3 发酵条件进行正交试验后发现 16个组合处理中以组合 A2B3C4D1E2 效果最好, 其抑菌带直径为 22.3 mm 明显高于其他处理(表 6).对试验结果进行方差、极差和因素间互作分析后发现5 各因素的 F 值均表现出差异极显著, 说明该假设检验灵敏度高(表 7);从极差比较可以看出, 初始pH 和温度极差 R 最大, 说明初始 pH 和温度是影响菌株 ML-3 抗菌蛋白产量的关键因子, 其次为发酵时间、装液量和接种量(表 6).从因素各水平间差异显著性分析结果可以看出, 菌株 ML-3 产抗菌蛋白的较优配方组合为 A2B3C4D4E2(表 8), 且对该水平进行试验验证后发现在该发酵条件下菌株 ML-3抑菌带直径可达 24.2 mm, 明显高于对照, 说明该条件为菌株 ML-3 产抗菌蛋白较优发酵条件.
对对菌株 ML-3 抗菌蛋白的热、酸碱和紫外稳定性进行分析后发现 :菌株 ML-3 抗菌蛋白在 25℃ -60℃之间具有良好热稳定性, 可使抑菌带直径保持在 20 mm 以上(图 6-A);在 pH 范围 5-8 之间具有较好抑菌效果(图 6-B);在紫外照射 8 h 内抗菌蛋白抑菌活性下降不明显, 紫外照射 36 h 抑菌带直径仍可达 19.2 mm(图 6-C), 说明菌株 ML-3 产生的抗菌蛋白具有较好的热稳定性、酸碱稳定性和紫外稳定性, 有制成制剂应用于马铃薯早疫病生物防治的潜力.
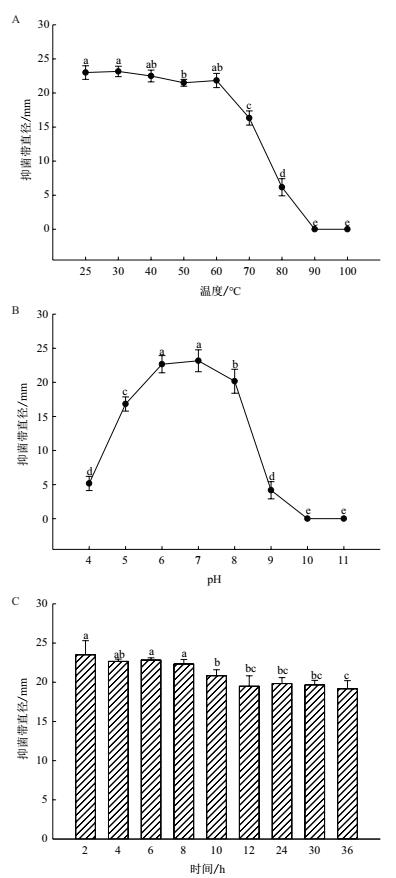
|
| 图 6 不同温度、pH 值和紫外照射时间对菌株 ML-3 抗菌蛋白抑菌特性的影响 |
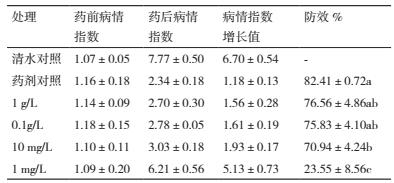
对菌株 ML-3 抗菌蛋白马铃薯早疫病田间防效进行测定后发现:该菌株抗菌蛋白浓度为 1 g/L 和 0.1g/L 时对马铃薯早疫病仍可保持较好防效, 防效分别为 76.56% 和 75.83%, 同对照药剂相比防治效果差异显著(表 9);当抗菌蛋白浓度为 10 mg/L 时田间防效出现一定程度下降, 明显低于对照药剂, 但仍可保持在 70% 左右 ;当抗菌蛋白浓度为 1 mg/L 时, 防效下降幅度明显, 仅有 23.55%.说明该菌株抗菌蛋白在马铃薯早疫病生物防治方面具有较好应用潜力, 且药液抗菌蛋白有效成分含量不低于 10 mg/L.
菌 株 ML-3 16S rDNA 序 列 经 27F/1492R 引 物扩增和测序后获得该基因序列, 长度为 1 415 bp, NCBI 数据库序列登录号 MN539138.
基于菌株 ML-3 16S rDNA 序列使用 Ezbiloud 在线软件同数据库中的模式菌株 16S rDNA 序列进行比 对 后 发 现 菌 株 ML-3 同 Bacillus tequilensis KCTC13622T、 Bacillus subtilis subsp. inaquosorum KCTC13429T 和 Bacillus subtilis subsp. subtilis NCIB 3610T 具有较高序列同源性, 相似比分别为 99.79%、99.79%和 99.72% ;使用 MEGA 5.0 基于菌株 ML-3 16S rDNA和序列相似比大于 96% 的近缘模式菌株 16S rDNA序列构建 NJ 系统发育树后发现菌株 ML-3 同模式菌株 Bacillus subtilis subsp. inaquosorum KCTC 13429T 聚在同一支(图 7), 说明菌株 ML-3 同该模式菌具有较高同源性, 因此通过 16S rDNA 序列分析可将菌株ML-3 鉴定为 Bacillus subtilis subsp. inaquosorum.
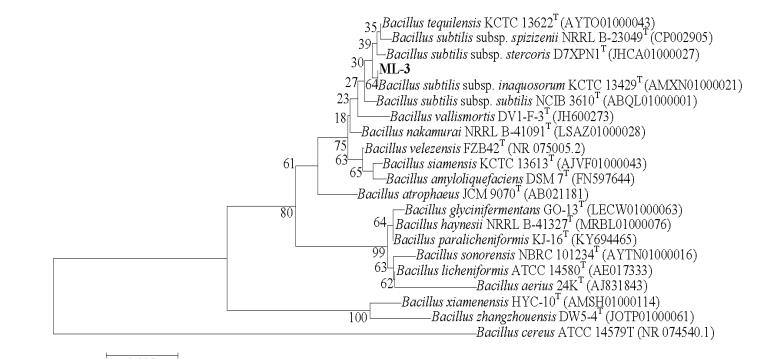
|
| 图 7 基于菌株 ML-3 16S rDNA 序列分析的 NJ 系统发育树 |
抗病微生物及其天然产物作为植物病害生物防治药剂的一类重要开发源, 对植物病害生物防治和我国化学农药减量使用具有重要意义, 因此近年来成为植物病害防治的一个研究热点, 且研究者已从多种来源分离和筛选出来了对植物病害具有拮抗作用的微生物[31].然而, 这些活性菌株筛选多数是以室内平板测定来完成, 只有少量菌株经过田间试验验证, 且目前有研究发现部分菌株虽然在室内具有良好活性, 但其田间活性出现一定程度下降或丧失, 而田间具有良好活性又是抗病微生物制剂化加工和走向市场的关键因素[32].另外, 虽然目前我国有关马铃薯早疫病拮抗微生物筛选也已有相关报道, 但报道数量极少, 仅有杨继业等[14] 和杨登路等[15] 做了相关报道, 且相关研究都仅测定了拮抗菌株的室内抑菌活性, 因此, 基于上述现状, 在筛选到马铃薯早疫病拮抗细菌菌株 ML-3, 并明确其抗菌物质为蛋白质后本研究从生产实际出发, 重点对该菌株的抗菌蛋白硫酸铵沉淀饱和度、发酵液配方、发酵条件、抗菌蛋白稳定性以及田间防效进行了研究, 旨在明确该菌株抗菌蛋白的制剂化加工和田间应用潜力, 为马铃薯早疫病生物防治药剂开发提供新开发源.
通过研究发现菌株 ML-3 抗菌蛋白的最佳硫酸铵沉淀饱和度为 80%, 且该菌株产生的抗菌蛋白在温度低于 60℃、pH 值 5-8 以及紫外照射 36 h 等条件下均可保持良好抑菌活性.另外研究还发现菌株ML-3 抑菌活性对 K+、Fe2+ 和 Zn2+ 稳定, 而 Cu2+ 和Mg2+ 则对菌株抑菌活性具有明显抑制作用.研究结果同枯草芽孢杆菌 Zl-2[33]、地衣芽孢杆菌 W10[34]、解淀粉芽孢杆菌 HRH317[35] 等菌株存在一定异同, 说明不同菌株可产生不同抗菌蛋白, 且不同抗菌蛋白的抑菌稳定性存在一定差异.
在明确菌株 ML-3 抗菌蛋白稳定性和最佳硫酸铵沉淀饱和度后, 本研究还采用单因素和正交试验对影响其产量的培养液配方和发酵条件进行了探究, 结果表明 :马铃薯作碳源可有效提高菌株 ML-3 抗菌蛋白产量, 使其抑菌带直径比对照增加了 8.8 mm ;在马铃薯介导下以蛋白胨作氮源时抑菌带直径可达24.2 mm, 明显高于对照和其它氮源 ;正交试验优化后培养液配方为 2% 马铃薯、1% 蛋白胨和 0.5%NaCl, 且在该配方下的较优发酵条件为初始 pH 值 7.0、发酵温度 30℃、500 mL 三角瓶装液量 400 mL、接种量 5 mL、发酵时间 48 h.该菌株产孢外抗菌蛋白培养液配方和发酵条件同枯草芽孢杆菌 SH7[36]、枯草芽孢杆菌 G8[37] 和枯草芽孢杆菌 B29[38] 存在一定差异, 造成这种差异的原因可能与菌株自身差异及来源不同关系密切, 说明同种不同来源菌株在抗菌物质产生方面也存在一定差异.
随后为进一步确定该菌株抗菌蛋白的田间应用潜力, 本研究以 80% 代森锌可湿性粉剂为对照药剂, 采用完全随机区组设计, 对不同稀释倍数后的菌株ML-3 抗菌蛋白田间防效进行了测定, 结果发现该菌株抗菌蛋白对马铃薯早疫病具有良好防效, 且用药浓度不低于 10 mg/L 时防效可达 70%.另外, 选择药前病情指数相近报道中的化学药剂马铃薯早疫病防效同菌株 ML-3 抗菌蛋白防效进行对比后, 发现该菌株抗菌蛋白田间防效同报道中的 25% 嘧菌酯悬浮剂[16]、42.4% 唑醚·氟酰胺悬浮剂[39] 和 50% 多菌灵可湿性粉剂[40] 等多种化学药剂防效相近, 说明该菌株抗菌蛋白在制剂化加工和田间应用方面具有良好潜力.
最后, 虽然本研究对菌株 ML-3 胞外抗菌蛋白的稳定性、发酵液配方、发酵条件、田间防效以及分类地位进行了探究, 为该菌株后期大规模发酵、制剂化加工以及田间应用奠定了基础, 但有关该菌株抗菌蛋白的种类鉴定、制剂加工、制剂剂型以及多点、多年田间药效试验还需进一步加强研究, 旨在为马铃薯早疫病生物防治提供新型绿色药剂.
4 结论生防细菌 ML-3 产抗菌蛋白的较优培养液组成成分为 2% 马铃薯、1% 蛋白胨和 0.5%NaCl ;较优发酵条件为初始 pH 值 7.0、温度 30℃、装液量 400mL/500 mL、接种量 5 mL 和发酵 48 h.菌株 ML-3抗菌蛋白不仅在温度≤ 60℃、pH 值 5-8 和紫外照射 36 h 内具有良好稳定性, 而且对 K+、Fe2+、Zn2+、Na+ 稳定性较好.该抗菌蛋白的马铃薯早疫病田间防治用药浓度为≥ 10 mg/L.
| [1] |
谷青, 赵冬梅, 张岱, 等. 北方一作区马铃薯早疫病病菌群体SSR 遗传结构分析[J]. 江苏农业科学, 2018, 46(19): 88-92. |
| [2] |
张福光, 杨志辉, 朱杰华, 等. 河北省马铃薯早疫病菌群体遗传结构的研究[J]. 菌物学报, 2012, 31(1): 40-49. |
| [3] |
周岱超, 赵振杰, 胡同乐, 等. 生长季马铃薯植株冠层空气中 Alternaria solani 分生孢子飞散动态及其影响因素[J]. 植物病理学报, 2014, 44(6): 687-692. |
| [4] |
李雅南, Sayed Rashad Ali Shah, 孙少慧, 等. 黑龙江省马铃薯叶斑类病害 Alternaria 属病原组成和分布[J]. 分子植物育种, 2017, 15(3): 1077-1083. |
| [5] |
Ding S, Rouse DI, Meinholz K, et al. Aerial concentrations of pathogens causing early blight and brown spot within susceptible potato fields[J]. Phytopathology, 2019, 109(8): 1425-1432. |
| [6] |
郭倩倩, 杨志辉, 崔亚婧, 等. 马铃薯早疫病菌的分子鉴定与田间早期诊断[J]. 植物保护学报, 2013, 40(4): 381-382. |
| [7] |
台莲梅, 左豫虎, 张亚玲, 等. 黑龙江省马铃薯早疫病菌遗传多样性分析[J]. 作物杂志, 2017(3): 151-156. |
| [8] |
Leiminger J, Bäβler E, Knappe C, et al. Quantification of disease progression of Alternaria spp[J]. European Journal of Plant Pathology, 2015, 141(2): 295-309. |
| [9] |
Gu Q, Yang ZH, Zhao DM, et al. Development of a semi-nested PCRbased method for specific and rapid detection of Alternaria solani causing potato early blight in soil[J]. Current Microbiology, 2017, 74(9): 1083-1088. |
| [10] |
郑寰宇. 马铃薯早疫病菌生物学特性及致病力分化的研究[J]. 大庆 :黑龙江八一农垦大学, 2010. |
| [11] |
姚亮亮. 黑龙江省链格孢属病原菌遗传多样性及杀菌剂抗药性分析[J]. 哈尔滨 :东北农业大学, 2011. |
| [12] |
Abuley IK, Nielsen BJ. Integrating cultivar resistance into the TOMCAST model to control early blight of potato, caused by Alternaria solani [J]. Crop Protection, 2019, 117: 69-76. |
| [13] |
Xue WY, Haynes KG, Qu XS. Characterization of early blight resistance in potato cultivars[J]. Plant Disease, 2019, 103(4): 629-637. |
| [14] |
杨 继业, 杨 帆, 崔 冠慧, et al. 马铃薯早疫病拮抗菌的筛选及其代谢产物的抑菌活性[J]. 中国蔬菜, 2018(5): 62-66. |
| [15] |
杨 登路, 雷 帮星, 康 冀川, et al. 马铃薯早疫病拮抗菌株筛选及其抗菌活性[J]. 山地农业生物学报, 2016, 35(1): 62-66. |
| [16] |
龚 启青, 朱 江, 牛 力立, et al. 七种杀菌剂对马铃薯早疫病的影响[J]. 耕作与栽培, 2018(4): 25-27. |
| [17] |
范 子耀, 孟 润杰, 马 志强, et al. 咯菌腈与苯醚甲环唑等三种药剂复配对马铃薯早疫病菌( Alternaria solani )的联合毒力[J]. 植物保护, 2012, 38(5): 184-188. |
| [18] |
范 子耀, 孟 润杰, 王 文桥, et al. 马铃薯早疫病菌化学防治及抗药性研究进展[J]. 河北农业科学, 2010, 14(8): 24-27. |
| [19] |
刘 亚苓, 于 营, 雷 慧霞, et al. 植物病害生防因子的作用机制及应用进展[J]. 中国植保导刊, 2019, 39(3): 23-28. |
| [20] |
Jabeen K, Noureen K, Naz S, et al. Fungistatic effects of melia azedarach L. against early blight of potat[J]. Pakistan Journal of Phytopathology, 2014, 26(2): 219-224. |
| [21] |
Novikova II, Litvinenko AI, Boikova IV, et al. Biological activity of new microbiological preparations alirins B and S designed for plant protection against diseases.I. Biological activity of alirins against diseases of vegetable crops and potato[J]. Mикология и фитопатология, 2003, 37(1): 92-98. |
| [22] |
Dalvi SG, Waghey P, Pawar BH, et al. In vitro study on the antifungal effects of chitosan and oligochitosan on early blight disease in potato[J]. Journal of Chitin and Chitosan Science, 2015, 3(1): 46-52. |
| [23] |
王聪. 向日葵花盘秸秆提取物对马铃薯早疫病干腐病防治特性研究[J]. 兰州 :兰州理工大学, 2016. |
| [24] |
高振峰. 梓树内生细菌 ZSYB-1 分离、鉴定及抗菌活性研究[J]. 太谷 :山西农业大学, 2015. |
| [25] |
Gao Z, Zhang B, Liu H, et al. Identification of endophytic Bacillus velezensis ZSY-1 strain and antifungal activity of its volatile compounds against Alternaria solani and Botrytis cinerea[J]. Biological Control, 2017, 105: 27-39. |
| [26] |
张晓宇, 高振峰, 张宝俊, 等. 生防菌成团泛菌 XM2 抗菌蛋白抗真菌特性研究[J]. 河南农业大学学报, 2017, 51(5): 693-698. |
| [27] |
赵胜民, 郑来久, 杜冰. 琼脂扩散法测定罗布麻韧皮中酮类物质的抑菌活性[J]. 科技导报, 2009, 27(7): 37-40. |
| [28] |
周长铨, 杨才祥. 关于菌数测定的一些方法和问题[J]. 生物制品参考资料, 1974(2): 37-48. |
| [29] |
采俊香, 李月梅. 抱茎苦荬菜内生甲基营养型芽孢杆菌 G-5 抗菌蛋白抗真菌特性研究[J]. 中国植保导刊, 2017, 37(4): 20-26. |
| [30] |
赵新贝, 王娟, 上官妮妮, 等. 番茄灰霉病生防细菌 TD-7 的鉴定、发酵条件优化及其防治效果[J]. 中国生物防治学报, 2019, 35(2): 226-239. |
| [31] |
Khan N, Martínez-Hidalgo P, Ice TA, et al. Antifungal activity of Bacillus species against Fusarium and analysis of the potential mechanisms used in biocontrol[J]. Frontiers in Microbiology, 2018, 9: 2363. |
| [32] |
Stumbriene K, Gudiukaite R, Semaskiene R, et al. Screening of new bacterial isolates with antifungal activity and application of selected Bacillus sp. cultures for biocontrol of Fusarium graminearum under field conditions[J]. Crop Protection, 2018, 113: 22-28. |
| [33] |
郑小亮, 董超, 牛瑞艳, 等. 枯草芽孢杆菌 Zl-2 抗菌蛋白特性及对小麦赤霉病菌的抑制作用[J]. 黑龙江大学自然科学学报, 2018, 35(2): 206-211. |
| [34] |
纪兆林, 宋浩, 徐敬友, 等. 地衣芽孢杆菌 W10 发酵产生抗菌蛋白的研究[J]. 中国生物防治学报, 2013, 29(4): 579-585. |
| [35] |
秦楠, 缪文玉, 李鑫, 等. 解淀粉芽孢杆菌 HRH317 抗菌蛋白发酵条件优化及其稳定性研究[J]. 食品工业科技, 2017, 38(13): 130-135. |
| [36] |
张秀玉, 孔凡玉, 王静, 等. 枯草芽孢杆菌 SH7 抑菌蛋白产生的最佳发酵条件及温室防效[J]. 中国烟草科学, 2010, 31(2): 45-48. |
| [37] |
石怀兴, 尚玉珂, 季静, 等. 培养条件对枯草芽孢杆菌 G8 抗菌蛋白含量的影响及蛋白液对黄瓜菌核病的生防效果[J]. 农药学学报, 2009, 11(2): 244-249. |
| [38] |
赵丽华 . 枯草芽孢杆菌拮抗菌株 B29 活性物质形成条件研究及其抗菌蛋白的分离纯化[D]. 哈尔滨 :黑龙江大学 , 2007.
|
| [39] |
张丽荣, 郭成瑾, 沈瑞清, 等. 42. 4% 唑醚·氟酰胺 SC 对马铃薯早疫病的田间防效评价[J]. 农药, 2016, 55(12): 934-936. |
| [40] |
肖春芳, 田恒林, 沈艳芬, 等. 嘧菌酯对马铃薯早疫病菌 Alternaria solani 的毒力及防效[J]. 湖南农业科学, 2015(8): 46-48. |