2. 许昌市林业科学研究所, 许昌 461000
2. Xuchang Forestry Research Institute, Xuchang 461000
干旱胁迫是限制植物正常生长发育, 造成作物产量和品质降低的重要环境因素之一[1].伴随着全球气候变化, 未来世界范围内干旱发生的频次和强度均会增加, 干旱及半干旱地区作物生长受到的威胁日趋严重[2].因此, 如何应对水资源短缺造成的植物生长受限, 逐渐成为植物研究领域热点.研究表明, 干旱胁迫导致植物根系细胞对水分的吸收受阻, 影响植物细胞内生理和生化反应正常进行, 造成植物生长矮小、干物质积累量降低等后果[3].此外, 干旱胁迫下植物叶片光合色素发生降解、气孔关闭、光化学活性受到抑制等, 致使叶片光合作用进程受到影响[4].干旱胁迫下植物细胞内活性氧(Reactiveoxygen species, ROS)等高反应活性的自由基过度积累, 通过氧化蛋白质、脂质等途径破坏细胞膜稳定性, 同时植物依赖一套以超氧化物歧化酶(Superoxidedismutase, SOD)、过氧化氢酶(Catalase, CAT)、抗坏血酸过氧化物酶(Ascorbate peroxidase, APX)等酶为代表的抗氧化酶系统协调缓解其过氧化伤害[5-6].干旱胁迫下, 植物自身还可以通过改变其新陈代谢过程, 提高并积累脯氨酸、可溶性蛋白等渗透调节物质以促进植物细胞对水分的摄取能力, 从而应对干旱胁迫影响[7].
研究表明, 外源物质尤其是植物生长调节剂的应用是提高作物抗旱性的有效途径[8].褪黑激素(Melatonine, MT), 又名N-乙酰基-5-甲氧基色胺, 是一种重要的外源性植物生长调节剂, 在植物种子生根发芽、促进营养和生殖生长等关键生长发育过程中发挥重要作用[9-10].众多研究表明, 褪黑素能够提高植物对盐碱、干旱、重金属、高温、紫外线辐射等多种胁迫的抵抗能力[11-14].研究发现, MT可作为一种抗氧化剂, 增强逆境胁迫下植物抗氧化防御系统并降低脂质过氧化和过氧化氢(Hydrogenperoxide, H2O2)水平, 从而提高植物的抗逆性[15].Dong等[16]研究发现, 外源褪黑素处理能够有效延缓干旱胁迫造成的奇异果叶片衰老.史中飞等[17]研究了外源褪黑素对油菜幼苗抗寒性的影响, 结果表明, 施用外源褪黑素能显著增强抗氧化酶系统活性、降低脂质过氧化水平从而增强油菜幼苗对低温的适应性.也有研究指出, 相对于未经外源褪黑素处理的植物而言, 经外源褪黑素处理后植物糖代谢和光合作用速率得到大幅提高, 从而有效提高了逆境胁迫下植物生长速率[18].此外, 在对辣椒[19]、向日葵[20]、小麦[21]、烟草[22]等方面的研究也表明外源褪黑素能有效缓解干旱胁迫对植物生长的抑制作用.
牡丹(Paeonia suffruticosa Andr.)属芍药科芍药属牡丹组, 是我国的传统名花, 素有“花王”之称[23].牡丹因其花大色艳, 在园林绿化、观赏花卉等领域有重要价值.在国内, 牡丹种植主要分布在干旱及半干旱地区, 而相对缺水的环境致使牡丹生长发育受到限制, 其观赏价值也大打折扣[24].褪黑素在提高植物抗旱性方面发挥着重要作用, 但关于褪黑素在牡丹上应用的研究鲜有报道, 褪黑素能否提高牡丹抗旱性及作用机制尚不清楚, 关于褪黑素施用浓度的具体效应亦不明确.
本研究以牡丹品种凤丹(Paeonia ostii Fengdan)幼苗为试材, 采用营养液水培法研究外源褪黑素对干旱胁迫下牡丹幼苗生长及生理特性的影响, 探讨褪黑素提高牡丹幼苗耐旱性的机制, 以期为牡丹栽培种植及推广应用提供参考.
1 材料与方法 1.1 材料试验用牡丹品种为凤丹(P. ostii Fengdan)一年生幼苗, 种子由洛阳国际牡丹园提供.褪黑素购自购自Sigma公司, 以PEG-6000(购自国药集团化学试剂有限公司)模拟干旱胁迫环境
1.2 方法 1.2.1 试验设计试验于2018年8月在许昌职业技术学院内进行.挑选优质饱满种子, 采用直接沙藏促牡丹种子生根发芽.后移植于营养钵中培育, 栽培基质为泥炭:蛭石:河砂=3:1:1(v:v:v).幼苗于温室常规栽培管理至复叶第三叶成熟, 移栽至人工气候培养箱(RXZ-380B, 宁波江南)用全Hoagland营养液水培培养, 培养条件设置为昼(14h/25℃)、夜(10 h/20℃), 光照强度3 000 lx, 60%相对湿度.还苗5 d后选取长势一致的健康植株开始试验处理.
在预试验的基础上, 采用随机试验设计, 以混合0.1 kg/L的PEG-6000的全Hoagland营养液模拟干旱胁迫, 共设置5个处理:(1)CK :0 kg/L PEG+0μmol/L MT; (2)D :0.1 kg/L PEG+0 μmol/L MT; (3)MT1 :0.1 kg/L PEG+50 μmol/L MT; (4)MT2 :0.1 kg/L PEG+100 μmol/L MT; (5)MT3 :0.1 kg/LPEG+200 μmol/L MT.每个处理重复5次, 每个重复10株.还苗5 d结束后开始喷施不同浓度外源MT, 对照以蒸馏水代替, 连续预处理3 d.随后将幼苗置于不同干旱胁迫处理营养液中, 干旱处理5 d后进行各项指标测定.
1.2.2 测定指标和方法 1.2.2.1 生长指标幼苗用蒸馏水冲洗干净后, 将茎叶和根系分开, 置于105℃蒸30 min, 后在80℃洁净烘箱烘干至恒重, 使用精密天平称量其干物质量.
1.2.2.2 叶片光合色素含量照王学奎等[25]方法, 采用95%乙醇提取测定叶片叶绿素a、叶绿素b和类胡萝卜素含量.使用分光光度计在波长665、649和470 nm下测定吸光度.
1.2.2.3 叶片光合及荧光参数使用便携式光合测定系统(LI-6400XT, 美国LI-COR)测定叶片净光合速率(Photosynthetic, Pn)、气孔导度(Stomatalconductance, Gs)、蒸腾速率(Transpiration rate, Tr)和胞间CO2浓度(Intercellular CO2 concentration, Ci)等光合作用参数, 测定光照强度为1 200 μmol/m2·s, CO2浓度为390 μmol/mol.使用便携式荧光测定仪(PAM-2100, 德国Walz)测定叶绿素荧光参数, 包括暗适应叶片PS Ⅱ最大光化学效率(Fv/Fm)、PS Ⅱ实际光能转换效率(Fv'/Fm')、PS Ⅱ潜在活性(Fv/Fo)、实际PS Ⅱ光化学效率(ΦPS Ⅱ)、叶绿素荧光光化学猝灭系数(qP)及非光化学猝灭系数(qN).
1.2.2.4 叶片生理指标参照李合生等[26]方法, 采用硫代巴比妥酸法(Thiobarbituric acid, TBA)测定丙二醛(Malondialdehyde, MDA)含量; 参照林植芳等[27]方法, 测定叶片H2O2含量; 参照杨璐等[28]方法, 采用羟胺氧化法测定叶片O2-含量; 参照Nayyar等[29]方法, 测定叶片膜质伤害指数(Membrane injure index, MII), 计算公式为MII(%)=(EC1/EC2)×100, 其中EC1为25℃2500, EC2为100℃1000.
参照王学奎等[25]方法, 采用氮蓝四唑还原法测定SOD活性; 采用紫外吸收法测定CAT活性; APX及谷胱甘肽还原酶(Glutathione reductase, GR)活性测定参照Constán-Aguilar等[30]方法测定; 参照李合生等[26]方法, 可溶性蛋白的含量采用考马斯亮蓝G-250染色法进行测定; 可溶性总糖的含量采用蒽酮比色法进行测定; 脯氨酸的含量采用酸性茚三酮法进行测定.
1.2.3 数据处理和分析采用Excel 2010和SPSS21.0软件进行数据统计分析, 采用Origin 9.0进行分析绘图, 每处理重复5次, 对平均数用Duncan新复极差法进行多重比较.
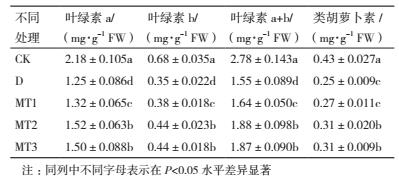
2 结果 2.1 外源MT对干旱胁迫下牡丹幼苗植株生长的影响如图 1所示, 与对照相比, 干旱胁迫处理条件下, 牡丹幼苗茎叶、根系和总干重均显著降低, 降幅分别达42.19%、28.50%和41.01%, 说明干旱胁迫限制了牡丹幼苗的生长.不同浓度外源MT处理后牡丹幼苗植株干物质量较干旱胁迫处理均有明显改善, 其中100 μmol/L MT处理下牡丹幼苗植株干物质量增幅最大, 茎叶、根系和总干重相对于干旱胁迫处理分别显著提高了67.59%、40.00%和64.75%, 与对照相比, 干物质量指标虽有一定降低, 但差异并不显著.50和200 μmol/L MT处理下牡丹幼苗植株干物质量较干旱胁迫处理虽有显著提高, 但根系和总干重两指标均显著低于100 μmol/L MT处理.可见, 外源MT处理能有效缓解干旱胁迫对牡丹幼苗生长的抑制, 但外源MT的缓解作用存在浓度差异, 以100 μmol/L MT处理效果最好.
|
| 图中不同字母表示在P < 0.05水平差异显著。下同 图 1 外源MT对干旱胁迫下牡丹幼苗植株生长的影响 |
如表 1所示, 干旱胁迫下牡丹幼苗叶片叶绿素a、叶绿素b、叶绿素a+b及类胡萝卜素等光合色素含量较对照处理均有不同程度降低, 各指标降幅分别达42.68%、48.48%、44.39%和40.91%, 且两处理间不同指标差异均显著.经不同浓度外源MT处理, 除类胡萝卜素含量指标外, 牡丹幼苗叶片光合色素含量较干旱胁迫处理均有显著提高, 其中叶绿素a、叶绿素b、叶绿素a+b及类胡萝卜素等指标增长范围分别在5.56%-21.11%、8.82%-23.53%、6.45%-21.77%和7.69%-23.08%.不同浓度外源MT处理之间, 以100 μmol/L MT处理下牡丹幼苗光合色素含量较干旱胁迫处理增幅最大, 但仍显著低于对照处理.100和200 μmol/L MT处理下牡丹幼苗光合色素含量均显著高于50 μmol/L MT处理, 而且200 μmol/L MT处理下各光合色素含量指标虽略低于100 μmol/L MT处理, 但两处理间差异并不显著.综上所述, 干旱胁迫导致牡丹幼苗叶片光合色素含量降低, 而不同浓度外源MT处理有效提高了干旱胁迫下牡丹幼苗叶片光合色素含量, 且100和200 μmol/L MT处理对干旱胁迫下牡丹幼苗叶片光合色素含量的提高作用较好.
如图 2所示, 与对照相比, 干旱胁迫下牡丹幼苗叶片净光合速率(Pn)、蒸腾速率(Tr)及气孔导度(Gs)分别显著降低了58.08%、66.67%和75.01%, 而胞间CO2浓度(Ci)则显著提高了17.03%, 说明干旱胁迫造成牡丹幼苗叶片光合作用过程受到抑制.经不同浓度外源MT处理, 不同程度改善了干旱胁迫下牡丹幼苗叶片光合参数指标, 具体表现为有效提高了净光合速率(Pn)、蒸腾速率(Tr)及气孔导度(Gs)参数, 而相对降低了干旱胁迫下牡丹幼苗叶片胞间CO2浓度(Ci).其中, 100 μmol/L MT处理下牡丹幼苗叶片净光合速率(Pn)、蒸腾速率(Tr)及气孔导度(Gs)较干旱胁迫处理增幅最为明显, 分别达117.08%、135.87%和180.01%, 胞间CO2浓度(Ci)亦显著降低了15.50%.继续提高外源MT施用浓度, 对干旱胁迫下牡丹幼苗光合作用的改善能力有所降低, 表现为200 μmol/L MT处理下牡丹幼苗叶片净光合速率(Pn)、蒸腾速率(Tr)及气孔导度(Gs)虽显著高于干旱胁迫处理, 但此三项指标相对于100 μmol/LMT处理分别显著降低了5.08%、17.97%和14.29%, 而胞间CO2浓度(Ci)在两处理间差异并不显著.综合来看, 外源MT处理能够有效缓解干旱胁迫对牡丹幼苗叶片光合作用的抑制影响.在不同处理浓度上, 以100 μmol/L MT处理改善叶片光合作用效果最为显著, 增加浓度会降低其缓解效果.

|
| 图 2 外源MT对干旱胁迫下牡丹幼苗叶片光合参数的影响 |
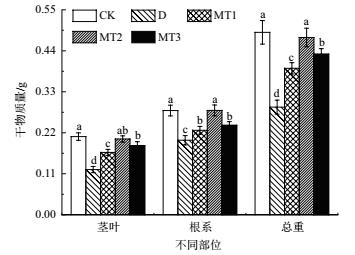
如图 3所示, 与对照相比, 干旱胁迫下牡丹幼苗暗适应叶片PS Ⅱ最大光化学效率(Fv/Fm)、PS Ⅱ实际光能转换效率(Fv'/Fm')、PS Ⅱ潜在活性(Fv/Fo)、实际PS Ⅱ光化学效率(ΦPS Ⅱ)及叶绿素荧光光化学猝灭系数(qP)均显著降低, 降幅分别达10.84%、28.38%、32.34%、63.33%和40.45%, 而非光化学猝灭系数(qN)则显著提高了24.07%, 说明干旱胁迫对牡丹幼苗PS Ⅱ功能产生影响, 其功能受到抑制.经不同浓度外源MT处理后牡丹幼苗叶片光抑制程度有不同程度降低, 具体表现为相对干旱胁迫处理暗适应叶片PS Ⅱ最大光化学效率(Fv/Fm)提高了4.05%-9.46%、PS Ⅱ实际光能转换效率(Fv'/Fm')提高了11.32%-30.19%、PS Ⅱ潜在活性(Fv/Fo)提高了13.27%-31.86%、实际PS Ⅱ光化学效率(ΦPS Ⅱ)提高了54.55%-140.91%、叶绿素荧光光化学猝灭系数(qP)提高了28.30%-64.15%, 而非光化学猝灭系数(qN)的降低了4.48%-13.43%, 且各处理间差异均显著.在不同浓度外源MT处理之间, 在缓解干旱胁迫对牡丹幼苗叶片光抑制效果上表现出100 μmol/L MT处理>200 μmol/L MT处理>50 μmol/L MT处理的整体趋势, 说明外源MT对干旱胁迫下牡丹幼苗叶片光抑制的缓解效应亦存在浓度差异, 以100 μmol/L MT处理表现最好.
|
| 图 3 外源MT对干旱胁迫下牡丹幼苗叶片荧光参数的影响 |
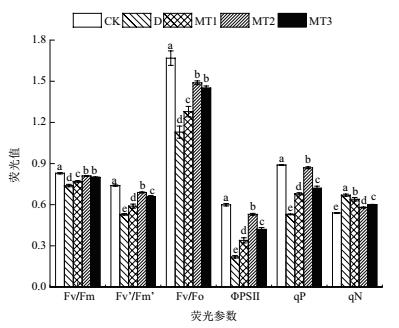
由图 4可知, 干旱胁迫下牡丹幼苗叶片MDA含量、O2-含量、H2O2含量及膜质伤害指数较对照处理分别显著提高了73.63%、63.64%、123.68%和168.75%, 说明干旱胁迫处理下牡丹幼苗叶片细胞膜质受到严重伤害.经不同浓度外源MT处理, 不同程度地缓解了干旱胁迫对牡丹幼苗叶片细胞膜质的影响, 其中MDA含量显著降低了17.88%-30.54%、O2-含量显著降低了7.94%-23.02%、H2O2含量显著降低了19.21%-38.41%、膜质伤害指数显著降低了15.73%-57.94%.不同浓度外源MT处理之间, 以100 μmol/L MT处理下牡丹幼苗叶片膜质各项指标最低, 尤其是H2O2含量和膜质伤害指数均显著低于50 μmol/L MT处理和200 μmol/L MT处理, 说明外源MT能有效控制干旱胁迫对牡丹幼苗叶片细胞膜质的破坏, 且100 μmol/L MT处理效果优于其他处理.
|
| 图 4 外源MT对干旱胁迫下牡丹幼苗叶片膜质的影响 |
由图 5可知, 与对照相比, 干旱胁迫及不同外源MT处理下牡丹幼苗叶片不同抗氧化酶活性有不同变化.干旱胁迫处理下牡丹幼苗叶片超氧化物歧化酶、抗坏血酸过氧化物酶及谷胱甘肽还原酶较对照处理有所升高, 其中抗坏血酸过氧化物酶及谷胱甘肽还原酶较对照处理分别显著提高了15.40%和123.39%, 而过氧化氢酶较对照处理则显著降低了82.88%.经不同浓度外源MT处理, 牡丹幼苗叶片超氧化物歧化酶及谷胱甘肽还原酶较干旱胁迫处理有不同程度降低, 其中以100 μmol/L MT处理降幅最大, 分别显著降低了74.93%和49.75%;而过氧化氢酶及抗坏血酸过氧化物酶则有所提高, 其中50 μmol/L MT处理较干旱胁迫处理分别显著提高了118.47%和16.17%、100 μmol/L MT处理较干旱胁迫处理分别显著提高了230.30%和86.76%、200 μmol/L MT处理较干旱胁迫处理分别显著提高了237.26%和42.12%.
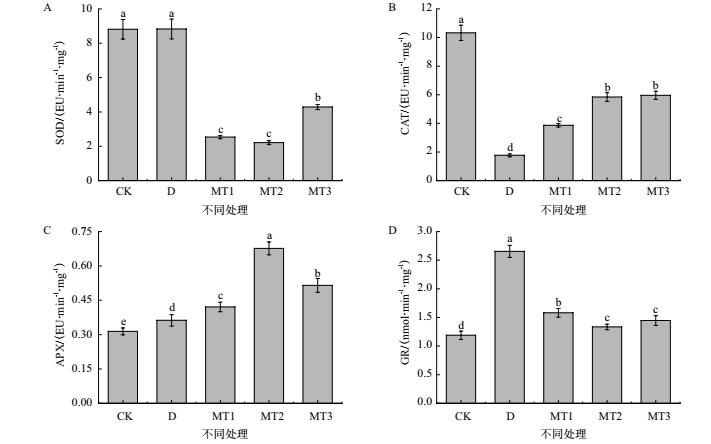
|
| 图 5 外源MT对干旱胁迫下牡丹幼苗叶片抗氧化酶的影响 |
综上所述, 牡丹幼苗叶片不同抗氧化酶对干旱胁迫的响应不尽相同, 同时外源MT处理能够介导调节牡丹幼苗叶片抗氧化酶活性, 以抵御干旱胁迫造成的过氧化伤害对叶片的伤害.
2.3.3 外源MT对干旱胁迫下牡丹幼苗叶片渗透调节的影响由图 6可知, 与对照相比, 干旱胁迫处理下牡丹幼苗叶片可溶性糖蛋白含量显著降低了24.54%, 而可溶性糖及脯氨酸含量分别显著提高了36.67%和30.82%, 说明干旱胁迫影响到牡丹幼苗叶片渗透调节系统平衡.与干旱胁迫处理相比, 不同浓度外源MT处理下牡丹幼苗叶片渗透调节物质含量均有所提高, 在可溶性蛋白和脯氨酸含量上表现为100 μmol/L MT处理>200 μmol/L MT处理>50 μmol/L MT处理的趋势, 且各处理间差异均显著.100 μmol/L MT处理下牡丹幼苗叶片可溶性蛋白和脯氨酸含量最高, 较干旱胁迫处理分别显著提高了48.78%和87.79%.而在可溶性糖含量方面, 呈现出随着外源MT处理浓度增加而增加的趋势, 其中200 μmol/L MT处理较干旱胁迫处理显著提高了134.15%.从以上分析可知, 外源MT处理能有效促进干旱胁迫下牡丹幼苗叶片渗透调节物质积累, 并以此应对干旱胁迫对叶片细胞造成的渗透胁迫伤害.
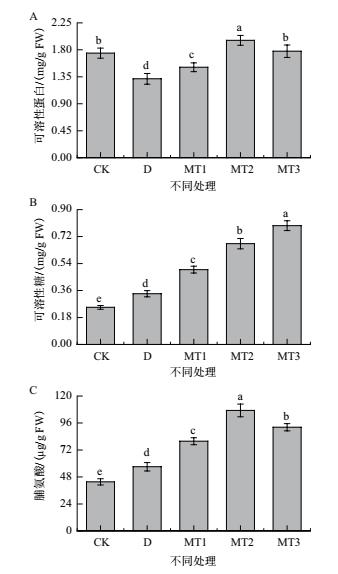
|
| 图 6 外源MT对干旱胁迫下牡丹幼苗叶片渗透调节的影响 |
干旱胁迫下植物体内各种生理生化反应产生异常, 致使细胞生长和增殖受到抑制, 最终影响植物生长和干物质量积累[31].本研究中, 干旱胁迫严重限制了牡丹幼苗根系和地上部干无质量的积累, 经外源褪黑素处理后牡丹幼苗干物质量有不同程度提高, 其中以100 μmol/L MT处理下增幅最大.本研究表明, 外源褪黑素处理能有效促进干旱胁迫下牡丹幼苗生长, 这与在大豆[13]、苹果[32]等作物上得到的结论一致.据报道, 褪黑素能够调节细胞壁延伸的物理过程以诱导植物根系生长, 在干旱环境中相对旺盛生长的根系吸水能力提高并促进了地上部茎叶的生长[33].同时, 经褪黑素预处理有效缓解了干旱胁迫引起的植物光合作用抑制现象, 促进植物生长以及提高其对干旱胁迫的适应性[34], 这在本试验中对牡丹幼苗光合及荧光特性的研究中也得到了验证.
植物叶片光合色素含量及光合荧光特性是表征植物光合作用进程的重要参数.在干旱胁迫条件下, 植物叶片叶绿素合成缓慢或者被快速分解, 从而导致叶绿素含量减少, 直接影响到植物的正常生长发育[35].研究表明, 应用外源褪黑素处理可能抑制干旱胁迫造成的叶绿素降解酶活性的增强, 或者促进参与叶绿素生物合成的δ氨基乙酰丙酸和原叶绿素酸酯还原酶复合体的合成, 从而提高了植物叶片叶绿素含量[36].值得注意的是, 本研究中外源褪黑素处理除显著提高了牡丹幼苗叶片叶绿素a及叶绿素b含量以外, 对提升叶片类胡萝卜素含量亦有显著作用.类胡萝卜素在光合作用中可作为抗氧化剂参与到光保护过程, 能够防止脂质过氧化以及稳定细胞膜结构[37].本研究中, 100和200 μmol/L MT处理下牡丹幼苗叶片类胡萝卜素含量显著提高, 对保护细胞膜稳定性和完整性有重要意义.
光合作用是植物进行有机物合成的主要途径, 本研究中干旱胁迫下牡丹幼苗叶片净光合速率(Pn)蒸腾速率(Tr)和气孔导度(Gs)降低, 而胞间CO2浓度(Ci)升高, 说明干旱胁迫导致牡丹幼苗叶片光合作用生理过程紊乱.外源褪黑素处理能有效改善牡丹幼苗叶片光合作用参数, 可能是因为经预处理后叶片光合色素含量增加, 同时植株根系旺盛生长的同时促进了地上部茎叶的生长, 光合作用性能得到改善[38].干旱胁迫下, 植物叶片光合保护机构受损, PS Ⅱ功能受到抑制其实际光能转换效率大大降低[4,7-8].本研究中, 经外源褪黑素处理干旱胁迫下牡丹幼苗暗适应叶片PS Ⅱ最大光化学效率(Fv/Fm)、PSⅡ实际光能转换效率(Fv'/Fm'),PS Ⅱ潜在活性(Fv/Fo),实际PS Ⅱ光化学效率(ΦPS Ⅱ)及叶绿素荧光光化学猝灭系数(qP)均显著提高, 而非光化学猝灭系数(qN)则显著降低, 说明褪黑素处理有助于维持较高的荧光电子传递效率及缓解PS Ⅱ反应中心被破坏程度, 这与前人的研究结果一致[39].有报道指出, 褪黑素可作为抗氧化剂介入植物对干旱胁迫引起的过氧化防御体系, 保护光合作用中的电子传递体免受伤害, 从而减少对光合电子传递速率的影响[40].
干旱胁迫下植物生成过量活性氧自由基, 损伤细胞质膜并破坏正常的生理生化代谢,同时植物通过抗氧化酶防御系统等机制应对过氧化胁迫[41].丙二醛是表征细胞膜脂质过氧化的重要指标,而细胞膜损害指数与干旱造成的胁迫效应呈正比, H2O2和O2-含量亦是常用来判断细胞过氧化程度的重要指标[42].本研究中, 干旱胁迫导致牡丹幼苗叶片MDA、H2O2、O2-含量及细胞膜损害指数大幅提高, 说明胁迫下ROS过量产生, 严重破坏了细胞膜的完整性和稳定性.经外源褪黑素处理, MDA、H2O2、O2-含量及细胞膜损害指数均有不同程度降低, 尤其是100 μmol/L MT处理中各项指标最低, 表明褪黑素可以作为抗氧化剂, 遏制干旱胁迫导致的过量自由基积累, 从而大大减少ROS等物质对细胞的毒性作用[43].本研究中, 外源MT处理能够介导调节牡丹幼苗叶片抗氧化酶活性, 以此参与提高牡丹幼苗的抗旱性.有研究表明, MDA含量的增加可能与CAT和APX酶活性降低有关, 导致OH·无法得到有效清除, 并导致H2O2和O2-过量产生[44].因此, 经外源褪黑素处理牡丹幼苗叶片H2O2和O2-含量降低可能与SOD、CAT和APX等抗氧化酶相互协调介导有很大关系, 这也在试验中得到了验证.
渗透调节是植物为了应对水分胁迫而进化的生理机制之一, 逆境条件下植物细胞积累脯氨酸、可溶性糖等渗透调节物质, 可以降低植物叶片细胞水势, 促进植物对水分的吸收以减轻胁迫伤害[41].本研究中, 经外源褪黑素处理, 特别是100 μmol/L MT处理中牡丹幼苗叶片脯氨酸及可溶性蛋白含量提高最多, 缓解了低渗透压对细胞的毒害作用.而在可溶性糖含量, 所有经外源褪黑素处理均高于对照和干旱胁迫处理, 尤其以200 μmol/L MT处理中可溶性糖含量最高.有研究指出, 可溶性糖可能通过氢键与蛋白质在质膜相互作用, 从而防止蛋白质发生变性作用[45].本研究中, 干旱胁迫下牡丹幼苗叶片可溶性蛋白水解加快导致其含量显著降低, 而经外源褪黑素处理后叶片可溶性蛋白含量显著提高, 说明褪黑素可能抑制干旱胁迫下牡丹幼苗叶片可溶性蛋白降解或者促进新的可溶性蛋白合成.此外, 本研究中经外源褪黑素处理叶片渗透调节物质含量提高表明, 经外源褪黑素处理的牡丹幼苗具有较高的渗透调节能力, 缓解干旱胁迫造成的伤害.
4 结论干旱胁迫严重抑制了牡丹幼苗的生长, 施用外源褪黑素能有效提高其在干旱胁迫中的适应性, 且以100 μmol/L褪黑素处理效果最好.干旱胁迫下, 经褪黑素预处理可以提高抗氧化酶活性以降低脂质过氧化对细胞膜的损伤, 抑制蛋白质降解或诱导其和脯氨酸等渗透调节物质的积累, 同时保持较高的光合色素含量及改善光合荧光特性, 最终表现为促进干旱胁迫下牡丹幼苗生长.
| [1] |
Chaves MM, João PM, João SP. Understanding plant responses to drought-from genes to the whole plant[J]. Functional Plant Biology, 2003, 30(3): 239-264. |
| [2] |
Swann ALS. Plants and drought in a changing climate[J]. Current Climate Change Reports, 2018(4): 192-201. |
| [3] |
张腾国, 李巧丽, 刁志宏, 等. 盐及干旱胁迫对油菜抗氧化系统和基因表达的影响[J]. 应用生态学报, 2019, 30(3): 969-978. |
| [4] |
裴斌, 张光灿, 张淑勇, 等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报, 2013, 33(5): 1386-1396. |
| [5] |
Zhang SH, Xu XF, Sun YM, et al. Influence of drought hardening on the resistance physiology of potato seedlings under drought stress[J]. Journal of Integrative Agriculture, 2018, 17(2): 336-347. |
| [6] |
Mashilo J, Odindo AO, Shimelis HA, et al. Photosynthetic response of bottle gourd [ Lagenaria siceraria, (Molina) Standl] to drought stress :Relationship between cucurbitacins accumulation and drought tolerance[J]. Scientia Horticulturae, 2018, 231: 133-143. |
| [7] |
王颖, 孔德浩, 陈佰鸿, 等. 外源ALA对干旱胁迫下山定子叶片叶绿素荧光特性及抗性生理指标的影响[J]. 西北植物学报, 2018, 38(5): 902-911. |
| [8] |
王书宏, 杜永吉. 外源激素对干旱胁迫下草莓光合特性的影响[J]. 中国农学通报, 2008(12): 377-381. |
| [9] |
叶君, 邓西平, 王仕稳, 等. 干旱胁迫下褪黑素对小麦幼苗生长、光合和抗氧化特性的影响[J]. 麦类作物学报, 2015(9): 97-105. |
| [10] |
杨小龙, 须晖, 李天来, 等. 外源褪黑素对干旱胁迫下番茄叶片光合作用的影响[J]. 中国农业科学, 2017, 50(16): 3186-3195. |
| [11] |
Zhang HM, Zhang Y. Melatonin :a well-documented antioxidant with conditional pro-oxidant actions[J]. Journal of Pineal Research, 2014, 57(2): 131-146. |
| [12] |
Janas KM, Malgorzata MP. Melatonin, an underestimated natural substance with great potential for agricultural application[J]. Acta Physiologiae Plantarum, 2013, 35(12): 3285-3292. |
| [13] |
邹京南, 曹亮, 王梦雪, 等. 外源褪黑素对干旱胁迫下大豆结荚期光合及生理的影响[J]. 生态学杂志, 2019, 38(9): 2709-2718. |
| [14] |
Reiter R, Tan DX, Zhou Z, et al. Phytomelatonin :Assisting plants to survive and thrive[J]. Molecules, 2015, 20(4): 7396-7437. |
| [15] |
Khana MN, Zhang J, Luo T. Seed priming with melatonin coping drought stress in rapeseed by regulating reactive oxygen species detoxification :Antioxidant defense system, osmotic adjustment, stomatal traits and chloroplast ultrastructure perseveration[J]. Industrial Crops & Products, 2019(140): 1-11. |
| [16] |
Dong L, Yanqiu S, Zhiyou N, et al. Exogenous melatonin application delays senescence of kiwifruit leaves by regulating the antioxidant capacity and biosynthesis of flavonoids[J]. Frontiers in Plant Science, 2018(9): 426-440. |
| [17] |
史中飞, 梁娟红, 张小花, 等. 外源褪黑素对低温胁迫下油菜幼苗抗寒性的影响[J]. 干旱地区农业研究, 2019, 37(4): 163-170. |
| [18] |
Wang LY, Liu JL, Wang WX, et al. Exogenous melatonin improves growth and photosynthetic capacity of cucumber under salinityinduced stress[J]. Photosynthetica, 2016, 54(1): 19-27. |
| [19] |
Armagan K, Zeynep BD. Melatonin improves the multiple stress tolerance in pepper(Capsicum annuum)[J]. Scientia Horticulturae, 2019(256): 1-9. |
| [20] |
杨新元. 外源褪黑素对干旱胁迫下向日葵幼苗生长、光合及抗氧化系统的影响[J]. 华北农学报, 2019, 34(4): 113-121. |
| [21] |
Cui GB, Zhao XX, Liu SD. Beneficial effects of melatonin in overcoming drought stress in wheat seedlings[J]. Plant Physiology and Biochemistry, 2017(118): 138-149. |
| [22] |
刘领, 李冬, 马宜林, 等. 外源褪黑素对干旱胁迫下烤烟幼苗生长的缓解效应与生理机制研究[J]. 草业学报, 2019(8): 95-105. |
| [23] |
贾清华, 刘爱青, 刘燕. 不同栽培方式下芍药生长开花及生物量变化[J]. 西南农业学报, 2013(2): 354-358. |
| [24] |
王琪, 刘建鑫, 张建军, 等. 水分胁迫对芍药生长和生理生化特性影响的研究[J]. 植物遗传资源学报, 2014(6): 1270-1277. |
| [25] |
王学奎, 黄建良. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2015.
|
| [26] |
李合生, 孙群, 赵世杰. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
|
| [27] |
林植芳, 李双顺, 林桂珠, 等. 衰老叶片和叶绿体中H2O2的累积与膜脂过氧化的关系[J]. 植物生理学报, 1988(1): 19-25. |
| [28] |
杨璐, 赵天宏. UV-B辐射增强对大豆根系活性氧代谢及抗氧化系统的影响[J]. 华北农学报, 2018, 33(5): 178-184. |
| [29] |
Nayyar H. Accumulation of osmolytes and osmotic adjustment in water-stressed wheat( Triticum aestivum )and maize( Zea mays ) as affected by calcium and its antagonists[J]. Environmental & Experimental Botany, 2003, 50(3): 253-264. |
| [30] |
Constán-Aguilar C, Leyva R, Blasco B, et al. Biofortification with potassium :Antioxidant responses during postharvest of cherry tomato fruits in cold storage[J]. Acta Physiologiae Plantarum, 2014, 36(2): 1-13. |
| [31] |
Muhammad ASR, Muhammad FS, Muhammad YA, et al. Glycinebetaine applied under drought improved the physiological efficiency of wheat( Triticum aestivum L.)plant[J]. Soil & Environment, 2012, 31(1): 67-71. |
| [32] |
厉恩茂, 李敏, 安秀红, 等. 叶面喷施褪黑素对干旱胁迫下苹果抗旱生理生化指标的影响[J]. 中国南方果树, 2019(4): 95-98. |
| [33] |
Sarropoulou VN, Therios IN, Dimassi T, et al. Melatonin promotes adventitious root regeneration in in vitro shoot tip explants of the commercial sweet cherry rootstocks CAB-6P[J]. Journal of Pineal Research, 2012, 52(1): 38-46. |
| [34] |
吴燕, 连洪燕, 牟雪姣, 等. 干旱胁迫下叶面喷施褪黑素对滁菊幼苗生理生化特性的影响[J]. 西北植物学报, 2016(11): 2241-2246. |
| [35] |
梁新华, 许兴, 徐兆桢, 等. 干旱对春小麦旗叶叶绿素a荧光动力学特征及产量间关系的影响[J]. 干旱地区农业研究, 2001(3): 74-79. |
| [36] |
Movahed N, Eshghi S, Jamali B, et al. Ameliorative effects of paclobutrazol on vegetative and physiological traits of grapevine cuttings under water stress condition[J]. Acta Horticulturae, 2012(931): 475-483. |
| [37] |
Xiao X, Xu X, Yang F. Adaptive responses to progressive drought stress in two populus cathayana populations[J]. Silva Fennica, 2008, 42(5): 705-719. |
| [38] |
郑雨, 赵玉文, 费文群, 等. 干旱胁迫下西藏2种牡丹幼苗叶绿素含量和光合特征比较[J]. 高原农业, 2018, 2(5): 3-11,107. |
| [39] |
Liu JL, Wei X. Exogenous melatonin improves seedling health index and drought tolerance in tomato[J]. Plant Growth Regulation, 2015(77): 317-326. |
| [40] |
Li H, Chang JJ, Chen HJ, et al. Exogenous melatonin confers salt stress tolerance to watermelon by improving photosynthesis and redox homeostasis[J]. Frontiers in Plant Science, 2017(8): 295-298. |
| [41] |
张环纬, 陈彪, 温心怡, 等. 外源硅对干旱胁迫下烟草幼苗生长、叶片光合及生理指标的影响[J]. 生物技术通报, 2019, 35(1): 23-32. |
| [42] |
Kocheva K, Lambrev P, Georgiev G, et al. Evaluation of chlorophyll fluorescence and membrane injury in the leaves of barley cultivars under osmotic stress[J]. Bioelectrochemistry, 2004, 63(1/2): 121-124. |
| [43] |
Wang P, Sun X, Li C, et al. Long-term exogenous application of melatonin delays drought-induced leaf senescence in apple[J]. Journal of Pineal Research, 2013, 54(3): 292-302. |
| [44] |
Liting W, Lina W, Yang Y, et al. Abscisic acid enhances tolerance of wheat seedlings to drought and regulates transcript levels of genes encoding ascorbate-glutathione biosynthesis[J]. Frontiers in Plant Science, 2015(6): 458-467. |
| [45] |
Leopold AC, Sun WQ, Bernal-Lugo I. The glassy state in seeds :analysis and function[J]. Seed Science Research, 1994, 4(3): 267-274. |