2. 天津市动植物抗性重点实验室,天津 300387
2. Tianjin Key Laboratory of Animal and Plant Resistance, Tianjin Normal University, Tianjin 300387
小麦(Triticum aestivum L.)是世界上广泛种植的禾本科粮食作物之一,但各种病虫害的发生严重影响了小麦的产量,其中由布氏白粉菌(Blumeriagraminis f. sp. tritici)引起的小麦白粉病是危害严重的病害之一[1-2]。
Sec14p是一种广泛存在于真核生物中的磷脂酰肌醇转运蛋白(Phosphatidylinositol transferproteins,PITPs) [3],最早在酿酒酵母(Saccharomycesi cerevisiae)中被发现[4],主要参与磷脂代谢和形成高尔基体分泌囊泡等过程[5-6]。最近发现,Sec14基因家族在植物响应逆境胁迫中发挥了重要的作用,Wang等[7]在拟南芥中过表达玉米Sec14p基因发现,转基因拟南芥的根长变短、种子萌发率下降,并且脯氨酸的积累减少,抗氧化酶活性下降,这一系列变化最终提高了转基因拟南芥对低温胁迫的耐受性。Kiełbowicz-Matuk等[8]在抗旱大麦中发现,HvSec14p蛋白能与大多数磷脂酰肌醇结合,且在渗透胁迫下转录水平明显增加。认为该蛋白可能通过参与细胞内磷脂酰肌醇的合成,增强抗旱大麦细胞膜的渗透能力。毛花英等[9]在甘蔗中克隆了Sec14基因,发现在聚乙二醇(Polyethylene glycol,PEG)、盐、CaCl2和水杨酸(Salicylic acid,SA)胁迫下ScSec14基因表达均上调,推测ScSec14可能参与了Ca2+和SA介导的信号通路从而响应逆境胁迫。苏世超等[10]发现TaSec14p-5基因在小麦孕穗期的不同组织中组成型表达,并受盐、脱落酸(Abscisic acid,ABA)、干旱及低温胁迫的诱导。有关Sec14基因参与植物与病原菌互作的研究仅在烟草(Nicotiana tabacumL.)中有过报道,Kiba等[11]发现烟草被青枯菌(Ralstonia solanacearum)侵染后,NbSec14基因的表达上调,而沉默NbSec14后烟草对青枯菌的抗性降低,推测该基因可能与植物防御反应有关。在随后的研究中还发现,NbSec14基因沉默植株中二酰甘油(Diacylglycerol,DAG)、磷脂酸(Phosphatidicacid,PA)的含量下降,磷脂酶C(Phospholipase C,PLC)、磷脂酶D(Phospholipase D,PLD)的活性降低;过表达NbSec14植株的DAG、PA含量上升,PLC、PLD活性升高。认为NbSec14蛋白可能通过参与磷脂代谢、调节磷脂酶活性,从而在烟草抗青枯菌的免疫反应中起重要作用[12]。目前,还未发现关于Sec14基因参与小麦与白粉菌互作过程的报道。
通过RNA-seq技术得到感病小麦品种京411中一段差异表达序列,根据该序列设计引物克隆了TaSec14基因。本研究利用生物信息学技术,分析TaSec14的基因结构和与其他物种Sec14的同源性。利用实时荧光定量PCR技术和VIGS技术分别分析TaSec14基因在不同抗性品种小麦接种白粉菌后的表达模式,以及降低该基因表达后感病小麦京411的抗病性变化,从而探究TaSec14基因在小麦与白粉菌互作过程中的作用,并为研究TaSec14基因功能提供理论支持。
1 材料与方法 1.1 材料京411是半矮秆小麦品种,具有抗寒性强、分蘖力强、成穗率高等优点,是我国北部冬麦区高产广适育种的骨干亲本[13],苗期对白粉菌侵染的表型为高感[14]。Brock是对白粉病具有强抗性的小麦品种,作为抗病遗传资源从英国引进,可能携带Pm2基因[15-16]。本实验室在前期研究发现,Brock的Pm2可能已经丧失了对白粉病病原菌的抗性,在Brock小麦的3BL上可能携带一个新的抗白粉病基因[17]。京411×Brock抗白粉病近等基因系BJ-1,该材料是以感病品种小麦京411为轮回亲本,以抗病品种小麦Brock为抗病基因供体,通过杂交获得F1代。之后再与感病品种小麦京411进行连续回交6代,每一代都在白粉菌胁迫下选取抗病植株,最后再自交1代后获得[18]。所用菌种为白粉菌生理小种E09,由中国农业科学院植物保护研究所提供。病毒材料为大麦条纹花叶病毒(Barley Stripe MosaicVirus,BSMV)。
实验所用引物见表 1,由金唯智生物科技有限公司天津分公司合成。
根据Promega公司Eastep® Super Total RNA Extraction Kit中的方法提取京411品种小麦叶片总RNA,用1%琼脂糖凝胶电泳分析RNA完整性,Nanodrop1000紫外分光光度计检测RNA的浓度和质量。按照Promega公司M-MLV Reverse Transcriptase中体系以oligo(dT) 18作为反转录引物,京411品种小麦总RNA为模板合成cDNA。使用天根公司PlantGenomic DNA Kit中的方法提取京411小麦基因组DNA,用1%琼脂糖凝胶电泳分析样品完整性。
1.2.2 TaSec14基因的克隆及序列分析根据RNASeq结果设计引物SecCDS-F/R,以京411小麦cDNA为模板,扩增差异表达序列。体系为:5×PSGXLBuffer 5 μL,dNTP 2 μL,SecCDS-F 0.5 μL,SecCDS-R 0.5 μL,cDNA 0.25 μL,Prime STAR GXL0.5 μL,灭菌水15.5 μL。反应程序为:94℃ 5 min;35个循环:98℃ 10 s,58℃ 15 s,68℃ 1 min 15 s;68℃ 7 min;4℃保存。回收目的基因并和pGEM-TEasy构建重组载体后送公司测序。将测序结果上传至NCBI中的保守结构域数据库(Conserved domaindatabase,CDD)分析其结构域。将基因序列上传至NCBI GeneBank进行Blastx比对,查找与其相似度高的基因。再利用DNAMAN软件将该基因的氨基酸序列与其他物种氨基酸序列进行比对,通过MEGA软件构建系统进化树,分析其同源性。
根据cDNA序列设计DNA扩增引物SecFlthF/R,以京411的DNA为模板进行扩增。体系为:5×PSGXL Buffer 5 μL,dNTP 2 μL,SecFlth-F 0.5μL,SecFlth-R 0.5 μL,DNA 1 μL,Prime STAR GXL 0.5μL,灭菌水15.5 μL。反应程序为:94℃ 5 min;35个循环:98℃ 10 s,58℃ 15 s,68℃ 2 min;68℃ 7min;4℃保存。按照与cDNA相同的方式测得目的基因的DNA序列,并用IBS 1.0.2软件绘制基因结构示意图。
1.2.3 TaSec14基因在白粉菌胁迫下的表达模式分析京411、BJ-1和Brock幼苗长至一叶一心期时,采用抖佛法将新鲜的白粉菌孢子均匀接种于小麦第一叶表面。分别对接种不同时间点(0、2、4、8、12、24和48 h)的不同品种小麦第一叶进行取材,剪取叶尖1/3部位3 cm,放于灭菌且经液氮低温处理过的2 mL EP管中,-80℃超低温冰箱保存。按照1.2.1中的方法获得小麦cDNA,并根据cDNA非保守区域序列设计引物SecQ-F/R,以小麦TaActin基因为内参,根据上海罗氏制药有限公司Fast StartUniversal SYBR Green Master(ROX)设计实时荧光定量PCR反应体系:SYBR Green Mix 10 μL,cDNA1 μL,SecQ-F 1 μL,SecQ-R 1 μL,无菌水7 μL。每个样品设置3个生物学重复。利用7500 Fast RealTime PCR System进行扩增,程序为:50℃ 2 min;40个循环:95℃ 10 min,95℃ 15 s,58℃ 30 s。反应完成后进行溶解曲线分析,以确定引物的特异性。将样品扩增的Ct值进行汇总,采用2-ΔΔCt法计算基因的相对表达量,将3个重复得到的相对表达量数据计算平均值作为最终结果,并用Origin 9软件绘制TaSec14基因的相对表达量图。
1.2.4 TaSec14基因的VIGS分析根据TaSec14基因非保守区序列设计特异性沉默引物SecV-F/R,以感病小麦京411的cDNA为模板扩增沉默片段。使用1%琼脂糖凝胶电泳对PCR产物进行分析,回收沉默片段后与BSMVγ:载体骨架构建重组载体BSMVγ: TaSec14。
提取含有病毒载体的质粒BSMVα、BSMVβ、BSMVγ: GFP、BSMVγ: PDS以及BSMγ: TaSec14,经线性化、酚仿抽提纯化后,参照普洛麦格公司RiboMAX TM Large Scale RNA Production System-T7试剂盒对BSMV病毒进行体外转录,获得病毒RNA。配制摩擦接种工作液:混合BSMVα、BSMVβ、BSMVγ: GFP各组分RNA作为BSMV: GFP阳性对照组;混合BSMVα、BSMVβ、BSMVγ: PDS各组分RNA作为BSMV: PDS阳性对照组;混合BSMVα、BSMVβ、BSMVγ: TaSec14各组分RNA作为BSMV: TaSec14实验组。等体积混合灭活的DEPC水和GKP Buffer作为空白对照组。待感病小麦京411长到第二叶完全展开时,将工作液以8 μL每份的剂量摩擦接种至叶片上。
1.2.5 TaSec14基因沉默效率验证首先对沉默体系的有效性进行检验,由于PDS基因是高等植物合成类胡萝卜素的关键基因,该基因的缺失将导致植株叶片白化,故对摩擦接种后BSMV: PDS对照组叶片的白化情况进行观察,验证沉默体系的有效性。待GKP Buffer对照组、BSMV: GFP对照组和BSMV: TaSec14实验组植株第三叶完全展开时,按照1.2.3中的方法接种白粉菌,并分别对接菌0 h和4 h各组植株的第三叶进行取材。按照1.2.3方法提取各样品总RNA后反转录成cDNA,每个样品进行3个生物学重复,利用实时荧光定量PCR技术和2-ΔΔCt法得到各组植株叶片TaSec14基因的表达量,将3个重复样品得到的相对表达量求均值后计算TaSec14基因的沉默效率,计算方法为:
TaSec14基因的沉默效率=(1-BSMV: TaSec14实验组中TaSec14基因的表达量/GKP Buffer对照组中TaSec14基因的表达量)×100%
之后采用t检验法检测实验组与对照组的差异情况,将TaSec14基因的相对表达量和差异情况利用Origin 9软件绘图。
1.2.6 TaSec14基因后的白粉菌细胞形态学观察和统计分析按照1.2.3取材方法,对接种白粉菌2 d、3 d和7 d的GKP Buffer对照组、BSMV: GFP对照组和BSMV: TaSec14实验组植株第三叶进行取材。经脱色固定、考马斯亮蓝R-250染色后,用共聚焦显微镜观察叶片上白粉菌孢子的发育情况。统计接种白粉菌24 h后BSMV: GFP对照组和BSMV: TaSec14实验组植株叶片上的白粉菌分生孢子、喙型附着胞和畸形附着胞(分瓣型和纤细型)数目,每个样品的白粉菌数目统计3次求平均值作为样本值。根据公式计算白粉菌的成功侵染率和畸形比率,分析基因沉默后小麦对白粉菌抗性的变化。
计算方法为:
白粉菌孢子成功侵染率=喙型附着胞/(喙型附着胞+畸形附着胞+分生孢子)×100%;白粉菌畸形孢比率=畸形附着胞/(喙型附着胞+畸形孢+分生孢子)×100%。
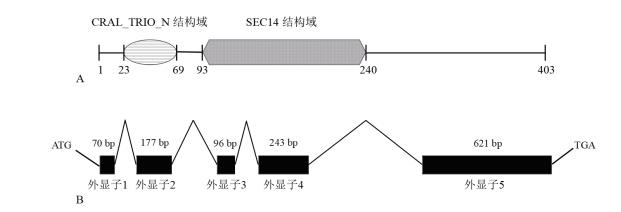
2 结果 2.1 TaSec14基因的生物信息学分析克隆得到该基因的cDNA全长序列(1 564 bp)和DNA全长序列(2 186 bp),利用APE软件预测其开放阅读框为1 212 bp,编码403个氨基酸,如图 1所示。利用IBS 1.0.2软件绘制基因结构示意图,该目的基因含有两个主要的结构域,即结合脂质的CRAL_TRIO_N结构域和具有磷脂酰肌醇转运功能的SEC14结构域(图 2-A),该基因包括5个外显子和4和内含子,呈间隔排布(图 2-B)。

|
| 图 1 TaSec14基因序列信息 |
|
| A:TaSec14蛋白的保守结构域,数字表示结构域的边界;B:TaSec14基因DNA结构示意图,数字表示外显子大小 图 2 TaSec14基因结构示意图 |
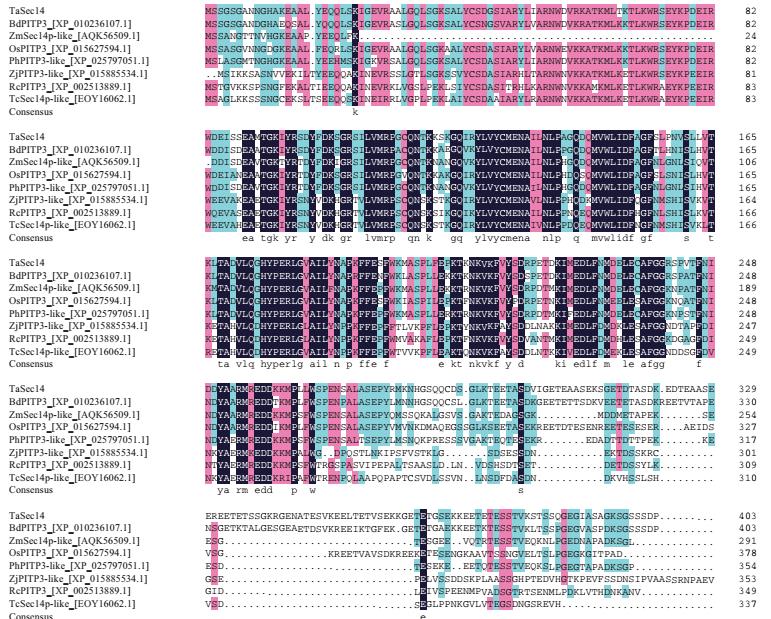
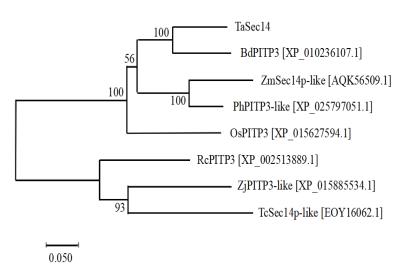
Blastx比对结果显示该基因与二穗短柄草(Brachypodium distachyon,Bd)、玉米(Zea mays,Zm)、水稻(Oryza sativa,Os)、黍(Panicum hallii,Ph)、枣(Ziziphus jujuba,Zj)、蓖麻(Ricinus communis,Rc)和可可(Theobroma cacao,Tc)中Sec14蛋白家族的相似性较高,分别为80.45%、76.75%、72.38%、68.67%、67.31%、65.80%和61.96%。利用DNAMAN软件将该基因的氨基酸序列与其他7个物种氨基酸序列进行比对分析,结果如图 3所示,几个物种Sec14结构域部分的相似性高,说明其具有较高的保守性。系统进化树分析表明该基因编码的蛋白与多个物种中的SEC14蛋白有亲缘关系,且与二穗短柄草PITP3蛋白(XP_010236107.1)的亲缘关系最为接近(图 4),说明其属于Sec14蛋白家族,故将该基因命名为TaSec14。
|
| 图 3 TaSec14同源序列比对结果 |
|
| 图 4 TaSec14系统进化树分析结果 |
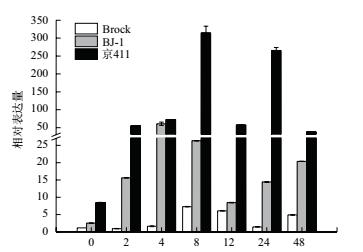
以小麦TaActin作为内参基因,分析接种白粉菌后3个小麦品种中TaSec14基因的表达模式(图 5)。发现在感病小麦京411中TaSec14基因的本底表达量最高,接种白粉菌之后表达量上升,在8 h达到一个高峰,之后开始下降,24 h再次达到高峰,之后再次下降。在抗病小麦BJ-1中,TaSec14表达量在接种白粉菌后开始上升,4 h达到高峰,之后开始下降,12 h后再次升高。在抗病小麦Brock中,峰值,之后开始下降,在24 h后又有小幅上升。在感病小麦京411及其近等基因系BJ-1中,TaSec14基因的表达量一直高于抗病小麦Brock,并且在近等基因系BJ-1中的表达趋势也和轮回亲本京411相似。
|
| 图 5 TaSec14基因在白粉菌侵染下的表达模式分析 |
利 用 特 异 性 沉 默 引 物 SecV-F/R 扩增 TaSec14基 因 片 段,然 后 与 BSMVγ∶ 载 体 骨 架 构 建BSMVγ∶ TaSec14 重组载体。待各组植株第三叶完全展开后,对其进行摩擦接种。图 6是各组叶片的表型观察结果,BSMV∶ PDS 对照组的叶片白化明显,说明 PDS 基因被有效沉默,体系构建成功。

|
| A:GKP Buffer对照组;B:BSMVγ: GFP对照组;C:BSMVγ: PDS对照组;D:BSMVγ: TaSec14实验组 图 6 TaSec14基因沉默后各组植株叶片的表型观察结果 |
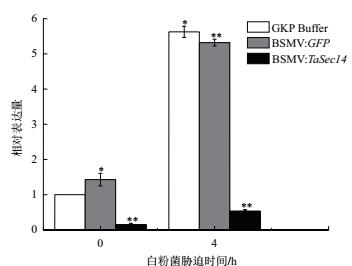
实时荧光定量PCR检测各组TaSec14基因转录水平变化,结果如图 7所示,发现与对照组相比,接种病毒RNA后,实验组TaSec14的表达水平在0 h时的沉默效率为85%,在4 h时的沉默效率为90.5%,并且t检验结果表明实验组中TaSec14基因的表达量与对照组的差异均达到极显著水平,说明小麦内源基因TaSec14的表达被有效抑制。
|
| *和**分别表示差异显著(P<0.05)和极显著(P<0.01) 图 7 TaSec14基因沉默效率验证 |
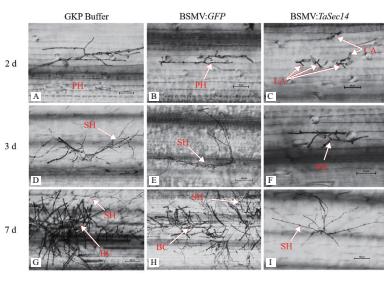
对基因敲减后感病小麦京411接种新鲜的白粉菌孢子,观察接种2 d、3 d和7 d后各组小麦植株的第3叶,统计叶片上白粉菌孢子的生长发育情况,图 8是接种白粉菌孢子不同时间后细胞生长发育情况。接种白粉菌2 d后,BSMV: TaSec14实验组叶片上多数为未侵染成功的畸形附着孢,仅可以看到少量的喙型附着胞(图 8-C),而在GKP Buffer对照组(图 8-A)和BSMV: GFP对照组中,已经出现了初级菌丝(图 8-B);接种白粉菌3 d后,BSMV: TaSec14实验组中才出现初级菌丝(图 8-F),而在另两个对照组中菌丝已经伸长,个别视野下还发现了念珠状的孢子(图 8-D-E);接种白粉菌7 d后,两个对照组中均出现了大量的念珠状孢子和遍布视野的次级菌丝(图 8-G、H),而这时BSMV: TaSec14实验组才开始有次级菌丝形成,没有观察到念珠状孢子(图 8-I)。
|
| * 和 ** 分别表示差异显著( P<0.05)和极显著( P<0.01) 图 8 白粉菌胁迫下各实验组的白粉菌细胞形态学观察 |
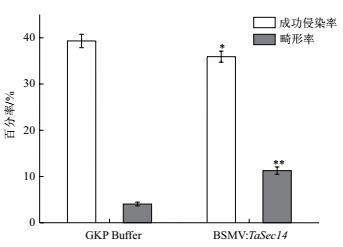
对每个样品叶片上白粉菌孢子数目进行统计3次,求平均值作为样本值。根据1.2.6中公式计算接种白粉菌24 h之后GKP Buffer对照组和BSMV: TaSec14实验组上白粉菌孢子的成功侵染率和畸形率,结果如图 9所示。BSMV: TaSec14实验组白粉菌的成功侵染率为35.92%,略低于GKP Buffer对照组的39.31%,白粉菌孢子的畸形率为11.27%明显高于对照组的4.05%,并且BSMV: TaSec14实验组中白粉菌孢子的侵染率和畸形率与GKP Buffer对照组相比,差异均达到了显著。以上结果表明,降低TaSec14基因的表达导致感病小麦京411对白粉菌抗性的增加。
|
| *和**分别表示差异显著(P<0.05)和极显著(P<0.01) 图 9 白粉菌细胞形态学统计 |
Sec14结构域是一种高度保守且古老的脂质结合结构域,由酵母(Saccharomyces cerevisiae)Sec14p进化而来,在亚细胞器和细胞运输中执行复杂的调节功能[19]。Sec14基因家族编码的蛋白参与植物非生物胁迫信号转导[20]、脂类的运输和代谢[21]、磷脂酶C调节的信号转导等生理过程[22]。本研究克隆了一个在感病小麦京411中特异表达的TaSec14基因,含有典型的SEC14保守结构域,属于磷脂酰肌醇转运蛋白家族的成员
3.2 敲减TaSec14基因改变京411对白粉菌的敏感性SVIGS是一种基于RNAi的对植物特定内源基因进行沉默实验的技术[23]。由于植物体内存在能识别外源RNA并将其降解的免疫机制[24-25],该技术利用该免疫机制,向植物体内转化人工改造的病毒载体,完成对基因的沉默。利用VIGS技术敲减京411中的TaSec14基因后,发现接种白粉菌24 h后BSMV: TaSec14实验组的白粉菌孢子成功侵染率低于GKP Buffer对照组,畸形率高于对照组。表明抑制TaSec14基因的表达能一定程度上提高感病小麦京411对白粉菌的抗性。
3.3 TaSec14基因在小麦与白粉菌互作中起到调控作用本研究克隆的TaSec14基因属于 Sec14基因家族,在接种白粉菌后,TaSec14在感病小麦京411及其近等基因系BJ-1中的表达量一直高于抗病小麦Brock,降低京411中的TaSec14基因表达后,BSMV: TaSec14实验组白粉菌的成功侵染率低于GKP Buffer对照组,并且畸形率明显高于对照组,即降低内源TaSec14基因的表达能在一定程度上增加感病小麦京411抵御白粉菌侵染的能力。因此推测,TaSec14基因可能在小麦与白粉菌互作过程中起到一定的作用。Sec14蛋白家族可以介导磷脂酰肌醇的代谢并参与二酰甘油-蛋白激酶C(DiacylglycerolProtein kinase C,DAG-PKC)途径[26]。在最新的一项研究中发现[27],稻瘟病菌(Magnaporthe grisea)的附着胞内存在一个组氨酸-天冬氨酸激酶Sln1膨压感受器,当Sln1感受到阈值范围内的膨压后,能通过PKC依赖性的途径发挥作用,磷酸化NADPH氧化酶或调控蛋白激酶A(Protein kinase A,PKA)途径,从而共同调节附着胞膨压和入侵栓的形成,参与水稻与稻瘟病菌的互作过程。由此发现,Sec14与Sln1都介导了PKC途径,参与了磷脂酰肌醇信号通路,且最终都影响了植物与病原菌的互作过程。我们推测,TaSec14蛋白也有可能通过PKC途径影响其他多元醇的合成,从而参与小麦与白粉病互作过程。本实验对TaSec14基因功能的分析可为 Sec14基因家族的研究提供新的依据。
4 结论本研究克隆得到了普通小麦中的TaSec14基因,该基因含有典型的SEC14家族保守结构域。接种白粉菌后,感病小麦京411及其近等基因系BJ-1中TaSec14基因的表达量一直高于抗病亲本Brock,且在BJ-1中的表达趋势与轮回亲本京411趋同。通过VIGS技术敲减京411中的TaSec14基因发现,降低京411内源TaSec14基因的表达能在一定程度上增加其对白粉菌的抗性。推测TaSec14基因可能在小麦与白粉菌互作过程起到了调控作用。
| [1] |
高红云, 杨习文, 贺德先, 等. 小麦白粉病对籽粒产量和品质的影响及防控途径[J]. 山东农业科学, 2015, 47(10): 139-144. |
| [2] |
Morgounov A, Tufan H A, Sharma R, et al. Global incidence of wheat rusts and powdery mildew during 1969-2010 and durability of resistance of winter wheat variety Bezostaya 1[J]. European Journal of Plant Pathology, 2012, 132(3): 323-340. |
| [3] |
毛花英, 苏亚春, 阙友雄. 植物Sec14-like磷脂酰肌醇转运蛋白:变化的结构和多样的功能[J]. 农业生物技术学报, 2019, 27(2): 162-174. |
| [4] |
Bankaitis VA. The Saccharomyces cerevisiae SEC14 gene encodes a cytosolic factor that is required for transport of secretory proteins from the yeast Golgi complex[J]. The Journal of Cell Biology, 1989, 108(4): 1271-1281. |
| [5] |
Bankaitis VA, Aitken JR, Cleves AE, et al. An essential role for a phospholipid transfer protein in yeast Golgi function[J]. Nature, 1990, 347(6293): 561-562. |
| [6] |
Novick P, Field C, Schekman R. Identification of 23 complementation groups required for post-translational events in the yeast secretory pathway[J]. Cell, 1980, 21(1): 205-215. |
| [7] |
Wang X, Shan X, Xue C, et al. Isolation and functional characterization of a cold responsive phosphatidylinositol transferassociated protein, ZmSEC14p, from maize(Zea may L[J]. .Plant Cell Reports, 20169, 35(8): 1671-1686. |
| [8] |
Kiełbowicz-Matuk A, Banachowicz E, Turska-Tarska A, et al. Expression and characterization of a barley phosphatidylinositol transfer protein structurally homologous to the yeast Sec14p protein[J]. Plant Science, 2016, 246: 98-111. |
| [9] |
毛花英, 刘峰, 苏炜华, 等. 甘蔗磷脂酰肌醇转运蛋白基因 ScSEC14 响应干旱和盐胁迫[J]. 作物学报, 2018, 44(6): 824-835. |
| [10] |
苏世超, 唐益苗, 徐磊, 等. 普通小麦 TaSEC14p-5 基因的克隆及表达分析[J]. 农业生物技术学报, 2016, 24(8): 1129-1137. |
| [11] |
Kiba A, Nakano M, Vincent-Pope P, et al. A novel Sec14 phospholipid transfer protein from Nicotiana benthamiana is upregulated in response to Ralstonia solanacearum infection, pathogen associated molecular patterns and effector molecules and involved in plant immunity[J]. Journal of Plant Physiology, 2012, 169(10): 1017-1022. |
| [12] |
Akinori K, Ivan G, Yuko H, et al. SEC14 phospholipid transfer protein is involved in lipid signaling-mediated plant immune responses in Nicotiana benthamiana [J]. PLoS One, 2014, 9(5). |
| [13] |
肖永贵, 路亚明, 闻伟锷, 等. 小麦骨干亲本京411及衍生品种苗期根部性状的遗传[J]. 中国农业科学, 2014, 47(15): 2916-2926. |
| [14] |
李丽华.北方冬麦区小麦慢白粉病品种的筛选与鉴定[D].北京: 中国农业科学院, 2001.
|
| [15] |
Paillards S, Goldringer I, Eujabert J, et al. Evolution of resistance against powdery mildew in winter wheat populations conducted under dynamic management[J]. Theoretical and Applied Genetics, 2000, 101(3): 449-456. |
| [16] |
李根桥, 房体麟, 朱婕, 等. 普通小麦品种Brock抗白粉病基因分子标记定位[J]. 作物学报, 2009, 35(9): 1613-1619. |
| [17] |
Wang Z, Zhao P, Chen H, et al. Identification of RAPD markers and development of SCAR markers linked to a powdery mildew resistance gene, and their location on chromosome in wheat cultivar brock[J]. Plant Production Science, 2005, 8(5): 578-585. |
| [18] |
张荣, 王轶, 刘晓颖, 等. 小麦Brock抗白粉病基因近等基因系的培育与分子检测[J]. 中国农业科学, 2010, 43(15): 3059-3066. |
| [19] |
Saito K, Tautz L, Mustelin T. The lipid-binding SEC14 domain[J]. Biochimica et Biophysica Acta, 2007, 1771(6): 719-726. |
| [20] |
Munnik T, Vermeer JEM. Osmotic stress-induced phosphoinositide and inositol phosphate signalling in plants[J]. Plant Cell & Environment, 2010, 33(4): 655-669. |
| [21] |
Tripathi A, Nile A, Bankaitis V. Sec14-like phosphatidylinositoltransfer proteins and diversification of phosphoinositide signalling outcomes[J]. Biochemical Society Transactions, 2014, 42(5): 1383-1388. |
| [22] |
路兆军.大豆疫霉磷脂酰肌醇转移蛋白PsPITP1功能分析[D].南京: 南京农业大学, 2013.
|
| [23] |
Katiyaragarwal S, Morgan R, Dahlbeck D. A pathogen-inducible endogenous siRNA in plant immunity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(47): 18002-18007. |
| [24] |
Stram Y, Kuzntzova L. Inhibition of viruses by RNA interference[J]. Virus Genes, 2006, 32(3): 299-306. |
| [25] |
Xin M, Wang Y, Yao Y, et al. Diverse set of microRNAs are responsive to powdery mildew infection and heat stress in wheat ( Triticum aestivum L)[J]. BMC Plant Biology, 2010, 10(1): 123-133. |
| [26] |
Schaaf G, Ortlund EA, Tyeryar KR, et al. Functional anatomy of phospholipid binding and regulation of phosphoinositide homeostasis by proteins of the Sec14 superfamily[J]. Molecular Cell, 2008, 29(2): 191-206. |
| [27] |
Ryder LS, Dagdas YF, Kershaw MJ, et al. A sensor kinase controls turgor-driven plant infection by the rice blast fungus[J]. Nature, 2019, 574(9): 423-427. |





