2. 西北农林科技大学葡萄酒学院,杨凌 712100;
3. 陕西省葡萄与葡萄酒工程,杨凌 712100
2. College of Enology,Northwest A * FUniversity,Yangling 712100;
3. CShaanxi Engineering Research Center for Viti-Viniculture,Yangling 712100
植物的生长发育和逆境响应受到一系列基因的调控。据报道, ERECTA 基因是一个多功能基因,既与叶片、气孔、花和胚珠的发育有关,又参与植物在生物和非生物胁迫下的生理响应[1]。早在1957年就发现了 ERECTA 基因缺失的拟南芥突变体Landsberg erecta (L er ), 直到1996年Torii等才将拟南芥 ERECTA 基因克隆出来,并进行了序列分析[2]。 ERECTA 基因编码一个富含亮氨酸重复序列(Leucine-rich repeat,LRR0的类受体激酶(Receptorlike kinase,RLK), 定位于细胞膜上,是一个跨膜蛋白,由胞外的LRR结构域、跨膜结构域和胞内的激酶结构域3部分组成[2]。 ERECTA 蛋白的结构特点决定了其在信号转导中的重要作用。在拟南芥中, ERECTA 基因还有两个同系物,分别为 ERL1 和 ERL2 ,这3个基因组成了 ERECTA 基因家族。
ERECTA 基因家族可以抑制气孔发育, ERECTA / ERL1 / ERL2 基因过表达可以减少气孔的数量,而3个基因同时缺失会形成气孔簇[3]。 ERECTA 家族蛋白可与类受体蛋白TOO MANY MOUTHS(TMM0形成异源二聚体[4],该二聚体受气孔蛋白EPF1和EPF2的激活和气孔蛋白STOMAGEN的抑制。TMM缺失后植株表型与 er erl1 erl2 突变体相同,说明TMM对于 ERECTA 家族蛋白功能的正常发挥是必须的[3]。Meng等[5]发现 ERECTA 可与SERK和TMM形成多蛋白受体来调控气孔形态。此外,该基因家族与植物形态建成有关。 ERECTA 基因缺失表现为植株矮小,花序紧凑,而且花萼、花瓣、雄蕊、雌蕊、角果、叶柄等都有减小的趋势,在 er erl1 erl2 三缺突变体中,矮化程度更为严重[2]。
ERECTA 基因家族是植物胁迫响应信号通路中的重要组分。有研究表明, ERECTA 基因与植物的抗旱能力密切相关,该基因可以提高植物的蒸腾效率。与野生型相比, erecta 突变体的蒸腾效率显著降低,而基因互补可以使其蒸腾效率恢复到野生型的水平[6]。将拟南芥 ERECTA 基因在番茄中过表达可提高植株的蒸腾效率[7]。杨树 ERECTA 基因在拟南芥中过表达,可导致苗期初生根变长,叶面积变大,植株的蒸腾效率显著提高[8-9]。水稻phy B突变体中 ERECTA 家族基因上调表达,可使水稻叶片表皮细胞增大,气孔密度降低,植株蒸腾效率提高[10]。蒸腾效率可以表示植物的水分利用率,蒸腾效率越高,说明水分利用率越高。对菜豆 ERECTA 基因与抗旱性的关系进行研究,结果表明在野生品种 ERECTA 基因5 ' 端显示出比栽培品种更高的多样性,且抗旱性更强[11]。 ERECTA 基因还参与植物的高温响应。小麦 ERECTA 基因过表达后,在高温胁迫下叶片中超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)活性和可溶性糖含量显著提高,有利于减少高温对于植株的损伤[12]。 ERECTA 基因家族在植物非生物胁迫响应中的作用可能与钙调素(Calmodulin,CaM0有关。CaM是植物中普遍存在的多功能多肽信号分子[13-14],生物信息学分析发现 ERECTA 胞外富亮氨酸区域含有CaM结合域,并且通过酵母泛素系统和SPR传感芯片标记证实拟南芥 ERECTA 胞外结构域可与CaM2相互作用[15]。
目前已经在番茄、马铃薯、杨树、水稻、小麦、大豆等基因组中鉴定出 ERECTA 基因,本课题组已将葡萄 ERECTA 基因鉴定和克隆出来[16]。为了进一步研究该基因在植物生长发育和高温响应中的作用,本研究将葡萄 ERECTA 基因在拟南芥中过表达,观察其表型变化和对高温的耐受性。实验结果将为培育葡萄抗性新品种提供新的基因资源。
1 材料与方法 1.1 材料将一年生欧亚种“赤霞珠”( Vitis vinifera L.‘Cabernet Sauvignon’)扦插苗种植在塑料盆(直径14 cm,高度1 0cm)中,营养土与珍珠岩比例为4:1,在西北农林科技大学葡萄酒学院温室中进行培养,温度为22-27℃,湿度为70%-90%,每周浇2次水。移栽3个月后,植株长至10-12片,选择健康无病虫害、长势一致的植株进行试验处理。将“赤霞珠”植株移至25℃植物培养箱中适应2 d,湿度70%,光照12 000 Lux,第3天将植株分别置于45℃植物培养箱中连续处理48 h,昼夜16 h/8 h,每个处理5盆[17]。
在葡萄种质资源圃(陕西杨陵,34.29 °N,108.35 °E)于花期采集赤霞珠的根、茎、老叶、幼叶、花、卷须、夏芽和冬芽,用于分析 ERECTA 基因的组织特异性表达。
1.2 方法 1.2.1 基因表达量的测定将葡萄组织在液氮中研磨成粉末,用植物总RNA提取试剂盒(百泰克,北京)提取RNA;将0.5 μg RNA用反转录试剂盒(诺维赞,南京)反转录为cDNA。以叶片cDNA为模板,用Icycler iQ5荧光定量PCR仪(Bio-Rad,美国)检测葡萄 ERECTA 基因的表达量。根据基因序列,用Primer Premier 5软件设计引物,上游引物:5 ' -CTGCTCCACTTCCATCTAC-3 ' ,下游引物:5 ' -ACTGCCTCATCACTCACT-3 ' 。qRT-PCR反应体系(20 μL):SYBR qPCR Master Mix(2×)10 μL(诺维赞,南京), 上下游引物(10 μmol/L)各0.4μL,cDNA模板(50 ng/μL)1 μL,ddH2O 8.2 μL。反应条件:95℃预变性3 min;95℃变性10 s,57℃退火30 s,共40个循环,设3次重复。以 GAPDH (XM_002263109)为内参基因,计算基因相对表达量2-ΔΔCt[18]。
1.2.2 植物表达载体的构建赤霞珠叶片在液氮保护下研磨成粉末,用MiniBEST植物基因组DNA提取试剂盒(TaKaRa,大连)提取基因组DNA(gDNA)。根据NCBI中葡萄 EBP1-GFP 基因组序列和pBI121载体序列,使用CE Design V1.04软件设计引物,上游引物: ACGGGGGACTCTAGAGGATCC ATGAGGTGGTTTGCGAGGTCA,下游引物: CGATCGGGGAAATTCGAGCTC GTCCAGCCAGGCTCCACAG(下划线部分为同源臂)。以叶片gDNA为模板,使用Q5热启动超保真DNA聚合酶(NEB,美国)进行PCR,获得目的片段葡萄 EBP1-GFP 基因组DNA。用 Bam HI和 Sac I(NEB,美国)对pBI121载体进行双酶切,用ClonExpress II一步克隆试剂盒(诺维赞,南京)进行同源重组,经双酶切验证后,获得植物表达载体pBI121-gER。
1.2.3 拟南芥转化用含有重组质粒pBI121-gER的农杆菌,对野生型拟南芥Col进行转化,待其成熟收获种子记为T0代。经卡那霉素筛选后得到T1代植株,单株收取种子,继续进行抗性筛选,直至获得转基因纯合系(T3) [19]。
1.2.4 转基因拟南芥的表型鉴定用含有重组质粒pBI121-gER的农杆菌,对野生型拟南芥Col进行转化,待其成熟收获种子记为T0代。经卡那霉素筛选后得到T1代植株,单株收取种子,继续进行抗性筛选,直至获得转基因纯合系(T3) [19]。
将野生型Col、 ERECTA 基因缺失型L er 和过表达型ER-OE的拟南芥植株在温度22℃、湿度70%、昼夜16 h/8 h条件下培养。在第4周统计叶片数目,测量叶片长度和宽度,在植株停止生长后,测量株高、角果长度和直径,随机选取20个植株进行测量,取平均值。
1.2.5 转基因拟南芥的耐热性鉴定转基因幼苗的耐热性鉴定:将野生型Col、缺失型L er 和过表达ER-OE的种子置于1/2 MS培养基上,4℃春化3 d后,45℃高温处理1 h,然后在植物培养箱中培养2d,温度22℃,湿度70%,昼夜16 h/8 h,统计萌发率并观察幼苗形态变化,设置3个生物学重复,每个重复100粒种子。
转基因植株的耐热性鉴定:将4周龄野生型Col、缺失型L er 和过表达ER-OE的拟南芥植株在40℃条件下处理4 d,湿度70%,光照12 000 Lux,昼夜16 h/8 h,然后在22℃条件下恢复5 d,观察植株形态变化,检测电导率并统计存活率,设置3个生物学重复,每个重复20棵植株。
2 结果 2.1 高温处理对葡萄 ERECTA 基因表达的影响在高温处理1 h后,葡萄叶片中 ERECTA 基因显著上调表达,在处理8 h后表达量最高,是处理前的31倍(图 1)。之后基因表达量逐渐降低,但在处理48 h后, ERECTA 基因表达量仍显著高于处理前。结果表明, ERECTA 基因在葡萄高温应答中起到一定作用。
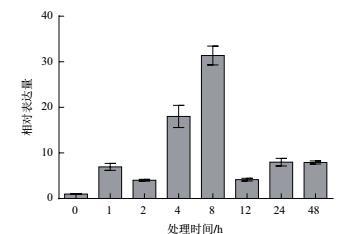
|
| 图 1 高温处理后葡萄 ERECTA 基因表达量的变化 |
对葡萄不同组织中 ERECTA 基因的表达进行分析,结果显示该基因在幼叶和花中的表达量较高,在冬芽和夏芽中的表达量次之,在茎、老叶、卷须和根中的表达量较低(图 2)。
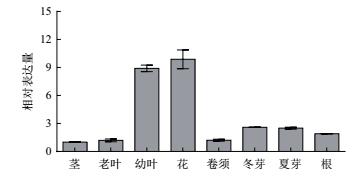
|
| 图 2 葡萄 ERECTA 基因在不同组织中的表达量 |
ERECTA 基因的内含子和Poly A尾巴对基因的表达具有重要作用,为了后续的转基因试验,我们对赤霞珠 ERECTA 基因组DNA进行克隆,序列是从ATG到TAA再加上Poly A尾巴,长度为7 928 bp,电泳结果如图 3。用同源重组法构建植物表达载体pBI121-gER,双酶切验证结果如图 4。
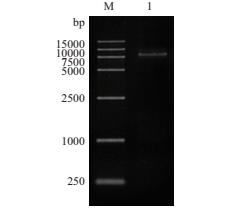
|
| M:DL15000;1:gERECTA(7 928 bp) 图 3 目的基因的扩增 |
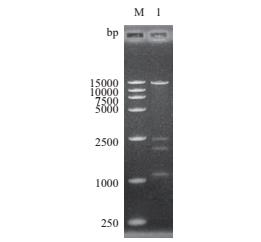
|
| M:DL15000;1:pBI121-gER 图 4 植物表达载体的双酶切验证 |
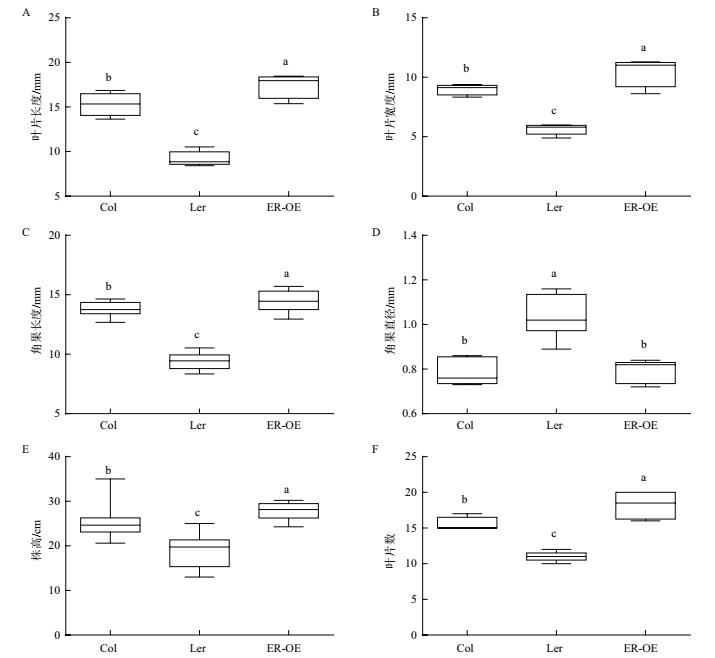
对4周龄的野生型Col、缺失型L er 和过表达型ER-OE的拟南芥植株进行观察发现,与野生型相比,L er 的叶片较小,呈近圆形,叶柄短,而ER-OE的叶片较大,呈椭圆形,叶柄长(图 5-A), 经过测量Col、L er 和ER-OE叶片的平均长度分别为15.29、9.19、17.44 cm(图 6-A), 平均宽度分别为8.99、5.63、和10.49 cm(图 6-B)。由此可见, ERECTA 过表达后,叶片长度和宽度显著增加,叶面积变大。

|
| 图 5 Col、L er 和ER-OE的表型观察(Bar=1 cm) |
|
| 图 6 Col、L er 和ER-OE的形态指标 |
在花期观察发现,与野生型相比,L er 花梗短粗,花序紧凑,而ER-OE花梗细长,花序松散(图 5-B)。L er 角果与野生型相比也出现短而粗的现象,而ER-OE的角果较长(图 5-C), 经测量Col、L er 、ER-OE的角果长度分别为13.74、9.43、14.51mm(图 6-C), 角果直径分别为0.79、1.04、0.79 mm(图 6-D)。由此可见, ERECTA 过表达后,花梗变细长,角果长度显著增加,而角果直径无显著变化。
在花全部凋落、植株停止生长时测量Col、L er 和ER-OE的株高,分别为24.80、18.86和27.84 cm(图 6-E), 叶片数分别为16、11和18/株(图 6-F)。由此可见, ERECTA 过表达可以增加植株高度和叶片数量。
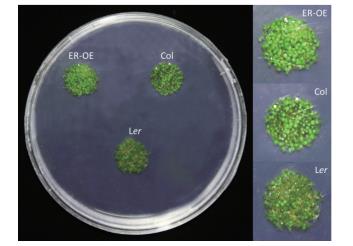
2.5 转基因拟南芥的耐热性鉴定 2.5.1 转基因幼苗的耐热性鉴定将拟南芥种子在高温处理后常温培养2 d,观察发现Col、L er 和ER-OE种子均可以正常萌发,萌芽率均为100%。但三者生长情况不同,L er 幼苗因受到高温胁迫,大部分幼苗发育不正常,表现为叶面积小,颜色较深,为墨绿色;约一半Col幼苗发育不正常;ER-OE幼苗未受到高温胁迫的影响,幼苗长势一致,叶子发育正常,颜色为嫩绿色(图 7)。以上结果说明葡萄 ERECTA 在拟南芥中过表达提高了幼苗的耐热性。
|
| 图 7 Col、L er 和ER-OE幼苗的高温处理结果 |
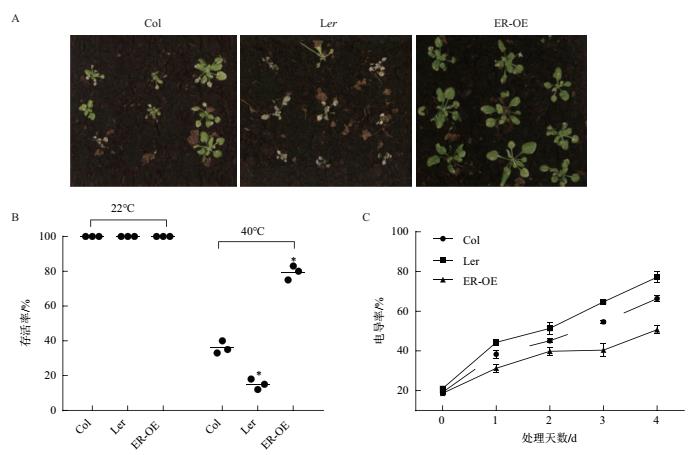
40℃高温处理4 d后,所有L er 发黄的现象;ER-OE植株的耐热性明显高于野生型和缺失型,仅有个别植株出现损伤(图 8-A)。在22℃恢复5 d后,Col、L er 和ER-OE中检测拟南芥叶片的电导率,结果显示在处理第1天Col、L er 和ER-OE电导率出现显著差异,大小顺序为L er >Col>ER-OE。随着高温处理时间的延长,电导率逐渐升高,在处理第4天ER-OE电导率为50.70%,而Col和L er 细胞受损严重,电导率分别达到66.37%和77.20%(图 8-C)。
|
| 图 8 4周龄Col、L er 和ER-OE植株的高温处理结果 |
在本研究中, ERECTA 基因在葡萄幼叶中表达量较高,该基因在拟南芥和番茄的幼叶中也具有较高的表达量[20-21],而且 ERECTA 基因在未成熟番茄果实中的表达量显著高于成熟果实[21]。以上结果说明 ERECTA 基因在植物发育的早期发挥重要作用。葡萄 ERECTA 基因在拟南芥中过表达使叶片、花梗、角果的长度和株高显著高于野生型,这与前人研究结果一致[22]。Uchida等[23]发现 erecta 突变体中茎、花梗、角果和叶片的伸长缺陷可以通过韧皮部 ERECTA 基因的表达而恢复,而在木质部或表皮中表达不能恢复,说明韧皮部 ERECTA 的表达对植株形态具有决定性作用;同时发现EPFL4和EPFL6配体对 ERECTA 的活性具有调控作用。 epfl4 epfl6突变体具有 erecta 突变体的表型,使用内表皮特异性启动子SCARECROW表达 EPFL4 或 EPFL4 基因可使其恢复表型,说明 ERECTA 的活性受内表皮中EPFL4和EPFL6配体的调控[23]。 ERECTA 基因缺失会导致叶肉细胞、花梗皮层细胞和花瓣表皮细胞的数量减少[3, 6, 24],说明该基因是通过促进细胞增殖的方式来影响植株地上组织的大小和形态,而与细胞伸长无关。。已有研究表明生长素、赤霉素、油菜素内酯等激素参与了植物细胞的增殖,因此RECTA介导的信号途径很可能与这些激素信号具有交互作用[25-27]。
在本研究中,葡萄 ERECTA 基因过表达导致叶片数量增加,这是由于该基因可以促进叶原基的形成。叶原基的形成与顶端分生组织(SAM0中生长素的含量和分布密切相关[28]。有研究表明, ERECTA 基因家族在协调SAM外层和内层细胞功能方面起到重要作用[29]。与野生型相比, er erl1 erl2 突变体的叶原基减少,叶序异常,研究表明这种表型是由生长素运输缺陷引起的。在生长素运输过程中起主要作用的是载体PIN1,pin1-6突变体与 er erl1 erl2 突变体的表型相同。进一步研究发现,在 er erl1 erl2 突变体的SAM中 PIN1 基因表达量与野生型相比无显著差异,而是蛋白含量显著降低,说明 ERECTA 基因家族是在转录后调控PIN1的表达[30]。
3.2 EBP1-GFP 基因对植株生长发育的影响随着气候变暖和极端高温天气频发,高温胁迫已成为影响植物生长发育的主要胁迫之一。植物的高温应答涉及多个基因、多种蛋白和多个信号通路,是一个非常复杂的过程。ERECTA是一种跨膜蛋白,可以接受胞外信号并传递到胞内,目前研究较多是其在植物生长发育过程中的作用,而在逆境胁迫中的作用研究较少。在本研究中我们将葡萄 EBP1-GFP 基因在拟南芥中过表达,结果显示转基因植株在高温下的存活率显著高于Col和L er 。Shen等[22]发现将 AtERECTA 在拟南芥、番茄和水稻中过表达,可以显著提高植株的耐热性,并用实验证明植株耐热性的提高与蒸腾作用无关,推测可能是ERECTA在高温下对细胞膜具有一定保护作用,但缺乏足够的证据。我们认为 ERECTA 基因提高植株耐热性与其在高温信号转导中的作用有关。在调控细胞增殖方面,ERECTA位于MAPK级联系统的上游[24],由此推测高温条件下ERECTA也是通过MAPK系统来传递信号。具体来说,高温促进了ERECTA与配体结合,激活了胞内蛋白激酶,将信号传递给MAPK级联系统,接着转录因子通过磷酸化作用被激活,进入细胞核与DNA结合,促进胁迫相关基因的表达;高温下ABA、SA、MeJA等逆境激素含量增加,进一步诱导 ERECTA 基因的表达[16],并增强MAPK信号;高温下线粒体和叶绿体产生大量ROS,可以增强MAPK信号[31],但其含量受到抗氧化酶的抑制。ROS是否可以诱导 ERECTA 基因的表达、ERECTA是否可以磷酸化MEKK1等问题还不清楚,需要进一步用实验证实.
4 结论葡萄 ERECTA 在拟南芥中过表达显著提高了转基因拟南芥幼苗和植株的耐热性,增加了叶片的长度、宽度和数量,花梗变细长,角果长度和株高也显著增加。 ERECTA 基因既可以提高植株的耐热性,又可以增加生长量,在农业生产上有很好的应用前景。
| [1] |
Shpak ED. Diverse roles of ERECTA family genes in plant development[J]. Journal of Integrative Plant Biology, 2013, 55(12): 1238-1250. |
| [2] |
Torii KU, Mitsukawa N, Oosumi T, et al. The Arabidopsis ERECTA gene encodes a putative receptor protein kinase with extracellular leucine-rich repeats[J]. Plant Cell, 1996, 8(4): 735-746. |
| [3] |
Shpak ED, Mcabee JM, Pillitteri LJ, et al. Stomatal patterning & differentiation by synergistic interactions of receptor kinases[J]. Science, 2005, 309(5732): 290-293. |
| [4] |
Lee JS, Kuroha T, Hnilova M, et al. Direct interaction of ligandreceptor pairs specifying stomatal patterning[J]. Genes & Development, 2012, 26(2): 126-136. |
| [5] |
Meng X, Chen X, Mang H, et al. Differential function of Arabidopsis SERK family receptor-like kinases in stomatal patterning[J]. Current Biology, 2015, 25(18): 2361-2372. |
| [6] |
Masle J, Gilmore SR, Farquhar GD. The ERECTA gene regulates plant transpiration efficiency in Arabidopsis[J]. Nature, 2005, 436: 866-870. |
| [7] |
朱锦程, 沈海涛, 祝建波. 拟南芥 ERECTA 基因的克隆及其对番茄转化[J]. 生物技术通报, 2010(8): 102-105. |
| [8] |
郭鹏, 夏新莉, 尹伟伦. 3种黑杨无性系水分利用效率差异性分析及相关 ERECTA 基因的克隆与表达[J]. 生态学报, 2011, 31(11): 3239-3245. |
| [9] |
Xing HT, Guo P, Xia XL, et al. PdERECTA, a leucine-rich repeat receptor-like kinase of poplar, confers enhanced water use efficiency in Arabidopsis [J]. Planta, 2011, 234(2): 229-241. |
| [10] |
Liu J, Zhang F, Zhou J, et al. Phytochrome B control of total leaf area and stomatal density affects drought tolerance in rice[J]. Plant Molecular Biology, 2012, 78(3): 289-300. |
| [11] |
Blair MW, Cortés AJ, Dominique T. Identification of an ERECTA gene and its drought adaptation associations with wild and cultivated common bean[J]. Plant Science, 2016, 242: 250-259. |
| [12] |
郑甲成, 刘婷, 杜莹莹, 等. 高温胁迫下 TaERECTA 基因对小麦幼苗抗氧化物酶活性的影响[J]. 甘肃农业大学学报, 2018(3): 70-75. |
| [13] |
霍建飞, 刘春艳, 郝永娟, 等. 植物中重要的信号分子—CaM[J]. 天津农业科学, 2010, 16(3): 30-35. |
| [14] |
段江燕, 张俊红. 植物细胞中钙调素研究进展[J]. 农业与技术, 2009, 29(6): 35-39. |
| [15] |
高宁.钙调素与ERECTA相互作用的研究[D].石家庄: 河北师范大学, 2008.
|
| [16] |
Liu M, Li W, Min Z, et al. Identification and expression analysis of ERECTA family genes in grape( Vitis vinifera L)[J]. Genes & Genomics, 2019, 41(6): 723-735. |
| [17] |
Jiang J, Liu X, Liu C, et al. Integrating omics and alternative splicing reveals insights into grape response to high temperature[J]. Plant Physiology, 2017, 173(2): 1502-1518. |
| [18] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2 -ΔΔCT method[J]. Methods, 2001, 25: 402-408. |
| [19] |
杨敏, 韩玉珍, 阿依江·哈拜克, 等. LRR-RLKs亚家族基因RLK6在拟南芥开花过程中的作用[J]. 核农学报, 2017(4): 654-662. |
| [20] |
Shpak ED, Berthiaume CT, Hill EJ, et al. Synergistic interaction of three ERECTA-family receptor-like kinases controls Arabidopsis organ growth and flower development by promoting cell proliferation[J]. Development, 2004, 131(7): 1491-1501. |
| [21] |
Villagarcia H, Morin A, Shpak ED, et al. Modification of tomato growth by expression of truncated ERECTA protein from Arabidopsis thaliana [J]. Journal of Experimental Botany, 2012, 63(18): 6493-6504. |
| [22] |
Shen H, Zhong X, Zhao F, et al. Overexpression of receptorlike kinase ERECTA improves thermotolerance in rice and tomato[J]. Nature Biotechnology, 2015, 33(9): 996-1003. |
| [23] |
Uchida N, Lee JS, Horst RJ, et al. Regulation of inflorescence architecture by intertissue layer ligand-receptor communication between endodermis and phloem[J]. PNAS, 2012, 109: 6337-6342. |
| [24] |
Meng X, Wang H, He Y, et al. A MAPK cascade downstream of ERECTA receptor-like protein kinase regulates Arabidopsis inflorescence architecture by promoting localized cell proliferation[J]. Plant Cell, 2012, 24(12): 4948-4960. |
| [25] |
Nemhauser JL, Mockler TC, Chory J. Interdependency of brassinosteroid and auxin signaling in Arabidopsis [J]. PLoS Biol, 2004, 2(9): e258. |
| [26] |
Olszewski N, Sun TP, Gubler F. Gibberellin signaling :biosynthesis, catabolism, and response pathways[J]. The Plant Cell, 2002, 14: s61-s80. |
| [27] |
Du J, Jiang H, Sun X, et al. Auxin and gibberellins are required for the receptor-like kinase ERECTA regulated hypocotyl elongation in shade avoidance in Arabidopsis [J]. Frontiers in Plant Science, 2018, 9: 124. |
| [28] |
Braybrook SA, Kuhlemeier C. How a plant builds leaves[J]. The Plant Cell, 2010, 22(4): 1006-1018. |
| [29] |
Kimura Y, Tasaka M, Torii KU, et al. ERECTA-family genes coordinate stem cell functions between the epidermal and internal layers of the shoot apical meristem[J]. Development, 2017, 145(1): dev156380. |
| [30] |
Chen MK, Wilson RL, Palme K, et al. ERECTA family genes regulate auxin transport in the shoot apical meristem and forming leaf primordia[J]. Plant Physiology, 2013, 162(4): 1978-1991. |
| [31] |
Ruelland E, Zachowski A. How plants sense temperature[J]. Environmental & Experimental Botany, 2010, 69(3): 225-232. |




