2. 甘肃省食品检验研究院, 兰州 730030;
3. 西北民族大学生命科学与工程学院, 兰州 730030
2. Gansu Province Food Inspection Institute, Lanzhou 730030;
3. College of Life Science and Engineering, Lanzhou 730030
作为唯一与肥胖症状呈负相关的脂肪细胞因子——脂联素(Adiponectin, APN)[1-2], 自1995年美国怀特黑德生物医学研究所学者Philipp E·Scherer发现至今的24年来, 研究者们对脂联素及其受体的相关研究不断深入, 脂联素从单一的“能量储存”功能, 到参与机体葡糖代谢、维持能量平衡, 具有抗氧化、抗消炎、抗动脉粥硬化和胰岛素拮抗以及心血管疾病等方面的调节作用, 是发挥多种生物功效的活性物质[3]。随着人们对健康生活的不断追求, 如何提高动物机体的生长性能, 如何有效降低体内脂肪沉积, 如何预防和减少疾病的发生, 如何加强临床诊断及新药物治疗开发已逐渐成为研究热点与关注的重点, 使得脂联素及其受体的相关研究显得愈发重要。
1 脂联素脂联素是源于人和动物脂肪组织的一类特异性表达的分泌蛋白[2-3]。在哺乳动物中, 主要是由白色脂肪组织特异性分泌呈胶状样的内源性细胞激素因子, 因此被称为脂肪细胞补体相关蛋白(Adipocyte complement related protein of 30 kD, Acrp30)[4]、APN[5]、特异性脂肪基因(Adipose most abundant gene transcript l, apM1)[6]、胶状蛋白(Gelatin binding protein of 28 kD, GBP28)[7], 即:Acrp30、APN、GBP28和apM1统称为脂联素。1999年, Arita等[8]将apM1产物称为脂联素, 并建立了人体血液中脂联素浓度的检测方法。随后, 学术界将该产物统称为脂联素。研究表明, 在血浆中脂联素的剂量单位是mg/mL[9]。人体内脂联素的浓度约为3-30 μg/mL[10], 鼠体内脂联素的浓度约为2-7 μg/mL, 猪体内脂联素的浓度约为3-4 μg /mL。哺乳动物机体内的脂联素含量增加, 能促进脂肪酸的氧化[11-12], 通过对肝脏和肌肉等胰岛素靶向器官的摄取, 以此增加机体胰岛素的增敏作用[13-14]。
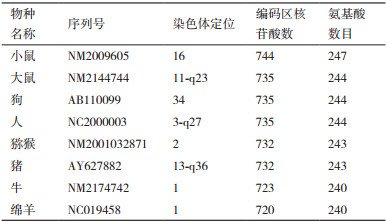
1.1 脂联素结构与类别GenBank上目前已登录了人、大猩猩、猕猴、大鼠和小鼠、猪、牛、绵羊、山羊及狗等不同哺乳动物脂联素基因的序列, 并定位于特定染色体上(表 1)。人、鼠、猪等哺乳动物脂联素的同源性达80%以上[6]。Saito等[15]发现, 人脂联素基因位于染色体的3q27上, 编码蛋白含有244个氨基酸, 分子量约为30 kD, 基因全长约17 kb, 人和哺乳动物的脂联素基因均含有3个外显子和2个内含子。Dasd[16]在小鼠第16号染色体的B3-B4位点发现脂联素基因, 全长约为20 kb, 编码蛋白有247个氨基酸。大鼠脂联素基因位于11号染色体, 编码244个氨基酸。研究表明, 猪、狗、猕猴、牛和羊的脂联素基因编码氨基酸数目几乎相近[17-18]。
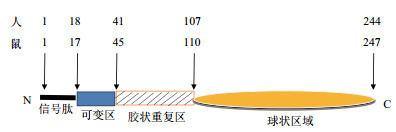
脂联素由氨基端的信号肽序列(17AA)、非同源或非螺旋可变区域(22AA)、一段由22个氨基酸组成的胶状样重复序列区域(65AA)和羧基端类似于C1q因子的球状区域(137AA)四部分构成[19]。研究表明, 脂联素是由3个相同单体组成的非对称三聚体结构[20]。在分子间二硫键的作用下, 通过特定区域被分泌到细胞外, 约有65个类似胶原蛋白的氨基酸保守区域[21]。以低分子量(LMW, 三聚体, -90 kD, 占APN总量25%), 中等分子量(MMW, 六聚体, -180 kD, 占APN总量25%-35%)和高分子量(HMW, 12-18倍体多聚合物, 360-540 kD, 占APN总量40%-50%)这3种形式存在[22](图 1)。
|
| 图 1 人和鼠脂联素基因结构 |
全长结构域脂联素(Full of adiponectin, fAd)和球状结构域脂联素(Global adiopnectin, gAd)是脂联素主要的两种生物活性形式。在脂肪细胞中脂联素是以单体形式存在, 若要发挥其生物学功效, 只能以多聚体或是多倍体形式的脂联素被分泌到细胞外, 才能发挥其重要作用。大量试验已证实, 多聚体形式的脂联素生物学活性最高, 具有抗动脉粥硬化、抗糖尿病、抗肥胖、抗消炎的作用, 可以阻止胰岛素拮抗和心血管疾病的诊断与治疗[23]。
值得注意的是, 在哺乳动物中, 发挥脂联素基因生物作用的首要场所不是肌肉而是肝脏。这是由于通常在脂肪细胞中, 被分泌到细胞外的低分子量脂联素在形成多聚体与其受体特异性结合后, 才能发挥下游的生物学作用; 而发挥下游最重要的生物学功能作用, 关键取决于血液中脂联素多聚体的分布; 而脂联素多聚体发挥生物学功能作用, 又主要取决于由Cys-39介导二硫键的结构[9]。从已报道有关人的球状脂联素三倍体信号肽的结构可以得知[24], 脂联素结构对其信号传导代谢, 在发挥生物学功能等作用方面极为重要。
2 脂联素受体目前, 已报道证实的脂联素受体有3种:脂联素受体1(AdipoR1)、脂联素受体2(AdipoR2)和T-钙黏蛋白(T-cadherin/CDH13)。一般情况下, 脂联素受体均指AdipoR1和AdipoR2。
2.1 AdipoR1和AdipoR22003年, Yamauchi等[25]通过构建人骨骼肌的cDNA文库, 从转染到Ba/F3细胞中首次克隆得到脂联素基因的两种受体:AdipoR1和AdipoR2, 其大小分别为2.0 kb和4.0 kb。人AdipoR1基因编码375个氨基酸, AdipoR2基因编码386个氨基酸, 分别位于染色体1p36.13-q41和12p13.31两个位点[26]。
研究表明, 脂联素受体(AdipoR)有7次跨膜结构的蛋白, 与G蛋白偶联受体家族结构(羧基末端在膜内、氨基末端在膜外)的拓扑结构相反, 脂联素受体的氨基端在细胞膜内, 羧基端在细胞膜外, 与脂联素特异性结合后发挥作用[21]。研究还发现AdipoR2比AdipoR1多一个开放阅读框, 二者的羧基端结构相似度高, 同源性达到66.7%[14]。人与小鼠AdipoR1的同源性为96.8%, 与小鼠AdipoR2同源性为95.2%, 说明脂联素受体的保守程度较高[19]。
脂联素受体的分子克隆和晶体结构鉴定为人们进一步掌握和了解脂联素的生物活性及其相关功能的研究提供了一条新的途径。2015年, Tanabe等[27]第一次报道了人AdipoR1和AdipoR2的晶体结构, 证实两种受体晶体结构基本相似, 都是由氨基端的胞内区域、短的胞内螺旋区域、7个跨膜区域以及羧基端的胞外区域组成, 而且7个跨膜螺旋结构以顺时针方式从第1螺旋到第7螺旋被循环捆绑排列着。最重要的是已证实在两个受体相似跨膜区内的相对巨大的空腔活动区, 存在一个锌离子结合位点, 能促进腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)和过氧化物酶体增殖物激活受体(Peroxisome-proliferator-activated receptor ɑ, PPARɑ)的活性, 增加胰岛素的敏感性作用, 并成为脂联素信号传导通路的一个新靶点[28]。
2017年, Vasiliauskaité-Brooks等[29]报道, AdipoR1和AdipoR2具有酶活性的新功能, 在受限制后表现出极低的神经酰胺活性。研究表明, 通过脂联素结合位点, AdipoR2的晶体状结构能够与一种游离脂肪酸分子结合, 以此加强受体的神经酰胺酶活性[21-29]。实验报道也证实, 脂联素受体能诱导神经酰胺酶的活性, 能够导致神经酰胺酶和游离脂肪酸的水解[30], 为进一步研究脂联素受体酶活性及其功能提供一些新见解, 以此为解决脂联素受体与底物间的专一性提供理论依据。
2.2 T型钙黏蛋白/CDH13脂联素的第3种受体——T型钙黏蛋白(T-cadherin/CDH13), 位于细胞膜上与高分子量脂联素的亚型特异性结合的一种截短型钙黏蛋白。T型钙黏蛋白没有跨膜区域, 通过糖基磷脂酰肌醇分子附着在细胞膜上。
Hug[31]发现T型钙黏蛋白不与脂联素的球状结构域或脂联素的三聚体结合, 但能作为脂联素传导代谢信号的协同受体, 主要在内皮细胞和平滑肌中表达。研究发现, 脂联素分子羧基端的球状结构域存在一个钙离子的结合位点, 可以通过钙离子介导与T型钙黏蛋白结合[32]。
T型钙黏蛋白独有的结构特性, 使得对其研究主要集中在心血管方面。研究发现, 在敲除小鼠心脏的脂联素基因后, 血管中T钙黏蛋白的表达量下降, 但用重组脂联素的作用后, 细胞表面的T型钙黏蛋白表达量会恢复到正常水平[33]。而且T钙黏蛋白具有减少小鼠心脏负荷的功能[34]。尽管T型钙黏蛋白在介导脂联素信号传导通路的激活机制及其一些功能还不明确, 而且在脂联素受体生物学功能方面的作用也较薄弱。但对机体的健康和疾病控制等方面却发挥着重要的作用。
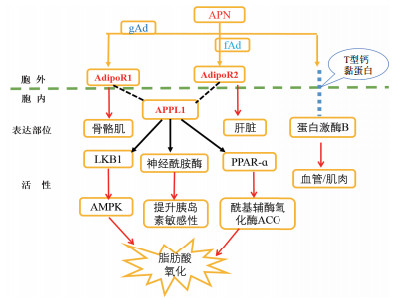
3 脂联素及其受体信号传导脂联素只有与其受体特异性结合后, 才能激活脂联素受体, 并和与之相匹配的蛋白衔接作用后, 诱导细胞内的信号级联激活, 发挥其生物学作用。研究证实, 脂联素受体与磷酸络氨酸衔接蛋白(APPL1)作用后, 主要通过激活AMPK、PPARɑ和促分裂原活化蛋白激酶(MAPK)通路进行下游糖类和脂肪代谢调节[35]。研究表明, gAd与AdipoR1羧基末端结合后, AdipoR1与APPL1发生作用, 促使肝激酶B1(LKB1)与AMPK活化, 引起脂肪酸的氧化; 而fAd在与AdipoR2羧基末端结合后, AdipoR2同样在与APPL1的作用下, 促使PPARɑ与酰基辅酶氧化酶(ACO)活化, 引起脂肪酸的氧化。脂联素受体通过与APPL1结合后, 能诱导神经酰胺酶的活性, 降低肝神经酰胺酶水平与促进神经酰胺酶的分解, 提升胰岛素的增敏作用[36]。因此, 机体内脂类代谢通路中的磷酸酪氨酸衔接蛋白(Adaptor protein containing PH domain, PTB domain and leucine zipper motif 1, APPL1)作为信号分子, 参与多种细胞信号通路介导、与多种膜受体、核因子和信号蛋白结合, 具有调节细胞增殖、染色质重塑、细胞存活等多种生物学功效[37]。通常在骨骼肌中, AdipoR1与AMPK亲和性高; 在肝脏中, AdipoR2与PPARɑ亲和性高(图 2)。研究表明, APPL1能直接增加LKB1在细胞溶质中的转移和在肌细胞中AMPK的活性。另一方面, APPL1复合体受胰岛素或脂联素的刺激后, 在肥胖症和APPL1的缺陷补充方面有很强的抗胰岛素性, 参与脂联素受体和转运胰岛素信号传导作用, 促使APPL1的诱导表达。
|
| 图 2 脂联素及其受体信号传导通路 |
脂联素基因参与哺乳动物体内能量代谢调节, 主要表现在脂肪组织中脂联素表达量的高低, 如在肥胖小鼠脂肪组织中脂联素的表达量是显著降低的[5]。研究发现, 重组后的脂联素能促进体内脂肪代谢, 使得血浆中的甘油三酯含量降低, 存贮在肝脏和肌肉组织中的甘油三酯含量减少, 继而使得脂肪酸氧化和清除相关蛋白的表达水平上调[38]。尽管机体中脂联素主要在脂肪组织中表达, 在皮下脂肪和内脏脂肪的表达量虽无明显差异, 但表达调控方式不同[9]。
研究表明, 通过测定1-21 d新生仔猪脂肪组织中各种脂肪因子的发育性变化情况后, 发现脂联素表达量显著上升[39]。猪脂联素及其受体的mRNA, 除了在皮下及内脏脂肪组织中大量表达外, 在卵巢、子宫也有较高的表达, 是影响猪繁殖性状的相关基因[40-41]。张长庆等[42]用qPCR方法检测荷斯坦公牛脂联素基因后, 发现在相同组织中脂联素基因的表达量会因月龄变化而不同, 以此反映荷斯坦牛生长发育的变化情况。沈留红等[43]发现奶牛胎盘中脂联素mRNA和蛋白表达水平含量与犊牛的出生体重呈正相关, 可作为哺乳动物选育的候选基因。李雪梅等[44]发现藏山羊的脂联素基因在不同组织中以皮下脂肪组织中表达量最高, 在不同脂肪组织中以肾周脂肪的表达量最高, 而且在不同脂肪组织中的表达差异不显著, 在藏山羊脂肪组织中发挥着重要作用, 参与脂肪细胞分化与代谢活动。研究表明, 肉牛育肥前期与后期脂联素基因的mRNA水平在前期与肌内脂肪含量呈正相关, 但在后期与肌内脂肪含量呈负相关[45]。De Rosa等[46]证实猪脂联素的组织特异性表达与其脂肪的沉积有关。Wang等[47]在山羊骨骼肌卫星细胞中检测到的脂联素蛋白表达, 能促使骨骼肌卫星细胞分化生成明显的前体脂肪细胞, 加快成熟脂肪细胞的生成。张辉[48]通过调节机体内脂肪细胞的分化和脂肪含量, 发现脂联素基因可以改善机体胴体性状, 其表达量与前体脂肪细胞分化及脂肪沉积呈正相关。
由此可知, 脂联素基因的表达水平与调控方式虽不同, 但对于但在哺乳动物的繁殖性状、脂肪细胞的分化、及脂肪酸合成代谢方面存在着密切的相关性, 使得脂联素基因已成为影响哺乳动物脂肪代谢的一个分子标记。
4.2 AdipoR的表达调控AdipoR1主要在机体的骨骼肌中表达, 与gAd亲和力高, 与fAd亲和力较低, 能激活AMPK; AdipoR2主要在机体的肝脏中表达, 对fAd和gAd均具有中等亲和力, 能激活PPARɑ, 能调节脂肪和葡萄糖代谢, 具有抗氧化、抗消炎、抗肥胖症等功效。而以多聚体结合为主的T钙黏蛋白脂联素受体, 在蛋白激酶B(AKT)的作用下, 主要在机体的血管和肌肉中表达。
Ding等[49]首次克隆出猪脂联素及其受体基因, 猪脂联素mRNA在脂肪、肝脏、心脏和肌肉等组织中大量表达。Das等[16]发现猪AdipoR1和AdipoR2基因在脂肪组织中能特异性表达, 并与人脂联素受体的同源性较高。Kang[50]发现日本猕猴AdipoR1和AdipoR2的跨膜分布区域保守性高, 在包括脑组织的大部分组织中, AdipoR1都有表达。Lemor等[18]对绵羊5种不同脂肪组织中的脂联素受体表达研究发现, AdipoR1和AdipoR2在内脏脂肪组织中的表达要高于皮下脂肪组织, 继而为小反刍动物脂联素及其受体基因的生脂机理研究提供理论支持。薛科[51]发现, 在山羊的瘤胃中AdipoR1和AdipoR2的表达量较高, 表明这两种受体在瘤胃内发挥着重要的作用, 而且还能与酵母中一种结构类似于脂联素的渗透蛋白相结合并发挥作用, 因而推测AdipoR1和 AdipoR2可能与其他受体蛋白结合后, 将信号传递到胞內发挥相应作用。罗军和赵旺生等[52]发现处于不同泌乳期的萨能奶山羊AdipoR1在肺中表达量最高; 在干奶期和泌乳期时, AdipoR1在不同组织间的表达量差异显著。乳腺上皮细胞用胰岛素处理后, AdipoR1的表达量则会下调; 用催乳素处理后, AdipoR1的表达量会上调, 说明该基因对萨能奶山羊的乳腺上皮细胞有调控作用。Oliveira等[53]通过qPCR和免疫组织化学分析方法, 检测了脂联素及其AdipoR1和AdipoR2在山羊卵巢卵泡中的表达, 验证出山羊重组脂联素能增加其体外卵母细胞核的成熟。
综上可知, 在哺乳动物中, AdipoR1和AdipoR2几乎同时分布于能够被检测到的所有组织中, 在通过与胞外的脂联素基因作用后, 能激活位于表达部位关键信号分子的活性, 从而调控机体的脂肪酸氧化代谢和维持机体的能量平衡。值得注意的是, AdipoR1和AdipoR2二者间的表达水平尽管不同, 但在每种组织中的表达只有一种受体占据着主导地位。
5 脂联素及其受体基因的多态性目前, 国内外主要以人、牛、羊、猪、禽类以及鱼类为研究对象, 对脂联素及其受体基因展开有关机体生脂机理、脂肪代谢及繁殖性状等方面的研究。以此探寻脂联素及其受体在疾病预防和靶点药物研制对其繁殖与遗传性状的影响。Kaklamani等[54]首先报道了人脂联素及其AdipoR1基因的多态性(SNPs)与结肠癌关联性研究, 但结果存在争议。后续报道发现, 在人类的一些癌症组织中发现了脂联素受体的表达, 如直肠癌、胃癌、肺癌、胰腺癌和前列腺癌等[55-56]。年士艳等[57]发现脂联素及其受体基因的多态性与心血管疾病、动脉粥硬化、冠心病等密切相关并且成为疾病候选基因的遗传标记, 为治疗如心血管等疾病的一类新型药物靶点提供参考。
研究表明, 秦川牛脂联素基因第2外显子的多态性被检测后发现, 有3种不同的基因型与秦川牛的屠宰重、背膘厚、胴体重、眼肌面积等产肉性状高度相关[58], 可以将脂联素基因作为秦川牛产肉性状的分子标记。杨磊等[59]对日本和牛和延边黄牛杂交后代、西门塔尔牛和延边黄牛杂交后代通过用遗传学分析后发现, 脂联素基因在这两大牛群体中具有丰富的多态性, 脂联素基因内含子1上和内含子2上均有2个核苷酸多态位点, 为改善牛酮体性状和生长性能奠定了基础。刘重旭等[60]研究发现贵州白山羊和古蔺马羊位于脂联素基因3'端非编码区的单碱基突变为多态位点, 对其繁殖性状相关性分析表明, 贵州白山羊和古蔺马羊中GG型和AG型的产羔数差异显著。因此, 脂联素基因可作为控制贵州白山羊和古蔺马羊多胎性的一个候选基因或是紧密连锁的分子遗传标记物。并且通过对贵州黔北麻羊和黑山羊的脂联素基因进行多态位点检测分析后, 首次揭示在内含子1和外显子3中发现5个单碱基突变, 发现在这两种山羊的遗传多态性较为丰富[61]。
安清明等[62]发现绵羊羔羊脂联素基因的多态性与其生长及屠宰等不同性状具有相关性。曹海洋[63]检测到小尾寒羊脂联素基因10454位点A/G突变, 显著影响第四胎产羔数, 10677位点突变对第二胎产羔数影响较为显著, 可知脂联素基因与繁殖性状间存在相关性。Houde等[64]研究发现, 长白母猪脂联素受体基因中存在11个多态位点(其中AdipoR1有6个多态位点, AdipoR2基因有5个多态位点)。这有助于增加平均窝产仔数、减少木乃伊猪、缩短断奶与发情间隔等特异性相关多态性的选择, 提高长白猪的生产效率。周宁[65]发现猪脂联素基因有3个多态位点, AdipoR1基因有1个多态位点, AdipoR2基因有1个未见报道的多态位点, 均与母猪的繁殖力有相关性。
因此, 脂联素及其受体的多态性与哺乳动物的繁殖性状、生产性状、胴体性状、肉品质及心血管疾病等方面具有相关性, 将为动物选育、繁殖性能及生理营养调控等方面提供理论支持与科学依据, 将对哺乳动物机体的健康、疾病预防和临床诊断等有重要指导意义。
6 总结与展望随着生物医药研究领域技术的飞速发展, 促进了脂联素及其受体研究的快速发展。自1995年脂联素被发现至今的24年的研究结果表明, 脂联素不单是机体内能量贮存和利用的场所, 还是直接影响机体内脂类代谢与合成, 促进脂肪酸氧化和增加抗消炎作用的重要因子。在抗胰岛素、抗动脉粥硬化、抗心血管疾病和2型糖尿病等方面发挥着重要作用, 并在增加胰岛素敏感性, 抗细胞凋亡、抗消炎、抗纤维化、抗脂类毒性及促进神经酰胺减少, 刺激着鞘氨醇磷酸酯的生成, 促使纤维原细胞活性增强[66-67], 在能量代谢中起着关键的调节作用。
在哺乳动物中, 通过对机体内脂肪代谢进行调控, 具有高潜力的脂联素及其受体基因在脂肪细胞分化、脂质代谢与沉积以及在畜禽经济性状方面发挥着重要的作用。动物生产中, 若机体内脂肪沉积过多, 则会降低饲料利用率, 增加养殖成本。若机体内脂肪沉积太少, 则会对动物肉品品质产生影响。脂联素作为机体内脂肪代谢的主效基因, 在动物生产和分子育种中, 已成为代谢综合症重要的靶向分子标记。因此, 对哺乳动物脂联素及其受体基因开展功能性细胞因子的相关研究, 为加快脂联素及其受体基因的研究及运用, 提供必要的理论依据和数据支持, 并在动物疾病预防及靶向药物临床诊断等方面具有重要的指导意义。
| [1] |
Balsan GA, Vieira JL, Oliveira AM, et al. Relationship between adiponectin, obesity and insulin resistance[J]. Revista da Associacao Medica Brasileira, 2015, 61(1): 72-80. DOI:10.1590/1806-9282.61.01.072 |
| [2] |
Katsiki N, Mantzoros C, Mikhailidis DP. Adiponectin, lipids and atherosclerosis[J]. Current Opinion in Lipidology, 2017, 28(4): 347-354. DOI:10.1097/MOL.0000000000000431 |
| [3] |
Achari AE, Jain SK. Adiponectin, a therapeutic target for obesity, diabetes, and endothelial dysfunction[J]. International Journal of Molecular Sciences, 2017, 18(6): pii:E1321. DOI:10.3390/ijms18061321 |
| [4] |
Scherer PE, Williams S, Fogliano M, et al. A novel serum protein similar to C1q, produced exclusively in adipocytes[J]. The Journal of Biological Chemistry, 1995, 270(45): 26746-26749. DOI:10.1074/jbc.270.45.26746 |
| [5] |
Hu E, Liang P, Spiegelman BM. AdipoQ is a novel adipose-specific gene dysregulated in obesity[J]. The Journal of Biological Chemistry, 1996, 271(18): 10697-10703. DOI:10.1074/jbc.271.18.10697 |
| [6] |
Maeda K, Okubo K, Shimomura I, et al. cDNA cloning and expression of a novel adipose specific collagen-like factor, apM1(AdiPose Most abundant Gene transcript 1)[J]. Biochemical and Biophysical Research Communications, 1996, 221(2): 286-289. DOI:10.1006/bbrc.1996.0587 |
| [7] |
Nakano Y, Tobe T, Choi-Miura NH, et al. Isolation and characterization of GBP28, a novel gelatin-binding protein purified from human plasma[J]. The Journal of Biological Chemistry, 1996, 120(4): 803-812. |
| [8] |
Arita Y, Kihara S, Ouchi N, et al. Paradoxical decrease of an adipose-specific protein, adiponectin, in obesity[J]. Biochemical and Biophysical Research Communications, 1999, 257(1): 79-83. DOI:10.1006/bbrc.1999.0255 |
| [9] |
Pajvani UB, Du X, Combs TP, et al. Structure-function studies of the adipocyte-secreted hormone Acrp30/adiponectin. Implications fpr metabolic regulation and bioactivity[J]. The Journal of Biological Chemistry, 2003, 278(11): 9073-9085. DOI:10.1074/jbc.M207198200 |
| [10] |
Frankenberg ADV, Reis AF, Gerchman F. Relationships between adiponectin levels, the metabolic syndrome, and type 2 diabetes:a literature review[J]. Archives of Endocrinology and Metabolism, 2017, 61(6): 614-622. DOI:10.1590/2359-3997000000316 |
| [11] |
Fruebis J, Tsao TS, Javorschi S, et al. Proteolytic cleavage product of 30-kDa adipocyte complement-related protein increases fatty acid oxidation in muscle and causes weight loss in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(4): 2005-2010. DOI:10.1073/pnas.98.4.2005 |
| [12] |
Yamauchi T, Kamon J, Minokoshi Y, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase[J]. Nature Medicine, 2002, 8(11): 1288-1295. DOI:10.1038/nm788 |
| [13] |
Yamauchi T, Kamon J, Waki H, et al. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity[J]. Nature Medicine, 2001, 7(8): 941-946. DOI:10.1038/90984 |
| [14] |
Kadowaki T, Yamauchi T. Adiponectin and adiponectin receptors[J]. Endocrine Reviews, 2005, 26(3): 439-451. DOI:10.1210/er.2005-0005 |
| [15] |
Saito K, Tobe T, Minoshima S, et al. Organization of the gene for gelatin-binding protein(GBP28)[J]. Gene, 1999, 229: 67-73. DOI:10.1016/S0378-1119(99)00041-4 |
| [16] |
Das K, Lin Y, Widen E, et al. Chromosomal localization, expression pattern, and promoter analysis of the mouse gene encoding adipocyte-specific secretory protein Acrp30[J]. Biochemical and Biophysical Research Communications, 2001, 280(4): 1120-1129. DOI:10.1006/bbrc.2001.4217 |
| [17] |
Dai MH, Xia T, Zhang GD, et al. Cloning, expression and chromosome localization of porcine adiponectin and adiponectin receptors genes[J]. Domestic Animal Endocrinology, 2006, 30(2): 117-125. DOI:10.1016/j.domaniend.2005.06.006 |
| [18] |
Lemor A, Mielenz M, Altmann M, et al. mRNA abundance of adiponectin and its receptors, leptin and visfatin and of G-protein coupled receptor 41 in five different fat depots from sheep[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 94(5): e96-e101. DOI:10.1111/j.1439-0396.2010.00987.x |
| [19] |
Zhang TX, Li WX, Qi L, et al. Adiponectin plays a role in energy metabolism for musk secretion in scent glands of muskrats(Ondatra zibethicus)[J]. Endocrine Journal, 2016, 63(7): 633-641. DOI:10.1507/endocrj.EJ15-0720 |
| [20] |
Shapiro L, Scherer PE. The crystal structure of a complement-1q family protein suggests an evolutionary link to tumor necrosis factor[J]. Current Biology, 1998, 8(6): 335-338. DOI:10.1016/S0960-9822(98)70133-2 |
| [21] |
Ghadge AA, Khaire AA, Kuvalekar AA. Adiponectin:A potential therapeutic target for metabolic syndrome[J]. Cytokine & Growth Factor Reviews, 2018, 39: 151-158. |
| [22] |
Han F, Robert L. Judd. Adiponectin regulation and function[J]. Comprehensive Physiology, 2018, 8(3), doi: https://doi.org/10.1002/cphy.c170046.
|
| [23] |
Gamberi T, Magherini F, Modesti A, et al. Adiponectin signaling pathways in liver diseases[J]. Biomedicines, 2018, 6(2): pii:E52. DOI:10.3390/biomedicines6020052 |
| [24] |
Min X, Lemon B, Tang J, et al. Crystal structure of a single-chain trimer of human adiponectin globular domain[J]. FEBS Letters, 2012, 586(6): 912-917. DOI:10.1016/j.febslet.2012.02.024 |
| [25] |
Yamauchi T, Kamon J, Ito Y, et al. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J]. Nature, 2003, 423(6941): 762-769. DOI:10.1038/nature01705 |
| [26] |
Dalamaga M, Christodoulatos GS. Adiponectin as a biomarker linking obesity and adiposopathy to hematologic malignancies[J]. Hormone Molecular Biology and Clinical Investigation, 2015, 23(1): 5-20. |
| [27] |
Tanabe H, Fujii Y, Okada-Iwabu M, et al. Crystal structures of the human adiponectin receptors[J]. Nature, 2015, 520(7547): 312-316. DOI:10.1038/nature14301 |
| [28] |
Tanabe H, Motoyama K, Ikeda M, et al. Expression, purification, crystallization, and preliminary X-ray crystallographic studies of the human adiponectin receptors, AdipoR1 and AdipoR2[J]. Journal of Structural and Functional Genomics, 2015, 16(1): 11-23. DOI:10.1007/s10969-014-9192-z |
| [29] |
Vasiliauskaité-Brooks I, Sounier R, Rochaix P, et al. Structural insights into adiponectin receptors suggest ceramidase activity[J]. Nature, 2017, 544(7648): 120-123. DOI:10.1038/nature21714 |
| [30] |
Holland WL, Xia JY, Johnson JA, et al. Inducible overexpression of adiponectin receptors highlight the roles of adiponectin-induced ceramidase signaling in lipid and glucose homeostasis[J]. Molecular Metabolism, 2017, 6(3): 267-275. DOI:10.1016/j.molmet.2017.01.002 |
| [31] |
Hug C, Wang J, Ahmad NS, et al. T-cadherin is a receptor for hexameric and high-molecular-weight forms of Acrp30/adiponectin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(28): 10308-10313. DOI:10.1073/pnas.0403382101 |
| [32] |
Schraw T, Wang ZV, Halberg N, et al. Plasma adiponectin complexes have distinct biochemical characteristics[J]. Endocrinology, 2008, 149(5): 2270-2282. DOI:10.1210/en.2007-1561 |
| [33] |
Parker-Duffen JL, Nakamura K, Silver M, et al. T-cadherin is essential for adiponectin-mediated revascularization[J]. The Journal of Biological Chemistry, 2013, 288(34): 24886-24897. DOI:10.1074/jbc.M113.454835 |
| [34] |
Denzel MS, Scimia MC, Zumstein PM, et al. T-cadherin is critical for adiponectin-mediated cardioprotection in mice[J]. The Journal of Clinical Investigation, 2010, 120(12): 4342-4352. DOI:10.1172/JCI43464 |
| [35] |
Ebrahimi-Mamaeghani M, Mohammadi S, Arefhosseini SR, et al. Adiponectin as a potential biomarker of vascular disease[J]. Vascular Health and Risk Management, 2015, 11: 55-70. |
| [36] |
Pal China S, Sanyal S, Chattopadhyay N. Adiponectin signaling and its role in bone metabolism[J]. Cytokine, 2018, 112: 116-131. DOI:10.1016/j.cyto.2018.06.012 |
| [37] |
Liu Z, Xiao T, Peng X, et al. APPLs:More than just adiponectin receptor binding proteins[J]. Cell Signal, 2017, 32: 76-84. DOI:10.1016/j.cellsig.2017.01.018 |
| [38] |
Wang ZV, Scherer PE. Adiponectin, the past two decades[J]. Journal of Molecular Cell Biology, 2016, 8(2): 93-100. DOI:10.1093/jmcb/mjw011 |
| [39] |
Ramsay TG, Caperna TJ. Ontogeny of adipokine expression in neonatal pig adipose tissue[J]. Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology, 2009, 152(1): 72-78. |
| [40] |
Lord E, Ledoux S, Murphy BD, et al. Expression of adiponectin and its receptors in swine[J]. Journal of Animal Science, 2005, 83(3): 565-578. DOI:10.2527/2005.833565x |
| [41] |
Jafarikia M, Méthot S, Maignel L, et al. Association of adiponectin and adiponectin receptor genes with sow productivity estimated breeding values[J]. Molecular Biology Reports, 2015, 42(9): 1391-1401. DOI:10.1007/s11033-015-3917-3 |
| [42] |
张长庆, 刘婷, 赵生国, 等. 脂联素基因在荷斯坦公牛不同组织部位的表达差异[J]. 西北农林科技大学学报:自然科学版, 2015, 43(1): 31-36. |
| [43] |
沈留红, 江涛, 巫晓峰, 等. 奶牛胎盘脂联素、瘦素、内脂素与犊牛初生重相关性研究[J]. 畜牧兽医学报, 2017, 48(1): 185-192. |
| [44] |
李雪梅, 薛科, 仲涛, 等. 藏山羊脂联素基因的克隆与表达分析[J]. 中国畜牧兽医, 2014, 41(6): 23-28. |
| [45] |
李鹏, 张辉, 闫峰. 日粮能量水平对延边黄牛肌内脂肪含量与脂联素表达水平的影响[J]. 中国饲料, 2010, 10: 21-23. |
| [46] |
De Rosa A, Monaco ML, Nigro E, et al. Tissue-specific downregulation of the adiponectin "system":possible implications for fat accumulation tendency in the pig[J]. Domestic Animal Endocrinology, 2013, 44(3): 131-138. DOI:10.1016/j.domaniend.2012.11.001 |
| [47] |
Wang L, Xue K, Wang Y, et al. Molecular and functional characterization of the adiponectin(AdipoQ)gene in goat skeletal muscle satellite cells[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(8): 1088-1097. DOI:10.5713/ajas.17.0407 |
| [48] |
张辉, 李鹏, 闫峰, 等. 不同品种肉牛脂联素表达与肌内脂肪沉积的关系[J]. 黑龙江畜牧兽医, 2010, 1: 36-39. |
| [49] |
Ding ST, Liu BH, Ko YH. Cloning and expression of porcine adiponectin and adiponectin receptor 1 and 2 genes in pigs[J]. Journal of Animal Science, 2004, 82(11): 3162-3174. DOI:10.2527/2004.82113162x |
| [50] |
Kang KH, Higashino A, Kim HS, et al. Molecular cloning, gene expression, and tissue distribution of adiponectin and its receptors in the Japanese monkey, Macaca fuscata[J]. Journal of Medical Primatology, 2009, 38(2): 77-85. DOI:10.1111/j.1600-0684.2008.00298.x |
| [51] |
薛科.脂联素(AdipoQ)及其受体(AdipoR1/2)对山羊脂肪沉积的作用机制研究[D].雅安: 四川农业大学, 2014.
|
| [52] |
罗军, 赵旺生, 张天颖, 等. 西农萨能奶山羊脂联素受体1基因(AdipoR1)cDNA克隆、表达及功能分析[J]. 农业生物技术学报, 2015, 23(1): 80-88. DOI:10.3969/j.issn.1674-7968.2015.01.009 |
| [53] |
Oliveira BSP, Costa JAS, Gomes ET, et al. Expression of adiponectin and its receptors(AdipoR1 and AdipoR2)in goat ovary and its effect on oocyte nuclear maturation in vitro[J]. Theriogenology, 2017, 104: 127-133. DOI:10.1016/j.theriogenology.2017.08.013 |
| [54] |
Kaklamani V, Yi N, Zhang K, et al. Polymorphisms of ADIPOQ and ADIPOR1 and prostate cancer risk[J]. Metabolism:Clinical and Experimental, 2011, 60(9): 1234-1243. DOI:10.1016/j.metabol.2011.01.005 |
| [55] |
Jasinski-Bergner S, Büttner M, Quandt D, et al. Adiponectin and its receptors are differentially expressed in human tissues and cell lines of distinct origin[J]. Obesity Facts, 2017, 10(6): 569-583. DOI:10.1159/000481732 |
| [56] |
Okada-Iwabu M, Iwabu M, Yamauchi T, et al. Structure and function analysis of adiponectin receptors toward development of novel antidiabetic agents promoting healthy longevity[J]. Endocrine Journal, 2018, 65(10): 971-977. DOI:10.1507/endocrj.EJ18-0310 |
| [57] |
年士艳. 脂联素及其受体基因多态性与冠心病相关性研究进展[J]. 云南医药, 2018(6): 541-544. |
| [58] |
杨彦杰, 昝林森, 王洪宝. 秦川牛脂联素基因第2外显子多态性及其与部分产肉性状的相关性[J]. 西北农林科技大学学报:自然科学版, 2009, 37(9): 53-58. |
| [59] |
杨磊, 马遇群, 王丹, 等. 和杂牛、西杂牛脂联素基因多态性分析[J]. 吉林农业科技学院学报, 2015, 24(3): 18-20. DOI:10.3969/j.issn.1674-7852.2015.03.007 |
| [60] |
刘重旭, 王凭青, 张宝云, 等. 贵州白山羊和古蔺马羊脂联素基因多态性及其与繁殖性能的关联研究[J]. 中国农业科学, 2011, 44(9): 1916-1922. DOI:10.3864/j.issn.0578-1752.2011.09.019 |
| [61] |
孙振梅, 陈祥, 龙威海, 等. 贵州地方山羊ADIPOQ基因外显子1和3多态性研究[J]. 基因组学与应用生物学, 2015, 34(3): 500-505. |
| [62] |
An Q, Zhou H, Hu J, et al. Haplotypes of the ovine adiponectin gene and their association with growth and carcass traits in New Zealand Romney Lambs[J]. Genes, 2017, 8(6): pii:E160. DOI:10.3390/genes8060160 |
| [63] |
曹海洋.小尾寒羊ADPN和IGF1基因多态性及其遗传效应分析[D].泰安: 山东农业大学, 2013.
|
| [64] |
Houde AA, Murphy BD, Mathieu O, et al. Characterization of swine adiponectin and adiponectin receptor polymorphisms and their association with reproductive traits[J]. Animal Genetics, 2008, 39(3): 249-257. DOI:10.1111/j.1365-2052.2008.01714.x |
| [65] |
周宁.猪ADIPOQ和ADIPORs多态性、表达及与产仔性状的关联分析[D].合肥: 安徽农业大学, 2016.
|
| [66] |
Fang F, Liu L, Yang Y, et al. The adipokine adiponectin has potent anti-fibrotic effects mediated via adenosine monophosphate-activated protein kinase:novel target for fibrosis therapy[J]. Arthritis Research & Therapy, 2012, 14(5): R229. |
| [67] |
Reinke L, Lam AP, Flozak AS, et al. Adiponectin inhibits Wnt co-receptor, Lrp6, phosphorylation and β-catenin signaling[J]. Biochemical and Biophysical Research Communications, 2016, 470(3): 606-612. DOI:10.1016/j.bbrc.2016.01.097 |