腺苷三磷酸结合盒转运蛋白(ATP-binding cassette transporters, ABC转运蛋白)家族庞大, 种类众多, 是现存生物体中发现的最大的蛋白质家族之一。ABC转运蛋白广泛分布于原核及真核生物中, 其主要是通过结合并水解ATP释放能量实现底物的跨膜运输, 其转运的底物主要包括肽、糖类、氨基酸、金属离子、生物碱、维生素、无机有机分子、谷胱甘肽和细胞代谢产物等[1]。底物的多样性促使了ABC转运体参与植物众多的生理过程, 如维持细胞渗透稳态, 对毒物的富集及外排、木栓化的形成、抵抗生物和非生物胁迫以及植物营养摄入、脂质稳态、信号转导、病毒防御及抗原呈递等[2], 从而引起国内外研究者的广泛关注。根据ABC转运蛋白的系统发育分析、核苷酸结合区域(Nucleotide-binding domains, NBDs)序列的相似性及结构域的组织形式, 将该家族划分为ABCA-ABCG及ABCI 8个亚家族[3], 其中ABCB目前是第二大亚族, 仅次于ABCG亚族。尽管通常可以根据植物的亚科成员预测植物ABC转运蛋白的功能, 但事实上许多植物的能力与其预测的功能存在不同, 甚至不同于最相关序列的性质。近年来的研究表明, ABCB亚族参与了许多关键生理过程, 如气孔的开合、根的发育、植物激素的运输、液泡对毒性物质的富集和次生代谢产物分泌。
1 ABCB转运蛋白的结构组成ABC转运蛋白因含有ATP结合框而得名, 即核苷酸结合结构域(Nucleotide-binding domain, NBD)[4]。植物ABCB转运蛋白具有能够编码125-140 kD蛋白质的开放阅读框[5], 其包含核苷酸结合区域(Nucleotide-binding domains, NBDs)和跨膜结合区域(Transmembrane domains, TMDs), 其中亲水性的NBDs结构和序列在ABC转运蛋白家族中高度保守, 包含3个保守的基序:“Walker A”, “Walker B”和“ABC标签序列”(又称Walker C)[5]。其中ABC标签序列约有120个氨基酸残基, 位于Walker A序列和Walker B序列之间[6-7]。每一个NBD结构域分为2个子域, 分别为核心结构域和α-螺旋结构域, 包括上述的Walker A和Walker B序列、ABC蛋白特异位点, 以及较不保守的H loop和Q loop[8]。相对于保守的NBDs结构域, ABCB转运蛋白的TMDs的结构、长度与序列呈现多样性, B亚族的TMDs是含有6个跨膜α-螺旋的疏水跨膜结构域, 形成了溶质跨膜的通道; NBDs结构域负责结合ATP, 并水解ATP使其构象发生改变, 从而激活转运过程, 而TMDs结构域则形成通道使得底物通过脂质双分子层, 二者的协调作用最终实现了物质的转运[9]。
功能表征ABCBs的计算模型已经表明, 拟南芥AtABCB4, AtABCB14和AtABCB21具有N端盘绕线圈结构。AtABCB4中第4个跨膜螺旋的疏水区域位于膜平面之下, 它的连接结构域含有另一个卷曲螺旋结构[10]。3种拟南芥ABCB转运蛋白(AtABCB4, AtABCB14和AtABCB19)的底物对接分析在AtABCB19和AtABCB4 TMD中分别显示了2个和3个推定的IAA结合位点, 以及AtABCB14 TMD中的非特异性IAA对接[11]。
2 ABCB转运蛋白的分类与性质ABC转运蛋白结构域组织形式多样, 根据蛋白的大小分为全分子转运蛋白、半分子转运蛋白和可溶性转运蛋白3类[12]。植物ABCB转运蛋白在此基础上有几种根据结构与性质的命名方案, 目前通用的是Sánchez-Fernández subfamily体系[13]中的MDR(Multidrug resistance)、TAP(Transporter associated with anatigen processing)和ATM(ABC transporter of the mitochondria)的命名方式。植物ABCB转运蛋白亚家族目前包括全分子转运蛋白和半分子转运蛋白两大类, 以人和酵母中ABCB蛋白的结构域和序列同源性为原型来定义分类[14], 其中全分子转运蛋白家族(MDR, multidrug resistance protein, 多药耐药性蛋白, PGP/ p-glycoprotein)的结构域以正向方式TMD-NBD-TMD-NBD形式排列在一条多肽分子上[8], 即(TMD-NBD)2;半分子ABCB转运蛋白是由1个TMD结构域与1个NBD结构域融合以形成1个(TMD-NBD)单元, 并且通过约由60个氨基酸组成的连接肽与另一个同源的TMD-NBD单元连接, 单个多肽的4个核心结构域都是连续的, 这种模块化结构提高了ABCB转运蛋白结合和运输不同类别化合物的可能性。值得一提的是相对于ABC转运蛋白其他亚家族, ABCB亚家族半分子转运蛋白拥有线粒体ABC转运蛋白(ABC transporter of the mitochondria, ATM)和抗原肽相关运载蛋白体(Transporter associated with antigen proccssing, TAP)两种形式, TAP在结构上比ATM多一个双亲信号肽(表 1)。ATM可编码线粒体蛋白是所有ABC转运蛋白亚家族中成员最少的, 目前在拟南芥中仅发现3个[15]。而对TAP的研究较少, 在拟南芥中存在该亚组基因可调节重金属抗性[16]。也发现属于该亚族的半分子转运蛋白与细菌基因组中的ABC转运蛋白具有同源性[17]。近几年, 有研究发现, 植物ABCB亚家族在番茄等作物中也存在除全分子蛋白和半分子蛋白以外的结构, 如番茄SLABCB19基因的结构域排列为NBD-TMD-NBD; 甚至存在仅有一个NBD结构域(SLABCB27等)的基因[18]。
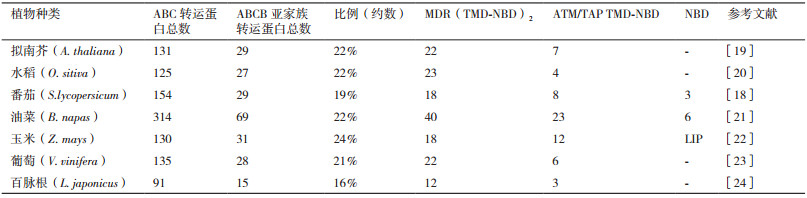
拟南芥[19]、水稻[20]、番茄[18]、油菜[21]、玉米[22]、葡萄[23]及百脉根[24]的全基因组测序结果表明其分别有29、27、29、69、31、28和15个ABCB转运蛋白(表 2)。徐杏等[20]鉴定了水稻中27个B亚族基因, OsABCB23等4个B亚族基因属于半分子转运蛋白; 其他的ABCB亚族成员属于全分子转运蛋白。核苷酸结合域NBD的5个基序中Walker A、Walker B和ABC域基序均高度保守, 而Q环和H环的保守性略差; 跨膜结构域TMD在同一蛋白内和不同蛋白之间没有明显的保守性, 并且水稻ABCB基因在组织器官中具有明显的表达特异性。拟南芥ABC转运蛋白B亚家族有22个全分子蛋白和7个半分子蛋白; 在组织器官表达主要集中在茎节的第2节、吸胀的种子、根、幼嫩的叶片、莲座叶、花器官的萼片和枯萎的叶片中[25]。此外, 通过蛋白相互作用网络预测发现亚族蛋白之间有相互作用[26]。McFarlane等[27]也证实了亚族蛋白之间可以形成异源二聚体从而发挥功能, 异源二聚体的形成, 不仅存在于各个亚族内部之间, 而且更多的是存在于各个亚族之间, 使功能更加多元化。
植株体内的重金属离子会导致植物膜细胞膜脂分子变化, 在胁迫下积累渗透调节物脯氨酸, 产生膜脂过氧化产物丙二醛[28], 影响植物正常代谢活动, 甚至导致植物死亡。在模式植物拟南芥中已经陆续发现一些半分子ABCB转运蛋白基因, 它们表现出对重金属镉、铝及铁的耐受性。Kim等[29]通过基因表达分析发现半分子转运蛋白AtATM3在用镉处理后的植物的根中上调表达, 从而验证了该基因涉及重金属耐受性。总之, 该研究显示AtATM3有助于镉抗性, 并表明它可能介导线粒体膜上镉的转运。植物积累的金属离子会破坏细胞的离子稳态, 为了尽量减少重金属暴露及其积累的有害影响, 植物进化出了解毒机制, 这些机制主要基于螯合和亚细胞区域化, 而重金属螯合是一种普遍存在于多种植物中的解毒策略[30]。此后, Larsen等[31]运用图位克隆等方法, 也从拟南芥als1-1突变体分离鉴定出另一个半分子ABCB转运蛋白AtABCB27/AtTAP2, 并且在铝(Al3+)处理条件下, 该基因根部的表达量明显上调; als1-1突变体则生长受抑, 根长显著低于野生型; 另外利用ICP-OES分析经过25 μm AlCl3处理的野生型和als1-1突变体根部的Al3+累积量, 结果表明这两者之间并无显著差异; 亚细胞定位显示该蛋白定位于植物的根尖液泡膜及脉管系统, 进而推测其可能将Al以螯合肽结合物的形式转运至液泡中, 并区隔起来, 提高植物重金属耐性。
研究发现了半分子ABCB转运蛋白基因AtATM1, AtATM2和AtATM3与酵母线粒体膜蛋白ATM1(ScATM1)同源, 所以推断其涉及线粒体合成的铁/硫簇合物的输出[32]。在3种拟南芥ATM型的ABCB转运蛋白中, AtATM3与ScATM1功能最接近。异源表达的AtATM3能够消除线粒体中的铁超累积并恢复线粒体呼吸功能以及细胞色素c的水平。相比之下, AtATM1只是轻微抑制, 而AtATM2几乎没有抑制作用, 在该系统中表达时甚至具有毒性。随着研究的深入, Teschner等[33]研究又发现ABCB转运蛋白AtABCB25/ATM3还存在涉及线粒体铁硫蛋白成熟以外的新功能。分析数据表明, 该基因在钼辅因子(Moco)的生物合成中具有关键作用。Moco是多数酶(如硝酸还原酶、亚硫酸盐氧化酶、黄嘌呤脱氢酶和醛氧化酶)所需要的一个基团。在拟南芥ATM3插入突变体中, 硝酸还原酶和亚硫酸盐氧化酶的活性降低到了50%。试验证明了在拟南芥ATM3减少突变体中, 钼酶活性和蛋白水平下降。还有研究表明苦荞FtABCB1基因在重金属铅的胁迫下在根、茎和叶中均上调表达[34]。
3.2 参与植物生长素调控生长素主要在幼嫩的叶片和根系中合成, 它极性运输对植物的正常生长发育至关重要。生长素合成量或运输异常, 都会引起植株发育受阻甚至矮化[35]。1992年, Dudler等[36]克隆出了植物中的第一个MDR型基因AtABCB1/AtPGP1, 证实其在植物的生命活动中发挥作用。Ma等[37]首次对苹果进行ABCB家族基因的鉴定与表达分析, 确定了ABCB1及ABCB19是两个生长素输出载体基因, 可以参加苹果的生长素运输和植株高度调控。在M106的嫩枝中, 它们的表达水平高于M9(苹果矮化砧木)的嫰枝, 推测ABCB19参与了抑制矮化砧木M9生长素的向基运输进而导致的矮化过程。随后, 宋春晖等[38]以苹果矮化砧木为材料克隆出与梨、油菜和拟南芥的ABCB19基因高度同源的基因, 名为MdABCB19。该基因在顶梢中表达量最高, 在乔化砧木各器官的表达量显著高于矮化砧木M9。MdABCB19启动子的活性在光照环境下高于黑暗环境, 表明MdABCB19的转录受光调控。在地上部, 光形态建成基因COP1通过控制生长素运输基因PIN1的转录来调节生长素的运输, 从而适当地调节根部生长素的水平[39]。鉴于ABCB19和PIN1的蛋白互作关系, MdABCB19可能也参与光照条件下生长素的运输。后来随着粟酒裂殖酵母系统的开发[11], 可以实现重组蛋白的功能分析和亚细胞定位。可诱导nmt41启动子下的mam1pdr1宿主系中表达了拟南芥ABCB1和ABCB19, 且ABCB19显示出比ABCB1更高的3H-IAA外排活动。随后研究表明了拟南芥生长素转运体ATABCB19在NPA(通过抑制植物生长素极性转运, 引起植物的异常生长发育)抑制生长素诱导的下胚轴向性中起重要作用[40]。通过突变ABCB19, 证明了生长素运输对核内循环的影响, 与弱光下拟南芥幼苗下胚轴伸长速率有定量关系[41]。AtABCB19是AtABCB1最相似的基因并且存在功能冗余性, 因为拟南芥atabcb1/abcb19双突变体中出现了因为生长素运输缺陷而植株矮化的现象[42]。对ABCB19和绿色荧光蛋白的转录和翻译融合的检测表明, 切除根部, 诱导了ABCB19的积累, 使生长素聚集, 从而导致不定根的形成[43]。水稻OsABCB14与拟南芥AtABCB19是同源基因[20], 该基因受生长素诱导在维管组织中强烈表达, 证实参与生长素极性运输[44]。
拟南芥ABCB转运蛋白B4ABCB4是细胞生长素水平的底物活化调节剂, 是一种根本定位的生长素外排转运蛋白, 其生物素摄取活性低, 生物素浓度低[45]。ABCB4对根尖的生长素运动的作用随着生长素浓度的增加而增加, 但是在根毛长度测定中, 发现ABCB4的表达对生长素浓度的变化相对不敏感, 在低浓度生长素下也是明显表达。AtABCB4被认为是底物激活的细胞生长素水平调节因子, 调控细胞内的生长素水平[46]。同样, 与AtABCB4相似的同源蛋白AtABCB21, 在子叶的背轴侧和地上部位的交界处有较强的表达, 而在根中主要在周细胞中表达。ABCB21作为兼性的输入/输出蛋白, 控制植物细胞中生长素的浓度[47]。越来越多的报告证实更多的ABCB转运蛋白, 如AtABCB11/MDR8、AtABCB14/MDR12和AtABCB15/MDR13都存在相似功能[12, 45]。
3.3 参与调节植物气孔开合ABCB转运蛋白AtABCB14在向高浓度的二氧化碳(CO2)过渡时会调节气孔闭合。在AtABCB14缺乏的植物中, 高二氧化碳水平导致气孔关闭加快[48]。在只含有保卫细胞的分离表皮条带中, 缺失AtABCB14的植株与过表达AtABCB14的植株相比, 苹果酸依赖的气孔闭合速度更快, 而过表达AtABCB14的植株比野生型植株慢, 这表明AtABCB14催化苹果酸盐从质外体转运到保卫细胞。当AtABCB14在大肠杆菌和HeLa细胞中异源表达时, 观察到苹果酸转运活性的增加。因此推测AtABCB14通过将苹果酸从质外体转运到保卫细胞中调节气孔运动, 从而增加其渗透压。
4 总结与展望随着对于ABC转运蛋白家族的不断深入研究, 也发现了许多植物中存在ABCB转运蛋白。从水生植物到陆生植物的一些遗传学研究表明, ABC转运蛋白家族的复杂性是随着生长素调控的发展而出现的[49]。其中ABCB转运蛋白参与植物的多种生理代谢活动, 但由于其家族的庞大, 转运机制复杂多样, 成员间存在同源或异源互作, 尚有很多ABCB转运蛋白未能深度探索。需要我们进一步深入分析在植物生命活动中发挥作用的ABCB转运蛋白。未来随着更多的植物完成基因组测序, 我们可以有更广泛的植物类型作为研究对象, 结合分子生物学技术揭示其在不同生命活动和逆境生理中的重要作用。在过去的研究中, 关于ABC转运蛋白的研究主要集中在其特异性底物的鉴定, 日后可以利用蛋白质组学和细胞生物学等方法深入解析ABCB转运蛋白的跨膜运输机制, 并进一步确定其转运的底物类型。最终我们运用基因工程的方法将具有重要应用价值的ABCB蛋白基因转入受体中, 从转化细胞中筛选新类型, 培育新品种来攻克一些遗传缺陷难题, 充分利用这类转运蛋白以提高植物生产力和质量。
| [1] |
Higgins CF. ABC transporters:From microorganisms to man[J]. Annual Review of Cell Biology, 1992, 8(1): 67-113. |
| [2] |
刘艳青, 赵永芳. ABC转运蛋白结构与转运机制的研究进展[J]. 生命科学, 2017, 29(3): 223-229. |
| [3] |
Verrier PJ, Bird D, Burla B, et al. Plant ABC proteins-A unified nomenclature and updated inventory[J]. Trends in Plant Science, 2008, 13(4): 151-159. DOI:10.1016/j.tplants.2008.02.001 |
| [4] |
Higgins CF, Linton KJ. The ATP switch model for ABC transporters[J]. Nature Structural & Molecular Biology, 2004, 11(10): 918-926. |
| [5] |
Jasinski M, Ducos E, Martinoia E, et al. The ATP-binding cassette transporters:structure, function, and gene family comparison between rice and Arabidopsis[J]. Plant Physiology, 2003, 131(3): 1169-1177. DOI:10.1104/pp.102.014720 |
| [6] |
Davidson AL, Dassa E, Orelle C, Chen J. Structure, function, and evolution of bacterial ATP-binding cassette systems[J]. Microbiol Mol Biol Rev, 2008, 7-2(2): 317-364. |
| [7] |
Bairoch A. The PROSITE dictionary of sites and patterns in proteins, its current status[J]. Nucleic Acids Research, 1993, 21(13): 3097-3103. DOI:10.1093/nar/21.13.3097 |
| [8] |
Rea PA. Plant ATP-binding cassette transporters[J]. Annual Review of Plant Biology, 2007, 58(58): 347-375. |
| [9] |
王晓珠, 孙杨, 肖仁坚, 等. 甘蓝型油菜BnABCG8基因的克隆及表达分析[J]. 分子植物育种, 2018, 16(1): 39-46. |
| [10] |
Xu YX, Liu Y, Chen ST, et al. The B subfamily of plant ATP binding cassette transporters and their roles in auxin transport[J]. Biologia Plantarum, 2014, 58(3): 401-410. DOI:10.1007/s10535-014-0423-8 |
| [11] |
Yang H, Murphy AS. Functional expression and characterization of Arabidopsis ABCB, AUX 1 and PIN auxin transporters in Schizosaccharomyces pombe[J]. Plant Journal, 2009, 59(1): 179-191. DOI:10.1111/j.1365-313X.2009.03856.x |
| [12] |
王晓珠, 孙万梅, 马义峰, 等. 拟南芥ABC转运蛋白研究进展[J]. 植物生理学报, 2017, 53(2): 133-144. |
| [13] |
Verrier PJ, Bird D, Burla B, et al. Plant ABC proteins - a unified nomenclature and updated inventory[J]. Trends in Plant Science, 2008, 13(4): 151-159. DOI:10.1016/j.tplants.2008.02.001 |
| [14] |
Garcia O, Bouige P, Forestier C, et al. Inventory and comparative analysis of rice and Arabidopsis ATP-binding cassette(ABC)systems[J]. Journal of Molecular Biology, 2004, 343(1): 249-265. DOI:10.1016/j.jmb.2004.07.093 |
| [15] |
Teschner J, Lachmann N, Schulze J, et al. A novel role for Arabidopsis mitochondrial ABC transporter ATM3 in molybdenum cofactor biosynthesis[J]. Plant Cell, 2010, 22(2): 468-480. DOI:10.1105/tpc.109.068478 |
| [16] |
Jaquinod M, Villiers F, Kiefferjaquinod S, et al. A proteomics dissection of Arabidopsis thaliana vacuoles isolated from cell culture[J]. Molecular & Cellular Proteomics, 2007, 6(3): 394-412. |
| [17] |
Dassa E, Bouige P. The ABC of ABCs:a phylogenetic and functional classification of ABC systems in living organisms[J]. Research in Microbiology, 2001, 152(3-4): 211-229. DOI:10.1016/S0923-2508(01)01194-9 |
| [18] |
Ofori PA, Mizuno A, Suzuki M, et al. Genome-wide analysis of ATP binding cassette(ABC)transporters in tomato[J]. PLoS One, 2018, 13(7): e0200854. DOI:10.1371/journal.pone.0200854 |
| [19] |
Sánchez-Fernández R, Davies TG, Coleman JO, et al. The Arabidopsis thaliana ABC protein superfamily, a complete inventory[J]. Journal of Biological Chemistry, 2001, 276(32): 30231-30244. DOI:10.1074/jbc.M103104200 |
| [20] |
徐杏, 邱杰, 徐扬, 等. 水稻ABCB转运蛋白基因的分子进化和表达分析[J]. 中国水稻科学, 201, 26(2): 127-136. |
| [21] |
Zhang XD, Zhao KX, Yang ZM. Identification of genomic ATP binding cassette(ABC)transporter genes and Cd-responsive ABCs in Brassica napus[J]. Gene, 201, 664(7): 139-151. |
| [22] |
Pang K, Li Y, Liu M, et al. Inventory and general analysis of the ATP-binding cassette(ABC)gene superfamily in maize(Zea mays L.)[J]. Gene, 2013, 526(2): 411-428. |
| [23] |
Çakır B, Kılıçkaya O. Whole-Genome survey of the putative ATP-Binding cassette transporter family genes in Vitis vinifera[J]. PLoS One, 2013, 8(11): e78860. DOI:10.1371/journal.pone.0078860 |
| [24] |
Sugiyama A, Shitan N, Sato S, et al. Genome-wide analysis of ATP-binding cassette(ABC)proteins in a model legume plant, Lotus japonicus:comparison with Arabidopsis ABC protein family[J]. DNA Research, 2006, 13(5): 205-228. DOI:10.1093/dnares/dsl013 |
| [25] |
Kang J, Park J, Choi H, et al. Plant ABC transporters[M]// Plant ABC Transporters. Springer International Publishing, 2014.
|
| [26] |
朱璐, 许杰, 张大兵. 拟南芥ABC转运类蛋白家族的分子进化、表达模式和蛋白功能网络预测分析[J]. 植物生理学报, 2012, 48(12): 1151-1166. |
| [27] |
McFarlane HE, Shin J J, Bird DA, et al. Arabidopsis ABCG transporters, which are required for export of diverse cuticular lipids, dimerize in different combinations[J]. Plant Cell, 2010, 22(9): 3066-3075. DOI:10.1105/tpc.110.077974 |
| [28] |
杨慧.植物对金属离子胁迫的响应机制研究[D].北京: 中国科学院研究生院, 2010.
|
| [29] |
Kim DY, Bovet L, Kushnir S, et al. AtATM3 is involved in heavy metal resistance in Arabidopsis[J]. Plant Physiology, 2006, 140(3): 922-932. DOI:10.1104/pp.105.074146 |
| [30] |
Yadav SK. Heavy metals toxicity in plants:An overview on the role of glutathione and phytochelatins in heavy metal stress tolerance of plants[J]. South African Journal of Botany, 2010, 76(2): 167-179. DOI:10.1016/j.sajb.2009.10.007 |
| [31] |
Larsen PB, Cancel J, Rounds M, et al. Arabidopsis, ALS1, encodes a root tip and stele localized half type ABC transporter required for root growth in an aluminum toxic environment[J]. Planta, 2007, 225(6): 1447-1458. DOI:10.1007/s00425-006-0452-4 |
| [32] |
Chen S, Sanchez-Fernandez R, Lyver ER, et al. Functional characterization of AtATM1, AtATM2, and AtATM3, a subfamily of Arabidopsis Half-molecule ATP-binding cassette transporters implicated in iron homeostasis[J]. Journal of Biological Chemistry, 2007, 282(29): 21561-21571. DOI:10.1074/jbc.M702383200 |
| [33] |
Teschner J, Lachmann N, Schulze J, et al. A novel role for Arabidopsis mitochondrial ABC transporter ATM3 in molybdenum cofactor biosynthesis[J]. Plant Cell, 2010, 22(2): 468-480. DOI:10.1105/tpc.109.068478 |
| [34] |
李洁.苦荞ABC转运蛋白基因的克隆与功能初步分析[D].西安: 西北农林科技大学, 2018.
|
| [35] |
宋春晖.苹果IAA代谢几个关键基因在矮化砧木与miRNA在短枝品种中致矮作用研究[D].西安: 西北农林科技大学, 2017.
|
| [36] |
Dudler R, Hertig C. Structure of an mdr-like gene from Arabidopsis thaliana[J]. J Biol Chem, 1992, 267(9): 5882-5888. |
| [37] |
Ma JJ, Han M. Genomewide analysis of ABCBs with a focus on ABCB1 and ABCB19 in Malus domestica[J]. Journal of Genetics, 2016, 95(1): 141-149. |
| [38] |
宋春晖, 张东, 马娟娟, 等. 苹果生长素运输基因MdABCB19的克隆及其在矮化砧木中的表达分析[J]. 园艺学报, 2017(3): 409-421. |
| [39] |
Sassi M, Lu YF, Zhang YH, Wang J, et al. COP1 mediates the coordination of root and shoot growth by light through modulation of PIN1- and PIN2-dependent auxin transport in Arabidopsis[J]. Development, 2012, 139(18): 3402-3412. DOI:10.1242/dev.078212 |
| [40] |
Nagashima A, Uehara Y, Sakai T. The ABC subfamily B auxin transporter AtABCB19 is involved in the inhibitory effects of N-1- naphthyphthalamic acid on the phototropic and gravitropic respon- ses of Arabidopsis hypocotyls[J]. Plant Cell Physiol, 2008, 49(8): 1250-1255. DOI:10.1093/pcp/pcn092 |
| [41] |
Wu G, Carville JS, Spalding EP. ABCB19mediated polar auxin transport modulates Arabidopsis hypocotyl elongation and the endoreplication variant of the cell cycle[J]. Plant Journal, 2016, 85(2): 209. DOI:10.1111/tpj.13095 |
| [42] |
Geisler M, Murphy AS. The ABC of auxin transport:The role of pglycoproteins in plant development[J]. FEBS Letters, 2006, 580(4): 1094-1102. DOI:10.1016/j.febslet.2005.11.054 |
| [43] |
Sukumar P, Maloney GS, Muday GK. Localized induction of the ATP-binding cassette B19 auxin transporter enhances adventitious root formation in Arabidopsis[J]. Plant Physiology, 2013, 162(3): 1392-1405. DOI:10.1104/pp.113.217174 |
| [44] |
徐艳霞. OsABCB14参与水稻生长素转运及铁平衡[D].杭州: 浙江大学, 2014.
|
| [45] |
Kaneda M, Schuetz M, Lin BS, et al. ABC transporters coordinately expressed during lignification of Arabidopsis stems include a set of ABCBs associated with auxin transport[J]. Journal of Experimental Botany, 2011, 62(6): 2063-2077. DOI:10.1093/jxb/erq416 |
| [46] |
Martin Kubě M, Yang H, Richter GL, et al. The Arabidopsis concentration-dependent influx/efflux transporter ABCB4 regulates cellular auxin levels in the root epidermis[J]. Plant Journal, 2012, 69(4): 640-654. DOI:10.1111/j.1365-313X.2011.04818.x |
| [47] |
Kamimoto Y, Terasaka K, Hamamoto M, et al. Arabidopsis ABCB21 is a facultative auxin importer/exporter regulated by cytoplasmic auxin concentration[J]. Plant and Cell Physiology, 2012, 53(12): 2090-2100. DOI:10.1093/pcp/pcs149 |
| [48] |
Lee M, Choi Y, Burla B, et al. The ABC transporter AtABCB14 is a malate importer and modulates stomatal response to CO2[J]. Nature Cell Biology, 2008, 10(10): 1217-1223. DOI:10.1038/ncb1782 |
| [49] |
Bailly A, Haibing Y, Enrico M, et al. Plant lessons:Exploring ABCB functionality through structural modeling[J]. Frontiers in Plant Science, 2012(2): 108. |