2. 西南民族大学 青藏高原研究院, 成都 610041;
3. 省部共建青稞和牦牛种质资源与遗传改良国家重点实验室, 拉萨 850000
2. Institute of Tibetan Plateau Research, Southwest Minzu University, Chengdu, 610041;
3. State Key Laboratory of Hulless Barley and Yak Germplasm Resources and Genetic Improvement, Lhasa 850000
富含半胱氨酸蛋白(Cysteine and glycine-rich proteins, CRPs)基因家族是LIM结构域蛋白质超家族的一个分支, 其特点是富含半胱氨酸和甘氨酸, 包括CSRP1、CSRP2、CSRP3和TLP四个基因, CSRP3基因编码的CRP3蛋白, 又称MLP蛋白(Mus-cle LIM protein)或CLP蛋白(Cardiac LIM protein), 主要在横纹肌组织中表达[1]。CSRP3基因最早于大鼠的组织中获得, 经研究发现人和大鼠的CSRP3基因均含6个外显子和5个内含子, 起始密码子位于第二外显子, 编码194个氨基酸, 主要是在心肌和骨骼肌中表达, 且其表达与肌分化过程一致, 是一个肌发生的正调节因子[2-4]。越来越多的研究表明, CRP3在肌源性分化和肌细胞结构中发挥重要作用。CRP3蛋白可通过多种方式调控肌肉发育和肌肉细胞结构维持, 同时也可作为机械传感器蛋白, 与许多细胞骨架蛋白相互作用, 参与基于肌动蛋白的细胞骨架组装[5-7]; 或通过其LIM结构域在自噬过程中与LC3(微管相关蛋白1轻链3)相互作用, 促进细胞自噬[8]; 或与心肌肌球蛋白MyBP-C结合形成CRP3/MyBP-C复合物, 参与肌纤维形成过程, 并通过调节肌动蛋白ATP酶活性, 在成肌细胞分化中发挥重要作用[9]。
研究发现CSRP3基因不仅对人类疾病有一定影响, 对畜禽肉质及其生长性能方面也有重要影响。已有研究表明, CSRP3基因突变会导致人肥厚性心肌病[10]。敲除小鼠CSRP3基因也会导致心肌肥大和心衰[6]。CSRP3基因缺陷小鼠的骨骼肌的肌小节与肌纤维长度都比正常小鼠短, 表明CRP3在维护正常的肌肉结构和功能中起重要作用[3]。对猪CSRP3基因进行克隆及鉴定表明CSRP3基因是影响猪肉品质的潜在功能候选基因[11]。干扰CSRP3 mRNA的表达会抑制鸡的骨骼肌卫星细胞向肌管分化, 表明CSRP3可能会通过促进鸡骨骼肌卫星细胞的分化从而促进肌肉生长[12]。对秦川牛CSRP3基因进行SNP分析发现, 群体中某些组合基因型与生长和胴体性状显著或极显著相关, 证明CSRP3作为一种标记基因在提高生长性能和胴体性状方面有着巨大潜力[13]。研究发现CSRP3在小尾寒羊心脏组织中的表达量显著高于杜泊羊, 而在肌肉(背长肌和股二头肌)组织中则相反[1]。
牦牛(Bos grunniens)是以我国青藏高原为起源地的大型反刍动物, 也是“世界屋脊”著名的景观牛种, 素有“高原之舟”的美称, 是一个极其难得的、宝贵的基因库[14-15]。牦牛肉品质好、口感好, 是无污染的绿色食品, 符合高蛋白、低脂肪的现代人健康饮食要求[16], 研究肌肉发育调控的相关基因对提高牦牛肉品质具有重要意义, 已有研究[1, 11-13]发现CSRP3基因参与调节肌肉发育过程, 对畜禽生长性能和肉品质具有重要影响, 而关于牦牛CSRP3基因的研究尚未见报道。故本实验通过对牦牛CSRP3基因进行克隆及组织表达谱分析, 以期为后续提高牦牛肉品质的研究提供基础数据。
1 材料与方法 1.1 材料实验样品采集于西藏自治区昌都市类乌齐县, 选取3头0.5岁健康类乌齐牦牛, 分别采集心脏、肝脏、脾脏、肺脏、臀大肌和臀脂, 用DEPC水清洗干净后, 包裹于锡箔纸中并做好标记, 迅速置于液氮中保存备用。
主要试剂:Taq DNA聚合酶、dNTPs购自博迈德生物公司; RNA提取试剂Trizol购自Invitrogen公司; RNA反转录试剂盒(PrimeScriptTM RT Reagent Kit with gDNA Eraser[Perfect Real Time])、pGEM-T Vector cloning kit、DH5α感受态细胞、2 000 bp DNA Marker、TB Green Premix Ex Taq Ⅱ均购自TaKaRa公司; 琼脂糖凝胶DNA纯化回收试剂盒购自北京天根生化科技有限公司。
1.2 方法 1.2.1 总RNA的提取及反转录使用TRIzol法提取组织总RNA, 用1%的琼脂糖凝胶电泳检测RNA纯度, 紫外分光光度计检测RNA浓度及OD260nm/280nm值。利用RNA反转录试剂盒将其反转录为cDNA, 存于﹣20℃冰箱备用。
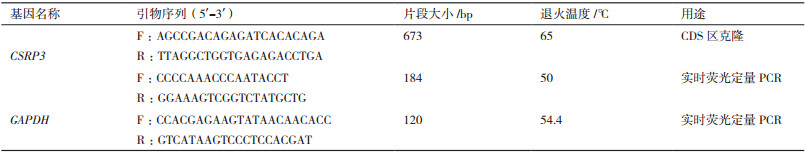
1.2.2 牦牛CSRP3基因的克隆根据GenBank中野牦牛CSRP3 mRNA序列(XM_005900673.2), 内参基因GAPDH(XM_014482068), 利用Primer Premier 5软件和NCBI Primer-BLAST在线软件设计引物扩增CSRP3基因CDS区, 再用克隆所得CSRP3基因序列设计实时荧光定量PCR引物(表 1), 引物由成都擎科梓熙生物技术有限公司合成。
PCR扩增体系(总体积为25 µL):上下游引物各1 µL、cDNA模板1 µL、ddH2O 9.5 µL、2×Taq PCR MasterMix 12.5 µL。PCR反应条件:95℃预变性5 min, 94℃变性30 s, 65℃退火30 s, 72℃延伸45 s, 循环35次, 72℃延伸7 min, 4℃保存。PCR产物用1%琼脂糖凝胶电泳检测并进行胶回收。
将纯化回收得到的PCR产物连接到pGEM-T载体, 并置于16℃恒温的金属浴中过夜连接。将连接产物转化至DH5α感受态细胞中, 筛选出阳性重组质粒, 进行菌液PCR鉴定, 并将筛选出来的菌液送成都擎科梓熙生物技术有限公司测序。
1.2.3 组织表达差异分析根据测序得到的序列设计实时荧光定量PCR引物, 检测CSRP3基因在心脏、肝脏、脾脏、肺脏、臀达肌和臀脂组织的表达量。反应体系(10 µL):TB Green Premix Ex Taq Ⅱ 5 µL、上下游引物各0.4 µL、无菌去离子水3.2 µL、模板cDNA 1 µL。反应程序:95℃预变性30 s, 95℃变性5 s, 55℃退火30 s, 共39个循环。其中每个样本设置3个生物学重复3个技术重复, 获得每个样品的Ct值后, 采用2-ΔΔCt法计算目的基因相对表达量, GAPDH作为内参基因对样本定量结果进行处理。利用SPSS 20.0软件对CSRP3基因在不同组织器官中的差异进行单因素方差分析, P < 0.05为差异显著。
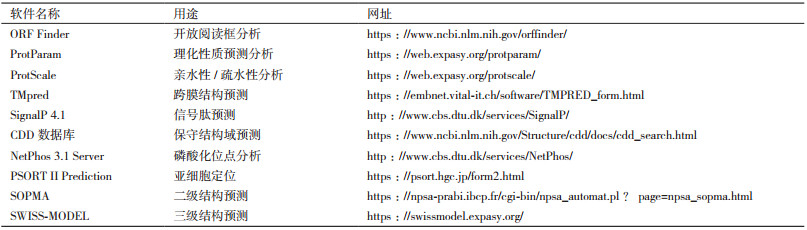
1.2.4 生物信息学分析对牦牛CSRP3基因进行生物信息学分析, 利用DNAStar中的MegAlign软件对牦牛与其他12个物种的CSRP3基因CDS区序列做同源性分析, 使用MEGA 7.0软件构建系统进化树, 其他所用到的在线软件如表 2所示。
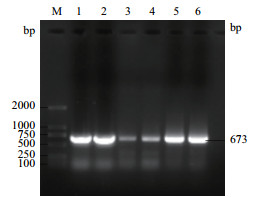
CSRP3基因PCR扩增产物经1%琼脂糖凝胶电泳检测, 获得与预期牦牛CSRP3基因片段大小一致的单一清晰条带, 大小为673 bp(图 1), 测序验证后得到牦牛CSRP3基因CDS区大小为585 bp, 编码194个氨基酸残基, 相关序列信息已提交NCBI, 登录号为MN695918。
|
| M:Maker D2 000 5-6:扩增电泳条带1-4:菌液PCR电泳条带 图 1 牦牛CSRP3基因PCR扩增结果 |
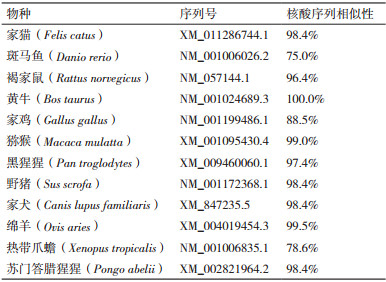
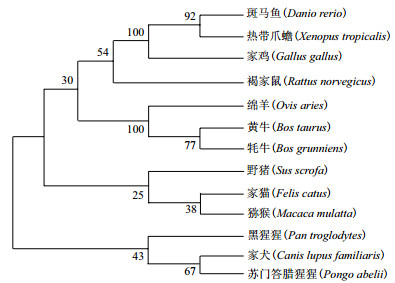
利用MegAlign软件将克隆得到的牦牛CSRP3基因序列与家猫、斑马鱼、褐家鼠、黄牛、家鸡、猕猴、黑猩猩、野猪、家犬、绵羊、热带爪蟾、苏门答腊猩猩的该基因序列进行相似性比对, 其中牦牛与黄牛的序列相似性高达100%, 与斑马鱼的序列相似性为75.0%(表 3)。利用MEGA 7.0软件采用NJ聚类法构建牦牛CSRP3基因系统进化树(图 2), 结果显示牦牛与黄牛的亲缘性最近; 其次是绵羊; 而与斑马鱼和热带爪蟾等较低等脊椎动物相距最远。
|
| 图 2 NJ法构建的牦牛CSRP3基因系统进化树 |
利用在线软件ExPASy中的ProtParam程序预测CRP3蛋白的理化性质, 结果表明:该蛋白的分子式为C903H1403N263O275S19, 由2 863个原子组成, 分子质量为20 952.81, 氨基酸总数为194, 含量最多的是甘氨酸(13.4%); 其次是赖氨酸和半胱氨酸(10.3%和8.2%); 带负电荷的残基总数(Asp + Glu)为17, 带正电荷的残基总数(Arg + Lys)为27, 说明该蛋白带正电荷; 总平均亲水性(GRAVY)为-0.561, 为亲水性蛋白; 理论等电点为8.89, 为偏碱性蛋白; 摩尔消光系数为23 920, 在哺乳动物网织红细胞内的半衰期为30 h, 不稳定指数为40.16, 脂肪指数为43.81, 根据Guruprasad方法表明CRP3为不稳定蛋白。
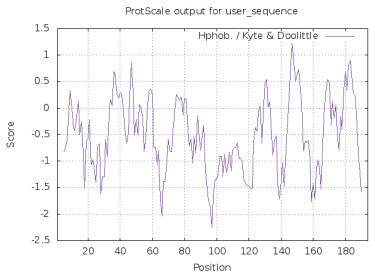
利用在线软件ExPASy中的ProtScale程序预测CRP3蛋白的亲水性/疏水性(图 3), 147位点处有最大值为1.222, 97位点处有最小值为-2.256, 故CRP3蛋白变现为亲水性, 与理化性质预测的结果一致。
|
| 正值表示疏水,负值表示亲水窗口大小为n=9 图 3 牦牛CRP3蛋白的亲水性/疏水性分析 |
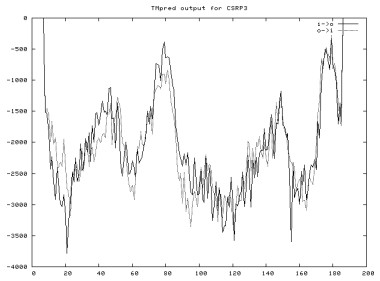
通过在线软件ExPASy中TMpred程序预测蛋白跨膜结构发现, CRP3蛋白无跨膜结构(图 4), 不属于跨膜蛋白。利用在线软件SignalP 4.1进行蛋白质信号肽分析, 发现无信号肽, 说明CRP3蛋白不属于分泌蛋白。
|
| 图 4 牦牛CRP3蛋白跨膜结构预测结果 |
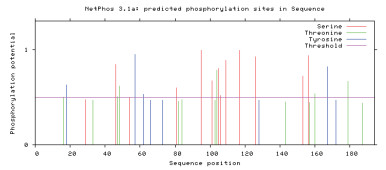
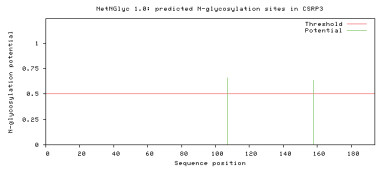
通过在线软件NetPhos 3.1 Server, 对CRP3蛋白序列进行磷酸化位点预测, 结果(图 5)显示在牦牛CSRP3基因编码的氨基酸中有12个丝氨酸(S)磷酸化位点、6个苏氨酸(T)磷酸化位点、4个酪氨酸(Y)磷酸化位点。利用NetNGlyc 1.0对其进行糖基化位点预测, 结果(图 6)显示CRP3有2个N-糖基化位点(Asn107和Asn158), 7个O-糖基化位点(Thr95、Thr101、Thr103、Thr104、Thr105、Thr106和Thr109)。
|
| Serine:丝氨酸;Threonine:苏氨酸;Tyrosine:酪氨酸;Threshold:阈值 图 5 牦牛CRP3蛋白磷酸化位点预测结果 |
|
| 图 6 牦牛CRP3蛋白N-糖基化位点预测结果 |
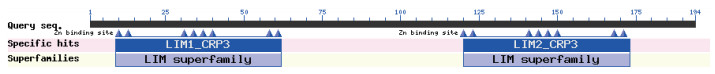
利用NCBI中的Conserved Domain Database(CDD)数据库对CRP3蛋白的保守结构域进行预测, 结果(图 7)显示该蛋白为LIM蛋白超家族成员, 在第9-61位之间和第119-171位之间存在两个LIM结构域, LIM结构域存在于多个发育途径的关键调控因子中, 两个结构域均含有8个Zn2+结合位点。
|
| 图 7 牦牛CRP3蛋白保守结构域预测结果 |
利用在线软件PSORT II Prediction分析牦牛CRP3蛋白的亚细胞定位发现, 该蛋白在细胞核内分布最多(78.3%); 其次为细胞质(17.4%), 线粒体中也有少量分布(4.3%)。
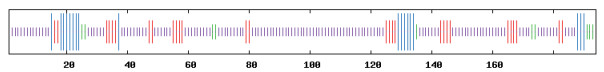
2.7 CRP3蛋白的高级结构预测使用在线软件ExPASy中的SOPMA程序预测牦牛CRP3的二级结构, 分析结果显示, 该蛋白以无规则卷曲为主, 其中α-螺旋18个占总链的9.28%, 延伸链28个占总链的14.43%, β-转角10个占总链的5.15%, 无规则卷曲138个占总链的71.13%(图 8)。
|
| 中长竖线区:α-螺旋;中竖线区:延伸链;次中竖线区:β-转角;短线区:无规则卷曲 图 8 牦牛CRP3蛋白二级结构预测结果 |
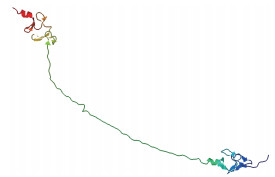
利用在线软件SWISS-MODEL对牦牛CRP3蛋白进行同源模建, 预测其三级结构模型, 其最佳模型是1b8t.1.A(图 9), 序列一致性为67.43%;另一模型是2xjy.1.A, 序列一致性为21.43%。该蛋白的三级结构表明, 他们组成的多肽链有两个高度相似的LIM结构域。
|
| 图 9 牦牛CRP3蛋白三级结构预测结果 |
通过实时荧光定量PCR检测CSRP3基因在心脏、肝脏、脾脏、肺脏、臀大肌和臀脂组织的表达量, 并用SPSS 20.0软件对其进行单因素方差分析。结果显示, CSRP3基因在心脏表达量最高, 并极显著高于其他组织(P < 0.01);其次是臀大肌, 在肝脏中的表达量最低(图 10)。
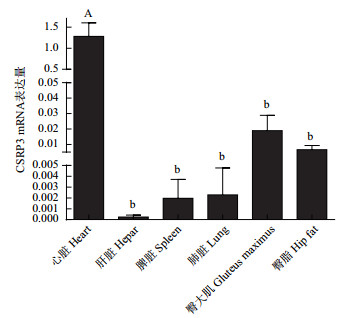
|
| 相同字母表示差异不显著(P>0.05);大写字母表示差异极显著(P<0.01);小写字母表示差异显著(P<0.05) 图 10 牦牛CSRP3基因的mRNA的组织表达分析 |
研究表明CSRP3基因能够参与调节肌肉发育, 其编码的CRP3蛋白可以通过蛋白质与蛋白质相互作用在肌肉发育过程中起重要调控作用。研究发现CSRP3基因在猪[11]、绵羊[1]、黄牛[13]、鸡[12]等畜禽的肌肉发育过程中发挥着重要作用, 说明该基因对畜禽生长性能和产肉品质具有重要影响。但关于牦牛CSRP3基因的相关研究尚未见报道, 而被誉为“高原之舟”的牦牛, 其肉质在很大程度上能决定其价值, 因此对牦牛CSRP3基因的研究具有重要意义。本研究成功克隆了CSRP3基因的CDS区序列并对其进行了生物信息学分析, 通过荧光定量PCR检测其在牦牛不同组织中的表达量。
对克隆得到的牦牛CSRP3基因序列进行分析, 发现该基因CDS区序列长585 bp, 编码194个氨基酸。甘氨酸具有独特的甜味, 是形成肉品香味所必需的前体氨基酸, 与肉质的鲜味有直接的关系, 同一种食物鲜味氨基酸含量越高, 滋味就越好[17]。赖氨酸作为必需氨基酸可以合成骨骼肌等多种蛋白, 抑制部分肌纤维蛋白质降解, 赖氨酸残基是骨胶原交联的主要构成物质, 羟赖氨酸参与胶原蛋白的糖基化修饰, 而胶原蛋白和钙磷等矿物质是构成骨骼的主要成分, 因此赖氨酸对骨骼代谢有重要影响[18]。半胱氨酸可以通过促进谷胱甘肽的合成来提高反刍动物的生长性能[19]。本研究显示牦牛CRP3蛋白甘氨酸、赖氨酸和半胱氨酸的含量分别为13.4%、10.3%和8.2%, 表明牦牛CSRP3基因对肌肉发育过程有一定调控作用并可能会影响其肉质和生长性能。带负电荷的残基总数(Asp + Glu)小于带正电荷的残基总数(Arg + Lys), 故CSRP3基因编码的蛋白质带正电荷, 该蛋白理论等电点为8.89, 是偏碱性蛋白, 其不稳定指数为40.16, 是不稳定蛋白, 对其亲水性/疏水性进行预测发现该蛋白为亲水性蛋白。预测结果显示, CSRP3基因编码的蛋白含有22个磷酸化位点, 2个N-糖基化位点和7个O-糖基化位点。磷酸化是一种广泛存在的重要的翻译后蛋白质修饰作用, 蛋白质磷酸化作用为调控蛋白质合成和代谢, 分子识别和信号传导, 肌肉收缩等, 糖基化属于蛋白修饰, 其作用是维持蛋白的空间构象, 调节细胞表面受体的表达和功能, 影响细胞生长和凋亡[20]。牦牛CRP3蛋白主要分布在细胞核中, 线粒体和细胞质中也有少量分布。有关研究表明[21], 在细胞核中, CRP3是肌生成的正向调控因子, 促进肌源性分化, CRP3过表达导致肌管分化增强, 这是由于CRP3与MyoD、肌原蛋白、MRF4等肌分化转录因子直接相关; 在细胞质中突变或缺乏CRP3会造成心脏细胞结构的严重破坏和肌纤维的紊乱, 这种细胞骨架效应主要是通过其在z盘上的定位及其与不同z盘组件的相互作用介导的, 说明CRP3蛋白在细胞核和细胞质中均可发挥作用。
CSRP3基因所属的CRPs基因家族是LIM结构域蛋白质超家族的一个分支, 该家族成员含有的典型结构域为LIM结构域, 对CRP3蛋白结构域的预测结果显示, 其含有两个LIM结构域, 与CRP3蛋白的三级结构预测结果一致。LIM结构域广泛存在于真核生物蛋白中, LIM由两个不同的锌指亚结构域组成, 其结构高度保守, 主要与蛋白质结合, 可以在细胞核和细胞质中介导蛋白质-蛋白质相互作用, 在信号转导、细胞分化和细胞骨架的形成中发挥重要作用。含有LIM结构域的CRP蛋白亚家族与细胞骨架相关, 在黏附斑块和肌动蛋白微丝组织中具有作用, 参与细胞骨架的重建和平滑肌的分化[22]。
实时荧光定量PCR检测结果显示, 牦牛CSRP3基因主要在心脏中表达; 其次是臀大肌。与He[13]发现CSRP3基因在黄牛肌肉中表达量最高; 其次是心脏的研究结果存在差异。这种差异表达可能是因为CSRP3基因在牦牛和黄牛肌肉细胞生长和分化中的调控机制存在差异; 也可能是所选取的发育阶段不同造成的; 另外也可能与牦牛生活在高海拔低氧地区, 心脏在高原低氧适应中扮演重要角色有关[23], 具体原因需要进一步研究。CRP3蛋白在心肌细胞和慢收缩骨骼肌细胞中均有表达[24], 研究发现CRP3是一种参与心肌细胞结构的蛋白质, siRNA沉默CSRP3基因之后, 可使由苯肾上腺素诱导的心肌细胞肥大和CSRP3过表达发生逆转, 说明CSRP3基因在心脏保护方面能够发挥重要作用[10]。CRP3蛋白在大鼠慢肌中组成性的表达, 在快肌中低表达, 并在快型骨骼肌蛋白转换为慢型骨骼肌蛋白过程中上调表达[25]。Vafiadaki等[26]发现了CRP3蛋白的剪接变异体(CRP3-b), CRP3-b定位于分化横纹肌的肌节, 可直接与z盘成分结合, 作为肌管形成的负调节因子参与肌发生过程。综上所述, 前人研究结果均表明CSRP3基因是心脏和骨骼肌功能的主要调节因子。本研究结果表明CRP3在牦牛臀大肌中具有较高表达量, 推测该基因在牦牛肉品质的调控中发挥着重要作用。
4 结论本研究成功克隆了牦牛CSRP3基因, 得到长为585 bp的CDS区序列, 编码194个氨基酸残基; 生物信息学分析结果显示, CRP3蛋白含有两个LIM结构域, 主要分布在细胞核中, 可正向调控肌肉发育过程; 实时荧光定量PCR结果显示牦牛CSRP3基因在臀大肌中具有较高表达量。以上研究结果为牦牛CSRP3基因在牦牛肉品质方面的调控机制研究提供了基础数据。
| [1] |
Guanqing L, Chunlan Z, Guizhi W, et al. Molecular cloning, characterization and tissue specificity of the expression of the ovine CSRP2 and CSRP3 genes from Small-tail Han sheep(Ovis aries)[J]. Gene, 2016, 580(1): 47-57. |
| [2] |
Arber S, Halder G, Caroni P. Muscle LIM protein, a novel essential regulator of myogenesis, promotes myogenic differentiation[J]. Cell, 1994, 79(2): 221-231. |
| [3] |
Barash I A, Mathew L, Lahey M, et al. Muscle LIM protein plays both structural and functional roles in skeletal muscle[J]. AJP Cell Physiology, 2005, 289(5): C1312-C1320. DOI:10.1152/ajpcell.00117.2005 |
| [4] |
Knöll R, Kostin S, Klede S, et al. A common MLP(muscle LIM protein)variant is associated with cardiomyopathy[J]. Circulation Research, 2010, 106(4): 695-704. DOI:10.1161/CIRCRESAHA.109.206243 |
| [5] |
Fatkin D, Graham RM. Molecular Mechanisms of Inherited Cardiomyopathies[J]. Physiological Reviews, 2002, 82(4): 945-980. |
| [6] |
Arber S, Hunter J J, Ross J, et al. MLP-deficient mice exhibit a disruption of cardiac cytoarchitectural organization, dilated cardiomyopathy, and heart failure[J]. Cell, 1997, 88(3): 393-403. DOI:10.1016/S0092-8674(00)81878-4 |
| [7] |
Buyandelger B, Ng K E, Miocic S, et al. MLP(muscle LIM protein)as a stress sensor in the heart[J]. Pflügers Archiv - European Journal of Physiology, 2011, 462(1): 135-142. DOI:10.1007/s00424-011-0961-2 |
| [8] |
Rashid M M, Runci A, Polletta L, et al. Muscle LIM protein/CSRP3:a mechanosensor with a role in autophagy[J]. Cell Death Discovery, 2015, 1: 15014. |
| [9] |
Arvanitis D A, Vafiadaki E, Papalouka V, et al. Muscle Lim Protein and Myosin Binding Protein C form a complex regulating muscle differentiation[J]. Biochimica et biophysica acta, 2017, 1864(12): 2308-2321. DOI:10.1016/j.bbamcr.2017.08.010 |
| [10] |
Carole O, Andreia G, Valérie N, et al. CSRP3 mediates polyphenols-induced cardioprotection in hypertension[J]. The Journal of Nutritional Biochemistry, 2019, 66: 29-42. DOI:10.1016/j.jnutbio.2019.01.001 |
| [11] |
Xu X, Qiu H, Du Z Q, et al. Porcine CSRP3:polymorphism and association analyses with meat quality traits and comparative analyses with CSRP1 and CSRP2[J]. Molecular Biology Reports, 2010, 37(1): 451-459. |
| [12] |
Han S, Cui C, Wang Y, et al. Knockdown of CSRP3 inhibits differentiation of chicken satellite cells by promoting TGF-β/Smad3 signaling[J]. Gene, 2019, 707: 36-43. DOI:10.1016/j.gene.2019.03.064 |
| [13] |
He H, Zhang H L, Li ZX, et al. Expression, SNV identification, linkage disequilibrium, and combined genotype association analysis of the muscle-specific gene CSRP3 in Chinese cattle[J]. Gene, 2014, 535(1): 17-23. |
| [14] |
张容昶. 中国的牦牛[M]. 兰州: 甘肃科学技术出版社, 1989.
|
| [15] |
蔡立. 中国的牦牛[J]. 西南民族大学学报:自然科学版, 1980(2): 1-5, 7-12. |
| [16] |
信金伟, 张成福, 姬秋梅, 等. 类乌齐牦牛产肉性能及肉品质分析[J]. 湖北农业科学, 2017, 56(3): 501-505. |
| [17] |
孙寿永, 张浩. 海门山羊不同部位肌肉中氨基酸含量的研究[J]. 中国畜牧兽医, 2012, 39(12): 77-81. DOI:10.3969/j.issn.1671-7236.2012.12.019 |
| [18] |
王一冰, 蒋守群, 苟钟勇, 等. 赖氨酸的生物学功能及肉鸡营养需要量的研究[J]. 广东畜牧兽医科技, 2018, 43(6): 17-20. DOI:10.3969/j.issn.1005-8567.2018.06.006 |
| [19] |
王丽慧.日粮不同水平半胱氨酸对滩寒杂交羊日增重、屠宰率与肉品质的影响[D].杨凌: 西北农林科技大学, 2015.
|
| [20] |
刘冠卿.小尾寒羊CSRP2、CSRP3和FSTL1基因克隆、结构特征及组织表达分析[D].泰安: 山东农业大学, 2015.
|
| [21] |
Vafiadaki E, Arvanitis DA, Sanoudou D. Muscle LIM Protein:Master regulator of cardiac and skeletal muscle functions[J]. Gene, 2015, 566(1): 1-7. |
| [22] |
孙向阳, 刘书宁, 侯照远, 等. LIM蛋白Ajuba的研究进展[J]. 药物生物技术, 2017, 24(3): 263-268. |
| [23] |
俞红贤, 莫重存. 青海牦牛心脏的比较解剖学特点[J]. 黑龙江畜牧兽医, 2000(6): 4-5. DOI:10.3969/j.issn.1004-7034.2000.06.002 |
| [24] |
Ehsan M, Jiang H, Thomson KL, et al. When signalling goes wrong:pathogenic variants in structural and signalling proteins causing cardiomyopathies[J]. Journal of Muscle Research and Cell Motility, 2017, 38(Pt 9): 303-316. |
| [25] |
Willmann R, Kusch J, Sultan K R, et al. Muscle LIM protein is upregulated in fast skeletal muscle during transition toward slower phenotypes[J]. AJP Cell Physiology, 2001, 280(2): C273-C279. |
| [26] |
Vafiadaki E, Arvanitis DA, Papalouka V, et al. Muscle lim protein isoform negatively regulates striated muscle actin dynamics and differentiation[J]. FEBS Journal, 2014, 281(14): 3261-3279. DOI:10.1111/febs.12859 |