2. 内蒙古圣牧控股有限公司, 巴彦淖尔 015000;
3. 宁夏上陵牧业有限公司, 青铜峡 751600
2. Inner Mongolia Shengmu Holdings Co. Ltd, Bayannaoer 015000;
3. Ningxia Shangling Animal Husbandry Co. Ltd, Qingtongxia 751600
围产期是从产前3周到产后3周, 这个阶段奶牛机体代谢发生巨大的变化[1]。主要体现在随着分娩的临近, 奶牛干物质的摄入不能满足自身能量消耗, 从而导致奶牛负能量平衡(Negative energy balance, NEB)[2]。NEB损害奶牛的健康和影响生产, 并导致免疫力下降[3]。当奶牛发生NEB时通常引起脂肪肝和酮病[4], 而这两种疾病均能造成肝功能的损伤[5-6]。肝脏是能量代谢的主要器官, 奶牛体内的糖代谢主要来自于肝脏糖异生[7]。天冬氨酸(Aspartic acid, ASP)、组氨酸、蛋氨酸、脯氨酸和丝氨酸的浓度在患有酮症的奶牛中下降[8]。这些氨基酸的浓度降低, 因为它们在糖异生过程中被大量使用[9-10]。而在分娩后的几天内, 乳腺对葡萄糖、氨基酸和脂肪的需求量成倍增加, 肝脏糖异生和脂肪动员的速度大大加快[11-12]。因此, 奶牛分娩后血浆代谢物发生显著变化, 影响奶牛的健康。代谢组学是一种高通量、高灵敏度的现代分析技术。目前, 代谢组学方法已成功地应用于奶牛产后血浆生物标志物的筛选[13]。
为此, 本研究通过对分娩当天和产后第7天血浆代谢组学研究, 探究分娩后早期奶牛血浆代谢物的变化情况, 探讨分娩后血液代谢组变化, 旨为了解分娩后血浆代谢物变化对奶牛健康状况提供参考。
1 材料与方法 1.1 材料 1.1.1 试验仪器和设备超高效液相:1290 UHPLC(美国Agilent公司); 高分辨质谱1:QTOF 6550(美国Agilent公司); 高分辨质谱2:Triple TOF 6 600(AB Sciex); 天平:BSA124S-CW(Sartorius); 研磨仪:JXFSTPRP-24(上海净信科技有限公司); 超声仪:PS-60AL(深圳市雷德邦电子有限公司); 纯水仪:明澈D24 UV(Merck Millipore); 色谱柱:ACQUITY UPLC BEH Amide 1.7 μm 2.1×100 mm(Waters)。
1.1.2 试验材料和试剂醋酸铵(CNW Technologies); 乙腈(CNW Technologies); 氨水(CNW Technologies); 甲醇(CNW Technologies); L-2-氯苯丙氨酸(上海恒柏生物科技有限公司)。
1.2 方法 1.2.1 试验动物分组和血液的采集保存在宁夏某大型集约化奶牛场, 选择15头2-3胎、预产期和体况相近(体况评分BCS 3.0-3.5)的健康荷斯坦奶牛, 奶牛奶产量(分娩当天由于采集初乳无法统计)和胎次的均值±SD, 见表 1。分别在分娩当天(A组)和产后第7天(B组)晨饲前(5:00-6:00)尾静脉采集血液10 mL, 使用肝素钠抗凝, 并以3 000 r/min离心10 min进行分离, 收集上层血浆于冷冻管中, 标记后置于-80℃冰箱冷冻保存, 以备后续分析。
参照张萌等[14]的代谢物提取方法。
1.2.2.2 上机检测使用的色谱柱为购自Waters的UPLC BEH Amide色谱柱(1.7 μm×2.1×100 mm)。进样体积为2 μL。按照表 2中的流动相参数在安捷伦1290超高效液相控制下进行分析。
控制软件(Analyst TF 1.7, AB Sciex)控制下AB 6600 Triple TOF & Agilent 6550 QTOF质谱仪基于IDA功能进行一级、二级质谱数据采集。每个数据循环采集中, 筛选出强度最强且大于100的分子离子进行采集对应的二级质谱数据。轰击能量:30 eV, 每50 ms15张二级谱图。ESI离子源参数设置如下:温度:650℃, 辅助气压:60 Psi, 气帘气压:35 Psi, 雾化气压(GS1):60 Psi, 喷雾电压:5 000 V(正离子模式)或-4 000 V(负离子模式)。
1.2.3 数据处理原始数据经ProteoWizard软件处理, 将数据转换成mzXML格式。采用XCMS程序对转化后数据进行峰对齐、提取峰面积和峰积分等处理工作。检查数据的完整性和缺失值状况, 补充或删除数据中的极值和数据中组内缺失值大于50%的离子峰。内标校正和归一化处理数据, 使得代谢物之间和各样本之间均可以进行平行比较。
1.2.4 统计学分析使用SIMCA软件对处理后数据进行模式识别和Pareto-scaling预处理。对处理后数据进行多元统计分析, 无监督主成分分析(Principal component analysis, PCA), 正交偏最小二乘判别分析(Orthogonal partial least squares-discriminant anal-ysis, OPLS-DA)。构建表达模型, 并对模型中的数据进行置换检验(Permutation test), 计算根据OPLS-DA模型得到变量投影重要度(Variable importance in the projection, VIP)。对数据进行单变量统计分析包括:变异倍数(Fold change, FC)和Students t-test分析。
1.2.5 差异代谢物鉴定和生物学信息学分析经过多元统计分析得到VIP大于1的值, 用产后第7天均值比上分娩当天均值得到FC值, 结合P值。以VIP > 1初步筛选出各组间的差异物, 单变量统计分析P < 0.05和FC > 1.3或FC < 0.77进一步筛选显著性差异代谢物。显著性差异代谢物使用Origin 8.0进行ROC Curve分析得到AUC面积大于0.8的代谢物。将筛选出的显著性差异代谢物在线分析平台MetaboAnalyst进行聚类分析和代谢通路分析。
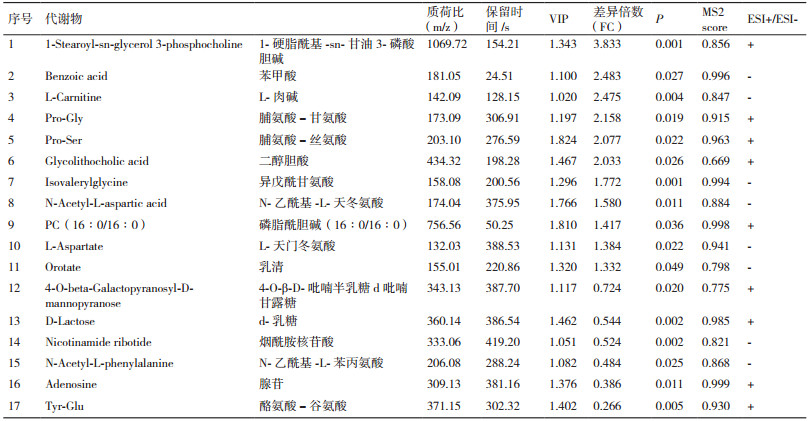
2 结果 2.1 代谢谱分析由图 1可知, QC样本TIC出峰保留时间和峰面积都重叠很好, 表明在整个实验过程中仪器稳定性很好。由图 2可知, QC样本相关性越接近于1, 说明整个方法稳定性越好数据质量越高。QC样本相关性很高, 表明数据质量很高。

|
| 图 1 QC样本TIC图 |
|
| 图 2 正离子和负离子QC样本相关性分析 |
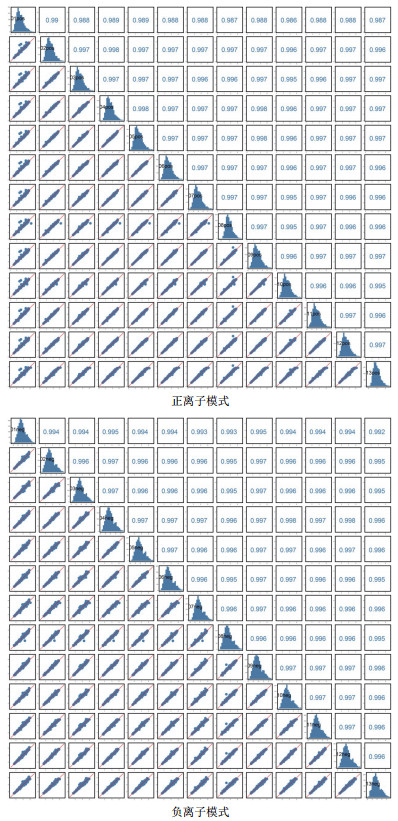
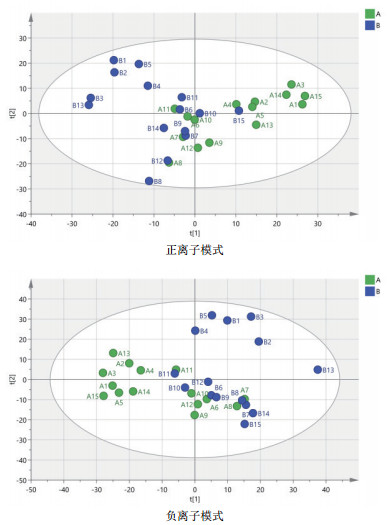
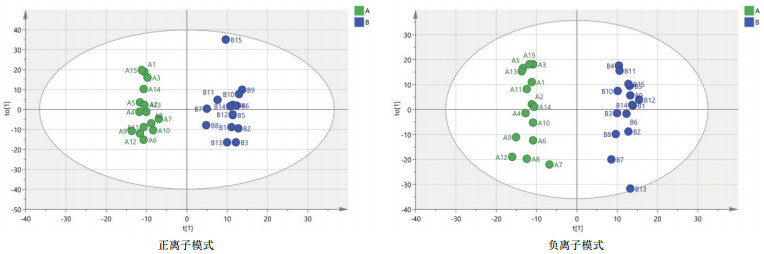
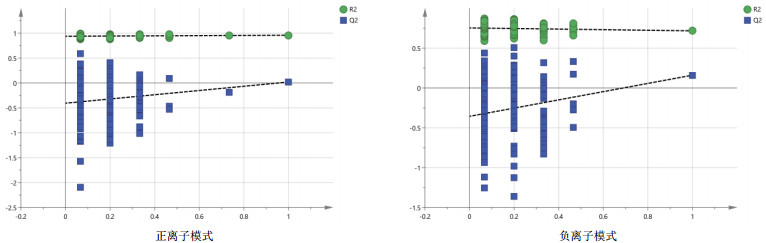
由图 3可知, 对分娩当天(A组)和产后第7天(B组)的PCA分析, 观察所有样本之间的总体分布趋势, 表明正、负离子模式数据下A组和B组有一定的分离趋势。由图 4可知, 建立A组和B组的OPLS-DA模型, 得到的模型评价参数正离子模式R2Y=0.959和负离子模式R2Y=0.973。R2越接近1表明模型越稳定可靠, 本试验正负离子均R2Y≥0.95, 表明模型稳定可靠。由图 5可知, 显示了基于正、负离子模式数据两组OPLS-DA模型的置换检验图, 正、负离子模式数据置换检验截距, 分别是Q2=-0.340(正离子模式)和Q2=-0.329(负离子模式)。Q2intercept < 0说明本试验正、负离子模式数据建立的OPLS-DA模型均未发生过度拟合。
|
| 图 3 A组和B组两两比较正、负离子模式下PCA图谱 |
|
| 图 4 A组和B组两两比较正、负离子模式下OPLS-DA图谱 |
|
| 图 5 A组和B组正、负离子模式下OPLS-DA模型置换检验图 |
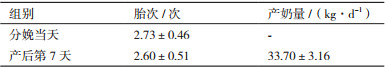
以VIP > 1、P < 0.05、FC > 1.3或FC < 0.77进一步筛选显著性差异代谢物。分娩当天和产后第7天两组共筛选出17种显著性代谢物。正离子模式下筛选出9个显著性差异代谢物, 其中4个代谢物产后第7天显著低于分娩当天组, 5个代谢物产后第7天显著高于分娩当天组(P < 0.05)。负离子模式下筛选出8个显著性差异代谢物, 其中2个代谢物产后第7天显著低于分娩当天组, 6个代谢物产后第7天显著高于分娩当天组(P < 0.05)。正、负离子模式下鉴定出的差异代谢物见表 3。
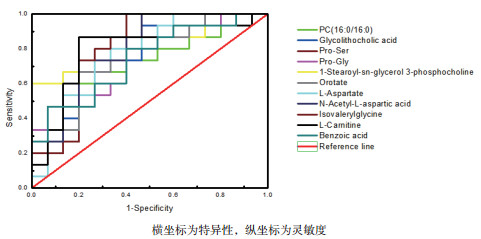
利用ROC曲线对显著性差异代谢物进行分析筛选, 考察这些显著性差异代谢物的分类识别能力。当ROC曲线下的面积(Area under curve, AUC)大于0.5识别能力较好, AUC值越接近于1, 识别效果越好。如图 6, 结果显示A组和B组共有11个代谢物AUC面积在0.8以上。筛选出11个代谢物产后第7天比分娩当天全部上调:磷脂酰胆碱(16:0/16:0)、二醇胆酸、脯氨酸-丝氨酸、脯氨酸-甘氨酸、1-硬脂酰基-sn-甘油3-磷酸胆碱、乳清、L-天冬氨酸、N-乙酰基-L-天冬氨酸、异戊酰甘氨酸、L-肉碱和苯甲酸。
|
| 图 6 11个显著性差异代谢物的ROC曲线 |
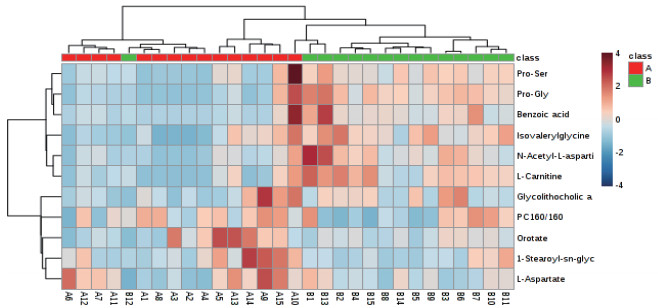
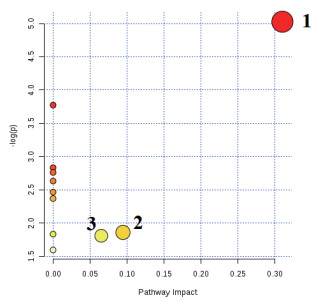
利用MetaboAnalyst分析平台对ROC曲线筛选出的显著性差异代谢物进行聚类分析和KEGG代谢通路分析。图 7显示了正负离子模式A组和B组显著性差异代谢物层次聚类结果。结果发现同组样品很好聚类在同一簇中, 聚在同一簇内的代谢物具有相似的表达模式, 表明筛选的显著性差异代谢物合理且准确。由图 8可知, A组和B组两组11个显著性差异代谢物共参与11种不同代谢通路。11个代谢通路分别是:丙氨酸, 天冬氨酸和谷氨酸代谢、亚油酸代谢、α-亚麻酸代谢、精氨酸生物合成、组氨酸代谢、泛酸和CoA生物合成、β-丙氨酸代谢、甘油磷脂代谢、花生四烯酸代谢、嘧啶代谢和氨基酰基-tRNA生物合成。主要代谢通路以影响力大于0.2(Pathway impact > 0.2)为筛选标准, Pathway impact > 0.2代谢通路丙氨酸, 天冬氨酸和谷氨酸代谢。甘油磷脂代谢和嘧啶代谢两组影响力相对较小(Pathway impact > 0.05)。
|
| 图 7 A组和B组显著性差异代谢物聚类热图 |
|
| 1.Alanine, aspartate and glutamate metabolism丙氨酸, 天冬氨酸和谷氨酸代谢; 2. Glycerophospholipid metabolism甘油磷脂代谢; 3. Pyrimidine metabolism嘧啶代谢; 横坐标为通路影响力, 纵坐标为-log(P值), 圆圈颜色越深代谢物通路中代谢物变化越显著, 圆圈越大小通路影响越大 图 8 A组和B组差异代谢物的代谢通路分析 |
N-乙酰-L-天冬氨酸(N-acetyl-aspartic acid, NAA)是存在于哺乳动物大脑中的游离氨基酸[15], 在线粒体由游离ASP乙酰化以乙酰辅酶A(CoA)为辅助因子合成[16]。NAA被认为是多种神经系统疾病的生物标志物[17]。ASP是一种重要的非必需氨基酸, 主要参与尿素循环、糖异生和苹果酸-天门冬氨酸穿梭等多种生化过程[18]。这些生化过程主要发生在肝脏, 当ASP含量降低时导致氨积累, 且引起肝脏损伤[19-20]。ASP含量的增加表明通过糖异生等过程产生的能量增加[19]。ASP的乙酰化可以促进其从线粒体中去除, 有利于谷氨酸转化为酮戊二酸, 从而进入三羧酸循环进行能量生产[16]。有研究表明丙氨酸、ASP和谷氨酸代谢在淋巴细胞再生和免疫过程中起着重要作用[21]。在本研究中NAA和ASP在产后第7天相对分娩当天上调, 可能是在丙氨酸, 天冬氨酸和谷氨酸代谢中参与能量代谢, 维持分娩后泌乳需要大量的能量。这可能是为了增加机体能量的产生, 减轻对肝脏的影响, 维持奶牛分娩后的机体健康。
3.2 甘油磷脂代谢磷脂酰胆碱(Phosphatidyl cholines, PC)是细胞膜的主要磷脂成分和生产脂质第二信使的底物[22], 也是肝脏三酰甘油(Triacylglyceride, TAG)分泌所必需的甘油磷脂[23]。PC主要参与甘油磷脂代谢, 甘油磷脂是比较复杂的代谢, 代谢中主要有PC和磷脂酰乙醇胺(PE)两种甘油磷脂[24]。而PE转化为PC是肝脏特异性的PC合成途径[25]。PC是促进肝脏中极低密度脂蛋白(Very low density lipoprotein, VLDL)转运甘油三酯必需的物质[26]。血液中PC水平的升高会导致奶牛肝脏中VLDL的分泌增加[27]。从妊娠到哺乳期血浆PC减少与产后脂肪肝的发展有关[28]。血浆中PC从泌乳早期到泌乳后期增加了10倍[29]。奶牛血浆中PC的浓度从分娩前2周开始下降, 分娩后开始上升到第4周达到高浓度[30]。有研究表明PC可以作为产后奶牛脂肪肝血浆脂质评价生物标志物[31]。本研究从分娩当天到产后第7天血浆PC浓度升高, 与前人研究结果一致。说明分娩后PC浓度增加, 使得奶牛肝脏中VLDL的分泌增加, 增强了TAG从肝脏中转运出来的速度, 降低了产后奶牛患脂肪肝的几率, 降低了奶牛分娩后负能量平衡的发生机率。
3.3 嘧啶代谢乳清酸(Orotic acid, OA)是核酸碱基的前体, 也是嘧啶合成的中间体。OA的多少与奶牛的来源、饮食和泌乳期有关[32]。比较泌乳奶牛和非泌乳奶牛乳腺组织表达时发现, OA是奶牛泌乳关键代谢产物, 泌乳组奶牛OA显著高于非泌乳组奶牛[33]。OA的再循环通常可以在肝脏中发生, 肝细胞将其吸收并转化为尿苷, 用于嘧啶循环途径[34]。嘧啶核苷酸合成的最后一步将OA转化为有活性的尿酶[35]。当肾脏受到严重损害时, 尿酶活性较低[36]。本研究产后第7天OA相比分娩当天浓度上调, 增加的OA可能是和泌乳密切相关, 升高的OA可能在嘧啶代谢中转化为尿酶, 从而降低对肾脏损伤, 有利于维持奶牛分娩后机体健康。
4 结论本研究通过分析分娩当天和产后第7天奶牛血浆代谢物, 发现产后第7天与分娩当天相比NAA、天冬氨酸、PC和OA上调。这些代谢物变化有利维持奶牛分娩后机体健康。
| [1] |
Fatima A, Waters S, Boyle PO, et al. Alterations in hepatic miRNA expression during negative energy balance in postpartum dairy cattle[J]. BMC Genomics, 2014, 15(1): 28. |
| [2] |
Shibano KI, Kawamura S. Serum free amino acid concentration in hepatic lipidosis of dairy cows in the periparturient period[J]. Journal of Veterinary Medical Science, 2006, 68(4): 393-396. |
| [3] |
Hammon DS, Evjen IM, Dhiman TR, et al. Neutrophil function and energy status in Holstein cows with uterine health disorders[J]. Veterinary Immunology and Immunopathology, 2006, 113(1-2): 21-29. |
| [4] |
Mulligan FJ, O'Grady L, Rice DA, et al. A herd health approach to dairy cow nutrition and production diseases of the transition cow[J]. Animal Reproduction Science, 2006, 96(3-4): 331-353. |
| [5] |
Minor DJ, Trower SL, Strang BD, et al. Effects of nonfiber carbohydrate and niacin on periparturient metabolic status and lactation of dairy cows[J]. Journal of Dairy Science, 1998, 81(1): 189-200. |
| [6] |
Bertoni G, Trevisi E, Han X, et al. Effects of inflammatory conditions on liver activity in puerperium period and consequences for performance in dairy cows[J]. Journal of Dairy Science, 2008, 91(9): 3300-3310. |
| [7] |
Mulligan FJ, Doherty ML. Production diseases of the transition cow[J]. Veterinary Journal, 2008, 176(1): 3-9. |
| [8] |
Marczuk J, Brodzki P, Brodzki A, et al. The concentration of free amino acids in blood serum of dairy cows with primary ketosis[J]. Polish Journal of Veterinary Sciences, 2018, 21(1): 149-156. |
| [9] |
Shibano KI, Kawamura S. Serum free amino acid concentration in hepatic lipidosis of dairy cows in the periparturient period[J]. Journal of Veterinary Medical Science, 2006, 68(4): 393-396. |
| [10] |
Maeda Y, Ohtsuka H, Oikawa MA, et al. Effect of the periparturient period on blood free amino acid concentration in dairy cows/healthy cows[J]. Journal of Veterinary Medicine and Animal Health, 2012, 4(9): 124-129. |
| [11] |
Kolk J, Gross JJ, Gerber V, et al. Disturbed bovine mitochondrial lipid metabolism:a review[J]. The Veterinary Quarterly, 2017, 37(1): 1-18. |
| [12] |
Bell AW. Regulation of organic nutrient metabolism during transition from late pregnancy to early lactation[J]. Journal of Animal Science, 1995, 73(9): 2804-2819. |
| [13] |
陶金忠, 郭延生. 奶牛产后血浆~1H-NMR代谢组学分析[J]. 畜牧兽医学报, 2016, 47(1): 198-206. |
| [14] |
张萌, 刘国林, 李向龙, 等. 围产前期添加山楂和黄芪混合物对奶牛血浆代谢组的影响[J]. 生物技术通报, 2019, 35(8): 127-137. |
| [15] |
Baslow MH. N-Acetylaspartate in the vertebrate brain:metabolism and function[J]. Neurochemical Research, 2003, 28(6): 941-953. |
| [16] |
Lu ZH, Chakraborty G, Ledeen RW, et al. N-Acetylaspartate synthase is bimodally expressed in microsomes and mitochondria of brain[J]. Molecular Brain Research, 2004, 122(1): 71-78. |
| [17] |
Moffett JR, Ross B, Arun P, et al. N-Acetylaspartate in the CNS:From neurodiagnostics to neurobiology[J]. Progress in Neurobiology, 2007, 81(2): 89-131. |
| [18] |
Liu MC, Gong XH, Quan YY, et al. A cell-based metabonomics approach to investigate the varied influences of chrysophanol-8-o-β-d-glucoside with different concentrations on L-02 cells[J]. Frontiers in Pharmacology, 2019, 9(1): 1-15. |
| [19] |
Li YX, Gong XH, Liu MC, et al. Investigation of liver injury of polygonum multiflorum thunb. in rats by metabolomics and traditional approaches[J]. Frontiers in Pharmacology, 2017, 11(8): 791-802. |
| [20] |
Lanpher BC, Gropman A, Chapman KA, et al. Urea cycle disorders overview[M]. University of Washington, Seattle GeneReviewsTM, 2005.
|
| [21] |
Jin ML, Zhang H, Wang JJ, et al. Response of intestinal metabolome to polysaccharides from mycelia of Ganoderma lucidum[J]. International Journal of Biological Macromolecules, 2019, 122(2): 723-731. |
| [22] |
Clem BF, Clem AL, Yalcin A, et al. A novel small molecule antagonist of choline kinase-α that simultaneously suppresses MAPK and PI3K/AKT signaling[J]. Oncogene, 2011, 30(30): 3370-3380. |
| [23] |
Saed S, Sina Z, Grilli Y, et al. Fatty liver develops with nonuniform changes in hepatic choline-containing sphingomyelins and phosphatidylcholines[C]. Reads Conference: ADSA Annual Meeting, 2018.
|
| [24] |
Myers WA, Rico JE, Davis AN, et al. Effects of abomasal infusions of fatty acids and one-carbon donors on hepatic ceramide and phosphatidylcholine in lactating Holstein dairy cows[J]. Journal of Dairy Science, 2019, 102(8): 1-15. |
| [25] |
Wu G, Aoyama C, Young SG, et al. Early embryonic lethality caused by disruption of the gene for choline kinase, the first enzyme in phosphatidylcholine biosynthesis[J]. Journal of Biological Chemistry, 2008, 283(3): 1456-1462. |
| [26] |
Vernon RG. Lipid metabolism during lactation:a review of adipose tissue-liver interactions and the development of fatty liver[J]. Journal of Dairy Research, 2005, 72(4): 460-469. |
| [27] |
Tharwat M, Iwasaki Y, Mizunuma Y, et al. Changes of very low-density lipoprotein concentration in hepatic blood from cows with fasting-induced hepatic lipidosis[J]. Canadian Journal of Veterinary Research, 2010, 74(4): 317-320. |
| [28] |
Bobe G, Young JW, Beitz DC. Invited review:pathology, etiology, prevention, and treatment of fatty liver in dairy cows[J]. Journal of Dairy Science, 2004, 87(10): 3105-3124. |
| [29] |
Artegoitia VM, Middleton JL, Harte FM, et al. Choline and choline metabolite patterns and associations in blood and milk during lactation in dairy cows[J]. PLoS One, 2014, 9(8): e103412. |
| [30] |
Imhasly S, Bieli C, Naegeli H, et al. Blood plasma lipidome profile of dairy cows during the transition period[J]. BMC Veterinary Research, 2015, 11(1): 252-264. |
| [31] |
Samii SS, Yu Z, Grilli E, et al. Lipidomics reveals phosphatidylcholines as candidate biomarkers for metabolic disease[C]. Reads Conference: ADSA Annual Meeting, 2017.
|
| [32] |
Anastasi G, Antonelli ML, Biondi A, et al. Orotic acid:a milk constituent[J]. Talanta, 2000, 52(5): 947-952. |
| [33] |
Sun HZ, Shi K, WU XH, et al. Lactation-related metabolic mechanism investigated based on mammary gland metabolomics and 4 biofluids metabolomics relationships in dairy cows[J]. BMC Genomics, 2017, 18(1): 936-950. |
| [34] |
Wang YM, Hu XQ, Xue Y, et al. Study on possible mechanism of orotic acid-induced fatty liver in rats[J]. Nutrition, 2011, 27(5): 571-575. |
| [35] |
Morkuniene K, Biziene R. Renata Detection of leukocyte adhesion defect uridine monophosphate synthase defect and complex vertebral deformity in holstein cattle[J]. Slovenian Veterinary Research, 2019, 56(2): 75-82. |
| [36] |
Dance N, Price RG, Cattell WR, et al. The excretion of N-acetyl-β-glucosaminidase and β-galactosidase by patients with renal disease[J]. International Journal of Clinical Chemistry, 1970, 27(1): 87-92. |