2. 上海农林职业技术学院, 上海 201600
2. Shanghai Vocational and Technical College of Agriculture and Forestry, Shanghai 201600
猪丹毒杆菌又称红斑丹毒丝菌(Erysipelothrix rhusiopathiae, ER), 是猪丹毒(Swine erysipelas)的病原。猪丹毒是一种急性、热性人兽共患传染病, 临诊特征主要为急性败血症、皮肤疹块、慢性心内膜炎和关节炎[1]。该病在美国、巴西、日本、澳大利亚和欧洲等大部分国家广泛流行, 既危害着全球养猪业, 造成了巨大的经济损失, 也威胁着人类健康。
20世纪80-90年代猪丹毒曾给我国养猪业造成了严重的危害[2]。该病得以有效控制20余年, 其逐渐淡出了人们的视线, 多数猪场停止接种猪丹毒疫苗。然而, 近年来猪丹毒在我国各地频频暴发, 猪群出现大面积急性感染死亡, 给很多养猪场造成了不小的经济损失。在广西、贵州、湖南、四川、福建、广东、安徽、云南等地均有猪丹毒散发的报道, 猪丹毒似乎又有卷土重来的态势[3-12]。
抗生素在猪丹毒等细菌性疫病的防治过程中发挥重要作用[13]。但是由于临床上不同程度存在滥用抗生素现象, 使得近年来在不同国家、不同地区及不同时期分离的猪斑丹毒杆菌的耐药性存在差异。本研究通过对2017-2018年华东地区猪场临床疑似猪丹毒的病/死猪进行细菌分离、分析其生化特性、血清型、小鼠毒力等生物学特征, 以及遗传进化分析、药物敏感性测定, 旨在了解当前该地区猪丹毒杆菌的生物学特性和耐药情况, 为当地猪场有效防控猪丹毒提供科学依据。
1 材料与方法 1.1 材料 1.1.1 菌株、主要试剂与实验动物商品化猪丹毒活疫苗(G4T10株, 血清1a型)、猪丹毒活疫苗(GC42株, 血清1a型)分别购自中牧实业股份有限公司和广东永顺生物制药股份有限公司。脑心浸液肉汤培养基(BHI)、绵羊血营养琼脂培养基、胰蛋白大豆肉汤培养基(TSB)购自英国Oxoid公司, 新生牛血清购自浙江天杭生物科技有限公司; 细菌基因组提取试剂盒、2×TaqPCR Master Mix、DNA胶回收试剂盒购自天根生物有限公司, DNA Marker DL2000、购自上海皓嘉科技发展有限公司; 革兰氏染色液和微量生化反应管均购自杭州天和微生物试剂有限公司。18种临床上常用的抗生素药敏试纸包括头孢噻呋(CEF)、头孢曲松(CRO)、青霉素(PEN)、氨苄西林(AMP)、复方新诺明(、SMZ)、林可霉素(LIN)、克林霉素(CLI)、氟苯尼考(FFC)、四环素(TET)、强力霉素(DOX)、链霉素(STR)、庆大霉素(GEN)、卡那霉素(KAN)、红霉素(ERY)、替米考星(TIL)、恩诺沙星(ENO)、环丙沙星(CIP)、多黏菌素B(PB)购自英国Oxoid公司。4周龄清洁级雌性昆明小鼠购自上海甲干生物有限公司。
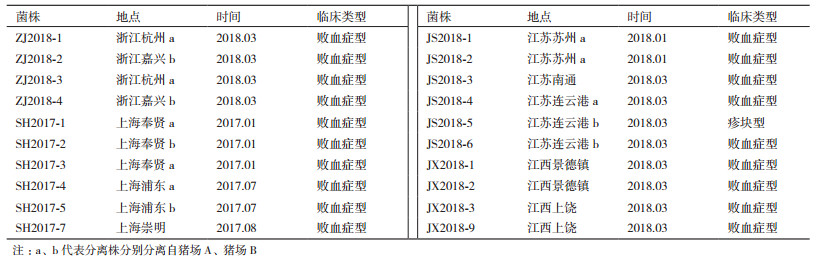
1.1.2 病料来源2017-2018年在上海、江苏、浙江和江西4个省市的20个非免疫规模化猪场采集的疑似猪丹毒的病/死猪心血、肺和脾等组织, 共计266份。并记录发病猪群来源、发病时间、猪的生长阶段及临床症状等流行病学背景资料(表 1)。
从病料组织无菌取样, 划线接种于5%绵羊血营养琼脂平板, 37℃培养24-48 h后, 挑取可疑形态的优势单菌落进行传代纯化, 然后挑取纯培养的单个典型菌落进行革兰氏染色镜检, 观察细菌的菌落形态和染色特征。
1.2.2 生化鉴定分离株的生化鉴定参考文献[8,14]和农业行业标准(猪丹毒诊断技术, NYT566-2002)[15]进行。将分离株的纯培养物分别进行靛基质试验、硫化氢试验和明胶穿刺试验、以及山梨醇、葡萄糖和乳糖等微量生化反应, 37℃(除明胶置室温之外)培养24-72 h, 观察、记录生化鉴定结果。
1.2.3 血清型鉴定按照文献[8,10]的方法制备猪丹毒抗原。具体如下:分别将猪丹毒分离株接种在含有10%新生牛血清的BHI培养基中, 37℃培养24 h, 加入终浓度为1%的甲醛溶液, 37℃灭活24 h, 然后在室温下静置24 h, 3 000 r/min离心30 min收集菌体, 弃上清, 用含0.5%甲醛的生理盐水溶液洗涤3次, 用2 mL蒸馏水重悬菌体后于121℃高压1 h, 待冷却至室温后, 3 000 r/min离心15 min, 收集上清, 寄送至英国爱丁堡大学猪病实验室鉴定分离菌株的血清型。
1.2.4 PCR鉴定16S rDNA的通用引物[16](27F:5'-AGAGTTTGATCCTGGCTCAG-3'和1492R:5'-TACGGCTACCTTGTTACGACTT-3')和猪丹毒杆菌Kmt1基因特异性引物(ER-F:5'- GTATTACTCATCACAGGCGG-3'和ER-R:5'- CCCAACAAATCCCGAAGCACC-3'), 由上海桑尼生物技术有限公司合成。利用细菌基因组提取试剂盒提取分离菌株的细菌基因组DNA, 按照王力波等[8]的方法进行PCR鉴定, 同时测定分离株的16S rDNA序列。将纯化后PCR产物送至上海英骏生物技术有限公司进行测序。将这些分离株的16S rDNA序列进行Blast比对, 然后应用DNAstar软件(Version 7.10, DNASTAR, Inc., Wisconsin, USA)进行16S rDNA基因序列同源性和遗传进化分析(Clustal W method, MegAlign)。
1.2.5 小鼠致病性试验将20株猪丹毒分离株分别接种于含有10%新生牛血清TSB培养基, 置37℃ 180 r/min振荡培养12-18 h, 3 000 r/min离心30 min收集菌体, 弃上清, 用无菌生理盐水洗涤菌体3次, 经菌落平板计数, 调整菌液浓度为1.0×108 CFU/mL, 取0.2 mL菌液分别于腹部内接种昆明小白鼠, 每个分离株接种10只, 并设立健康对照组, 注射等量的无菌生理盐水, 连续观察7 d, 每天观察并记录小鼠发病及死亡情况, 解剖死亡小鼠进行细菌的分离、鉴定。
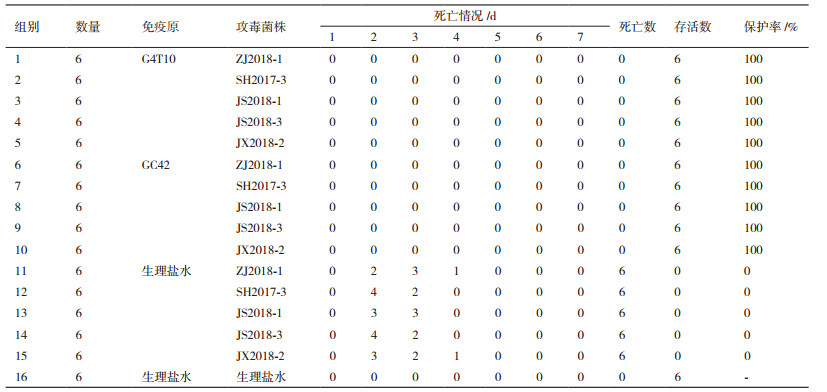
1.2.6 免疫保护实验选取具有地区代表性的5株猪丹毒分离株(ZJ2018-1、SH2017-3、SH2017-4、JS2018-3、JX2018-2)进行攻毒保护试验。将96只4周龄清洁级雌性昆明小鼠随机分为16组, 每组6只, 其中1-5组为G4T10活疫苗免疫组, 6-10组为GC42株活疫苗免疫组, 11-15组为5株猪丹毒分离株攻毒对照组, 16组为健康对照组。受试疫苗的免疫剂量、免疫程序参考文献[3]和疫苗的使用说明进行。两种活疫苗免疫组均采取背部皮下多点注射0.1 mL经生理盐水稀释的疫苗, 免疫剂量为106 CFU/0.1 mL, 间隔2周后加强免疫; 攻毒对照组和健康对照组均以同样方式注射等量生理盐水。二免后14 d, 活疫苗免疫组和攻毒对照组分别以腹腔注射方式接种致死剂量的猪丹毒杆菌分离株(104 CFU/只), 健康对照组以同样方式注射等体积生理盐水。连续观察7 d, 每天观察并记录小鼠死亡情况, 计算死亡率, 并解剖死亡小鼠进行细菌分离鉴定。
1.2.7 药敏试验根据抗菌机制不同, 选取猪场常用的10大类抗生素中临床上常见的18种抗生素的药敏试纸, 按照常规的纸片法操作[16]对上述20株猪丹毒杆菌进行药敏试验, 通过测量抑菌圈(mm)大小, 参照美国国家临床实验室标准委员会(NCCLS)提供的判断标准[17], 分析这些分离菌株的耐药情况。
2 结果 2.1 细菌的分离培养与染色镜检从采集的266份病料中分离到的20株疑似猪丹毒杆菌的病原菌, 分别编号为ER-1-ER-20, 分离株在绵羊血营养琼脂培养基上长成针尖大小、半透明、表面光滑、边缘整齐、直径1-2 mm的白色细小菌落, 有α溶血现象(图 1-A)。革兰氏染色镜检, 可见分离菌均为G+、弯曲或长丝状杆菌, 有的呈短链排列, 有的呈长丝形(图 1-B)。
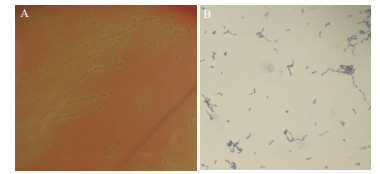
|
| A:分离株的菌落形态(400×); B:革兰氏染色镜检(1 000×) 图 1 猪丹毒临床分离株培养特征及形态特征 |
生化鉴定结果表明, 20株猪丹毒分离株均符合猪丹毒杆菌的生化特征(表 2)。
20株猪丹毒分离株的血清型均为1a型, 仅与1a型标准血清发生凝集反应, 与其余标准血清均未观察到凝集反应。
2.4 PCR鉴定与16S rDNA的序列分析 2.4.1 PCR鉴定应用ER的特异性引物对20株分离株进行PCR扩增, 目的片段长度均为1 038 bp。分离株16S rDNA的PCR扩增片段长度均约为1 400 bp, 与预期相符(图 2)。
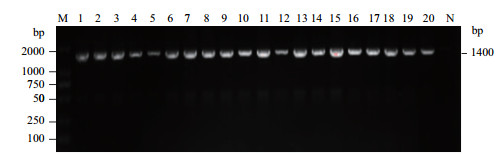
|
| 1-20:分离株的PCR扩增产物; M:DL2000 DNA分子量标准; N:阴性对照 图 2 猪丹毒杆菌分离株的PCR鉴定结果 |
20株猪丹毒分离株的16S rDNA经序列测定与分析, 发现这些分离株的核苷酸序列同源性为99.7%-100%, 其中本研究所得20个分离株中有10株与本地区其他的分离株的同源性为100%;与国外参考株ATCC19414等的核苷酸序列同源性为99.4%-100%;与四川ZJ株(2016)、广西GXBY-1株(2012)、江苏SY1027株(2010)、黑龙江ZYL株(2010)和湖南YZ12.2株(2012)等国内分离株的核苷酸序列同源性为99.6%-100%。其中, 浙江杭州ZJ2018-1株和嘉兴ZJ2018-2株与乌拉圭2007年人源分离株(EU188793)同源性达100.0%;江西上饶JX2018-9株与英国2012年绵羊分离株(T127_5)同源性达99.9%;江苏连云港JS2018-4株与江苏猪源分离株(SY1027)同源性也达99.9%。如图 3所示, 除GD-GZ外, 分离株、参考菌株核苷酸序列同源性均很高, 处在同一个进化树分支上。

|
| 图中分别为菌株、登陆号、来源、时间、地点; 红色标示部分为本研究分离的猪丹毒菌株 图 3 分离株与参考菌株16S rDNA基因序列的系统进化树 |
20株猪丹毒分离株攻毒组小鼠在接种36 h后, 出现精神萎靡, 食欲下降, 被毛松乱, 蜷缩等症状, 均在72 h内相继死亡, 剖检可见败血性出血, 脾肿大、充血、肺出血、肝点状坏死及出血。用含有5%血清绵羊血营养琼脂从死亡小鼠的心血、脾和肝等组织中分离细菌, 分离到的细菌经镜检与PCR鉴定均与接种的菌株一致。对照组小鼠未见异常。
2.6 免疫保护实验5株猪丹毒分离株攻毒对照组小鼠在攻毒后第2天开始出现明显临床症状, 并相继死亡。从死亡小鼠的心血、脾和肝中均分离到猪丹毒杆菌。对照组小鼠均正常。G4T10活疫苗和GC42株活疫苗免疫组小鼠全部存活, 没有出现任何临床症状, 保护率为100%(表 3)。
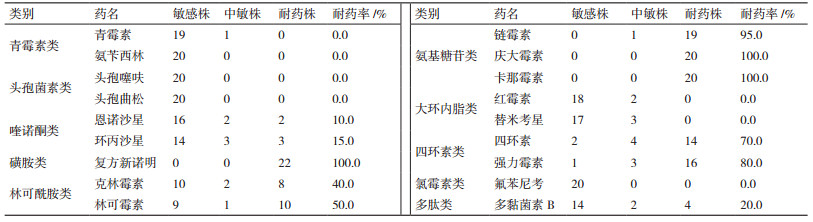
由表 4可知, 20株ER均对青霉素、氨苄西林、头孢噻呋、头孢曲松、红霉素、替米考星和氟苯尼考高度敏感。这些抗生素可作为该地区防治猪丹毒的首选药物。依据NCCLS的判定标准, 这些抗生素的耐药率大小依次为:复方新诺明、庆大霉素、卡那霉素(100%)>链霉素(95%)>强力霉素(80%)>四环素(70%)>林可霉素(50%)>克林霉素(40%)>多黏菌素B(20%)>环丙沙星(15%)>恩诺沙星(10%)。总体而言, 本研究中ER对氯霉素类、β-内酰胺类药物、大环内酯类药物敏感, 对氨基糖苷类、磺胺类药物表现为耐药, 对林可酰胺类、喹诺酮类、多肽类和四环素类抗生素也存在不同程度的耐药。
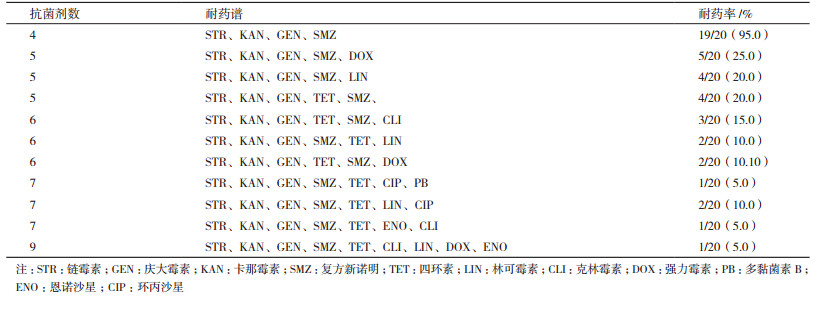
这些分离株进行多重耐药性分析, 结果显示它们有11种ER的耐药谱型, 耐受4-7种的抗生素的菌株约占80%, 其中, 19个分离株均能耐4种抗生素, 还有1株同时耐9种药物(表 5)。
目前已发现猪丹毒杆菌血清型存在1a、1b、2-24及N型26个血清型, 其中15种可感染猪[1]。不同血清型的菌株致病力存在差异性, 毒力最强是1型, 能引起急性败血型猪丹毒, 2型毒力较弱, 主要引起疹块型或关节炎型猪丹毒[2]。近年来, 日本、美国等国猪丹毒的发生明显增多, 在临床上分离猪丹毒杆菌血清型多是1a型和2型[18]。我国猪群中流行的猪丹毒杆菌血清型主要为1a型、1b型和2型[2,19]。20世纪80年代, 徐克勤等[19]对我国部分猪场猪丹毒杆菌进行血清型鉴定, 结果表明血清型主要为1a型和2型。本研究中20株猪丹毒杆菌的血清型经鉴定均为1a型, 而且以急性败血型为主(95%), 仅有1株为疹块型(5%), 与以前的调查结果一致[10,20], 然而, 这与美国、日本等国猪群中主要为关节炎型的报道不一样[21-22]。小鼠致病性试验也显示20株猪丹毒杆菌分离株均能致死小白鼠, 与临床病例一致。由此可见, 华东地区猪场流行的猪丹毒杆菌仍为毒力较强的1a型。
疫苗接种是预防猪丹毒最有效的方法[1], 目前我国猪丹毒商品化疫苗有GC42株和G4T10株弱毒活菌苗、猪瘟-猪丹毒-猪肺疫三联活疫苗和灭活菌苗等。一些报道显示部分猪丹毒分离株出现了一些变异[6]。此次在华东地区卷土重来的猪丹毒杆菌的毒力是否也发生变异, 我国现有的商品化疫苗对临床流行毒株是否有免疫保护作用。针对这些问题, 本研究选用临床上常用的猪丹毒活疫苗(G4T10株和GC42株)分别免疫小鼠后, 选取具有地区代表性的5株猪丹毒分离株(ZJ2018-1、SH2017-3、SH2017-4、JS2018-3、JX2018-2)进行攻毒保护试验。结果显示5株猪丹毒分离株攻毒对照组小鼠均出现明显临床症状, 并相继全部死亡。G4T10活疫苗和GC42株活疫苗免疫组小鼠全部存活, 没有出现任何临床症状, 保护率均为100%, 这与陆萍等[3]的攻毒保护试验结果相符。此外, spaA基因编码的SpaA蛋白是猪丹毒杆菌的主要免疫保护性抗原, 魏文涛等[10]发现临床分离的42株猪丹毒杆菌分离株(1a型)与猪丹毒弱毒苗G4T10株(1a型)和GC42株(1a型)的spaA基因的相似性很高, 核苷酸同源性为98.5%-99.9%。由此可见, 当前的猪丹毒GC42株和G4T10株弱毒疫苗对我国猪群中流行的1a型猪丹毒杆菌依然有效。猪丹毒在我国局部暴发一个主要原因是疏于防范, 没有进行猪丹毒疫苗免疫。当然, 一些免疫抑制性病毒如猪圆环病毒2型、猪蓝耳病毒和非洲猪瘟等也会对猪丹毒的流行起到推波助澜的作用。因此, 科学合理接种猪丹毒疫苗, 可有效地预防猪丹毒的发生。
猪丹毒杆菌是一种人畜共患的病原菌, 可感染猪、羊、鱼等多种动物引发丹毒[2], 人感染后表现为“类丹毒”[1]。值得注意的是, 本研究中浙江杭州ZJ2018-1株和嘉兴ZJ2018-2株与乌拉圭2007年人源分离株(EU188793)同源性达100.0%;江西上饶JX2018-9株与英国2012年绵羊分离株(T127_5)同源性达99.9%, 而且小鼠致病性试验表明这些分离菌株均为急性败血型强毒株。同时, 这些猪丹毒杆菌分离菌与四川ZJ株(2016)、广西GXBY-1株(2012)、江苏SY1027株(2010)、黑龙江ZYL株(2010)和湖南YZ12.2株(2012)等国内分离株以及与国外参考株ATCC19414的核苷酸序列同源性为99.4%-100%, 表明华东地区猪丹毒杆菌变异性较小, 处在同一个进化树分支上。可见, 我国的致病猪丹毒杆菌存在跨地区传播的可能。猪丹毒杆菌抵抗能力极强, 广泛存在在环境中, 有跨区域传播的风险[23], 因此, 要重视猪丹毒病的防治, 加强猪场生物安全管理, 并且针对猪等主要传染源采取有效措施。
不同地区、不同时期猪丹毒杆菌分离株对常规药物的敏感性存在差异。因此, 对于来自于不同地区、不同时期的不同菌株均需要进行敏感药物的筛选显得极为重要。本研究中ER对β-内酰胺类药物、氯霉素类和大环内酯类药物高度敏感, 这与以往的国内报道[3,11]相一致, 所有菌株均对青霉素、氨苄西林、头孢噻呋、头孢曲松、红霉素、替米考星和氟苯尼考敏感, 这7种药物可作为该地区控制本病的首选药物。然而由于临床上长期滥用抗生素, 使得我国猪场中猪丹毒杆菌产生了较强的耐药性且出现了多重耐药菌株, 并且耐药菌株广泛传播[13]。斯特劳《猪病学》第9版中描述的猪丹毒对四环素、林可霉素有很好的疗效[1], 王力波等[8]发现2012年广西地区的猪丹毒分离菌株较之20世纪50-80年代的4株参考毒株, 对四环素、林可霉素、诺氟沙星敏感性出现显著差异, 敏感程度下降, 已对氨基糖苷类、多肽类、磺胺类等药物表现为耐药。陆萍等[3]报道了2012-2013年安徽地区的29株猪丹毒杆菌仅对氨苄西林、头孢曲松敏感率达100%, 而对青霉素、红霉素和头孢噻肟的敏感率出现了下降, 分别为93%、89.7%、75.9%, 且对其他13种药物也表现不同程度的耐药性。姚焱彬等[4]进一步分析了2012-2015年安徽地区的42株猪丹毒分离菌株的耐药性发现, 虽对青霉素、氨苄青霉素、头孢噻肟、头孢曲松等抗生素的敏感率均高于80%, 但100%的菌株可耐受4种及以上的药物, 耐受5种及以上药物的比例达95.2%, 其中耐庆大霉素+卡那霉素+链霉素+克林霉素+林可霉素占81%。本研究中ER对对氨基糖苷类、磺胺类药物表现为耐药, 对林可酰胺类、喹诺酮类、多肽类和四环素类抗生素也存在不同程度的耐药, 而且也存在多重耐药性, 耐受4-7种的抗生素的菌株约占80%, 还有1株同时耐9种药物。郭良兴等[7]、胡晓芬等[24]、杨佳冰等[11]分别在吉林、湖北和宁夏地区也发现一些临床分离菌株对β-内酰胺类药物敏感性下降, 甚至对氨苄西林、阿莫西林、头孢噻肟等不同程度耐药。由此可见, 虽然青霉素类药物仍是防治猪丹毒的首选药物, 但是临床分离菌株对青霉素、氨苄西林、头孢噻呋、头孢曲松、红霉素等敏感药物敏感性下降, 显示具有产生耐药性的趋势, 对四环素类、林可酰胺类、喹诺酮类的耐药率较以往的报道明显增高, 这可能是由于抗菌药物选择的压力所导致。因此, 适时监控猪丹毒杆菌的耐药性及其变化趋势, 药敏试验筛选药物, 合理、科学、规范用药, 完善兽药的监管制度, 有利于控制和减少耐药菌株的产生, 这对有效防控猪丹毒具有重要的意义[4]。
猪丹毒的临床症状与非洲猪瘟非常类似, 均表现为高热、皮肤发红及脾脏、淋巴结等内脏器官出血, 有时候容易混淆, 两者鉴别与确诊还需要借助于实验室诊断[1]。尽管猪只都会急性死亡, 但是猪丹毒的死亡率通常比非洲猪瘟低得多。本研究利用细菌的分离培养及形态学检查、生化试验、PCR鉴定和动物回归试验, 确定源自上海、江苏、浙江和江西4个省市猪场临床疑似猪丹毒病/死猪中的分离菌均为猪丹毒杆菌, 而且进一步结合其他细菌和病毒的检测排除、临床上敏感抗生素治疗与疫苗免疫的实际控制成效, 确诊这几起疫情均由猪丹毒杆菌引起。
4 结论本研究从2017-2018年华东地区猪场临床疑似猪丹毒感染的266份病料中分离鉴定出20株猪丹毒杆菌, 均为能100%致死小白鼠的1a型, 具有猪丹毒杆菌的生化特性, 16S rDNA序列与国内外参考菌株、临床流行株的同源性达99%以上; 现有商品化猪丹毒弱毒疫苗对流行的强毒株可提供完全的免疫保护; 所有菌株对氨基糖苷类、磺胺类药物表现为耐药, 对林可酰胺类、四环素类、喹诺酮类和多肽类也存在不同程度的多重耐药, 对青霉素、氨苄西林、头孢噻呋、头孢曲松、红霉素、替米考星和氟苯尼考敏感, 这7种药物可作为该地区控制本病的首选药物。
| [1] |
斯特劳BE.猪病学[M].第9版.赵德明, 张仲秋, 译.北京: 中国农业出版社, 2000.
|
| [2] |
陈溥言. 兽医传染病学[M]. 北京: 中国农业出版社, 2007.
|
| [3] |
陆萍, 黄晓慧, 李春芬, 等. 安徽部分地区猪丹毒杆菌的分离鉴定及生物学特性研究[J]. 微生物学通报, 2014, 41(9): 1822-1828. |
| [4] |
姚焱彬, 卜凡, 魏文涛, 等. 2012年~2015年安徽地区猪丹毒的流行特征及病原分离株药物敏感性分析[J]. 中国预防兽医学报, 2017, 39(5): 374-378. |
| [5] |
车勇良, 陈如敬, 王隆柏, 等. 猪丹毒杆菌的分离鉴定及其SpaA基因的遗传变异分析[J]. 中国兽医学报, 2011, 31(1): 1591-1593. |
| [6] |
徐锋, 王晓旭, 张维谊, 等. 上海地区屠宰场猪红斑丹毒丝菌的分离鉴定[J]. 中国畜牧兽医, 2017, 44(1): 227-235. |
| [7] |
郭良兴, 陈克研, 赵魁, 等. 猪丹毒杆菌的分离鉴定及耐药性试验[J]. 中国畜牧兽医, 2011, 38(4): 199-202. |
| [8] |
王力波, 刘芳, 谢江, 等. 猪丹毒杆菌血清型鉴定及药敏特性研究[J]. 家畜生态学报, 2016, 37(2): 60-66. |
| [9] |
曾文斌, 刘悦欣, 王萍, 等. 急性死亡猪中猪丹毒杆菌的分离鉴定[J]. 中国畜牧兽医, 2015, 42(3): 752-756. |
| [10] |
魏文涛, 姚焱彬, 李郁, 等. 2012-2015年江淮地区猪丹毒杆菌分离株血清型、spaA基因遗传进化及PFGE基因型分析[J]. 微生物学通报, 2017, 44(3): 664-672. |
| [11] |
杨佳冰, 吴亚文, 王晓亮, 等. 一例病死猪猪丹毒杆菌分离鉴定及药敏试验[J]. 黑龙江畜牧兽医, 2014, 1(2): 73-74. |
| [12] |
赵墩, 魏榕, 刘晓波, 等. 一株猪丹毒杆菌的分离鉴定及其致病性实验[J]. 湖南畜牧兽医, 2015, 185(1): 18-21. DOI:10.3969/j.issn.1006-4907.2015.01.008 |
| [13] |
Opriessnig T, Bender JS, Halbur PG. Development and validation of an immunohistochemical method for rapid diagnosis of swine erysipelas in formalin-fixed, paraffin-embedded tissue samples[J]. J Vet Invest, 2010, 22(1): 86-90. |
| [14] |
RE布坎南, NE吉本斯, 等.中国科学院微生物研究所译.伯杰细菌鉴定手册[M].第八版.北京: 科学出版社, 1984,827-828.
|
| [15] |
中华人民共和国农业部.猪丹毒诊断技术, 中华人民共和国农业行业标准NY/T566-2002[S]. 2002-08-27.
|
| [16] |
刘东良, 钟登科, 李蓓蓓, 等. 上海市猪源多杀性巴氏杆菌分离鉴定及其耐药性分析[J]. 中国动物传染病学报, 2016, 24(6): 20-25. |
| [17] |
Wayne PA. Performance standards for antimicrobial susceptibility testing[C]. Ninth informational supplement NCCLS document M100-S9. National Committee for Clinical Laboratory Standards, 2009.
|
| [18] |
Ozawa W, Yamamoto K, Kojima A, et al. Etiological and biological characteristic of Erysipelothrix rhusiopathiae isolated between 1994 and 2001 from pigs with swine erysipelas in Japan[J]. J Vet Med Sci, 2009, 71(6): 697-702. DOI:10.1292/jvms.71.697 |
| [19] |
徐克勤, 胡秀芳, 陆琴英. 我国不同地区分离的猪丹毒杆菌血清型鉴定[J]. 江苏农业科学, 1982, 6(6): 35-38. |
| [20] |
Zou Y, Zhu XM, Muhammad HM, et al. Characterization of Erysipelothrix rhusiopathiae strains isolated from acute swine erysipelas outbreaks in Eastern China[J]. J Vet Med Sci, 2015, 77(6): 653-660. DOI:10.1292/jvms.14-0589 |
| [21] |
Opriessnig T, Hoffman L J, Harris DL, et al. Erysipelothrix rhusiopathiae:genetic characterization of midwest US isolates and live commercial vaccines using pulsed-field gel electrophoresis[J]. J Vet Invest, 2004, 16(2): 101-107. |
| [22] |
To H, Sato H, Tazumi A, et al. Characterization of Erysipelothrix rhusiopathiae strains isolated from recent swine erysipelas outbreaks in Japan[J]. J Vet Med Sci, 2012, 74(7): 949-953. DOI:10.1292/jvms.11-0533 |
| [23] |
张蓉, 藤原孝彦. 隔绝猪丹毒感染和传播的途径[J]. 国外畜牧学-猪与禽, 2013, 33(2): 18-21. |
| [24] |
胡晓芬, 王静, 熊剑锋, 等. 一起猪丹毒丝菌病例的临床分离鉴定及诊治[J]. 养猪, 2014, 4(2): 107-109. DOI:10.3969/j.issn.1002-1957.2014.02.054 |