2. 中国科学技术大学, 合肥 230026;
3. 淮南新能源研究中心, 淮南 232001
2. University of Science and Technology of China, Hefei 230026;
3. Huainan New Energy Research Center, Huainan 232001
N-乙酰神经氨酸(N-acetylneuraminicacid, Neu5Ac)是一种具有吡喃糖结构的酸性氨基糖, 是细胞膜蛋白的重要组成部分, 参与细胞表面多种生理功能[1]。如提高婴幼儿智力和记忆力[2]、抗老年痴呆[3]、用作治疗病毒感染的药物[4]、检测恶性肿瘤的诊断试剂[5]。鉴于此, 研究Neu5Ac的工业化生产方法显得十分重要。
Neu5Ac的生产方法主要包括天然抽提法[6]、化学合成法[7]、微生物发酵法[8-10]和生物酶法[11-14]等。天然抽提法产率低; 化学合成法反应条件苛刻, 污染环境; 微生物发酵法周期长, 不易分离纯化; 生物酶法反应条件温和、产率高、副产物较少, 属于环境友好型方法。而目前Neu5Ac的酶法制备主要是以N-乙酰葡萄糖胺(N-acetyl glucosamine, GlcNAc)和丙酮酸(Pyruvic acid, Pyr)为底物, 先利用N-乙酰葡萄糖胺差向异构酶(N-acetyl-D-glucosamine 2-epimerase, AGE)将GlcNAc异构成N-乙酰甘露糖胺(N-acetyl-D-manosamine, ManNAc), 再通过N-乙酰神经氨酸醛缩酶(N-acetylneuraminic acid aldolase, NAL)催化ManNAc和Pyr生成Neu5Ac。
由上可知, NAL是酶法制备Neu5Ac途径中的关键酶。相比较于游离酶, 固定化酶可以较大程度上弥补稳定性差、产物抽提困难和不可重复利用等缺点[15-18], 更符合工业规模化生产的要求。酶的固定化方法主要包括物理吸附法、包埋法、直接交联法和共价结合法。其中共价结合法主要是通过形成共价键将酶与载体结合在一起, 优势主要在于操作简单、稳定性强、易回收。氨基树脂是一种高度多孔的固定化载体, 经戊二醛活化后, 具有高比面积, 载酶量大, 酶活高, 机械强度高, 使用周期数多等优点[19-23]。戊二醛作为双官能团交联剂在酶的固定化技术中心有着广泛的应用, 它可以将酶和载体与官能团共价连接[16-18]。
虽然已有文献对于NAL的固定化进行了报道, 但选用的是Eupergit® C等[24-25]国外进口或实验自制, 并不能满足工业化大规模生产的需求。本研究通过对市面上常见的环氧树脂和氨基树脂进行筛选, 选择了国产商业化氨基树脂载体LX-1000HFA对NAL进行固定化工艺研究, 优化了固定化过程中的反应条件, 确定了最佳固定化条件, 极大地提高了酶的稳定性, 还对游离酶与固定化酶的酶学性质进行了比较, 以期对工业化大批量生产Neu5Ac提供数据参考和理论支持。
1 材料与方法 1.1 材料 1.1.1 菌株本研究所用菌株为大肠杆菌BL21(DE3)工程菌, 由实验室构建并保藏, 基因来源于大肠杆菌W3110菌株, 并克隆到pET24a载体上。
1.1.2 仪器与试剂仪器:ZWY-211B恒温摇床, 上海智诚; 5 L发酵罐:上海保兴; FE28 pH计, 瑞士梅特勒; JY96超声破碎仪, 宁波新芝; 3H16R1高速冷冻离心机, 湖南赫西; LC-15c液相色谱仪, 日本岛津; MB-580多功能酶标分析仪, 深圳汇松。
试剂:ES-1、ES-103B、ES-108、ESR-1, 天津南开和成; LX-1000EA、LX-1000EP、LX-1000HA、LX-1000HFA、LX-1000EP, 西安蓝晓; N-乙酰甘露糖胺、N-乙酰神经氨酸、N-乙酰葡萄糖胺, 分析标准品; 蛋白胨, BR级, 英国OXOID; 酵母浸粉, BR级, 英国OXOID; 琼脂粉、硫酸卡那霉素, BR级, 上海国药; Bradford蛋白浓度测定试剂盒, 北京索莱宝; 其他试剂皆为国产分析纯。
1.1.3 培养基LB液体培养基(g/L):酵母浸粉5, 蛋白胨10, 氯化钠10, 必要时加入琼脂粉20制备LB固体培养基。高压蒸汽灭菌121℃, 30 min。待冷却至50-60℃, 使用前加入卡那霉素使得终浓度为30 μg/mL。
TB液体培养基(g/L):酵母浸粉24, 蛋白胨12, 磷酸二氢钾2.31, 三水磷酸氢二钾16.43, 甘油5.04, 高压蒸汽灭菌121℃, 30 min。待冷却至50-60℃, 使用前加入卡那霉素使得终浓度为30 μg/mL。
5 L罐发酵培养基(g/L):蛋白胨12, 酵母浸粉8, 磷酸氢二钾4, 氯化钠3, 硫酸铵2.5, 甘油10, 硫酸亚铁0.3, 柠檬酸2.3, 硫酸镁0.49。高压蒸汽灭菌121℃, 30 min。其中硫酸镁单独灭菌。硫酸亚铁和异丙基硫代半乳糖苷(IPTG)均于超净台中用无菌注射器和0.22 μm过滤。发酵过程中加入IPTG, 至终浓度为0.1 mmol/L。
补料培养基(g/L):蛋白胨22.5, 酵母浸粉75, 甘油300。高压蒸汽灭菌121℃, 30 min。
1.2 方法 1.2.1酶活的测定酶活定义:以37℃, pH7.5条件下, 1 min内产生1 μmol N-乙酰神经氨酸所需的酶量定义为一个酶活单位(U)。
酶活测定:采用高效液相色谱法分别测定游离酶和固定化酶的酶活[19]。HPLC条件:色谱柱:Aminex HPX-87H;柱温:60℃; 流动相:5 mmol/L H2SO4; 流动相流速:0.60 mL/min; 紫外检测器波长为210 nm; 进样量10 μL。相对酶活:在同一批实验组中, 以测得最高酶活的实验组数值为100%, 其余实验组与之的比值(%)为相对酶活。
 (1)
(1)
式(1)中, T为用于固定化的粗酶液的总酶活, A1为固定化酶的总酶活, A2为抽滤上清的总酶活。
1.2.2 粗酶液的制备将保藏菌种画线接种至固体LB平板上活化, 37℃培养过夜。然后从平板上挑取一环菌种, 将其接种至LB液体种子培养基中, 37℃、200 r/min条件下培养20 h, 即为一级种子液; 按1%接种量将一级种子液转接至TB培养基, 37℃培养5 h。
发酵产酶:全自动5L发酵罐装液量3L, 接种量为5%, 起始温度37℃, 补料后降至25℃, 起始通气量1 vvm, 进气压力调整为0.06 MPa, 设置起始转速为200 r/min, 保持溶氧不低于30%, 并待pH和溶氧回升时开始匀速补料, 补料速度为4.2 g/L*h。发酵过程通过25%(M/V)氨水控制pH为7.0, 发酵时间约为24 h。
发酵液于4℃, 6 000 r/min离心15min, 弃去上清得到湿菌体。称取湿菌体重悬于100 mmo/L磷酸钾缓冲液(pH8.0)使得菌体终浓度为100 g/L, 超声波破碎(冰水浴, 功率400 W, 工作时间3 s, 间歇时间5 s)15 min, 4℃下11 000 r/min离心11 min, 上清液即为粗酶液。
1.2.3 蛋白浓度的测定Bradford蛋白浓度测定试剂盒检测蛋白浓度。
1.2.4 树脂预处理环氧树脂称取5 g环氧树脂, 加入20 mL的0.1 mol/L磷酸钾缓冲液(pH8.0)混匀, 25℃, 170 r/min振荡1 h, 蒸馏水洗涤干净。
氨基树脂:0.1 mol/L磷酸钾缓冲液(pH8.0)配制5%戊二醛溶液。称取5 g氨基树脂, 加入20 mL配制好的5%戊二醛溶液, 在25℃, 170 r/min活化1 h, 20 mmol/L的磷酸钾缓冲液(pH8.0)洗净至无戊二醛残留。
1.2.5 N-乙酰神经氨酸醛缩酶固定化方法称取经预处理的树脂载体4 g置于250 mL三角瓶中, 加入20 mL 1.0 mol/L磷酸钾缓冲液(pH 8.0)和20 mL NAL粗酶液放置于25℃恒温摇床中震荡固定化24 h。真空抽滤, 用20 mmol/L磷酸钾缓冲液(pH 8.0)洗涤固定化酶颗粒5次, 抽干后于4℃保存。
1.2.6 酶学性质比较控制pH相同, 在不同的温度条件下测定固定化酶和游离酶的酶活力, 并且在不同温度中处理12 h之后在最适反应条件下测定固定化酶和游离酶的剩余酶活, 考察固定化酶与游离酶的最适温度和温度稳定性。
控制温度相同, 在不同的pH条件下测定固定化酶和游离酶的酶活力, 并且在不同pH中处理12 h之后在最适反应条件下测定固定化酶和游离酶的剩余酶活, 考察固定化酶与游离酶的最适pH和pH稳定性。
将游离酶和固定化酶颗粒密封储存于4℃冰箱中, 每间隔一段时间取出测残余酶活, 考察固定化酶与游离酶的储存稳定性
1.2.7 固定化N-乙酰神经氨酸醛缩酶催化合成N-乙酰神经氨酸在50 mL转化体系中, 加入0.4 mol/L的N-乙酰葡萄糖胺, 1.0 mol/L的丙酮酸钠, 2.5 mmol/L的ATP和7.5 mmol/L的氯化镁。转化10 h和15 h均补料添加2.75 g丙酮酸钠。在37℃, pH 7.5, 转速170 r/min的条件下, 加入400 U的NAL固定化酶颗粒, 再加入100 U的N-乙酰葡萄糖胺异构酶游离酶, 反应24 h完成后, 用20 mmol/L磷酸钾缓冲液(pH 8.0)冲洗抽滤, 连续反应10次。
2 结果 2.1 粗酶液蛋白浓度测定粗酶液蛋白浓度为20 mg/mL, 比酶活为25 U/mg。
2.2 树脂载体的选择分别称取4 g不同的树脂载体, 进行固定化, 检测不同载体的固定化酶酶活, 结果如表 1。由于携带官能团的不同, 不同类型的树脂对酶的固定化效果也不同。从表 1的结果可以看出, 在9种不同类型的树脂中, 氨基类树脂LX-1000HFA的固定化效果最好, 酶活回收率达到39.75%。因此, 选用LX-1000HFA作为最佳固定化载体进行下一步研究。
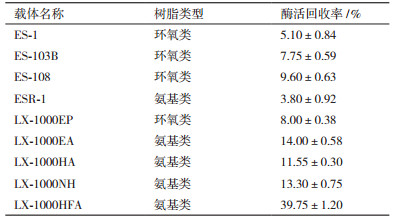
向250 mL的三角瓶中准确称取LX-1000HFA载体1 g、2 g、3 g、4 g、5 g、6 g, 检测不同载量的固定化酶酶活及酶活回收率, 结果如图 1。由图 1中的数据可知, 固定化酶的相对酶活随着载体量的不断增加在不断减少, 而酶活回收率随着载体量的不断增加而增加。载体量为5 g时酶活回收率达到45.00%, 载体表面的醛基结合位点已经与酶分子结合达到了饱和。因此, 综合来看在40 mL的粗酶液中投放5 g载体是最佳的比例。
|
| 图 1 树脂投放量对固定化的影响 |
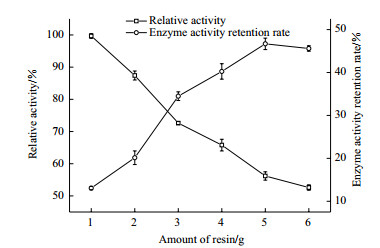
往250 mL的三角瓶中准确称取筛选的载体5 g, 固定不同时间。检测不同固定化时间的固定化酶酶活, 结果如图 2。由图 2可以看出, 固定化酶酶活随着固定化时间的延长呈先上升后下降最后逐渐稳定的趋势。在2-6 h固定化酶酶活是逐渐升高的, 在6 h时酶活最高, 这一阶段载体与酶蛋白主要是进行简单的物理吸附作用, 并没有形成牢固的共价键。固定化时间在6 h后酶活则逐渐下降, 下降到12 h时固定化酶酶活逐渐稳定。因此, 在后续的实验中选择12 h作为固定化时间。
|
| 图 2 固定化时间对固定化的影响 |
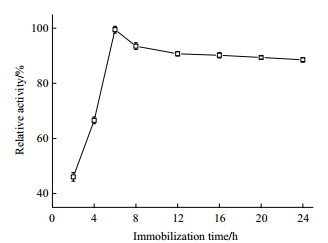
向250 mL的三角瓶中分别加入20 mL的0.1 mol/L、0.3 mol/L、0.5 mol/L、1.0 mol/L、1.5 mol/L、2.0 mol/L的pH 8.0不同浓度的磷酸钾缓冲液, 并准确称取筛选的载体5 g, 固定化12 h。检测不同缓冲液浓度处理的固定化反应下固定化酶酶活, 结果如图 3。可以看出, 随着缓冲液浓度的不断增大, 固定化酶酶活先增加后降低。当缓冲液浓度为1.0 mol/L时固定化酶酶活最大, 而后不断减少。所以本研究选择1.0 mol/L为最佳缓冲液浓度。
|
| 图 3 缓冲液浓度对固定化的影响 |
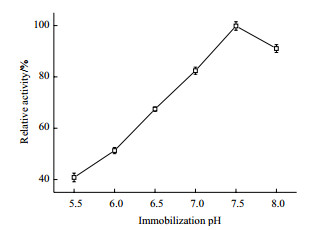
向250 mL三角瓶中分别加入1.0mol/L的pH为5.5、6.0、6.5、7.0、7.5、8.0的磷酸钾缓冲液, 并准确称取筛选的载体5g, 固定化12 h。检测不同pH的固定化反应下固定化酶酶活, 结果如图 4。偏碱性环境更适合NAL的固定化, 当pH为5.5至7.5时, 固定化酶酶活一直随着pH值的增大而升高。当pH为7.5时, 固定化酶活是最高的, 所以本研究选择pH7.5作为固定化的最适pH。
|
| 图 4 pH对固定化的影响 |
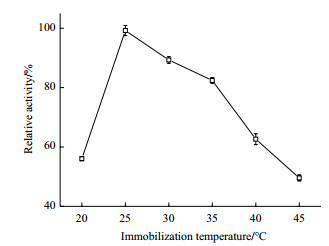
向250 mL的三角瓶中准确称取筛选的载体5 g, 加入20 mL的1.0 mol/L磷酸钾缓冲液(pH 8.0), 放置于25℃、30℃、35℃、40℃、45℃、50℃的恒温摇床, 固定化12 h。检测不同温度的固定化反应下固定化酶酶活, 结果如图 5。
|
| 图 5 温度对固定化的影响 |
由图 5可知, 在25℃时固定化酶活最高, 当温度从20℃升高至25℃, 固定化酶活是增大的。当温度大于25℃后, 固定化酶活则处于一直下降的趋势。所以, NAL不适合在高温下进行固定化, 本研究选取25℃做固定化的最适温度。
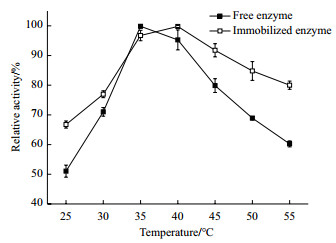
2.8 酶学性质的比较 2.8.1 最适反应温度由图 6可知, 游离酶的最适反应温度是35℃, 固定化酶的最适反应温度是40℃, NAL被固定化后最适反应温度有所上升。当温度高于40℃, 固定化酶和游离酶的酶活都随着温度的升高而下降, 但固定化酶的下降趋势相对游离酶较平缓。温度达55℃时, 游离酶仅剩60%的酶活, 而固定化酶仍保持有80%的酶活。这可能是由于游离酶在被固定化后载体分子对酶分子有一定的保护作用, 从而使得固定化酶的适用温度范围较游离酶更广。
|
| 图 6 固定化酶和游离酶的最适反应温度 |
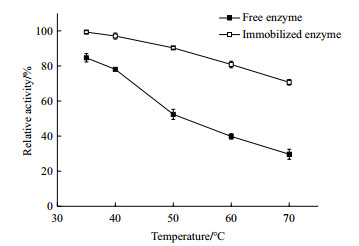
由图 7可知, 游离酶在35℃时处理12 h保持有85%左右的酶活, 但在70℃中处理12 h只残余30%的酶活。相比而言, 在不同温度条件下处理12 h, 固定化酶的残余酶活下降速度较低, 特别地在35℃时处理12 h酶活基本无损失, 在70℃高温条件下固定化酶酶活仍保持有71%的酶活。所以, 固定化酶的热稳定性显著优于游离酶。
|
| 图 7 固定化酶和游离酶的温度稳定性 |
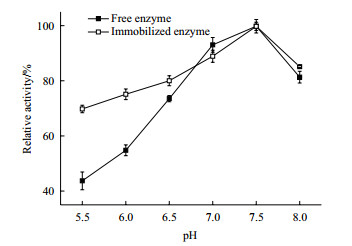
由图 8可以看出, 游离酶与固定化酶的最适反应pH均是7.5, 说明酶在被固定化后最适反应pH并不受影响。当pH小于7.5时, 游离酶和固定化酶的相对酶活都是随着pH的增大而增大, 但游离酶的变化趋势较为剧烈。特别在强酸性(pH5.5)条件下游离酶的相对酶活只有44%左右, 而固定化酶还保有70%的酶活。游离酶的构象在酸性条件下比固定化酶更容易改变, 从而失去活性。因此, 固定化酶比游离酶更适应强酸性环境, 具有更广的pH应用范围。
|
| 图 8 固定化酶和游离酶的最适反应pH |
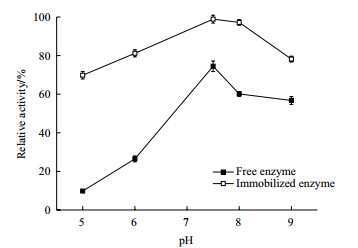
由图 9可以看出, 无论是游离酶还是固定化酶, NAL在强碱性(pH9.0)环境中酶活相对于强酸性(pH5.0)稳定性更好, 这可能与酶本身的性质有关。游离酶经固定化后pH稳定性有非常大的提升, 特别是在酸性环境中。在pH为5.0的条件下处理12 h, 游离酶只剩余10%左右的酶活, 而固定化酶还保持在70%的酶活。在pH为7.5的条件下处理12 h固定化酶的酶活基本无损失, 而在pH为9.0的碱性环境中处理12 h, 固定化酶的酶活仍然保留有78%。总体来说, 固定化酶的pH稳定性优于游离酶。
|
| 图 9 固定化酶和游离酶的pH稳定性 |
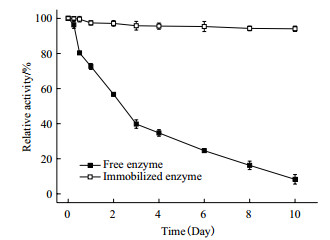
从图 10中可以看出, 在4℃条件下储存2 d后, 游离酶只保留有57%的酶活, 已经接近半衰期了, 而固定化酶依然保持在96%的酶活水平。在储存10 d后, 游离酶几乎丧失全部活性, 固定化酶只损失了6%的酶活。固定化NAL酶储存稳定性较好, 且易于储存。
|
| 图 10 固定化酶和游离酶的储存稳定性 |
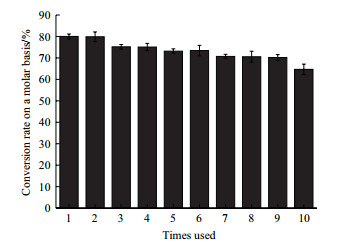
操作稳定性是衡量固定化酶效果的一个重要指标之一, 它决定着固定化酶在工业化生产上的应用价值。从图 11中可以看出, 转化1次后产生99.3 g/L Neu5Ac, GlcNAc的转化率为80.03%, 生产强度为4.14 g/L/h。在连续转化第3次时, 摩尔转化率为75.18%左右, 说明酶的稳定性有略微下降的趋势。持续转化10个批次, 最终摩尔转化率能达到64.67%。故连续转化10次, 酶活能够保持80%。
|
| 图 11 固定化酶的操作稳定性 |
固定化酶初次和连续10次催化合成Neu5Ac的HPLC色谱对比图如图 12所示, 峰2、3、4、5分别为Neu5Ac、丙酮酸、ManNAc、GlcNAc, 其对应出峰时间分别为8.6、9.7、11.6、12.2 min。固定化酶在持续催化第10次后, 其摩尔转化率为64.67%, Neu5Ac产量仍达到80.0 g/L。
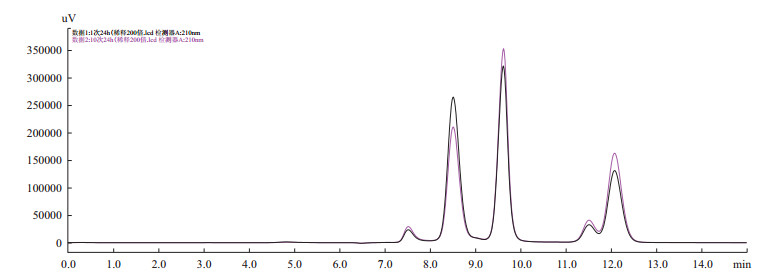
|
| 图 12 固定化酶催化合成Neu5Ac的HPLC色谱图 |
目前Neu5Ac的酶法制备主要是通过AGE与NAL偶联催化实现的, 通常先利用AGE将GlcNAc异构成ManNAc, 再通过NAL催化ManNAc和Pyr生成Neu5Ac。近些年来, 由于固定化酶的可循环利用性, 一些研究者开始将目光投向利用固定化酶生产Neu5Ac。作为酶法生产Neu5Ac的关键酶NAL, 其固定化研究早有报道。2006年杨茂区等[24]使用Eupergit® C进口环氧树脂固定化NAL粗酶液, 其比酶活仅10.4 U/g。为了提高固定化酶活, 2009年胡世元等[25]利用Amberzyme进口环氧树脂对NAL纯酶进行固定化研究, 结果获得比酶活达到了69.3 U/g, 比之前固定化酶活有较大提高, 但酶的纯化成本较高, 且使用国外进口的树脂不宜国内进行规模化生产。2016年Cheng等[19]使用实验室自制的氨基树脂对纯化后的NAL进行固定化, 最终得到固定化比酶活达183 U/g, 但其固定化酶在连续转化5次后酶活仅初始酶活的75%。
本研究使用不同树脂对NAL粗酶液进行固定化后发现, 采用LX-1000HFA进行固定化时效果最好, 可以制备较高酶活的固定化酶。而在固定化过程中, 固定化时间、缓冲液浓度、pH及温度等因素直接影响了固定化效果。由于LX-1000HFA是一类氨基载体, 在2-6 h内, 酶蛋白仅简单地被吸附于载体表面。而随着固定化时间延长至12 h, 固定化酶活稳定在91%左右时, 这可能是因为少量酶蛋白逐渐脱落, 大量的酶分子与载体之间形成共价结合且达到饱和状态[26-27]; 适当浓度的缓冲液也可能促进载体与酶分子的表面疏水作用, 促使酶分子被吸附于载体的树脂表面。当缓冲液浓度为1.0 mol/L时固定化酶活最高, 缓冲液浓度为2.0 mol/L时固定化酶活仅40%左右。这可能是磷酸盐浓度过高造成酶蛋白变性失活, 且易形成较大颗粒, 堵塞载体孔径通道, 影响游离酶分子与载体的结合[28]; 当体系pH为5.5时, 固定化酶活仅为pH为7.5的41%左右, 可能是pH影响了戊二醛的醛基与载体的氨基基团反应生成的席夫碱的稳定性[29]; 另外, 固定化温度直接影响了游离酶分子的扩散运动, 且低温时酶分子热运动效率较低, 适当提高温度直接影响载体与酶分子的结合效率[30], 但高温首先会直接破坏酶分子的蛋白结构, 导致酶蛋白变性失活。其次氨基载体固定化酶是共价结合的方式, 高温会破坏共价键的形成。所以固定化温度为25℃时固定化效果最好, 而温度上升到45℃时, 固定化酶活下降至最高酶活的50%左右。游离酶经固定化后, 其最佳作用温度提升5℃, 温度稳定性(70℃处理12 h)提高了近2.4倍。最适pH范围变广, pH稳定性(pH 5.0处理12 h)则提高近7.1倍。值得注意的是, 当在4℃条件下储存10 d时, 固定化酶的储存稳定性显著提高(11.4倍)。
4 结论从9种不同类型的载体中, 筛选出氨基树脂LX-1000HFA对NAL进行固定化, 经优化得到最佳固定化条件为:载体投放量5.0 g, 固定化时间12 h, 缓冲液浓度1.0 mol/L, pH 7.5, 温度25℃。在此条件下制备得到的固定化NAL, 无需纯化, 酶活达200 U/g湿载体。通过对游离酶与固定化酶的酶学性质及稳定性进行了对比研究, 结果相对于游离酶, 固定化酶具有良好的热稳定性、pH稳定性、储存稳定性和操作稳定性, 可适应工业化生产的复杂的操作环境。
| [1] |
Schauer R. Achievements and challenges of sialic acid research[J]. Glycoconjugate Journal, 2000, 17(7-9): 485-499. |
| [2] |
Saleem T. Soluble CD14, Sialic Acid and L-Fucose in breast milk and their role in increasing the immunity of breast-fed infants[J]. American Journal of Biochemistry and Biotechnology, 2011, 7(1): S35. |
| [3] |
Schnaar R L, Gerardy-Schahn R, Hildebrandt H. Sialic acids in the brain:Gangliosides and polysialic acid in nervous system development, stability, disease, and regeneration[J]. Physiological Reviews, 2014, 94(2): 461-518. |
| [4] |
Kawai N, Ikematsu H, Iwaki N, et al. Comparison of the effectiveness of zanamivir and oseltamivir against influenza A/H1N1, A/H3N2, and B[J]. Clinical Infectious Diseases, 2009, 48(7): 996-997. |
| [5] |
Wang B. Molecular Mechanism underlying sialic acid as an essential nutrient for brain development and cognition[J]. Advances in Nutrition:An International Review Journal, 2012, 3(3): 465S-472S. |
| [6] |
Koketsu M, Juneja LR, Kawanami H, et al. Preparation of N-acetyln-eurammic acid from delipidated egg yolk[J]. Glycoconjugate Journal, 1992, 9(2): 70-74. |
| [7] |
KimioFuruhata. Chemistry of N-Acetylneuraminic Acid(Neu5Ac)[J]. Trends in Glycoscience and Glycotechnology, 2004, 16(89): 143-169. |
| [8] |
Ishikawa M, Koizumi S. Microbial production of N-acetylneuraminic acid by genetically engineered Escherichia coli[J]. Carbohydrate Research, 2010, 345(18): 2605-2609. |
| [9] |
朱德强.产N-乙酰神经氨酸重组大肠杆菌的构建及其生物转化合成[D].无锡: 江南大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10295-1017018480.htm
|
| [10] |
李宏越.微生物发酵法生产N-乙酰神经氨酸的研究[D].大连: 大连工业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10152-1016070291.htm
|
| [11] |
Maru I, Ohnishi J, Ohta Y, et al. Simple and large-scale production of N-acetylneuraminic acid from N-acetyl-D-glucosamine and pyruvate using N-acyl-D-glucosamine 2-epi-merase and N-acetylneuraminatelyase[J]. Carbohydrate Research, 1998, 306: 575-578. |
| [12] |
Mahmoudian M, Noble D, Drake C S, et al. An efficient process for production of N-acetylneuraminic acid using N-acetylneuraminic acid aldolase[J]. Enzyme MicrobTechnol, 1997, 20(5): 393-400. |
| [13] |
Lin BX, Zhang ZJ, Liu WF, et al. Enhanced production of N-acetyl-D-neuraminic acid by multi-approachwhole-cell biocatalyst[J]. Applied Microbiology and Biotechnology, 2013, 97(11): 4775-4784. |
| [14] |
Sun W, Ji W, Li N, et al. Construction and expression of a polycistronic plasmid encoding N-acetylglucosamine 2-epimerase and N-acetylneuraminic acid lyase simultaneously for production of N-acetylneuraminic acid[J]. Bioresource Technology, 2013, 130: 23-29. |
| [15] |
Krajewska B. Application of chitin- and chitosan-based materials for enzyme immobilizations:A review[J]. Enzyme and Microbial Technology, 2004, 35(2-3): 126-139. |
| [16] |
Mateo C, Palomo J M, Fernandez-Lorente G, et al. Improvement of enzyme activity, stability and selectivity via immobilization techniques[J]. Enzyme and Microbial Technology, 2007, 40(6): 1451-1463. |
| [17] |
Wang M, Hua X, Yang R, et al. Immobilization of cellobiose 2-epimerase from Caldicellulosiruptorsaccharolyticus on commercial resin DuoliteA568[J]. Food Bioscience, 2016, 14: 47-53. |
| [18] |
钟汕.碱性蛋白酶的固定化及其应用[D].杭州: 浙江大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10335-1018132171.htm
|
| [19] |
Cheng J, Zhuang W, Tang C, et al. Efficient immobilization of AGE and NAL enzymes onto functional amino resin as recyclable and high-performance biocatalyst[J]. Bioprocess and Biosystems Engineering, 2017, 40(3): 331-340. |
| [20] |
尹春丽, 曹珊珊, 许乐, 等. 氨基树脂固定化S-腺苷甲硫氨酸合成酶的研究[J]. 化学与生物工程, 2014(9): 17-20. |
| [21] |
Mendes AA, Giordano RC, Giordano RDLC, et al. Immobilization and stabilization of microbial lipases by multipoint covalent attachment on aldehyde-resin affinity:Application of the biocatalysts in biodiesel synthesis[J]. Journal of Molecular Catalysis B:Enzymatic, 2011, 68(1): 109-115. |
| [22] |
He H, Wei Y, Luo H, et al. Immobilization and stabilization of cephalosporin C acylase on aminated support by crosslinking with glutaraldehyde and further modifying with aminated macromolecules[J]. Biotechnology Progress, 2015, 31: 387-395. |
| [23] |
许敬亮, 袁振宏, 张宇, 等. 氨基功能载体固定化酶研究进展[J]. 化工进展, 2010, 29(3): 494-497. |
| [24] |
杨茂区.固定化N-乙酰-D神经氨酸醛缩酶的制备及生化性质研究[D].杭州: 浙江大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10335-2006074364.htm
|
| [25] |
Hu S, Chen J, Yang Z, et al. Coupled bioconversion for preparation of N-acetyl-d-neuraminic acid using immobilized N-acetyl-d-glucosamine-2-epimerase and N-acetyl-d-neuraminic acid lyase[J]. Applied Microbiology Biotechnology, 2010, 85(5): 1383-1391. |
| [26] |
顾恺, 邹树平, 王志才, 等. 环氧树脂固定化卤醇脱卤酶的研究[J]. 现代化工, 2016(11): 69-72. |
| [27] |
嵇东情, 郑仁朝, 郑裕国, 等. 环氧树脂固定化拟南芥腈水解酶NIT的研究[J]. 精细与专用化学品, 2015, 23(5): 12-16. |
| [28] |
徐珊, 李任强, 张继福, 等. 使用国产环氧树脂LXEP-120固定化脂肪酶研究[J]. 广西师范大学学报:自然科学版, 2018, 36(4): 113-123. |
| [29] |
刘天龙.异丙醇脱氢酶固定化工艺研究[D].杭州: 浙江大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10335-1018132138.htm
|
| [30] |
Mendes AA, Freitas L, De Carvalho AKF, et al. Immobilization of a commercial lipase from Penicilliumcamembertii(Lipase G)by different strategies[J]. Enzyme Research, 2011, 2011: 1-8. |