L-谷氨酸(L-glutamate, L-Glu)是生物体内的重要营养物质, 参与动物、植物、微生物细胞内的蛋白质代谢过程[1]。L-谷氨酸在食品行业中广泛用作增鲜剂, 另外在医药、人造制革、化妆品工业及农业生产上也具有广泛的用途, 是目前世界上产量最大的氨基酸[2-5]。L-谷氨酸最早是在1866年由德国化学家以小麦面筋水解而得[6], 近一个世纪之后, 随着谷氨酸生产菌的分离得到与研究改造, 逐步过渡到采用发酵法进行生产。随着谷氨酸棒杆菌基因组信息注解及微生物育种技术的进步, 谷氨酸的发酵水平得到极大的提升。然而, 从产酸水平和糖酸转化率来看, 我国谷氨酸发酵生产还落后于国际水平[7-9]。因此, 选育L-谷氨酸高产菌株, 进一步提高产酸水平及转化率, 对谷氨酸清洁生产具有重要的意义。
常压室温等离子体(Atmospheric and room temperature plasma, ARTP)诱变系统能够在常压下产生25-40℃的具有高活性粒子浓度的等离子体射流, 通过作用于微生物细胞造成有效的DNA多样性损伤[10-11], 具有操作简便、设备简单、条件温和、安全性高、诱变快速、产生突变的多样性大等特点[12-13], 是新近发展起来的非常安全高效的诱变系统。在氨基酸菌株选育方面, 都比较多的集中在ARTP的直接诱变, 如杨立鹏等[14]采用ARTP方法选育到一株高产L-色氨酸的突变株TRP-YP-3-2, 其L-色氨酸产量达到61.4 g/L, 糖酸转化率达到19.25%, 分别较出发菌提高了15.41%和22.77%, 而且遗传稳定, 生长速率高。蔡友华等[15]利用ARTP诱变集合48孔板筛选, 获得突变株1905#, 其能够耐受更低的pH, 摇瓶产酸较出发菌株提高99.6%, 遗传稳定。另外, 将细胞制备成原生质体, 去除了细胞壁的保护, 使得细胞对诱变因素更为敏感, 对原生质体进行ARTP诱变处理, 操作简便易行, 可大大提高诱变的效果。如蒋顺进[16]以绿色产色链霉菌AVL4为研究对象, 通过原生质体ARTP诱变, 筛选获得变株S251, 其50 L罐发酵阿维拉霉素水平最高达到4 500 μg/mL, 较对照菌株AVL4提高27.4%。公维亮等[17]采用原生质体ARTP诱变, 结合双亲酶活的原生质体融合方案, 获得GSM-4、GSM-5两株那西肽效价提高15%以上的突变菌株, 体现了非常好的选育效果。在谷氨酸高产菌株的选育方面, 鲜有原生质体ARTP诱变选育的报道。
本研究以经过多次诱变及代谢改造的高产L-谷氨酸的谷氨酸棒杆菌工程菌(Corynebacterium glutamicum)GY1为研究对象, 对该菌株的原生质体形成和再生的条件进行探索, 并对原生质体进行ARTP诱变, 全局诱变L-谷氨酸工程菌, 获取更多样的细胞膜及基因损伤, 最大限度的获得突变菌株库, 以期获得产酸及糖酸转化率提高的突变株。诱变的主要的流程如图 1所示。
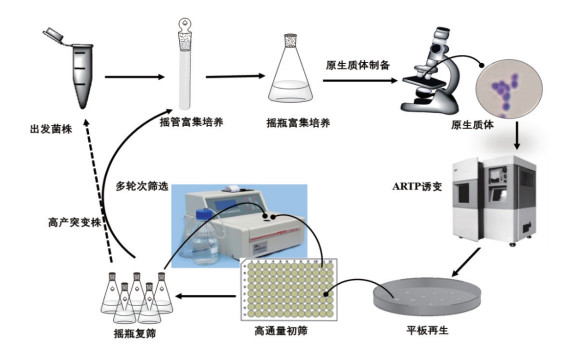
|
| 图 1 L-谷氨酸高产菌株原生质体ARTP诱变选育流程 |
谷氨酸棒杆菌Corynebacterium glutamicum GY1(FluAr/ProAr/Glnr/odhA-/pckA-/dtsR1-/ltsA-/alaT-), 由工业微生物教育部工程研究中心保存。
1.1.2 培养基斜面培养基及固体平板培养基(g/L):葡萄糖5.0, 豆粕提取物18.0, 酵母粉10.0, 磷酸二氢钾1.0, 尿素3.0, 丁二酸0.5, 琼脂粉20.0, 生物素10.0 μg/L, pH7.0,121℃灭菌20 min。
种子培养基(g/L):葡萄糖22.0, 酵母粉10.0, 豆粕提取物20.0, 硫酸镁0.4, 尿素10.0, 丁二酸1.0, 硫酸亚铁0.01, 硫酸锰0.01, 甲硫氨酸0.5, 生物素0.4 mg/L, 维生素B1 0.2 mg/L, pH7.0,121℃灭菌20 min。
发酵培养基(g/L):葡萄糖80, 豆浓30, 玉米浆干粉35, 豆粕提取物10, 糖蜜10, 毛发水解物2.3, 甜菜碱1.2, 丁二酸3.75, 尿素6.0, 硫酸镁1.6, 磷酸二氢钾12.5, 苏氨酸0.015, 赖氨酸0.015, 甲硫氨酸0.05, 天冬氨酸0.12, FeSO4·7H2O 0.8 mg/L, MnSO4·3H2O 0.8 mg/L, 抗坏血酸0.08 mg/L, 对氨基苯甲酸0.08 mg/L, 生物素0.08 mg/L, 维生素B1 0.03 mg/L, 维生素B12 2.5 μg/L, pH7.0,121℃灭菌20 min。
再生培养基:在固体平板培养基的基础上添加0.5 mol/L的蔗糖即为再生培养基。
1.1.3 主要药品和试剂SMM缓冲液:0.5 mol/L蔗糖, 0.02 mol/L MgC12·6H2O, 0.02 mol/L顺丁烯二酸, pH7.0,121℃灭菌20 min。
甘氨酸溶液:称取1 g甘氨酸溶于10 mL水中, 用0.22 μm的针头式过滤器过滤除菌, -4℃保藏。
溶菌酶液:称取0.2 g溶菌酶, 溶于10 mL SMM缓冲液, 即溶菌酶浓度为20 g/L, 用0.22 μm的针头式过滤器过滤除菌, -20℃保藏。
1.1.4 主要仪器设备SBA-40D型生物传感分析仪由山东省科学院生物研究所制造; UV-2100型紫外可见分光光度计由尤尼柯(上海)仪器有限公司制造; 梅特勒pH计由瑞士梅特勒-托利多集团制造; ARTP-ⅡS型ARTP诱变仪由无锡源清天木生物科技有限公司制造。
1.2 方法 1.2.1 原生质体的制备与再生原生质体制备:取一环保藏于-80℃冰箱的谷氨酸棒杆菌GY1, 接种于3 mL的种子培养基中, 30℃, 220 r/min振荡培养12 h, 吸取1mL菌液至装有30 mL种子培养基的250 mL三角瓶, 添加1 mL 10%的甘氨酸, 30℃, 220 r/min振荡培养12 h, 培养结束后, 将菌液6 000 r/min离心10 min, SMM高渗缓冲液洗涤离心两次, 弃去上清, 得到制备原生质体的出发菌。取一部分用高渗液适当稀释, 吸取100 μL涂布于固体培养基上, 30℃培养至长出菌落, 计算菌落数A。
以SMM溶液作为高渗液, 在出发菌中加入溶菌酶液, 使终浓度分别为2.5、5.0、7.5、10.0和12.5 mg/mL, 转入直径为6 cm的平皿, 放置于恒温振荡器, 30℃, 60 r/min条件下分别酶解30、60、90、120和150 min, 随后2 500 r/min离心10 min, 弃上清, 用SMM溶液洗涤离心两次, 最后加入3 mL SMM溶液重悬细胞, 得到原生质体悬液。
原生质体再生:原生质体悬液用SMM溶液梯度稀释后取100 μL涂布于再生培养基平板上, 30℃培养2 d长出菌落, 计算菌落数B。另外, 将原生质体用无菌水梯度稀释后涂布于再生培养基平板, 30℃培养2 d, 计算长出的菌落数C。根据实验结果结合后续实验需求选择合适的原生质体制备与再生条件。原生质体再生率 = (B-C)/(A-C)×100%。
1.2.2 ARTP诱变参照ARTP诱变育种仪操作流程, 将原生质体悬液加入终浓度为5%的甘油作为保护剂, 吸取10 μL原生质体悬液均匀涂于载片, 将载片转入操作仓, 以氦气作为工作载气, 功率为110 W, 通气量为10 L/min, 距离为2 mm, 进行诱变处理。处理时间设置为10、20、30、40、50、60、70和80 s, 诱变结束后将载片转入SMM高渗液中, 30℃, 60 r/min振荡15 min, 确保将原生质体全部洗脱下来, 然后稀释涂布至再生培养基平板, 30℃培养2 d至长出单菌落, 进行平板菌落计数, 以处理0 s的样品为对照, 计算致死率并绘制致死率曲线, 选择致死率约为85%-90%的处理时间对原生质体进行诱变。
1.2.3 突变株的筛选再生培养基平板培养2 d后长出单个菌落, 挑选外观形态与对照菌株(如菌落大小、形状、色泽等)存在差异的的单菌落转接至谷氨酸固体平板, 30℃培养24 h, 然后用96微孔板发酵进行初筛, 采用生物传感分析仪测定谷氨酸含量, 选择产酸提高幅度较大的突变株进行摇瓶复筛。从固体平板菌落接种至斜面, 以原始出发菌株GY1为对照, 30℃培养24 h后, 按2%的接种量接种至种子培养基中, 30℃, 220 r/min培养24 h, 再以10%的接种量转至发酵摇瓶, 30℃, 220 r/min, 振荡培养24 h后温度调至37℃, 继续发酵24 h后结束培养。分析发酵液中L-谷氨酸含量、菌体生物量。L-谷氨酸含量采用生物传感器分析仪测定。
1.2.4 50 L发酵罐补料分批发酵验证采用三级发酵工艺, 以摇瓶种作为一级种子接入二级种子罐, 接种量为2%, 再以20%的移种量从种子罐移种至发酵罐, 发酵周期为36 h, 控制发酵罐参数:罐压0.05 MPa, 初始通气量1:1.5 vvm, 培养24 h后提高至1:1 vvm, 发酵前期温度为30℃, 培养至OD562达到80后升温至37℃诱导表达谷氨酸; 初始搅拌300 r/min, 初始葡萄糖浓度为100 g/L, 初始PH7.0, 发酵期间每隔2 h取样检测菌体生物量(OD562)、L-Glu含量及残糖, 根据耗糖速率确定补料量, 流加质量分数为20%的氨水控制pH在6.9-7.1, 通过控制搅拌和补料维持发酵过程溶氧(DO)在15%-35%, 流加700 g/L葡萄糖溶液控制发酵过程中葡萄糖浓度在4.0-7.0 g/L, 发酵结束前2-4 h停止补料, 当残糖基本耗尽时, 发酵结束。
2 结果 2.1 最佳原生质体制备与再生条件的选择 2.1.1 不同溶菌酶浓度对原生质体制备的影响由图 2可知, 在一定时间内(本实验时间为90 min), 随着溶菌酶浓度的增加, 谷氨酸棒杆菌GY1原生质体生成率逐步提高, 在酶浓度为12.5 mg/mL时达到最高, 继续提高溶菌酶的浓度, 原生质体数量略有下降。当酶浓度比较低的时候, 再生率随着酶浓度增加而提高, 当溶菌酶浓度为10.0 mg/mL时, 再生率达到峰值21.3%, 继续提高酶浓度, 再生率急剧下降。可能是由于过高的酶浓度使细胞壁酶解过度, 将细胞壁彻底降解, 进而对细胞膜造成损伤, 不利于原生质体再生。结合原生质体制备量和再生率的综合考虑, 选取最佳的溶菌酶浓度为10.0 mg/mL。
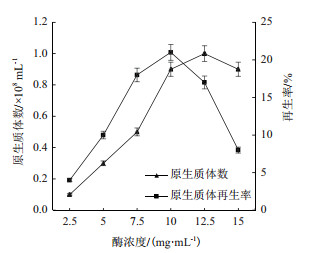
|
| 图 2 酶浓度对原生质体制备的影响 |
在制备原生质体的过程中, 原生质体的数量随着酶解时间的延长逐步增加, 在显微镜下观察可见越来越多的棒状细胞转变为球状的原生质体, 最终几乎全部酶解成为球形原生质体。由图 3可见, 原生质体的制备量随着时间的延长而增加, 但是当酶解时间过长时, 再生率显著下跌。可能原因是酶解太长时间导致细胞壁全部去除, 进而损伤质膜系统, 使原生质体质量下降难以再生。综合考虑原生质体的制备率再生率, 使用10 mg/mL的溶菌酶处理90 min为最佳酶解时间。

|
| 图 3 酶解时间对原生质体制备的影响 |
根据ARTP诱变不同的时长, 再生后平板长出的菌落数, 以未经诱变的平板菌落数为对照, 计算致死率, 绘制致死率曲线(图 4)。由图 4可知, ARTP处理60 s时, GY1原生质体已达到100%的致死率, 处理20 s, 致死率达到55.7%。鉴于出发菌株GY1本身经历了多次物理化学诱变, 而且谷氨酸棒杆菌具备的限制修饰系统, 在ARTP处理时间的选择方面, 一方面想通过ARTP处理强化菌株原生质体损伤的“程度”, 获得较多的DNA损伤, 另一方面也尽可能保证有一定数量的再生菌落进行筛选, 增加获取优良变株的机率, 选择致死率为90%左右的处理时长, 即处理40 s(致死率为89.6%)作为最佳的ARTP诱变时间。
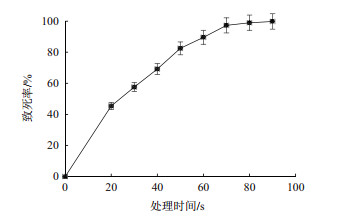
|
| 图 4 ARTP处理时间对GY1原生质体致死率的影响 |
原生质体进行ARTP诱变后, 在长出单菌落的再生平板上, 根据菌落的形态特征如菌落大小、光泽度或颜色, 随机挑取了760个单菌落进行96微孔板初步筛选, 筛选结果表明, 有136个菌株比出发菌株产酸提高, 正变率为17.9%, 选取其中60株产酸较出发菌株提高12%以上的菌株进行摇瓶复筛, 产酸结果见表 1。由表 1可见, 有22株诱变菌株在摇瓶发酵中产酸比对照菌GY1高, 最高的一株为YAG117, L-Glu含量达16.3 g/L, 较GY1提高13.9%。
诱变株通常稳定性较差, 为验证该变株的稳定性, 将变株连续传代5次, 每次传代进行摇瓶发酵验证L-Glu产量, 均设置3个平行实验, 结果如表 2。从菌株形态特征上看, 变株YAG117在传代过程中稳定性良好, 菌落形态及显微形态都没有变化, 而且L-谷氨酸产量变化幅度在3%以内, 体现了较好的遗传稳定性。
根据原有的发酵工艺, 将变株YAG117与出发菌株GY1进行50 L罐发酵对比验证, 每隔2 h测定生物量, 残糖及L-Glu含量, 绘制发酵曲线, 结果如图 5。结果显示, 变株YAG117与出发菌株GY1有相似的生长曲线, 葡萄糖消耗速度趋于一致, 细胞生长性能优于对照菌株, 菌体密度从发酵之初就比对照菌株生长迅猛并维持在较高水平, 展现了很好的环境适应性和生长特性。从L-谷氨酸产量上看, L-谷氨酸积累在发酵初期就高于对照菌株, 并且产酸势头强劲, 随着菌体密度对数生长迅速积累, 在菌体生长进入稳定期后, 产酸保持增速。发酵30 h以后, 产酸增加速度下降, 在发酵36 h时产酸达到216.6 g/L, 较出发菌株GY1(发酵36 h产酸191.9 g/L)提高了12.9%, 糖酸转化率比出发菌株提高了10.2%。整个发酵周期诱变菌株YAG117产酸均比对照菌株GY1高, 发酵过程稳定, 糖酸转化率达到68.87%, 展现了非常好的工业应用前景。
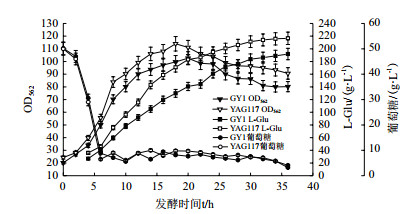
|
| 图 5 菌株YAG117/GY1分批补料发酵代谢曲线 |
谷氨酸棒杆菌GY1是一株工业化发酵生产的L-谷氨酸的工业菌株, 期间经历多代的传统诱变及代谢改造, 在多次的诱变修饰过程中往往积累了较多的细胞结构及生理上的不利突变, 致使细胞出现一定的“死胡同”效应, 而且谷氨酸棒杆菌作为一类革兰氏阳性菌株, 其细胞壁较厚, 细胞修复机制复杂, 使得进一步通过普通诱变的方式对菌株改良变得非常困难。ARTP作为一种新近发展起来的全局诱变工具, 其较普通的紫外及化学诱变方式来说具有更高的突变率、更多样的DNA损伤和蛋白突变类型, 而且没有方向性和偏好性[11]。通过去除细胞壁, 制备原生质体, 结合ARTP这种不常见的诱变体系对于经历多次诱变的工业菌株更加有利于形成L-谷氨酸生物合成相关代谢网络的全局变化, 最终形成遗传稳定的突变株。
制备数量多, 质量优的原生质体是进行原生质体ARTP诱变的前提, 酶法破壁制备原生质体的过程中, 酶浓度、酶解时间对原生质体的制备率及再生率影响显著。酶浓度太低, 细胞壁不能被有效去除, 不能形成原生质体; 酶浓度太高, 则可能会损伤细胞膜, 造成细胞存活率不高。酶解时间的影响与酶浓度相似, 时间不足时细胞壁尚未去除, 原生质体数量少, 而时间太长, 细胞膜可能会受到损伤, 影响细胞再生[17]。另外, 出发菌的活力也对原生质体的形成与再生影响显著, 对数生长期的细胞代谢活跃、一致性好, 收集此时期菌体制备原生质体可得到较好的制备效果, 不仅如此, 在培养细胞的过程中添加适量的甘氨酸或氨苄青霉素能使细胞壁的合成受阻, 造成细胞壁的结构疏松, 有利于酶解破壁[18]。本研究通过优化原生质体制备条件、选取最佳的ARTP处理时间, 既保证一定数量的细胞个体, 又能够兼容足够的诱变丰富性。从760个突变株中获得136株正突变株, 正变率达到17.9%, 相对较低的正变率也再次体现了工业菌株对诱变体系的“疲劳”作用, 最终通过96孔板的初筛和摇瓶复筛获得L-谷氨酸发酵水平显著提高的变株YAG117, L-Glu含量达16.3 g/L, 较GY1提高13.9%, 50 L罐分批发酵36 h, L-谷氨酸产量达到216.6 g/L, 比出发菌株提高了12.9%, 较户红通等[19]通过优化清洁发酵工艺的谷氨酸产量提高了12.5%, 也是目前文献报道最高水平, 这充分体现了原生质体ARTP诱变在工程菌株改良中的良好效果。值得注意的是, 优良变株从传代菌株整体的产酸水平来看, 连续传代3次L-谷氨酸的产量基本不变, 但到第4代时(F4), L-谷氨酸产量下降幅度加大, 所以, 在进行生产实践或是发酵中试时, 为取得较好的产酸水平, 建议一次菌株的斜面传代次数不超过3代, 以F2代斜面菌株进行进一步的发酵最佳。
原生质体的ARTP诱变作为传统诱变育种的补充, 能够有效的进行包括细胞膜在内的细胞全方位损伤, 有利于获取全局扰动的突变株, 从而实现选育目标, 但其还是无法在机制及机理上解释突变株的代谢变化, 接下来, 可以借助组学的分析方法, 全面比较出发菌株及突变株的组学数据, 增进对突变株L-谷氨酸全局代谢的认知, 有利于寻找新的L-谷氨酸生物合成扰动点, 为L-谷氨酸工程菌的构建提供新的理论支持。
4 结论以高产L-谷氨酸的谷氨酸棒杆菌GY1为出发菌株, 采用10.0 mg/mL的溶菌酶酶解90 min制备原生质体, 随后在综合考虑致死率及菌落数的条件下, 利用ARTP处理40 s。突变株经96微孔板初筛及摇瓶复筛, 最终获得L-谷氨酸产量明显提高的的优良突变株YAG117, 摇瓶产酸为16.3 g/L, 较出发菌株GY1提高13.9%, 同时, 进行50 L罐的补料分批发酵验证, 其L-谷氨酸产量达到216.6 g/L, 糖酸转化率达到68.87%, 较出发菌株GY1分别提高12.9%和10.2%。
| [1] |
Jinap S, Hajeb P. Glutamate. Its applications in food and contribution to health[J]. Appetite, 2010, 55(1): 1-10. DOI:10.1016/j.appet.2010.05.002 |
| [2] |
吴新世, 王楠, 彭湲, 等. 一株产谷氨酸菌株的复合诱变选育及突变株的生物学特性[J]. 天津理工大学学报, 2012, 28(1): 83-88. DOI:10.3969/j.issn.1673-095X.2012.01.020 |
| [3] |
缪建顺, 曹国珍, 张苗苗, 等. 重离子束诱变选育谷氨酸高产菌株[J]. 辐射研究与辐射工艺学报, 2015, 33(5): 37-43. |
| [4] |
康传利. L-谷氨酸产生菌的选育及其代谢调控的研究[D].无锡: 江南大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10295-1011061316.htm
|
| [5] |
Eggeling L, Sahm H. l-Glutamate and l-lysine:traditional products with impetuous developments[J]. Applied Microbiology & Biotechnology, 1999, 52(2): 146-153. |
| [6] |
陈宁, 彭飞, 张克旭. L-谷氨酸温度敏感突变株的细胞融合育种及发酵条件[J]. 发酵科技通讯, 2004, 33(1): 10-12. DOI:10.3969/j.issn.1674-2214.2004.01.004 |
| [7] |
Kumar R, Vikramachakravarthi D, Pal P. Production and purification of glutamic acid:A critical review towards process intensification[J]. Chemical Engineering & Processing:Process Intensification, 2014, 81(7): 59-71. |
| [8] |
杜军, 徐庆阳, 等. 谷氨酸高产菌GDK-9的定向选育及其发酵过程研究[J]. 食品与发酵工业, 2008, 34(7): 17-19. |
| [9] |
于信令. 味精工业手册[M]. 第2版. 北京: 中国轻工业出版社, 2009: 99-101.
|
| [10] |
吴亦楠, 邢新会, 张翀, 等. ARTP生物育种技术与装备研发及其产业化发展[J]. 生物产业技术, 2017(1): 37-45. DOI:10.3969/j.issn.1674-0319.2017.01.006 |
| [11] |
Ottenheim C, Nawrath M, et al. Microbial mutagenesis by atmospheric and room-temperature plasma(ARTP):the latest development[J]. Bioresources & Bioprocessing, 2018, 5(1): 12. |
| [12] |
张雪, 张晓菲, 等. 常压室温等离子体生物诱变育种及其应用研究进展[J]. 化工学报, 2014, 65(7): 2676-2684. DOI:10.3969/j.issn.0438-1157.2014.07.027 |
| [13] |
Zhang X, Zhang XF, Li HP, et al. Atmospheric and room temperature plasma(ARTP)as a new powerful mutagenesis tool[J]. Applied Microbiology & Biotechnology, 2014, 98(12): 5387-5396. |
| [14] |
杨立鹏, 李小刚, 魏爱英, 等. 基于常压室温等离子体诱变技术选育高产色氨酸突变株的研究[J]. 发酵科技通讯, 2015, 44(1): 28-32. DOI:10.3969/j.issn.1674-2214.2015.01.007 |
| [15] |
蔡友华, 李文锋, 卢伟宁, 等. 新型常压室温等离子体(ARTP)快速诱变高产苏氨酸的突变株[J]. 现代食品科技, 2013, 29(8): 1888-1892. |
| [16] |
蒋顺进. 原生质体ARTP诱变选育阿维拉霉素高产菌株[J]. 中国抗生素杂志, 2018, 43(7): 831-836. DOI:10.3969/j.issn.1001-8689.2018.07.009 |
| [17] |
公维亮, 薛正莲, 周扬, 等. 原生质体诱变及融合选育那西肽高产菌株[J]. 中国抗生素杂志, 2016, 41(5): 335-339. DOI:10.3969/j.issn.1001-8689.2016.05.003 |
| [18] |
祁咏春, 徐军庆, 高艳华, 等. 黄色短杆菌原生质体制备与再生条件的研究[J]. 食品与药品, 2013, 15(1): 18-22. DOI:10.3969/j.issn.1672-979X.2013.01.007 |
| [19] |
户红通, 徐达, 徐庆阳. 谷氨酸清洁发酵工艺研究[J]. 中国酿造, 2018, 37(10): 51-56. DOI:10.11882/j.issn.0254-5071.2018.10.010 |






