木质纤维素生物质预处理产生的发酵抑制物已经成为限制生物炼制产业发展的重要问题之一。木质素衍生的酚类化合物广泛出现在不同预处理方式所得的水解物中, 并表现出种类复杂、毒性强和难去除的特性[1-3]。这类抑制物可以分为:酚醛、酚酸和酚醇(酮), 其对微生物的毒性依次减弱。虽然酚酸毒性弱于酚醛, 但是预处理水解物中酚酸化合物的种类和含量均高于酚醛和酚醇, 且化学性质更稳定。因此有必要深入分析这类抑制物对典型的纤维素乙醇发酵微生物酿酒酵母生理特性的影响, 并提出具有针对性的应对策略。
目前, 关于木质素衍生酚类化合物对酿酒酵母抑制作用机制尚不明确, 且缺乏有效应对措施。以往研究主要集中在酚醛和酚酸的抑制作用强弱比较[4-7], 而缺乏关于作用机制方面的深入研究。已有研究报道酚酸对细菌类乳酸菌和运动发酵单胞菌的细胞膜渗透性有影响, 导致细胞活性下降[8]。但是缺乏有效的应对措施, 酚酸物质的水中溶解度低, 通过常规水洗脱毒不能有效脱除, 反而使其在木质纤维素原料上富集[9]。另外, 缺乏发酵微生物对酚酸耐受性相关的分子生物学背景信息, 并不能够通过理性的基因工程改造构建耐受性菌株。
对微生物进行驯化是一种应对恶劣发酵环境的有效方法[10]。这种方法具有实际应用价值, 在培养发酵种子液的过程中同时进行驯化能够缩减操作步骤, 降低木质纤维素原料脱毒成本[11-12]。在恶劣环境正式发酵前, 先将菌株置于低水平的压力胁迫下进行短期培养, 使其产生应激反应, 从而在发酵初期能够快速适应发酵环境。本研究拟通过短期驯化方式提高酿酒酵母对酚酸抑制物的耐受性, 并初步探究酚酸耐受机制。以木质素3种结构单元对应的香草酸、丁香酸和对羟基苯甲酸为酚酸模式化合物, 分别考察酚酸对酿酒酵母生长发酵的影响, 比较不同策略驯化的菌株在酚酸环境中的生长发酵动力学指标, 并从细胞膜完整性角度分析其酚酸耐受性原因。
1 材料与方法 1.1 材料 1.1.1 菌种酿酒酵母(Saccharomyces cerevisiae), 购自安琪酵母股份有限公司。
1.1.2 试剂香草酸、对羟基苯甲酸、丁香酸为分析纯, 购自上海阿拉丁试剂公司; 其余化学试剂均为分析纯, 购自天津市科密欧化学试剂公司; 酵母浸粉为生物试剂, 购自西宝生物科技股份有限公司。
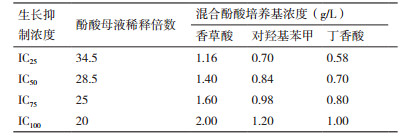
1.1.3 培养基和抑制剂合成培养基(SM, g/L):葡萄糖20、磷酸二氢钾2、七水合硫酸镁1、硫酸铵1和酵母浸粉10。单一酚酸抑制物母液(g/L):香草酸母液60、对羟基苯甲酸母液100和丁香酸母液40。混合酚酸抑制物母液(g/L):香草酸40、对羟基苯甲酸24和丁香酸20。3种酚酸的比例根据不同禾本植物木质纤维素经过不同类型预处理方式产生的水解物中愈创木基、对羟基苯基和紫丁香基类酚酸含量进行设定[2-3,13]。上述酚酸抑制物母液中, 二甲基亚砜(DMSO)作为助溶剂。母液按比例添加到SM中获得设定的酚酸浓度, 培养基中DMSO含量低于0.7%(V/V)。
1.2 方法 1.2.1 酚酸抑制物对酿酒酵母的影响酵母菌株以10%接种量在SM中活化18 h(30℃、150 r/min), 当菌体密度在600 nm处吸光值(OD600)达到7-8, 以10%接种量分别转接到不同浓度的香草酸、对羟基苯甲酸和丁香酸和混合酚酸培养基中, 30℃, 150 r/min培养24 h。在设定时间取样, 10 000 r/min离心5 min, 上清液用于液相色谱检测, 菌体沉淀用于测定生长曲线。
1.2.2 酚酸短期驯化策略对酿酒酵母耐受性的影响策略A:活化的原始菌株以10%的接种量依次在抑制浓度(IC25, IC50和IC75)逐渐升高的混合酚酸培养基进行转接和培养, 每次在30℃, 150 r/min培养12 h后以10%接种量转接到下一个抑制浓度培养基中, 最终获得耐受性菌株。策略B:菌株在抑制浓度IC50保持不变的混合酚酸培养基中转接和培养4次。策略C:菌株依次在抑制浓度IC25, IC75, IC50和IC75脉冲变化的混合酚酸培养基中进行转接和培养。对照组:将活化后的酵母菌株以10%的接种量接种在不含抑制物的SM中转接培养4次, 其他培养条件同策略A。IC25、IC50、IC75和IC100分别代表能够导致原始菌株生长抑制率为25%、50%、75%和100%时对应的混合酚酸浓度(表 1)。其中生长抑制率是根据酵母菌株在不同酚酸浓度培养基中培养15 h内的最大比生长速率计算所得。将上述菌株以10%的接种量分别转接到能够导致酵母生长抑制率为75%的混合酚酸抑制浓度下30℃, 150 r/min培养24 h, 比较菌株在酚酸胁迫下的生长和发酵性能。
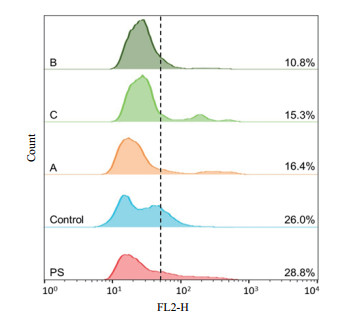
通过UV-VIS分光光度计(UV-752N, 上海精密科学仪器有限公司)测定菌液在OD600吸光值分析菌体生长。发酵液中葡萄糖和乙醇浓度通过液相色谱(LC-20, 日本岛津公司)检测:检测器为RID-20A, 色谱柱为Aminex-HPX-87H(300 mm×7.8 mm), 柱温箱温度为65℃, 流动相为0.005 mol/L稀硫酸, 流速为0.60 mL/min, 进样量为20 μL[14]。流式细胞仪检测(FACSCaliburTM, 美国BD Biosciences公司)[15]:酵母菌株在IC75的混合酚酸中培养9 h后进行细胞收集, 调整待测菌体浓度为1×106个细胞/mL, 用碘化丙啶(PI, 10 μg/mL)的PBS(0.1 mol/L, pH7.4)溶液染色。上样量1 mL, 流速为2.0 mL/min, 收集20 000个细胞, 激发光波长488 nm, 检测波长564-606 nm条件进行检测。阳性和阴性对照为原始菌株在不含抑制物的SM中培养9 h后, 收集细胞分别在沸水浴处理10 min和不处理。图 4中黑虚线是通过阳性和阴性对照细胞数量标记的PI染色和未染色细胞的界线, 右侧为被染色的细胞比例。
|
| 图 4 酚酸对酵母细胞膜完整性影响 |
酵母在不同酚酸抑制物培养基中的生长性能由比生长速率(μ)和菌体最大生物量(Biomass)表示。计算公式如下:μ = ln(xt/x0)/t, 式中xt、x0分别为t和0时刻菌体浓度, 单位g/L; t为菌体浓度x0到xt的间隔时间, 单位h。酿酒酵母发酵性能分别由最大葡萄糖消耗速率(QGlu)和乙醇生产速率(QEth)表示, 计算公式如下[9]:QGlu = (G0-Gt)/t; QEth = Eth/t, 式中G0和Gt分别是0和t时刻葡萄糖浓度, 单位g/L; Eth是最大乙醇浓度, 单位g/L; t为发酵时间, 单位h。驯化菌株的生长和发酵性能变化以Dx表示, Dx = (Xt-Xp)/Xp×100%, 其中Xt和Xp分别代表驯化菌株和原始菌株的生长和发酵性能各项指标。
2 结果 2.1 酚酸对酿酒酵母生长和发酵的影响首先考察单一酚酸对酿酒酵母生长和发酵的影响。生长方面, 低浓度酚酸对酵母比生长速率没有明显抑制, 随着浓度增加, 生长抑制作用逐渐增强。得到香草酸、丁香酸和对羟基苯甲酸的最小致死浓度分别为3.03、3.82和5.04 g/L(图 1-A)。其中, 由于丁香酸水中溶解度较低[16], 其浓度高于2.0 g/L对酵母产生的抑制作用未能进行实验检测。而其最小致死浓度是参考已有研究报道的方法, 根据实验数据通过非线性拟合曲线向外延伸与x轴的交点推测所得[5]。发酵方面, 糖耗速率和乙醇生产速率变化趋势与生长变化趋势一致。虽然香草酸和对羟基苯甲酸对乙醇发酵速率有明显抑制作用, 但是并未影响乙醇最高浓度。而丁香酸在本实验浓度范围内对酵母的糖耗和乙醇发酵没有明显的抑制作用。(图 1-B-D)。

|
| A:单一酚酸对酵母比生长速率影响; B, C, D:分别在含有香草酸、对羟基苯甲酸和丁香酸的培养基中的发酵结果 图 1 单一酚酸化合物对酵母生长和发酵的影响 |
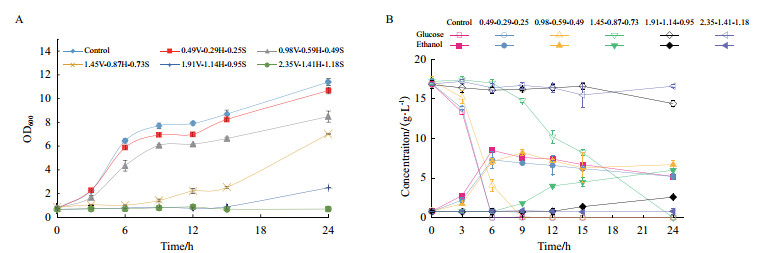
进一步考察混合酚酸之间相互作用对酵母菌的协同抑制。随混合酚酸浓度增加, 菌体最大生物量和比生长速率均受到明显抑制, 生长延滞期由3 h延长至24 h(图 2-A)。同时, 糖耗速率和乙醇生产速率逐渐降低, 乙醇最高浓度从8.33 g/L降低为0。当混合酚酸中香草酸、对羟基苯甲酸和丁香酸浓度分别为1.91、1.14和0.95 g/L时, 在培养15 h内酵母生长收到完全抑制, 发酵性能受到严重影响(图 2-B)。
|
| A:生长曲线; B:发酵性能。V-H-S表示香草酸、对羟基苯甲酸和丁香酸的混合物, 数字(0.49-0.29-0.25)代表对应酚酸的浓度 图 2 混合酚酸化合物对酵母生长和发酵性能的影响 |
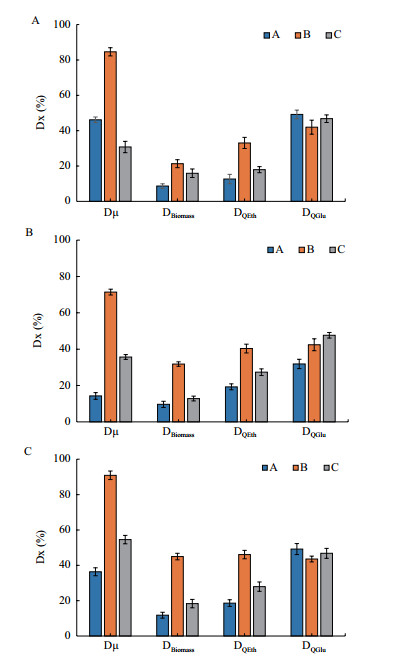
通过不同驯化策略提高酿酒酵母对酚酸耐受能力, 分别在驯化培养过程中逐渐提高(策略A)、保持恒定(策略B)和脉冲式提高(策略C)酚酸浓度。结果表明, 在单独和混合酚酸作用下, 策略B驯化菌株的比生长速率、最大生物量和乙醇生产速率均高于其他驯化菌株, 其中比生长速率的提高最显著, 可达70%以上。另外, 对羟基苯甲酸作用下, 策略C驯化菌株的葡萄糖消耗速率略高于其他驯化菌株, 相比原始菌株提高了46.73%。驯化菌株生长和发酵性能均比原始菌株得到显著提升, 其中, 策略B驯化菌株的比生长速率、最大生物量和乙醇生产速率均高于其他驯化菌株, 在生长和乙醇发酵方面对酚酸均表现出良好的耐受性(图 3)。
|
| 分别在含有抑制浓度IC75的香草酸(A), 对羟基苯甲酸(B), 混合酚酸(C)培养基中进行比较 图 3 短期酚酸胁迫策略对酵母酚酸耐受性影响 |
细胞膜是发酵微生物对有害物质的选择性屏障, 因此通过荧光探针对酚酸作用下酵母细胞膜完整性进行检测, 分析其对酚酸耐受性的原因。碘化丙啶(PI)是一种荧光染料, 能够穿过破损的细胞膜与胞内DNA结合形成能够产生红色荧光的复合物, 从而标记细胞膜受损细胞。流式细胞检测结果表明原始菌株(PS)和驯化策略培养过程的对照组菌株(Control)被PI染色的细胞率分别是28.8%和26.0%, 明显高于策略A、B和C驯化菌株, 其中策略B驯化菌株PI染色细胞率最低, 仅为10.8%(图 4), 这与上述酚酸作用下生长发酵性能的结果一致。
3 讨论木质纤维素预处理过程中主要产生呋喃、弱酸和酚类三大类抑制物[17], 其中对于酚类抑制物的研究主要集中于毒性较强的酚醛抑制物, 而对于酚酸类抑制物的作用机制和应对措施并未彻底研究清楚。单一和混合酚酸对酿酒酵母生长和发酵性能的影响表明, 单一酚酸在低浓度时, 对酿酒酵母的生长和发酵没有明显的抑制作用; 当增加到一定浓度时, 对比生长速率、糖耗速率和乙醇生产速率有明显的抑制作用, 但对产生乙醇的最高浓度没有影响。这与之前关于酚酸对其他微生物抑制作用的研究结果一致[7,9,13]。这可能因为酚酸主要对酵母的生长产生抑制, 而并不直接作用于乙醇发酵代谢路径, 从而表现出生长速率下降进而限制糖耗和乙醇生产速率。另外, 本实验所选用酚酸的抑制作用顺序为香草酸 > 丁香酸 > 对羟基苯甲酸, 这可能与其官能团类型和位置有关[5]。混合酚酸对酵母菌的生长和发酵抑制作用显著增强, 特别对发酵可达最高乙醇浓度有严重影响。这与相关研究报道的混合酚酸对其他种类微生物的生长具有协同抑制作用的结果相似[7,18]。
驯化策略在微生物育种构建鲁棒性工业发酵微生物方面是一种非常有效的方法[16,19-20]。短期驯化方法适合工业发酵实际应用, 将驯化过程整合到种子液培养过程同时完成, 简化操作步骤。本实验比较不同短期驯化策略对酿酒酵母酚酸耐受性的影响。结果表明, 驯化策略均能提高酵母菌株在单一和混合酚酸环境中的生长和发酵性能, 特别是比生长速率和葡萄糖消耗速率提高比较明显。这与之前研究报道短期驯化提高酵母对高渗透压和抑制物等恶劣条件耐受能力的结果类似[21-22]。但是, 短期驯化获得的菌株所产生的酚酸耐受性表型, 在撤去酚酸压力胁迫后并不能在子代中稳定遗传(相关数据本文没有列举), 因此推测短期驯化并未导致原始菌株产生相应的基因突变。而酵母菌株产生酚酸耐受性提高现象的原因可能是短期酚酸压力胁迫使酵母产生应激作用, 并形成了对酚酸应激反应的转录记忆, 当驯化后将其转接到酚酸培养基中, 在初始阶段酵母细胞能够很快表现出对酚酸耐受性状[23-24]。另外, 策略B驯化菌株在生长和发酵方面均优于其他驯化菌株, 这可能与不同驯化过程中酚酸浓度变化情况有关。保持恒定酚酸浓度可能更容易使细胞产生表观遗传的转录记忆。
酚类化合物因其具有较强的疏水性, 能够插入细胞膜脂质分子层破坏细胞膜的完整性, 从而导致细胞凋亡[25]。实验结果说明, 酚酸能够破坏酿酒酵母的细胞膜完整性, 这与其他酚类化合物对微生物的破坏作用机制相同。经过短期驯化策略能使酵母细胞膜在酚酸作用下能够保持良好的完整性, 从而提高对酚酸的耐受性。对于更为深入的耐受性机制分析, 将在后续研究中通过透射电镜直接观察其结构形态变化, 以及分析其细胞膜脂质成分的变化, 从而揭示酵母细胞应对酚酸的作用机制。
4 结论木质纤维素预处理过程产生的酚酸类化合物对酿酒酵母的生长有抑制作用, 从而导致乙醇发酵性能下降。多种酚酸混合后因彼此之间的相互作用会对酵母产生更强的抑制作用; 短期驯化策略能够有效提高酵母菌株在混合酚酸胁迫下的生长和发酵性能。驯化菌株酚酸耐受性的强弱与驯化过程中酚酸胁迫压力水平变化方式有关; 短期驯化提高酵母酚酸耐受性可能与细胞膜应激反应保持其完整性有关。后续将从细胞膜的结构、脂质成分, 以及相关基因等方面进行脂质组学和转录组学分析, 进一步解释其内在作用机制。
| [1] |
Yang S, Franden MA, Yang Q, et al. Identification of inhibitors in lignocellulosic slurries and determination of their effect on hydrocarbon-producing microorganisms[J]. Front Bioeng Biotech, 2018, 6(23): 1-15. |
| [2] |
Cao GL, Ren NQ, Wang AJ, et al. Effect of lignocellulose-derived inhibitors on growth and hydrogen production by Thermoanaerobacterium thermosaccharolyticum W16[J]. Int J Hydrogen Energ, 2010, 35(24): 13475-13480. DOI:10.1016/j.ijhydene.2009.11.127 |
| [3] |
Zhang L, Li X, Yong Q, et al. Impacts of lignocellulose-derived inhibitors on l-lactic acid fermentation by Rhizopus oryzae[J]. Bioresour Technol, 2016, 203: 173-180. DOI:10.1016/j.biortech.2015.12.014 |
| [4] |
Yi X, Gu H, Gao Q, et al. Transcriptome analysis of Zymomonas mobilis ZM4 reveals mechanisms of tolerance and detoxification of phenolic aldehyde inhibitors from lignocellulose pretreatment[J]. Biotechnol Biofuels, 2015, 8(1): 153. |
| [5] |
Franden MA, Pilath H, Mohagheghi A, et al. Inhibition of growth of Zymomonas mobilis by model compounds found in lignocellulosic hydrolysates[J]. Biotechnol Biofuels, 2013, 6(1): 99. |
| [6] |
Adeboye PT, Bettiga M, Olsson L. The chemical nature of phenolic compounds determines their toxicity and induces distinct physiological responses in Saccharomyces cerevisiae in lignocellulose hydrolysates[J]. AMB Express, 2014, 4: 46. DOI:10.1186/s13568-014-0046-7 |
| [7] |
Zhu J, Yang J, Zhu Y, et al. Cause analysis of the effects of acid-catalyzed steam-exploded corn stover prehydrolyzate on ethanol fermentation by Pichia stipitis CBS 5776[J]. Bioproc Biosyst Eng, 2014, 37(11): 2215-2222. DOI:10.1007/s00449-014-1199-0 |
| [8] |
Campos FM, Couto JA, Figueiredo AR, et al. Cell membrane damage induced by phenolic acids on wine lactic acid bacteria[J]. Int J Food Microbiol, 2009, 135(2): 144-151. |
| [9] |
Gu H, Zhang J, Bao J. High tolerance and physiological mechanism of Zymomonas mobilis to phenolic inhibitors in ethanol fermentation of corncob residue[J]. Biotechnol Bioeng, 2015, 112(9): 1770-1782. DOI:10.1002/bit.25603 |
| [10] |
林贝, 李健秀, 刘雪凌. 紫外诱变结合驯化提高酿酒酵母对抑制物耐受性[J]. 生物技术, 2018, 28(1): 85-91. |
| [11] |
Aulitto M, Fusco S, Nickel DB, et al. Seed culture pre-adaptation of Bacillus coagulans MA-13 improves lactic acid production in simultaneous saccharification and fermentation[J]. Biotechnol Biofuels, 2019, 12(1): 45. |
| [12] |
Narayanan V, Sànchez I, Nogué V, Van Niel EWJ, et al. Adaptation to low pH and lignocellulosic inhibitors resulting in ethanolic fermentation and growth of Saccharomyces cerevisiae[J]. AMB Express, 2016, 6(1): 59. |
| [13] |
Klinke HB, Ahring BK, Schmidt AS, et al. Characterization of degradation products from alkaline wet oxidation of wheat straw[J]. Bioresour Technol, 2002, 82(1): 15-26. DOI:10.1016/S0960-8524(01)00152-3 |
| [14] |
Zhang J, Chu D, Huang J, et al. Simultaneous saccharification and ethanol fermentation at high corn stover solids loading in a helical stirring bioreactor[J]. Biotechnol Bioeng, 2010, 105(4): 718-728. |
| [15] |
Narayanan V, Schelin J, Gorwa-Grauslund M, et al. Increased lignocellulosic inhibitor tolerance of Saccharomyces cerevisiae cell populations in early stationary phase[J]. Biotechnol Biofuels, 2017, 10(1): 114. |
| [16] |
Gu H, Zhang J, Bao J. Inhibitor analysis and adaptive evolution of Saccharomyces cerevisiae for simultaneous saccharification and ethanol fermentation from industrial waste corncob residues[J]. Bioresour Technol, 2014, 157: 6-13. DOI:10.1016/j.biortech.2014.01.060 |
| [17] |
Jönsson LJ, Martín C. Pretreatment of lignocellulose:Formation of inhibitory by-products and strategies for minimizing their effects[J]. Bioresour Technol, 2016, 199: 103-112. DOI:10.1016/j.biortech.2015.10.009 |
| [18] |
Van Der Pol EC, Vaessen E, Weusthuis RA, et al. Identifying inhibitory effects of lignocellulosic by-products on growth of lactic acid producing micro-organisms using a rapid small-scale screening method[J]. Bioresour Technol, 2016, 209: 297-304. DOI:10.1016/j.biortech.2016.03.037 |
| [19] |
Qureshi AS, Zhang J, Bao J. High ethanol fermentation performance of the dry dilute acid pretreated corn stover by an evolutionarily adapted Saccharomyces cerevisiae strain[J]. Bioresour Technol, 2015, 189: 399-404. DOI:10.1016/j.biortech.2015.04.025 |
| [20] |
张译之, 苟敏, 汤岳琴. 紫外诱变驯化提高酿酒酵母木糖发酵的抑制物耐受性[J]. 生物技术通报, 2017, 33(9): 191-199. |
| [21] |
Mettetal JT, Muzzey D, Gómez-Uribe C, et al. The frequency dependence of Osmo-adaptation in Saccharomyces cerevisiae[J]. Science, 2008, 319(5862): 482-484. DOI:10.1126/science.1151582 |
| [22] |
Cakar ZP, Alkım C, Turanlı B, et al. Isolation of cobalt hyperresistant mutants of Saccharomyces cerevisiae by in vivo evolutionary engineering approach[J]. J Biotechnol, 2009, 143(2): 130-138. |
| [23] |
Zacharioudakis I, Gligoris T, Tzamarias D. A yeast catabolic enzyme controls transcriptional memory[J]. Curr Biol, 2007, 17(23): 2041-2046. DOI:10.1016/j.cub.2007.10.044 |
| [24] |
Ben Meriem Z, Khalil Y, Hersen P, et al. Hyperosmotic stress response memory is modulated by gene positioning in yeast[J]. Cells, 2019, 8(6): 582. DOI:10.3390/cells8060582 |
| [25] |
Almeida JRM, Modig T, Petersson A, et al. Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates by Saccharomyces cerevisiae[J]. J Chem Technol Biotechnol, 2007, 82(4): 340-349. |