沉积物作为底栖生物的栖息场所和水生生态系统的重要组成部分, 是地球化学循环和生态系统耦合的重要发生区域, 是地球上各种人为源及自然源污染物的重要储存库。排入水体的持久性有机污染物大量富集在沉积物中, 造成沉积物中持久性有机污染物浓度一般比上部水体高出1-2个以上的数量级[1], 并且可能会造成水体长期的二次污染, 这不仅给水生生态系统带来危害, 而且可通过食物链的传递对人类健康构成威胁。
多环芳烃(Polycyclic aromatic hydrocarbons, PAHs)是一种典型的疏水性有机污染物[2], 由两个或两个以上苯环组成的, 广泛存在于沉积物、水体、土壤和大气中, 可通过森林火灾、火山爆发、石油泄漏、工业排放等[3]自然和人为过程释放到周围环境中。其中, 菲(Phenanthrene, PHE)是一种三环PAHs, 因其具有潜在致癌性、致畸性、致突变性及遗传毒性, 受到人类广泛关注。
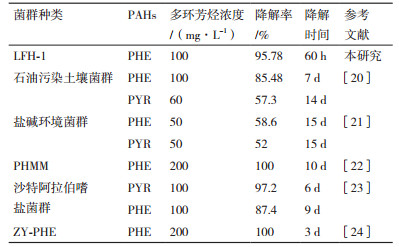
PAHs的微生物修复因其经济、高效且无二次污染等特点, 已成为去除环境中PAHs的理想方法和重要手段[4]。目前, 研究人员已从环境中分离出多种PAHs降解菌[5]。Kamyabi等[6]筛选出一株以芘(Pyrene, PYR)作为唯一碳源和能源的细菌菌株Basidioascus persicus EBL-C16可在21 d降解300 mg/L的PYR, 降解率为89.3%。Li等[7]获得一株白腐真菌Pycnoporus sanguineus 14在14 d降解20 mg/L的PHE, 降解率为45.6%。相较于单一菌株, 含有不同微生物种类的复合菌群修复效果更好, 如Bacosa等[8]和Bharatkumar等[9]富集得到的菌群对PAHs均有较高的降解率, 分别是10 d降解95%的PHE和5 d降解70.21%的PHE。这主要是由于在自然环境中, 微生物修复依赖于混合菌群的协同代谢作用, 一些微生物代谢降解过程中产生的中间产物可作为其他微生物的生长底物[10], 继而更为完全的降解修复。除此之外, 复合菌群适应性更强、抗冲击能力更高。
就目前而言, 在微生物降解持久性有机污染物工作中, 重心多放在土壤中PAHs降解菌群的富集筛选, 而对河流沉积物中PAHs高效降解菌群的筛选及降解特性研究较少。基于此, 本研究从受长期钢铁企业污染的内河河流采集表层沉积物, 经富集筛选后得到一组菲高效降解菌群, 作为进一步的生物修复资源研究菌群生物群落结构特征, 并测试在不同环境条件下降解菲的能力。
1 材料与方法 1.1 材料 1.1.1 菌群来源与试剂菌群来源:从马鞍山市内河流六汾河(31°42'N, 118°27'E)采集表层沉积物样品, 以菲作为唯一碳源进行长期驯化, 后经富集分离得到菌群。沉积物样品经检测, 其16种PAHs浓度在695.70 ng/g-33 830.20 ng/g之间, 平均浓度为6 894.36 ng/g, 组分以4环、5环为主[11]。
试剂:菲(纯度>99%); 甲醇、正己烷和丙酮均为HPLC色谱纯; 其他药品均为分析纯。
1.1.2 培养基无机盐液体培养基(g/L)[12-13]:K2HPO4·3H2O 4.25, NaH2PO4·H2O 1, NH4Cl 2, MgSO4·7H2O 0.2, FeSO4·7H2O 0.012, MnSO4·H2O 0.003, ZnSO4·7H2O 0.003, CoSO4·7H2O 0.001。蒸馏水1 000 mL, 调pH为7。
PAHs无机盐培养基:将菲溶于丙酮中制成一定浓度, 过0.22 μm滤膜除菌后加入到无机盐液体培养基中, 待丙酮挥发完后制成PAHs培养基。
上述培养基均在121℃高温灭菌20 min备用。
1.2 方法 1.2.1 高效降解菌群的富集分离取表层沉积物样品10 g加入到90 mL无菌水中, 加入一定量玻璃珠在150 r/min、35℃条件下震荡3 h。静置2 h后取5 mL上清液加入45 mL PAHs无机盐培养基中, 使得菲浓度为100 mg/L, 于150 r/min、35℃条件进行避光培养7 d。一周后取5 mL上清液加入到45 mL PAHs无机盐培养基中, 使得菲浓度为150 mg/L。富集7次后, 每次富集菲浓度增加50 mg/L, 直到菲浓度到达400 mg/L。由此得到的菌液作为储备菌液。
1.2.2 16S rRNA基因高通量测序高效降解菌群16S rRNA基因高通量测序具体步骤为:储备菌液经预处理后收集菌体; 按照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit的使用说明书提取储备菌液DNA, 检测DNA完整性; 利用Miseq测序平台的V3-V4通用引物, 构建PCR反应体系, 进行PCR扩增。
341F引物:CCCTACACGACGCTCTTCCGATCTG(barcode)CCTACGGGNGGCWGCAG
805R引物:GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC
PCR结束后, PCR产物进行琼脂糖电泳检测; 对PCR扩增片段进行DNA纯化回收, 定量混合后上机检测测序。16S rRNA基因高通量测序工作委托上海生工生物股份有限公司完成。
16S rRNA基因高通量测序数据分析:在Miseq测序过程中含有barcode序列以及测序时加入的引物和接头序列, 对于得到的原始序列(reads)数据, 首先需要去除引物接头序列, 再根据双端测序reads之间的重叠关系, 将成对的reads拼接成一条序列, 然后按照barcode标签序列识别并区分样品得到各样本数据, 最后对各样本数据的质量进行质控过滤, 得到各样本有效数据。将有效序列按照序列间的距离进行聚类, 按照97%相似水平分成不同的操作单元分类(Operational taxonomic unit, OTU), 按照RDP(Ribosomal Database Project)classifier方法对OTU进行物种分类, 并绘制菌群群落结构分布图。
1.2.3 高效降解菌群降解率取储备菌液5 mL加入到pH为7的45 mL PAHs无机盐培养基中, 使得菲浓度为100 mg/L, 以50 mL不加菌PAHs无机盐培养基为空白对照组, 于150 r/min、35℃条件下进行避光培养, 每隔12 h进行取样, 利用高效液相色谱测定剩余菲浓度、计算降解率, 考察菌群降解能力。
1.2.4 pH对高效降解菌群降解特性的影响将PAHs无机盐培养基的pH分别调整为2、3、4、5、6、7、8、9、10和11。取储备菌液5 mL分别加入到不同pH的45 mL PAHs无机盐培养基中, 使得菲浓度为100 mg/L, 以50 mL不加菌pH为7的PAHs无机盐培养基为对照组, 于150 r/min、35℃条件下进行避光培养, 考察pH对高效降解菌群降解影响, 3 d后取样测定剩余菲浓度、计算降解率。
1.2.5 温度对高效降解菌群降解特性的影响取储备菌液5 mL加入到pH为7的45 mL PAHs无机盐培养基中, 使得菲浓度为100 mg/L, 以50 mL不加菌PAHs无机盐培养基为对照组, 分别于20、25、30、35和40℃温度条件下以150 r/min进行避光培养, 考察温度对高效降解菌群降解影响, 3 d后取样测定剩余菲浓度、计算降解率。
1.2.6 不同盐度对高效降解菌群降解特性的影响改变无机盐培养基盐度、调节pH为7, 取储备菌液5 mL加入到45 mL盐度分别为0%、1%、2%、3%和4%的PAHs无机盐培养基中, 使得菲的初始浓度为100 mg/L, 于150 r/min、35℃条件下进行避光培养, 以50 mL不加菌PAHs无机盐培养基为对照组, 3 d后取样测定剩余菲浓度、计算降解率。
1.2.7 初始浓度对高效降解菌群降解特性的影响改变菲初始浓度, 将初始浓度分别设置为200、300和400 mg/L, 取储备菌液5 mL加入到45 mL pH为7的上述不同浓度PAHs无机盐培养基, 以50 mL不加菌PAHs无机盐培养基为对照组, 于150 r/min、35℃条件下进行避光培养, 考察初始浓度对高效降解菌群的降解影响, 于1、2、3、5和7 d取样测定剩余菲浓度、计算降解率。
以上实验均设置3个平行, 取值为平均值。
1.2.8 检测方法液体中菲的检测:因菲难溶于水, 为保证实验准确性, 需进行整瓶取样。
样品处理:取样后用等体积的正己烷进行液液萃取, 将上清液收集, 下层液重复萃取。萃取3次后合并萃取液, 在40℃旋转蒸发浓缩, 过无水硫酸钠柱子, 后氮吹至干加入10 mL甲醇进行溶剂替换。稀释一定倍数后4℃冰箱保存待用高效液相色谱进行检测。
HPLC检测条件:色谱柱为C18反相色谱柱, 柱温为30℃, 流动相为甲醇:水 = 90:10, 进样体积为20 µL, 停留时间9 min, 紫外检测波长为254 nm。
生物量的测定:取培养样品5 mL, 采用可见分光光度计在600 nm波长下检测菌群的光密度(OD600), 以OD600表示生物量。
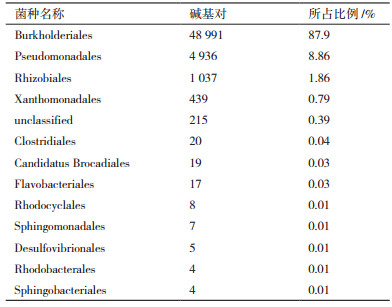
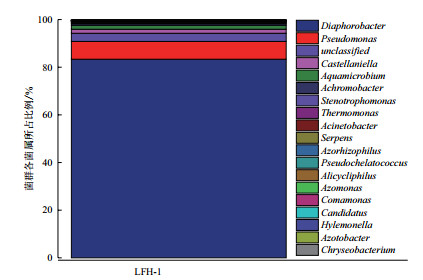
2 结果 2.1 高效降解菌群的群落结构经多次富集分离, 从表层沉积物中富集得到一组新型菲高效降解菌群, 命名为LYH-1。对菌群进行16S rRNA基因高通量测序, 得到LYH-1菌群58 783个碱基对, 平均长度为424.11 bp。LFH-1菌群具体群落组成及结构分布如表 1和图 1所示。
|
| 图 1 genus水平LFH-1菌群群落结构分布图 |
在目层面上, LFH-1菌群主要含有Burkholde-riales(87.9%)、Pseudomonadales(8.86%)、Rhizo-biales(1.86%)、Xanthomonadales(0.79%)等菌株种类。此外, 亦含有一些所占比例较少的菌株种类如Clostridiales、Candidatus Brocadiales、Flavoba-cteriale等。
在属水平上, LFH-1菌群主要包括硝基黄杆菌(Diaphorobacter)83.35%、假单胞杆菌属(Pseudomonas)7.46%、反硝化卡斯特兰尼氏菌(Castellaniella)1.67%、水微菌属(Aquamicrobium)1.65%、无色杆菌(Achromobacter)0.68%, 嗜麦芽窄食单胞菌属(Stenotrophomonas)0.39%、热单胞菌属(Thermomonas)0.34%、不动杆菌属(Acinetobacter)0.16%和嗜氮根瘤菌属(Azorhizophilus)0.13%。
2.2 高效降解菌群降解率LFH-1菌群降解率如图 2所示。从图 2可得知LFH-1菌群对菲有高效降解效果, 于60 h降解率可达到95.78%。菌群接种后几乎没有滞后期, 肉眼可见菲含量降低、培养基颜色由透明色转变为土黄色澄清状且伴有絮状生物膜产生(图 3)。在48 h时, LFH-1菌群生物量达到顶峰, 此时菲降解率可达到84.86%。在48 h过后, 菌群生物量有稍许下降, 但降解率未受生物量降低影响, 依旧缓慢升高。于84 h可将菲降解至不可检测水平。
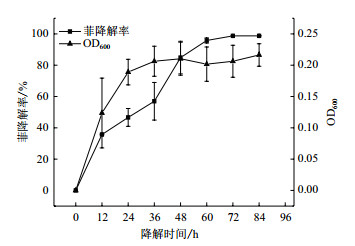
|
| 图 2 LFH-1菌群降解率 |

|
| 图 3 菌群初接种(左)及培养3 d后(右)无机盐培养基表观变化 |
pH对降解菌群降解效率影响如图 4所示。
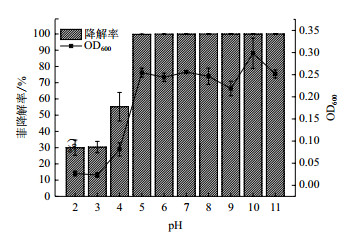
|
| 图 4 pH对菌群降解效率影响 |
结果表明, LFH-1菌群能在pH4-11之间生长, 体现出LFH-1菌群广泛的pH适应范围, 同时, LFH-1菌群在pH5-11之间降解率均能达到98%以上, 且更适合弱碱环境。当pH为2-3时, LFH-1菌群降解率在30%以下, 菌群生长量不足0.05, 近乎未生长。当pH为4时, LFH-1菌群降解率可达到55%左右, 菌群开始缓慢生长。对培养3 d的培养基重新测定pH, 发现培养基pH保持在6.44-7.33之间, 培养基pH发生较大改变。
2.3.2 温度对降解菌群降解效率影响温度对降解菌群降解效率影响如图 5所示。
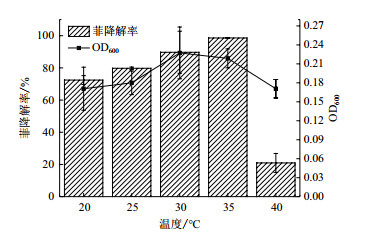
|
| 图 5 温度对LFH-1菌群降解效率影响 |
从图 5可以看出, LFH-1菌群在20-40℃均能生长, 且在35℃降解效果最好。就降解率而言, 菌群在20-35℃降解率逐步增大, 在35℃降解率达到98.61%, 近乎完全降解菲, 而在40℃时, 降解率急剧式下降仅有20.94%,
2.3.3 不同盐度对高效降解菌群降解特性的影响盐度对菌群降解效果影响如图 6所示。由图 6可以看出, 在盐度为0-4%的范围内, LFH-1菌群降解率与菌群生长量均随着盐度的增加而下降。当盐度为0%时, LFH-1菌群降解效率最高, 可近乎完全降解菲; 当盐度为1%时, LFH-1菌群降解效率影响不大, 降解率可达到97.26%;当盐度为2%时, LFH-1菌群降解急剧式下降, 降解率仅为51.75%, 菌群生长量也仅为0.127;当盐度为3%和4%时, 菌群降解率降至较低水平。
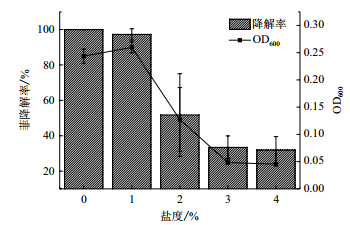
|
| 图 6 盐度对LFH-1菌群降解效果的影响 |
改变菲初始浓度, 探究菲初始浓度对LFH-1菌群降解效率影响, 结果如图 7所示。从图 7可知, LFH-1菌群整体降解趋势为平缓至增大后稳定状态。在接种初期, LFH-1菌群均存在一个缓冲期, 随着浓度的增大, 缓冲期适当延长。LFH-1菌群可降解浓度为400 mg/L的菲, 在第7天, 剩余菲浓度为14.55 mg/L, 降解率达96.36%。图 7表明, LFH-1菌群不仅高效降解菲, 且能在较高菲浓度范围内正常生长, 表明LFH-1菌群有较广的浓度适应范围。
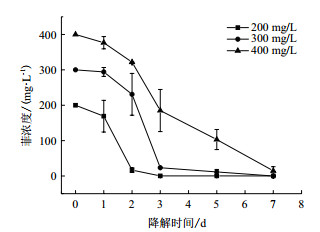
|
| 图 7 初始浓度对LFH-1菌群降解效果的影响 |
本研究通过多次富集分离从长期受钢铁企业污染的河流沉积物中得到一组新型好氧微生物菌群, 经16S rRNA基因高通量测序发现LFH-1菌群群落结构组成新颖, 其中优势菌种Diaphorobacter sp.在多环芳烃降解方面鲜有报道。Klankeo等[14]发现Diaphorobacter sp.对多环芳烃有降解能力, 能在16 d内降解99%的100 mg/L的PYR, 且能在8 d内完全降解100 mg/L的PHE, 表现出Diaphorobacter sp.对多环芳烃的降解性。多数研究认为Diaphorobacter sp.对苯酚类有一定的降解能力, 段佩玲等[15]筛选出一株以苯酚为唯一碳源的Diaphorobacter sp., 能在苯酚浓度为4 g/L环境中生长, 通过邻苯二酚-2, 3-加氧酶基因进行代谢。Yang等[16]富集筛选出一株Diaphorobacter sp., 命名为TPD-1, 该菌株可将50 mg/L三唑磷和PHT完全降解至不可检测水平。
除Diaphorobacter sp.外, LFH-1菌群也含有Pseudomonas sp.。较Diaphorobacter sp.而言, 已有大量的研究表明Pseudomonas sp.对多环芳烃具有降解能力。Kuppusamy等[17]筛选出一株Pseudomonas sp., 能够降解3环至5环多环芳烃。Ma[18]及Chebbi等[19]也筛选出Pseudomonas sp.可降解菲、芘等多环芳烃。对于Castellaniella sp.与Aquamicrobium sp.报道较少:Castellaniella sp.多数是从水及海水中筛选, 常用于海洋中石油烃的降解; Aquamicrobium sp.多数从水、土壤中筛选, 常用于硝基苯降解。结合菌群群落结构组成及各个菌株主要用途, 发现占据成分较多的菌株多是对菲有直接降解能力的, 而含量较少的菌株多是对环数较少的苯系物或烃系物的降解, 即以菲的中间产物作为主要降解目标物, 体现出混合菌群的协同代谢作用。
LFH-1菌群降解实验表明其对菲有着高效降解能力, 对比其他研究(表 2), LFH-1菌群所表现的降解能力可为后续菲污染水体或土壤提供微生物修复新的种质选择。
LFH-1菌群生长和降解特性实验表明该菌群具有广泛的pH适应范围, 此研究结果与Patel等[25]研究结果相似, 除此之外菌群更适应碱性胁迫可能是因为沉积物中pH值和氧化还原电位是控制多环芳烃降解的两个重要参数, 在好氧的情况下, 弱碱环境更适合多环芳烃矿化[26]。对培养3 d培养基测定pH, 发现pH值维持在中性附近, 是因为微生物本身具有一定的调节pH值的能力, 使得pH值处于比较适宜的状态。基于此, 推测LFH-1菌群有广泛的pH生长范围是由于菌群内部各微生物互相调节, 使得环境更适应生长, 继而达到高效降解效果。对于温度影响, 菌群在高温情况下生长及降解能力欠佳, 引起这一现象的原因可能是因为温度过高, 引起酶活性降低, 导致降解下降。研究表明[27-28], 细菌降解菲主要是在双加氧酶、脱氢酶及其他各种酶的作用下进行开环、脱氢。经过复杂的开环过程, 最终被降解为CO2和H2O。盐度是影响降解菌群降解效果的关键因素之一, 盐度过高细菌可能会脱水进入休眠期[29]。LFH-1菌群可耐受0-2%的盐度, 在实际应用中可耐受较高的盐含量, 抗冲击负荷能力强。
针对不同初始浓度影响, 建立Monod模型[30-31], 对菌群进行降解反应一级动力学模拟。动力学方程式经推导为:
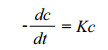 (1)
(1)
式中:c为污染物浓度, mg/L; 为反应时间, d; K为降解速率常数。
当污染物浓度降解到一半时, 所需要的时间称之为半衰期。对于一级反应而言:
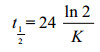 (2)
(2)
式中, K为降解速率常数。
利用公式1和公式2对一组菌群进行动力学模拟, 模拟结果见表 3。
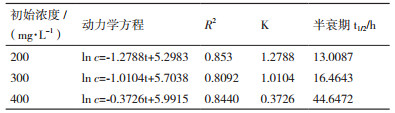
结果表明, 当浓度范围为200 mg/L-400 mg/L时, LFH-1菌群半衰期在1-44 h之间, 并随着初始浓度的增加, 降解速率逐渐下降。当降解浓度为200 mg/L时, 半衰期仅为13.01 h, 降解速率最快, 半衰期最短。基于目前所做的工作, 对后期研究进行展望:探究菌群如何协同作用, 降解途径的判断; 筛选高效单一菌株并结合固定化技术进行多环芳烃生物修复。
4 结论从长期受钢铁企业污染河流中沉积物富集出一组新型菲高效降解菌群, 命名为LFH-1。利用16S rRNA基因高通量测序对LFH-1菌群进行微生物种类分析, 结果表明LFH-1菌群主要包括硝基黄杆菌(Diaphorobacter)83.35%, 假单胞杆菌属(Pseudomonas)7.46%, 反硝化卡斯特兰尼氏菌(Castellaniella)1.67%, 水微菌属(Aquamicrobium)1.65%, 无色杆菌(Achromobacter)0.68%, 嗜麦芽窄食单胞菌属(Stenotrophomonas)0.39%, 热单胞菌属(Thermomonas)0.34%, 不动杆菌属(Acinetobacter)0.16%, 嗜氮根瘤菌属(Azorhizophilus)0.13%。
富集分离出的LFH-1降解菌群在接种量为10%、pH7、温度为35℃、150 r/min、初始菲浓度为100 mg/L的条件下48 h内菌群生长量达到顶峰, 此时菲降解率为84.86%;在60 h, 菲降解率达到95.78%;在84 h, 近乎完全降解菲, 降解达到平衡。
LFH-1菌群生长和降解特性实验表明:菌群可在pH为5-11范围内生长且保持较高的降解率; 菌群最适温度为35℃, 当温度为40℃时, 降解率降至较低水平; 盐度为1%时对菌群影响较小, 降解率依旧保持在97.26%;菌群可耐受初始浓度为400 mg/L的菲, 对不同初始浓度降解曲线进行分析, LFH-1菌群降解规律基本符合一级动力学方程, 当浓度范围为200 mg/L-400 mg/L时, LFH-1菌群降解半衰期在13-44 h之间。
| [1] |
宋世杰, 黄韬, 周胜, 等. 博斯腾湖流域沉积物中多环芳烃的时空分布、来源及生态风险评价[J]. 环境科学学报, 2019, 39(8): 2780-2790. |
| [2] |
Hadibarata T, Yusoff AR, Aris A, et al. Identification of naphthalene metabolism by white rot fungus Armillaria sp. F022[J]. J Environ Sci, 2012, 24(4): 728-732. DOI:10.1016/S1001-0742(11)60843-7 |
| [3] |
Sukhdhane KS, Pandey PK, Ajima MNO, et al. Isolation and characterization of phenanthrene-degrading bacteria from PAHs contaminated mangrove sediment of thane creek in Mumbai, India[J]. Polycyclic Aromatic Compounds, 2019, 39(1): 73-83. DOI:10.1080/10406638.2016.1261911 |
| [4] |
Kuppusamy S, Thavamani P, Megharaj M, et al. Polyaromatic aromatic hydrocarbon(PAH)degradation potential of a new acid tolerant, diazotrophic P-solubilizing and heavy metal resistant bacterium Cupriavidus sp. MTS-7 isolated from long-term mixed contaminated soil[J]. Chemosphere, 2016, 162(11): 31-39. |
| [5] |
Sun S, Wang Y, Zang T, et al. A biosurfactant-producing Pseudomonas aeruginos S5 isolated from coking wastewater and its application for bioremediation of polycyclic aromatic hydrocarbons[J]. Bioresource Technology, 2019, 281(6): 421-428. |
| [6] |
Kamyabi A, Nouri H, Moghimi H. Characterization of pyrene degradation and metabolite identification by Basidioascus persicus, and mineralization enhancement with bacterial-yeast co-culture[J]. Ecotoxicol Environ Saf, 2018, 163(11): 471-477. |
| [7] |
Li XZ, Pan YS, Hu S, et al. Diversity of phenanthrene and benz[J]. International Biodeterioration & Biodegradation, 2018, 134(10): 25-30. |
| [8] |
Bacosa HP, Inoue C. Polycyclic aromatic hydrocarbons(PAHs)biodegradation potential and diversity of microbial consortia enriched from tsunami sediments in Miyagi, Japan[J]. Journal of Hazardous Materials, 2015, 283(2): 689-697. |
| [9] |
Bharatkumar PA, Mahala K, Jain K, et al. Development of mixed bacterial cultures DAK11 capable for degrading mixture of polycyclic aromatic hydrocarbons(PAHs)[J]. Bioresource Technology, 2018, 253(4): 288-296. |
| [10] |
Wu M, Chen L, Tian Y, et al. Degradation of polycyclic aromatic hydrocarbons by microbial consortia enriched from three soils using two different culture media[J]. Environmental Pollution, 2013, 178(7): 152-158. |
| [11] |
胡文.马鞍山河流沉积物多环芳烃分布特征及其吸附机理研究[D].马鞍山: 安徽工业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10360-1018254137.htm
|
| [12] |
钟磊.菲高效降解菌的分离、鉴定及其在菲污染土壤修复中的应用研究[D].南京: 南京农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012490685.htm
|
| [13] |
Oyehan TA, Al-Thukair AA. Isolation and characterization of PAH-degrading bacteria from the eastern province, Saudi Arabia[J]. Marine Pollution Bulletin, 2017, 115(1-2): 39-46. DOI:10.1016/j.marpolbul.2016.11.007 |
| [14] |
Klankeo P, Nopcharoenkul W, Pinyakong O. Two novel pyrene-degrading Diaphorobacter sp. and Pseudoxanthomonas sp. isolated from soil[J]. Journal of Bioscience & Bioengineering, 2009, 108(6): 488-495. |
| [15] |
段佩玲, 王振宇, 党玉姣, 等. 一株Diaphorobacter属细菌对苯酚的降解特性和代谢途径[J]. 环境科学与技术, 2010, 33(8): 33-36. |
| [16] |
Yang C, Li R, Song Y, et al. Identification of the biochemical degradation pathway of triazophos and its intermediate in Diapho-robacter sp. TPD-1[J]. Current Microbiology, 2011, 62(4): 1294-1301. DOI:10.1007/s00284-010-9859-z |
| [17] |
Kuppusamy S, Thavamani P, Megharaj M, et al. Isolation and characterization of polycyclic aromatic hydrocarbons(PAHs)degrading, pH tolerant, N-fixing and P-solubilizing novel bacteria from manufactured gas plant(MGP)site soils[J]. Environmental Technology & Innovation, 2016, 6(11): 204-219. |
| [18] |
Ma Z, Liu J, Dick RP, et al. Rhamnolipid influences biosorption and biodegradation of phenanthrene by phenanthrene-degrading strain Pseudomonas sp. Ph6[J]. Environmental Pollution, 2018, 240(9): 359-367. |
| [19] |
Chebbi A, Hentati D, Zaghden H, et al. Polycyclic aromatic hydrocarbon degradation and biosurfactant production by a newly isolated, Pseudomonas sp. strain from used motor oil-contaminated soil[J]. International Biodeterioration & Biodegradation, 2017, 122(8): 128-140. |
| [20] |
李康. 盐环境下降解菌群对芘的降解特性研究[J]. 环境污染与防治, 2018, 40(7): 755-759. |
| [21] |
宋立超, 刘灵芝, 李培军, 等. 盐碱土壤多环芳烃降解菌群筛选及其降解特性[J]. 石油学报:石油加工, 2012, 28(1): 161-166. |
| [22] |
Mnif S, Chebbi A, Mhiri N, et al. Biodegradation of phenanthrene by a bacterial consortium enriched from sercina oilfield[J]. Process Safety and Environmental Protection, 2017, 107(4): 44-53. |
| [23] |
Pugazhendi A, Qari H, Basahi AB, et al. Role of a halothermophilic bacterial consortium for the biodegradation of PAHs and the treatment of petroleum wastewater at extreme conditions[J]. International Biodeterioration & Biodegradation, 2017, 121(7): 44-54. |
| [24] |
Wang F, Li C, Wang H, et al. Characterization of a phenanthrene-degrading microbial consortium enriched from petrochemical contaminated environment[J]. International Biodeterioration & Biodegradation, 2016, 115(11): 286-292. |
| [25] |
Patel V, Patel J, Madamwar D. Biodegradation of phenanthrene in bioaugmented microcosm by consortium ASP developed from coastal sediment of alang-sosiya ship breaking yard[J]. Marine Pollution Bulletin, 2013, 74(1): 199-207. |
| [26] |
Hambrick GA, Delaune RD, Patrick WH. Effect of estuarine sediment pH and oxidation-reduction potential on microbial hydrocarbon degradation[J]. Applied & Environmental Microbiology, 1980, 40(2): 365-369. |
| [27] |
王涛, 蓝慧, 田云, 等. 多环芳烃的微生物降解机制研究进展[J]. 化学与生物工程, 2016, 33(2): 8-14. DOI:10.3969/j.issn.1672-5425.2016.02.002 |
| [28] |
Aydin S, Karacay HA, Shahi A, et al. Aerobic and anaerobic fungal metabolism and omics insights for increasing polycyclic aromatic hydrocarbons biodegradation[J]. Fungal Biology Reviews, 2017, 31(2): 61-72. DOI:10.1016/j.fbr.2016.12.001 |
| [29] |
王慧, 周海燕, 黄勇, 等. 一株高环多环芳烃降解嗜盐菌Thalassospira sp.的分离及降解特性[J]. 清华大学学报:自然科学版, 2015, 55(1): 87-92. |
| [30] |
Rabodonirina S, Rasolomampianina R, Krier F, et al. Degradation of flourene and phenanthrene in PAHs-contaminated soil using pseudomonas and bacillus strains isolated from oil spill sites[J]. Journal of Environmental Management, 2019, 232(15): 1-7. |
| [31] |
苏丹, 李培军, 王鑫, 等. 3株细菌对土壤中芘和苯并芘的降解及其动力学[J]. 环境科学, 2007, 28(4): 913-917. DOI:10.3321/j.issn:0250-3301.2007.04.039 |