2. 陕西省科学院秦岭天然产物工程中心, 西安 710032
2. Engineering Center of Qinling Mountains Natural Products, Shaanxi Academy of Sciences, Xi'an 710032
菊酯类农药是目前使用最为广泛的低毒杀虫剂, 该类农药包括天然除虫菊素及其衍生物30余种, 通过扰乱昆虫电压门钠通道使之麻痹死亡[1]。过去普遍认为菊酯类对环境及人类危害不大, 但目前许多研究表明菊酯对藻类、鱼类、蜂类等有较高毒性[2-4], 干扰脊椎动物内分泌[5], 引起免疫紊乱[6], 影响孕妇及儿童[7], 具有遗传毒性[8]。为解决土壤中残留的菊酯类农药的问题, 利用微生物进行降解是一种经济且环保的方法[9]。微生物将农药作为其营养来源可分解矿化有机分子成为CO2和水, 可在短时间内有效降低土壤中农药残留的水平, 使土壤恢复健康状态[10]。有研究表明细菌[11]、真菌[12]均具有效降解菊酯类农药的潜能。本研究从土壤中筛获得一株真菌菌株, 该菌可高效分解利用高浓度氯氰菊酯, 可在较宽泛的条件下生存, 并且该菌对多种菊酯类农药均有作用, 或能解决土壤中残留菊酯类农药的问题。
1 材料与方法 1.1 材料样本来源于陕西省境内棚室、果园及秦岭等地, 共收集土壤样本70余份。
1.2 方法 1.2.1 氯氰菊酯降解菌的分离无机盐培养基:KH2PO4 0.5 g, MgSO4 0.5 g, (NH4)2SO4 0.4 g, NaCl 0.5 g, NH4NO3 1.2 g, K2HPO4 1.5 g, 酵母提取物0.05 g, pH 7.0, 至1 000 mL。在摇瓶中加入100 mL液体无机盐培养基灭菌冷却后, 加入氯氰菊酯(终浓度1 000 mg/L, 大工达10%悬浮剂), 称取土样5 g, 28℃ 180 r/min富集培养7 d, 连续转接3次。将富集菌液梯度稀释涂布于含氯氰菊酯(1 000 mg/L)的无机盐固体培养基平板上, 28℃培养7 d。选取菌落进行划线纯化, 选择单菌落, KMB或PDA斜面培养, 待长出孢子后, 取孢子液甘油-80℃低温保藏。
1.2.2 氯氰菊酯降解菌的筛选采用紫外分光光度法对筛选出的菌株进行氯氰菊酯降解菌的初步筛选。将获得的菌株活化, 于90 mL无机盐培养基中加入氯氰菊酯(终浓度1 000 mg/L), 接种菌液10 mL, 28℃ 180 r/min震荡培养, 24 h后采用紫外分光光度法235 nm测定氯氰菊酯残留量。取含菌发酵液4 mL, 加入8 mL石油醚, 振荡器上震荡1 min, 静置10 min, 重复震荡2次。吸取上层有机相, 235 nm测定氯氰菊酯残留浓度, 标准试剂购自沈阳化工研究院(含量大于99.5%)[13]。选出最优菌株后进行进一步验证, 90 mL无机盐培养基中加入氯氰菊酯(终浓度1 000,800,600,500 mg/L), 接入菌液10 mL, 设3个重复, 以无菌发酵液作为平行对照, 28℃, 180 r/min培养, 每12 h、24 h取样1次, 石油醚萃取后, 紫外分光光度法235 nm测定氯氰菊酯残留量。
1.2.3 氯氰菊酯降解菌的形态鉴定取菌株在PDA插片平板上接种, 28℃培养48 h, 待菌丝长至盖玻片上后镜检观察。分别在MA及CYA平板上接种观察其菌落形态。
1.2.4 氯氰菊酯降解菌的生长特性菌株摇瓶生长曲线:取保藏菌种转接斜面, 28℃培养48 h, 转接3次, 培养120 h待生成孢子。将孢子重悬至生理盐水反复吹吸至均匀, 接100 µL孢子悬液入PDA液体摇瓶中, 共27瓶, 28℃, 180 r/min培养, 12 h、24 h、36 h、48 h、60 h、72 h、84 h及96 h取发酵液3瓶。将全部菌体过滤至定量滤纸, 烘干称重。测定菌丝发酵生长情况。
菌株固体发酵产孢量测定:以麸皮50 g, 稻壳10 g, 水40 mL, 豆粕0.1 g, 大米粉2 g, 植物油500 µL作为固体培养基, 取摇瓶培养对数期菌丝液10%接种固体发酵, 28℃ 240 h培养, 待孢子充分形成。取培养好的发酵固体物1 g, 放入49 mL 0.5%的吐温-80溶液中(加玻璃珠), 震荡混匀, 设3次重复, 取500 µL梯度稀释, 采用平板培养法进行活菌计数, 计算产孢量。
1.2.5 降解菌的ITS rDNA序列鉴定取含孢子的斜面, 接种至摇瓶, 28℃, 180 r/min培养24 h待生成菌丝球后取含菌丝的发酵液2 mL离心, 植物基因组提取试剂盒(TIANGEN DP305)提取SSCL-5菌株的基因。ITS序列扩增采用ITS1及ITS4序列引物, PCR扩增测序。测序结果利用Blast软件在GenBank数据库中进行比对, 用系统发育树软件Clustal X及MEGA5.1构建分类系统发育树。
1.2.6 草酸青霉SSCL-5对氯氰菊酯的降解率测定准确称取0.0500 g氯氰菊酯标准品, 乙腈溶解至10 mL容量瓶(5 g/L), 梯度稀释, 制作标准曲线。氯氰菊酯加入50 mL无机盐培养基中(终浓度为500 mg/L), 接入对数生长期含菌丝发酵液5 mL, 设置3个重复及无菌发酵液对照, 28℃、180 r/min培养0 h、12 h、24 h。在带菌体的发酵液中加入石油醚50 mL震荡萃取1.5 h, 转入分液漏斗, 取下层有机相, 上层水相转入三角瓶, 萃取3次。将有机相合并, 加入无水硫酸钠, 再转入250 mL烧瓶, 56℃旋转负压蒸发至干, 分3次加入石油醚溶解, 定容至20 mL, 待HPLC测定[14]。HPLC检测:色谱柱依利特C18柱, 粒径5 µm, 流动相:水+乙腈(80:20), 流速:1 mL/min, 检测波长:235 nm, 进样量:10 µL, 柱温:35℃。
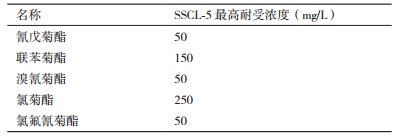
1.2.7 草酸青霉SSCL-5对其他菊酯类农药耐药能力测定文献报道表明微生物对菊酯类农药降解具有广泛性[15]。在无机盐培养基中分别加入不同浓度(终浓度分别为50,100,150,200,250 mg/L)的氰戊菊酯(庆丰20%乳油)、联苯菊酯(白拜5%乳油)、溴氰菊酯(顺丰2.5%粉剂)、氯菊酯(卫将25%粉剂)、氯氟氰菊酯(卫豹10%粉剂), 接入对数生长期含菌丝发酵液5 mL, 28℃、180 r/min培养48 h, 观察SSCL-5在该培养基中的生长情况。
1.2.8 菌剂制备及土壤室内试验验证将固体发酵物在35℃条件下烘干48 h。收集干燥物于气流粉碎机中, 按照工作5 min、停止2 min间歇模式进行粉碎, 粉碎至60目大小。将固体发酵孢子粉:麸皮:高岭土 = 2:4:4, 搅拌混合均匀, 获得菌剂。在尺寸为30 cm × 45 cm× 20 cm的土壤盒内进行室内降解试验。人工添加氯氰菊酯至土壤中, 使土壤中氯氰菊酯含量达到400 mg/kg。加入菌剂40 g搅拌均匀。中间喷施补充水分, 保持温度20-34℃, 湿度40%-60%条件, 一个月之后测定土壤氯氰菊酯残留量。
2 结果 2.1 氯氰菊酯降解菌的分离经选择性梯度稀释平板培养, 分离获得8株可耐受1 000 mg/L氯氰菊酯的微生物菌株。其中细菌菌株5株, 真菌菌株3株。其对氯氰菊酯的利用率也有差异, 需要对菌株降解能力进行进一步验证。
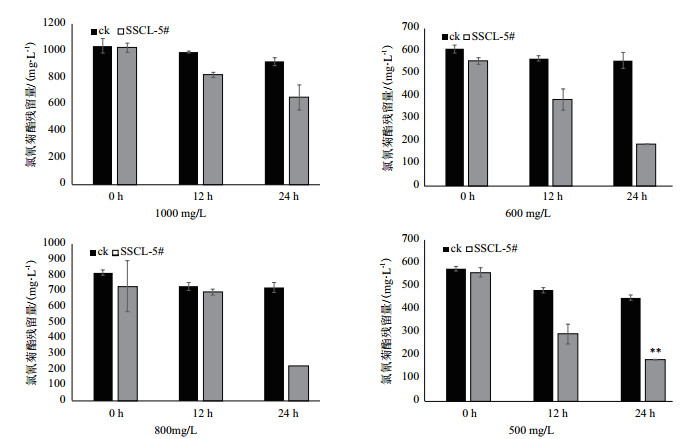
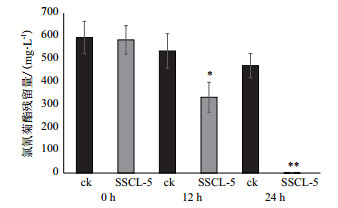
2.2 氯氰菊酯降解菌的筛选8株可利用氯氰菊酯作为唯一碳源生长的菌株中, SSCL-5的降解效果最好, 如表 1所示。因此选取SSCL-5作为出发菌株, 0 h、12 h及24 h后测定的氯氰菊酯残留浓度, 与空白对照相比, SSCL-5显著的降低了氯氰菊酯在发酵液中的含量。氯氰菊酯初始浓度500 mg/L的发酵液, 接种12 h后降解率即可达到47.9%, 对照的自然降解率为16.1%。24 h时降解率达67.9%, 对照为21.7%, 据有极显著差异(如图 1, t, P = 0.000 003), 由于测定方法的限制, 在250 mg/L以下紫外分光光度计测定值不能反映发酵液中氯氰菊酯的真实含量, 需要在HPLC中精确的检测SSCL-5的实际降解效果。
|
| *同列差异达显著水平(P < 0.05), **同列差异达极显著水平(P < 0.01) 图 1 不同浓度条件下SSCL-5菌株发酵0 h、12 h及24 h后氯氰菊酯的残留量 |
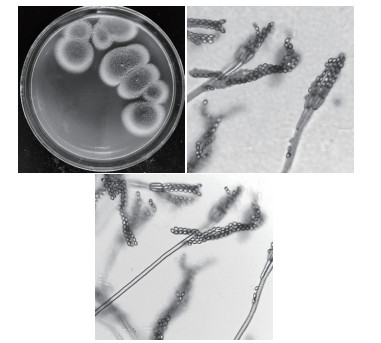
氯氰菊酯降解菌SSCL-5在MA平板上生长稍缓慢、在CYA平板上生长快, 菌丝短、绒状, 背面无色, 生成墨绿色浓密孢子。镜检显示其小梗平行排列, 6-10个, 孢子椭圆形(图 2), 鉴定该菌为草酸青霉(Penicillium oxalicum)[16]。
|
| 图 2 SSCL-5菌株形态鉴定 |
该菌以孢子悬液接种, 28℃, 180 r/min培养, 于12 h进入对数生长期, 大约在84 h进入平台期, 平台期可一直维持至96 h(图 3)。在固体发酵过程中, 适当的稻壳有利于通气, 使菌丝深入培养基, 大量孢子一般形成于第7天, 形成大约5×109个/g的孢子。
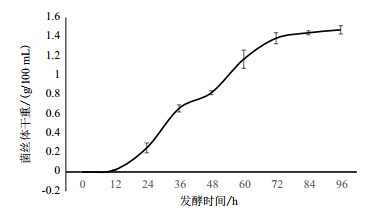
|
| 图 3 SSCL-5菌株液体及固体生长特性 |
经ITS基因扩增, 测序后经GenBank比对, 用系统发育树软件Clustal X及MEGA5.1构建系统发育树(图 4), 系统发育树显示该菌为草酸青霉(Penicillium oxalicum)。将该序列提交基因GenBank, 登录号为:MK 163534。

|
| 图 4 SSCL-5与模式菌株建树 |
HPLC检测标准品后绘制标准曲线Y = 617.54x+203 2.1(R2 = 0.999 9), 该曲线适用范围为5 mg/L-1 000 mg/L。经石油醚萃取-HPLC法测定, 摇瓶发酵24 h后氯氰菊酯残留量如图 5所示。12 h后氯氰菊酯在SSCL-5发酵液中残留量为56.9%, 与对照具极显著差异(t, P = 0.024 8)。24 h后与SSCL-5发酵液中残留量为0.2%, 对照的残留量为79.2%, 具有极显著差异(t, P = 0.000 109)。
|
| *同列差异达显著水平(P < 0.05), **同列差异达极显著水平(P < 0.01) 图 5 石油醚-HPLC法测定不同时间氯氰菊酯降解率 |
接种于不同浓度的5种菊酯类农药(氰戊菊酯、联苯菊酯、溴氰菊酯、氯菊酯、氯氟氰菊酯)无机盐培养基, 其结果表明, 草酸青霉SSCL-5具有广泛的菊酯类农药的耐受能力, 并且可能具有降解其他菊酯类农药的潜能, 如表 2、图 6所示。
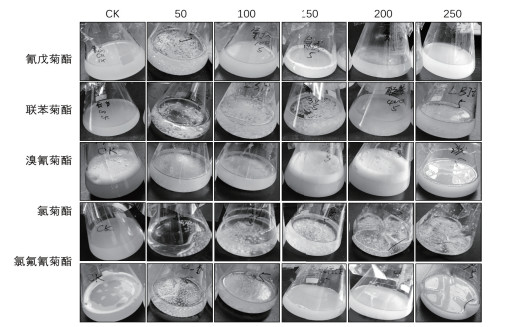
|
| 图 6 草酸青霉对其他菊酯类农药的耐受 |
SSCL-5固体发酵后期形成大量深绿色孢子, 与麸皮稻壳培养基等一起经低温烘干、间歇粉碎后形成棕色粉末。与麸皮、高岭土的菌剂复配后形成浅棕色的菌剂。土壤室内实验中依照土壤重量的千分之一施用菌剂。为使草酸青霉孢子在土壤中的萌发及定殖, 需要土壤保持相当的湿度及松散度。保持温度在20-34℃之间, 基本不会影响真菌的生长过程。可以在土壤盒内观察到白色菌丝迅速布满土壤表面的过程。经石油醚萃取-HPLC法测定, 土壤中400 mg/L的氯氰菊酯被降解至133.31 mg/L, 降解率达67.6%(表 3)。延长测定时间或降低土壤中受测氯氰菊酯的原始含量有利于菌剂对氯氰菊酯的降解效果。
近年来, 大量农药应用于农业生产过程, 一方面杀虫剂的使用有效控制植物病害, 提高作物产量, 促进了经济发展, 另一方面农药的使用和滥用引起了关注[17]。残留于土壤中的农药一部分发生降解转化, 另一部分或累积于土壤、或被植物吸收、或挥发进入大气、或进入地表、地下水[18-19]。农药残留物引起生态毒理、遗传毒性和细胞毒性、发育和生殖毒性、畸形或慢性毒性等问题[20]。研究表明氯氰菊酯在土壤中的消解动态均符合一级动力学方程, 原始沉积量与施药量、施药次数密切相关[21]。
微生物法降解土壤残留农药对于恢复生态环境、降低脊椎动物风险具有重要意义[22-23]。目前发现的对菊酯类农药具有降解能力的微生物包括细菌:如无色杆菌属(Achromobacter sp.)[24]、芽孢杆菌(Bacillus sp.)[25]、固氮弧菌(Azoarcus indigens)[26]、梭状芽孢杆菌(Clostridium sp.)[27]、鞘氨醇菌属(Sphingobium sp.)[28]、克雷伯氏菌属(Klebsiella sp.)[29]、沙雷氏属(Serratia sp.)[30]、酸单胞菌属(Acidomonas sp.)[31]、假单胞菌(Pseudomonas sp.)[32]等;放线菌:如链霉菌(Streptomyces sp.)[33]等及真菌如黑曲霉(Aspergillus niger)[34]、木霉属(Trichoderma viridae)[35]、黄孢原毛平革菌(Phanerochaete chrysoporium)[35]、菌膜假丝酵母(candida pelliculosa)[36]等。而大部分菌株在摇瓶内有效降解范围低于100 mg/L。Tallur等[37]报道微球菌属(Micrococcus sp.)菌株CPN-1可将1 000 mg/L的氯氰菊酯在8 d内降解90%。Zhao等[38]报道小链小杆菌属(Catellibacterium sp.)菌株CC-5可将500 mg/L的氯氰菊酯在7 d内降解56%。在室内土壤实验中据Akbar等人报道氯氰菊酯(200 mg/L), 在42 d内可被醋酸钙不动杆菌(Acinetobacter calcoaceticus)菌株MCm531、鞘氨醇菌属(Sphingomonas sp.)菌株RCm6、副短短芽孢杆菌(Brevibacillus parabrevis)菌株FCm9、巨大芽孢杆菌(Bacillus megaterium)菌株JCm2、红球菌属(Rhodococcus sp.)菌株JCm5或人苍白杆菌(Ochrobactrum anthropic)菌株JCm1降解90%以上[39-40]。Chen等[41]报道在田间试验中金色链霉菌(Streptomyces aureus)菌株HP-S-01可将氯氰菊酯(50 mg/L)降低81.1%。Tallur、Zhao及Chen等[36-38,41]均研究了氯氰菊酯在细菌(微球菌、芽孢杆菌、金黄色葡萄球菌、链球菌、地衣芽孢杆菌和鞘氨醇单胞菌)中的降解途径。细菌主要通过羧酸酯酶的酯键水解作用产生羧酸和醇。经过羧酸酯酶的作用可将氯氰菊酯水解, 3-苯氧基苯甲酸是氯氰菊酯细菌降解的的主要代谢产物之一。而3-苯氧基苯甲酸属雌激素类物质, 具有相当的生殖毒性[42]。在本研究中除草酸青霉SSCL-5也发现恶臭假单胞菌(Pseudomonas putida)、无色杆菌(Achromobacter sp.)、噬线沙雷氏菌(Serratia nematodiphila)、贝莱斯芽孢杆菌(Bacillus velezensis)等菌株, 对氯氰菊酯具有一定的降解性能。但部分菌株具有条件致病性如阴沟肠杆菌(Enterobacter cloacae)、苍白杆菌(Ochrobactrum anthropi)等, 部分不形成孢子的细菌例如鞘氨醇杆菌(Sphingobacterium sp.)、韩国假单胞菌(Pseudomonas koreensis)等, 均不利于应用型研究的开展。目前有关真菌降解菊酯类农药的研究报道不多, 但真菌可产生大量孢子有利于生产制备及其在土壤环境中定殖。真菌孢子的生长速度及其孢子数量的多少决定了其在土壤中定殖能力的大小及微生物菌剂制备成本的高低, 生长速度越快形成孢子数量越高则越有利于其产业化开发。因此草酸青霉的代谢途径有待于进一步的研究。
4 结论本研究采用多重筛选方法从70余份土壤中获得一株高效分解利用菊酯类农药的微生物菌株SSCL-5, 该菌株可在含1 000 mg/L的氯氰菊酯无机盐培养基中正常生长。经鉴定确定该菌为草酸青霉(Penicillium oxalicum), 产深绿色孢子。经紫外分光光度法及HPLC证实, 在无机盐培养基(氯氰菊酯400 mg/L)、28℃、180 r/min摇瓶培养24 h的条件下, 草酸青霉SSCL-5对氯氰菊酯的降解率为97%。可在含其他多种菊酯类农药的培养基中正常生长。土壤室内试验证明, 在土壤中, 温度20-34℃、水分含量保藏40%-60%, 30 d条件下, 草酸青霉SSCL-5可将土壤中400 mg/L的氯氰菊酯降解67.6%。显示了该菌株在解决氯氰菊酯在土壤残留问题中的潜能。
| [1] |
Field LM, Emyr Davies TG, O'Reilly AO, et al. Voltage-gated sodium channels as targets for pyrethroid insecticides[J]. Eur Biophys J, 2017, 46(7): 675-679. DOI:10.1007/s00249-016-1195-1 |
| [2] |
许超, 李梅梅, 曾伟, 等. 高效氯氰菊酯对蛋白核小球藻的毒性影响[J]. 环境科学与技术, 2013(S2): 6-10. |
| [3] |
Li H, Cheng F, Wei Y, et al. Global occurrence of pyrethroid insecticides in sediment and the associated toxicological effects on benthic invertebrates:An overview[J]. J Hazard Mater, 2017, 15(324): 258-271. |
| [4] |
Mužinić V, Želježić D. Non-target toxicity of novel insecticides[J]. Arh Hig Rada Toksikol, 2018, 69(2): 86-102. DOI:10.2478/aiht-2018-69-3111 |
| [5] |
Ye X, Liu J. Effects of pyrethroid insecticides on hypothalamic-pituitary-gonadal axis:A reproductive health perspective[J]. Environ Pollut, 2019, 245: 590-599. DOI:10.1016/j.envpol.2018.11.031 |
| [6] |
Skolarczyk J, Pekar J, Nieradko-Iwanicka B. Immune disorders induced by exposure to pyrethroid insecticides[J]. Postepy Hig Med Dosw, 2017, 71(0): 446-453. |
| [7] |
Irva HP, Jennifer B Sass, et al. Organophosphate exposures during pregnancy and child neurodevelopment:Recommendations for essential policy reforms[J]. PLoS Med, 2018, 15(10): e1002671. DOI:10.1371/journal.pmed.1002671 |
| [8] |
Navarrete-Meneses MDP, Pérez-Vera P. Pyrethroid pesticide exposure and hematological cancer:epidemiological, biological and molecular evidence[J]. Rev Environ Health, 2019, 34(2): 197-210. DOI:10.1515/reveh-2018-0070 |
| [9] |
Cycoń M, Piotrowska-Seget Z. Pyrethroid-degrading microorganisms and their potential for the bioremediation of contaminated soils:A review[J]. Front Microbiol, 2016, 7: 1463. |
| [10] |
Huang Y, Xiao L, Li F, et al. Microbial degradation of pesticide residues and an emphasis on the degradation of cypermethrin and 3-phenoxy benzoic acid:A review[J]. Molecules, 2018, 23(9): pii:E2313. DOI:10.3390/molecules23092313 |
| [11] |
Yang J, Feng Y, Zhan H, et al. Characterization of a pyrethroid-degrading Pseudomonas fulva strain P31 and biochemical degradation pathway of D-phenothrin[J]. Front Microbiol, 2018, 9: 1003. DOI:10.3389/fmicb.2018.01003 |
| [12] |
Deng W, Lin D, Yao K, et al. Characterization of a novel β-cypermethrin-degrading Aspergillus niger YAT strain and the biochemical degradation pathway of β-cypermethrin[J]. Appl Microbiol Biotechnol, 2015, 99(19): 8187-8198. DOI:10.1007/s00253-015-6690-2 |
| [13] |
陈连升.高效氯氰菊酯降解菌的筛选、鉴定及其降解特性研究[D].杭州: 浙江工业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10337-1013365398.htm
|
| [14] |
汪华.高效氯氰菊酯降解菌的分离、鉴定及特性研究[D].杭州: 浙江工业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10337-2009202126.htm
|
| [15] |
Maloney SE, Mauleand A, Smith ARW. Purification and preliminary characterization of permethrinase from a pyrethroid-tranforming strain of Bacillus cereus[J]. Appl Environ Microbiol, 1993, 59: 2007-2013. DOI:10.1128/AEM.59.7.2007-2013.1993 |
| [16] |
魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 507.
|
| [17] |
Saillenfait AM, Ndiaye D, Sabaté JP. Pyrethroids:exposure and health effects--an update[J]. Int J Hyg Environ Health, 2015, 218(3): 281-292. DOI:10.1016/j.ijheh.2015.01.002 |
| [18] |
Alvarez A, Saez JM, Davila Costa JS, et al. Actinobacteria:Current research and perspectives for bioremediation of pesticides and heavy metals[J]. Chemosphere, 2017, 166: 41-62. DOI:10.1016/j.chemosphere.2016.09.070 |
| [19] |
Tang W, Wang D, Wang J, et al. Pyrethroid pesticide residues in the global environment:An overview[J]. Chemosphere, 2018, 191: 990-1007. DOI:10.1016/j.chemosphere.2017.10.115 |
| [20] |
Chrustek A, Hołyńska-Iwan I, Dziembowska I, et al. Current research on the safety of pyrethroids used as insecticides[J]. Medicina(Kaunas), 2018, 54(4): pii:E61. |
| [21] |
姚国君.顺式氯氰菊酯及其代谢物的环境行为、生物毒性及其污染修复[D].北京: 中国农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10019-1017168367.htm
|
| [22] |
Pankaj, Negi G, Gangola S, et al. Differential expression and characterization of cypermethrin-degrading potential proteins in Bacillus thuringiensis strain, SG4[J]. 3 Biotech, 2016, 6(2): 225. DOI:10.1007/s13205-016-0541-4 |
| [23] |
Cycoń M, Mrozik A, Piotrowska-Seget Z. Bioaugmentation as a strategy for the remediation of pesticide-polluted soil:A review[J]. Chemosphere, 2017, 172: 52-71. DOI:10.1016/j.chemosphere.2016.12.129 |
| [24] |
Maloney SE, Maule A, Smith AR. Microbial transformation of the pyrethroid insecticides:permethrin, deltamethrin, fastac, fenvalerate, and fluvalinate[J]. Appl Environ Microbiol, 1988, 54: 2874-2876. DOI:10.1128/AEM.54.11.2874-2876.1988 |
| [25] |
Pankaj, Sharma A, Gangola S, et al. Novel pathway of cypermethrin biodegradation in a Bacillus sp. strain SG2 isolated from cypermethrin-contaminated agriculture field[J]. 3 Biotech, 2016, 6(1): 45. |
| [26] |
Ma Y, Chen L, Qiu J. Biodegradation of β-cypermethrin by a novel Azoarcus indigens strain HZ5[J]. J Environ Sci Health B, 2013, 48: 851-859. DOI:10.1080/03601234.2013.795843 |
| [27] |
Zhang S, Yin L, Liu Y, et al. Cometabolic biotransformation of fenpropathrin by Clostridium species strain ZP3[J]. Biodegradation, 2011, 22: 869-875. DOI:10.1007/s10532-010-9444-y |
| [28] |
Guo P, Wang B, Hang B, et al. Pyrethroid-degrading Sphingobium sp. JZ-2 and the purification and characterization of a novel pyrethroid hydrolase[J]. Int Biodeter Biodegr, 2009, 63: 1107-1112. DOI:10.1016/j.ibiod.2009.09.008 |
| [29] |
梁卫驱, 刘玉焕, 李荷. 氯氰菊酷降解菌的分离鉴定及其降解特性研究[J]. 广东药学院学报, 2007, 23(2): 199-203. DOI:10.3969/j.issn.1006-8783.2007.02.033 |
| [30] |
Cycón M, Zmijowska A, Piotrowska-Seget Z. Enhancement of deltamethrin degradation by soil bioaugmentation with two different strains of Serratia marcescens[J]. Int J Environ Sci Tech, 2014, 11: 1305-1316. DOI:10.1007/s13762-013-0322-0 |
| [31] |
Paingankar M, Jain M, Deobagkar D. Biodegradation of allethrin, a pyrethroid insecticide, by an Acidomonas sp.[J]. Biotechnol Lett, 2005, 27: 1909-1913. DOI:10.1007/s10529-005-3902-3 |
| [32] |
Saikia N, Das SK, Patel BK, et al. Biodegradation of beta-cyfluthrin by Pseudomonas stutzeri strain S1[J]. Biodegradation, 2005, 16(6): 581-589. DOI:10.1007/s10532-005-0211-4 |
| [33] |
Lin QS, Chen SH, Hu MY, et al. Biodegradation of cypermethrin by a newly isolated Actinomycetes HU-S-01 from wastewater sludge[J]. Int J Environ Sci Techn, 2011, 8: 45-56. DOI:10.1007/BF03326194 |
| [34] |
Liang WQ, Wang ZY, Li H, et al. Purification and characterization of a novel pyrethroid hydrolase from Aspergillus Niger ZD11[J]. J Agric Food Chem, 2005, 53(19): 7415-7420. DOI:10.1021/jf051460k |
| [35] |
Saikia N, Gopal M. Biodegradation of β-cyfluthrin by fungi[J]. J Agric Food Chem, 2004, 52: 1220-1223. DOI:10.1021/jf0349580 |
| [36] |
Chen S, Luo J, Hu M, et al. Microbial detoxification of bifenthrin by a novel yeast and its potential for contaminated soils treatment[J]. PLoS One, 2012, 7: e30862. DOI:10.1371/journal.pone.0030862 |
| [37] |
Tallur PN, Mulla SI, Megadi VB, et al. Biodegradation of cypermethrin by immobilized cells of Micrococcus sp. strain CPN1[J]. Braz J Microbiol, 2015, 46(3): 667-672. DOI:10.1590/S1517-838246320130557 |
| [38] |
Zhao H, Geng Y, Chen L, et al. Biodegradation of cypermethrin by a novel Catellibacterium sp. strain CC-5 isolated from contaminated soil[J]. Can J Microbiol, 2013, 59(5): 311-317. DOI:10.1139/cjm-2012-0580 |
| [39] |
Akbar S, Sultan S, Kertesz M. Determination of cypermethrin degradation potential of soil bacteria along with plant growth-promoting characteristics[J]. Curr Microbiol, 2015, 70: 75-84. DOI:10.1007/s00284-014-0684-7 |
| [40] |
Akbar S, Sultan S, Kertesz M. Bacterial community analysis of cypermethrin enrichment cultures and bioremediation of cypermethrin contaminated soils[J]. J Basic Microbiol, 2015, 55: 819-829. DOI:10.1002/jobm.201400805 |
| [41] |
Chen S, Geng P, Xiao Y, et al. Bioremediation of β-cypermethrin and 3-phenoxybenzaldehyde contaminated soils using Streptomyces aureus HP-S-01[J]. Appl Microbiol Biotechnol, 2012, 94: 505-515. DOI:10.1007/s00253-011-3640-5 |
| [42] |
Liu Y, Wu AH, Hu J, et al. Detection of 3-phenoxybenzoic acid in river water with a colloidal gold-based lateral flow immunoassay[J]. Analytical Biochemistry, 2015, 483: 7-11. DOI:10.1016/j.ab.2015.04.022 |