除草剂的广泛使用, 在保证农业生产过程中做出了巨大的贡献。但除草剂的过量及不恰当使用也带来了严重的环境污染问题, 导致各种除草剂在土壤和水体环境中被普遍检出[1]。敌草隆(N-(3, 4-dichlorophenyl)-N, N-dimethylurea)是一种高效选择性除草剂, 主要通过杂草根部被吸收, 也可以被茎、叶吸收, 通过抑制杂草的光合作用而使杂草死亡(通过阻断光合系统Ⅱ中质体醌的结合位点, 从而阻止电子向质体醌的转移, 进而抑制光合作用), 可有效防除大多数一年生和多年生杂草, 在棉花、大豆、花生、玉米、黄瓜、果树、咖啡、糖甘蔗和柑橘等的生产中均有较好的应用[2-4]。
敌草隆自1954年进入市场至今, 被广泛应用于农业生产。由于其难溶于水且稳定性较好, 导致其容易在环境中长期积累, 在土壤与水体中均有检出报道[5]。在土壤中, 敌草隆的残留周期从几个月到一年;而由于使用过程中的过量施用、雨水冲刷, 导致敌草隆进入水体环境, 对水生生物及饮用水造成巨大威胁[6]。因此, 敌草隆对环境及人体健康的影响受到了广泛的关注。已有研究表明, 敌草隆的接触对眼睛和皮肤具有较强的刺激作用, 同时, 敌草隆暴露实验表明, 敌草隆还具有致癌、致突变及影响代谢过程的毒性[7];同时, 敌草隆还可影响环境生物的多样性, 从而破坏生态系统[4]。敌草隆及其代谢中间产物3, 4-二氯苯胺(3, 4-dichloroaniline)在已有的报道中已被列为主要的水体污染物[8]。欧盟已将敌草隆列为欧洲淡水资源中的“优先控制污染物”[2]。因此, 如何高效的将敌草隆从环境中去除正逐渐成为环境安全的重要研究课题。
生物降解通常利用可以特定种类污染物作为唯一碳源、氮源或能源的微生物对污染物进行逐步的酶解、利用, 从而实现污染物的分解, 被认为是高效、环境友好且低成本的污染物去除方式[9-10]。随着敌草隆使用导致的环境污染的大量报道及敌草隆毒性研究的深入, 敌草隆的生物降解受到了广泛的关注, 敌草隆降解菌得到了一定量分离与报道。已报道的敌草隆降解菌来自芽孢杆菌属(Bacillus sp.)[2]、Variovarax sp.[11]、微球菌属(Micrococcus sp.)[12]等, 还包括一些真菌如灵芝菌属(Ganoderma sp.)[13]、曲霉菌属(Aspergillus sp.)[14]、小克银汉霉菌属(Cunninghamella sp.)[15]、被孢霉菌属(Mortierella sp.)[16]、脉孢菌属(Neurospora sp.)[17]等。值得注意的是, 目前获得敌草隆的降解菌数量相对较少, 降解机理研究还不充分, 且菌株在实际敌草隆污染环境中修复应用探索较少。
本研究自长期使用敌草隆的棉花地土壤中分离获得到一株能以敌草隆为唯一碳源生长的高效降解菌LX-C-06, 通过菌落形态、生理生化特征和16S rRNA基因序列分析与确定菌株LX-C-06为木糖氧化无色杆菌(Achromobacter xylosoxidans)。通过单因素分析对菌株的环境适应性展开了系统的研究, 并基于代谢中间产物分析推测了菌株对敌草隆的代谢途径, 进一步通过模拟原位土壤修复试验探索了菌株在实际应用中的潜能, 旨在丰富敌草隆降解菌资源, 为敌草隆污染环境的生物修复提供理论参考。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒本研究中所使用的敌草隆降解菌LX-C-06为本实验室自行分离、保存, 实验中使用的感受态细胞大肠杆菌Escherichia coli DH5α购自生工生物工程(上海)股份有限公司, 基因克隆用的载体(pMD18-T)购自TaKaRa公司。
1.1.2 试剂敌草隆原药(分析纯, 99%)购自上海麦克林生化科技有限公司, 以色谱纯甲醇配制为1×105 mg/L的母液备用, 使用时根据所需浓度进行添加;酵母粉、蛋白胨、琼脂粉等试剂均购自Amresco公司;化学试剂如NaCl、KH2PO4、CaCl2等均购自国药集团;基因组提取试剂盒、琼脂糖凝胶回收试剂盒、质粒提取试剂盒及PCR反应所需的DNA聚合酶等均购自生工生物工程(上海)股份有限公司;甲醇为色谱纯, 购自上海麦克林生化科技有限公司;引物合成及测序均委托生工生物工程(上海)股份有限公司进行。
1.1.3 培养基无机盐离子培养基(MSM):(NH4)2SO4 1.5 g/L, MgCl2 0.05 g/L, CaCl2 0.02 g/L, KH2PO4 1.0 g/L, K2HPO4 1.0 g/L, K2SO4 1.0g/L, NaCl 5.0 g/L, 调整pH至7.0±0.2, 定容后灭菌备用。
富集培养基:蛋白胨5 g/L, KH2PO4 1.5 g/L, K2HPO4 1.5 g/L, NaCl 10.0 g/L, MgCl2 0.05 g/L, CaCl2 0.02 g/L, 调整pH至7.0±0.2, 定容后灭菌备用。
LB培养基:胰蛋白胨10 g/L, 酵母提取物5 g/L, NaCl 10 g/L, 调整pH至7.0±0.2, 定容后灭菌备用。
所有培养基的灭菌均在121℃条件下灭菌30 min完成, 如需使用固体培养基, 在配制完成后加入1.2%(W/V)的琼脂粉后灭菌即可得。
1.2 方法 1.2.1 敌草隆降解菌的富集与分离土壤样品取至河南省安阳市白璧镇长期种植棉花且有敌草隆使用记录的棉田(北纬36°06'85″, 东经114°50'68″), 去除表层土壤后, 取底下5-10 cm处的土壤装入自封袋后置于4℃冰盒中保存并迅速送回实验室, 置于4℃冰箱保存、备用。取1.0 g土壤样品, 加入100 mL富集培养基(液体, 含敌草隆50 mg/L)中, 于30℃条件下避光震荡培养(160 r/min)。培养5 d后, 取10 mL培养液加入新鲜的100 mL富集培养基(液体)中并提高敌草隆浓度至100 mg/L, 在上述相同条件下进行培养。重复上述转接、培养方法, 并每次提高敌草隆浓度50 mg/L至最终浓度达到400 mg/L。
取最终富集的培养液进行划线至无机盐离子固体培养基上(含50 mg/L敌草隆), 于30℃条件下避光培养3 d, 挑取单菌落接种至新鲜的LB液体培养基中培养24 h(30℃, 160 r/min)。取获得的菌液1 mL在7 000 r/min条件下离心3 min, 弃上清, 获得的菌体沉淀用新鲜的无机盐离子液体培养基冲洗后再次离心(7 000 r/min, 3 min)。重复洗涤3次后用1 mL新鲜的无机盐离子液体培养基将菌体重悬浮, 用于降解能力测定。将重悬浮的菌液接种至10 mL无机盐离子液体培养基(含50 mg/L敌草隆)作为处理组, 以相同条件下不接入菌液的10 mL无机盐离子液体培养基(含50 mg/L敌草隆)作为对照组, 将处理组与对照组于30℃条件下避光震荡培养(160 r/min)5 d后取样, 检测敌草隆浓度并计算菌株对敌草隆的降解率(计算公式:降解率(%) = 100×(对照组中敌草隆浓度-处理组中敌草隆浓度)/对照组中敌草隆浓度)。重复上述实验, 直至获得稳定、高效降解敌草隆的微生物菌株。
1.2.2 敌草隆降解菌的鉴定首先, 对获得的降解菌进行16S rRNA基因序列的克隆与测序, 并对测序结果进行分析, 具体如下:将获得的敌草隆降解菌接种LB液体培养基中过夜培养, 以细菌基因组提取试剂盒对菌株进行基因组提取。以获得的基因组为模板进行16S rRNA基因的PCR扩增, 扩增使用通用引物27F和1492R, PCR反应条件为:(1)95℃ 3 min, (2)95℃ 30 s, 50℃ 30 s, 72℃ 1.5 min, 重复34次, (3)72℃ 10 min, 4℃ 60 min。使用琼脂糖凝胶回收试剂盒进行切胶回收, 回收片段连接至pMD18-T载体后转入感受态细胞E. coli DH5α后提取质粒送上海生工进行测序。对测序结果进行载体去除后进行BLAST比对, 根据比对结果, 从微生物标准命名数据库(LPSN, http://www.bacterio.net/)下载标准菌株16S rRNA基因序列构建系统发育分析, 使用MEGA 7.0软件的NJ法进行(Bootstrap value = 1 000)[18]。
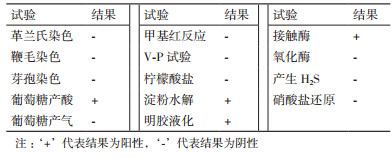
同时, 基于《Bergey’s Manual of Systematic Bacteriology》和《常见细菌系统鉴定手册》对获得菌株的生理生化特征进分析, 具体实验方法参照《常见细菌系统鉴定手册》[19-20]。
1.2.3 菌株的降解特性研究菌株的降解特性研究包括菌株对环境因素温度、pH及盐离子浓度的耐受能力, 对不同浓度敌草隆的降解能力。首先, 将获得的降解菌接种至LB液体培养基培养至OD600 = 0.8, 取1 mL菌液进行离心洗涤(参考1.2.1中离心洗涤方法)作为种子。菌株对环境因素温度、pH及盐离子浓度的耐受能力测定方法如下:(1)以10%的接种量将菌种接种至pH分别为5.0、6.0、7.0、8.0和9.0的无机盐离子液体培养基(均含50 mg/L敌草隆)中作为处理组, 以相同pH条件下的无机盐离子液体培养基不接入菌种作为对照组, 处理组与对照组均在30℃条件下避光震荡(160 r/min)培养, 每24 h测定一次敌草隆浓度;(2)以10%的接种量将菌种接种至pH为7.0的无机盐离子液体培养基(含50 mg/L敌草隆)中作为处理组, 以相同条件下的无机盐离子液体培养基不接入菌种作为对照组, 处理组与对照组分别在10℃、20℃、30℃、40℃和50℃条件下避光震荡(160 r/min)培养, 每24 h测定一次敌草隆浓度;(3)以10%的接种量将菌种接种至pH为7.0的NaCl浓度分别为1%、3%、5%、7%、9%和12%(W/V)无机盐离子液体培养基(各含50 mg/L敌草隆)中作为处理组, 以相同条件下的无机盐离子液体培养基不接入菌种作为对照组, 处理组与对照组均在30℃条件下避光震荡(160 r/min)培养, 每24 h测定一次敌草隆浓度。最后, 以10%的接种量将菌种接种至分别含100 mg/L、200 mg/L、400 mg/L、600 mg/L、800 mg/L和1 000 mg/L敌草隆的无机盐离子液体培养基(pH 7.0)中作为处理组, 以相同敌草隆浓度条件下的无机盐离子液体培养基不接入菌种作为对照组, 处理组与对照组均在30℃条件下避光震荡(160 r/min)培养, 培养5 d后测定残留敌草隆浓度并计算敌草隆降解率。上述所有实验均设3次重复, 并根据1.2.1中降解率计算公式计算敌草隆的降解率。
1.2.4 菌株对敌草隆的代谢途径研究以10%的接种量将菌种接种至分别10 mL含50 mg/L敌草隆的无机盐离子液体培养基(pH 7.0)中, 在30℃条件下避光震荡(160 r/min)培养, 每24 h取样一次。样品以等体积正己烷萃取2次后将有机相合并, 合并后的有机相通过旋转蒸发仪蒸发掉有机溶剂后, 用5 mL色谱纯的甲醇复溶, 经0.22 μm滤膜过滤后用于代谢中间产物的质谱分析。采用LC-MS对代谢中间产物进行检测, 具体如下:安捷伦LC-MS(6420), 流动相为甲醇(100%), 直接进样法(1 μL), 检测模式为负离子检测模式, 使用安捷伦Mass Hunter(v A.02.00)进行数据采集与分析, 采集信号范围为100-400 m/z。基于已有的报道结合质谱分析结果, 获得菌株降解敌草隆的代谢中间产物, 进而推测菌株对敌草隆的代谢途径。
1.2.5 菌株在模拟土壤修复中的应用将获得的降解菌在LB液体培养基中培养至OD600 = 1.0, 离心后收集菌体, 以无机盐离子液体培养基冲洗(参考1.2.1), 并以等体积的新鲜MSM重悬浮作为种子(约为5.7×106 CFU/mL)。取郑州工业应用技术学院校园内花园土壤作为供试土壤, 将土壤用20目筛子过筛去除土壤中的石子等大颗粒物质后备用。根据目标浓度将敌草隆母液加入10 g土壤中, 充分搅拌后在通风橱中进行甲醇挥发12 h, 从而获得模拟的敌草隆污染土壤。分别向10 g灭菌(121℃, 30 min, 反复2次)和未灭菌的土壤中加入敌草隆至终浓度为50 mg/kg(参照前述进行甲醇挥发处理), 加入1 mL降解菌的种子溶液, 与土壤进行充分混合, 做为处理组, 同时以10 g灭菌(121℃, 30 min, 反复2次)和未灭菌的土壤中加入敌草隆至终浓度为50 mg/kg但不接入降解菌作为对照组, 将处理组与对照至于恒温恒湿光照培养箱中, 在30℃、相对湿度50%、光照12 h、黑暗12 h条件下培养, 每5 d取样一次, 取样至30 d, 测定残留敌草隆浓度并计算降解率, 上述所有实验组与处理均设3次重复。
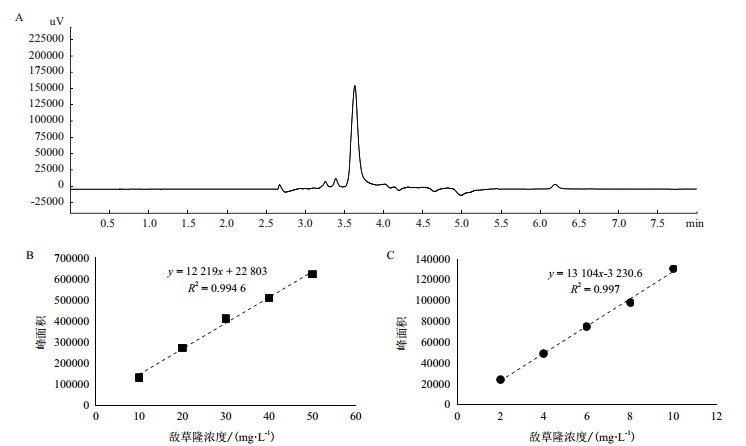
1.2.6 分析与统计方法基于气相色谱法对样品中敌草隆浓度进行测定。使用岛津气相色谱(GC-2010)建立敌草隆检测方法, 具体如下:色谱柱为Wonda Cap(10.25 mm×30 m×0.25 μm), 进样扣温度为260℃, 色谱柱采取程序升温方式(200℃保持2 min, 20℃/min升温至240℃保持4 min), 检测器温度为280℃, 载气为高纯氮气(99.999%), 气体流速为2 mL/min, 不分流进样, 进样量为1 μL, 使用电子捕获检测器(ECD)。以敌草隆标准溶液配制梯度浓度溶液, 建立浓度与峰面积间的标准曲线, 气相色谱对50 mg/L敌草隆的检测结果(保留时间为3.67 min)、2-10 mg/L和10-50 mg/L浓度区间的标准曲线如图 1所示。
|
| A:气相色谱对敌草隆的检测结果, B:10-50 mg/L间的标准曲线, C:2-10 mg/L间的标准曲线 图 1 气相色谱对敌草隆的检测与标准曲线 |
对于土壤中的敌草隆, 以正己烷作为萃取剂, 每10 g土壤中加入10 mL正己烷, 在密封条件下充分混匀后进行超声震荡混匀1 h, 取有机相(1);将剩余的土壤样品再次重复上述萃取步骤, 并最终获得有机相(2);将最终获得的土壤样品进行滤纸过滤, 用正己烷对样品进行淋洗, 大约30-50 mL, 收集滤液作为有机相(3)。最终, 将有机相(1)、(2)和(3)合并, 进行旋转蒸发并用甲醇复溶至10 mL用于敌草隆检测。同时, 测得土壤中敌草隆(浓度范围为5-50 mg/L)提取的回收效率均在96%以上。
2 结果 2.1 敌草隆降解菌的分离与鉴定经过多次对采集土壤样品的富集、驯化与分离, 筛选到一株可将无机盐离子液体培养基中的敌草隆为唯一碳源和能源进行生长, 并在5 d内对无机盐离子液体培养基中50 mg/L敌草隆的降解率为100%, 将菌株命名为LX-C-06。菌株LX-C-06在LB固体培养基上呈黄色, 菌落为边缘规则的圆形且表面光滑(图 2), 对菌株的生理生化特征分析结果如表 1所示。
|
| 图 2 菌株LX-C-06在LB固体培养基上的菌落形态 |
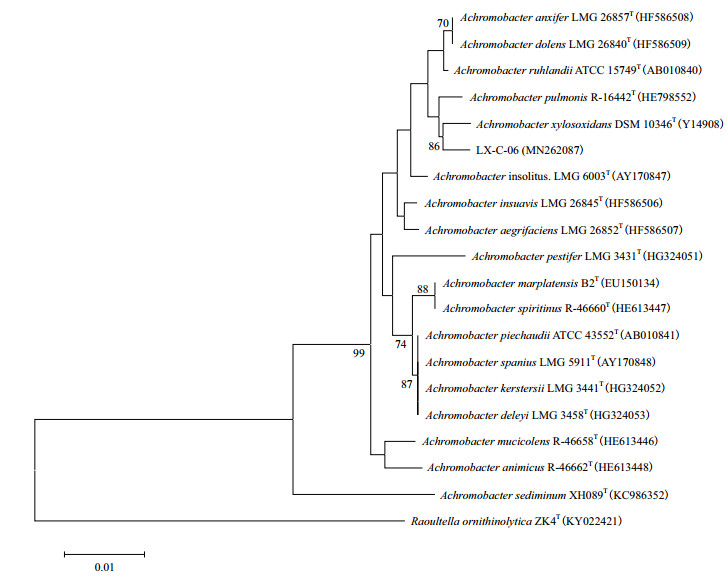
对菌株LX-C-06进行16S rRNA基因扩增后获得的片段进行连接、转化后测序, 测序结果显示PCR获得的片段长度为1 455 bp, 将获得的序列与NCBI中已有的序列进行BLAST比对并将序列提交至NCBI的GenBank(登录号为:MN262087), 结果显示菌株LX-C-06的16S rRNA基因序列与无色杆菌属(Achromobacter sp.)细菌的16S rRNA基因序列具有较高的相似性, 进一步从标准菌株命名数据库(LPSN)中下载无色杆菌属细菌所有模式菌株的16S rRNA基因序列, 并以Raoultella ornithinolytica ZK4的16S rRNA基因序列为外群, 构建系统发育树(图 3), 结果显示, 菌株LX-C-06与木糖氧化无色杆菌(Achromobacter xylosoxidans)的亲缘关系最近, 进一步结合菌株的生理生化特征, 确定菌株LX-C-06为木糖氧化无色杆菌。
|
| 图 3 菌株LX-C-06的16S rRNA基因系统发育分析 |
环境pH值对LX-C-06降解敌草隆的影响如图 4-A所示, 可以看出, 当pH为7.0时, 菌株120 h对敌草隆的降解率最高为100%;同时, 当pH为6.0和8.0时, 菌株120 h对敌草隆的降解率均大于80%(分别为80.1%和90.7%);当pH过酸或者过碱时, 菌株的降解能力受到显著抑制, pH5.0和9.0条件下菌株120 h对敌草隆的降解率分别为12.8%和36.2%;同时, 基于上述结果可以看出相对酸性条件, 菌株对碱性条件有更好的适应能力。
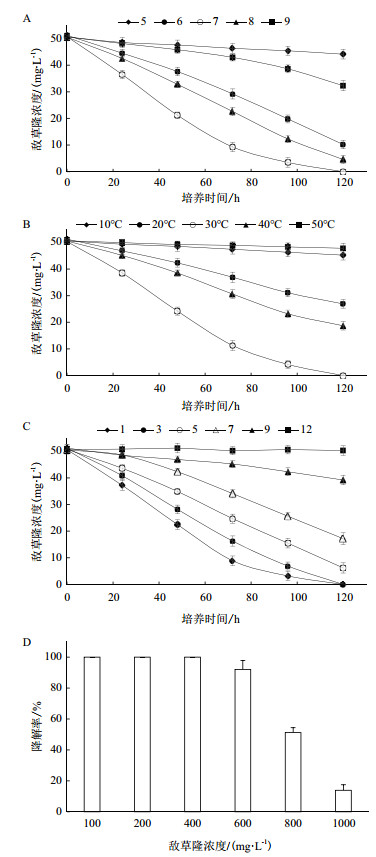
|
| A:pH对敌草隆降解的影响;B:培养温度对敌草隆降解的影响;C:盐离子浓度对敌草隆降解的影响;D:初始敌草隆浓度对敌草隆降解影响 图 4 菌株LX-C-06对敌草隆的降解特性 |
培养温度对菌株LX-C-06降解敌草隆的影响如图 4-B所示, 由图可知, 菌株LX-C-06的最佳降解温度为30℃, 且菌株对温度有较宽的耐受范围。当温度为30℃时, 120 h对50 mg/L敌草隆的降解率为100%, 而当温度为20℃和40℃时, 120 h对50 mg/L敌草隆的降解率分别为47.5%和63.0%。当温度过高(50℃)或过低(10℃)时, 菌株对敌草隆的降解受到显著抑制, 120 h对50 mg/L敌草隆的降解率分别为降解率仅为10.8%和5.6%。
菌株LX-C-06在不同盐离子浓度条件下对敌草隆的降解情况如图 4-C所示, 当NaCl浓度为1-3%时, 菌株120 h内对50 mg/L敌草隆的降解未受到影响(降解率均为100%);当NaCl浓度为5%时, 菌株120 h内对50 mg/L敌草隆的降解未受到显著影响(降解率为87.8%);随着NaCl浓度的逐渐提高, 菌株对敌草隆的降解能力受到显著抑制, 当NaCl浓度达到12%时, 菌株的降解能力被完全抑制(降解率为0)。
菌株LX-C-06在120 h对不同浓度敌草隆的降解率如图 4-D所示, 可以看出, 当敌草隆浓度≤ 400 mg/L时, 菌株LX-C-06在120 h对敌草隆的降解率均为100%;当敌草隆浓度升高至600 mg/L时, 菌株LX-C-06对敌草隆的降解能力并未受到显著影响, 在120 h对敌草隆的降解率为92.1%;当敌草隆浓度大于600 mg/L后, 菌株对敌草隆的降解能力受到显著影响, 当敌草隆浓度为800 mg/L和1 000 mg/L时, 菌株120 h对敌草隆的降解率仅为51.2%和13.9%。
2.3 菌株LX-C-06降解敌草隆的代谢中间产物及代谢途径分析对不同时间点采集的样品进行质谱分析, 根据获得的质荷比(m/z)、可能代谢中间产物的分子量(M.W.)并结合已有敌草隆降解相关报道, 推测质谱检测获得的敌草隆降解中间产物包括3, 4-二氯苯胺(3, 4-dichloroaniline, 3, 4-DCA, m/z = 161.1, M.W. = 162)、1, 2-二氯苯(1, 2-dichlorobenzene, 1, 2-DCB, m/z = 146.2, M.W. = 147)、4, 5-二氯儿茶酚(dichlorocatechol, 4, 5-DCC, m/z = 178.0, M.W. = 179)、3, 4-二氯-3-烯-1, 6-己二醇(3, 4-dichlorohex-3-ene-1, 6-diol, 3, 4-DCHED, m/z = 184.1, M.W. = 185)和3-氯-4-酮基-己二酸(3-chloro-4-oxohexanedioic acid, 3C4OHDA, m/z = 193.3, M.W. = 194)(图 5-A)。
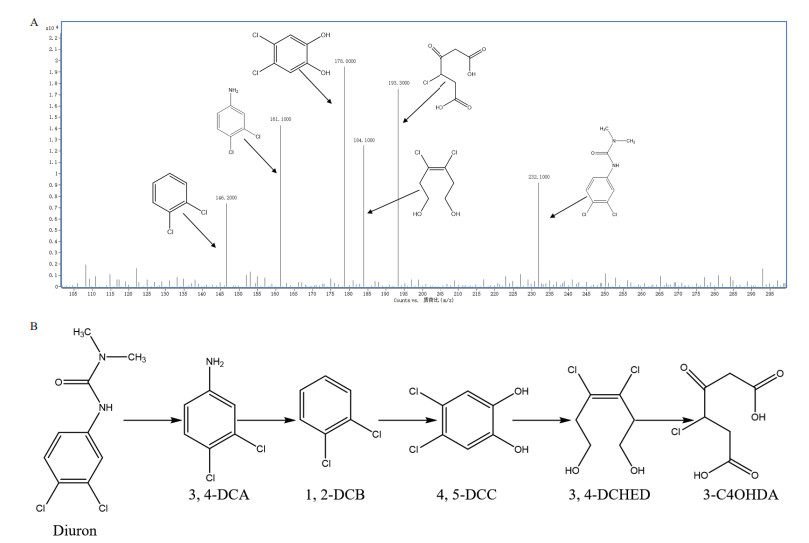
|
| 图 5 菌株LX-C-06降解敌草隆(48 h)代谢中间产物质谱分析(A)及推测的代谢途径(B) |
根据质谱分析的敌草隆降解中间产物, 推测菌株LX-C-06降解敌草隆的代谢途径为:敌草隆经水解酯键生成3, 4-二氯苯胺, 3, 4-二氯苯胺则经脱氨基作用生成1, 2-二氯苯, 而1, 2-二氯苯则在羟基化后生成4, 5-二氯儿茶酚, 4, 5-二氯儿茶酚在两个羟基之间开环生成3-氯-4-酮基-己二酸(图 5-B)。结合已有的报道, 可以推测3-氯-4-酮基-己二酸进一步通过2-氯琥珀酸脱氯转化为琥珀酸而被生物体所利用。
2.4 菌株LX-C-06在模拟土壤修复中的应用经过30 d内连续7次的采样与检测(图 6), 可以看到随着时间的发展, 在未添加菌株LX-C-06情况下, 灭菌土壤和未灭菌土壤中敌草隆浓度均无显著变化, 这表明在自然条件下敌草隆降解缓慢;在添加了菌株LX-C-06情况下, 灭菌土壤和未灭菌土壤中的敌草隆浓度均逐渐降低, 且未灭菌土壤中敌草隆浓度降低的速度快于灭菌土壤中敌草隆浓度的降低速度, 培养的30 d后未灭菌土壤和灭菌土壤中敌草隆的降解率分别为78.1%和90.7%, 结果表明添加菌株LX-C-06可显著的促进敌草隆在环境中的降解。
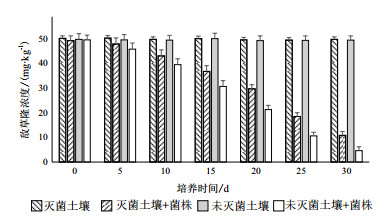
|
| 图 6 土壤中敌草隆浓度 |
随着敌草隆在农业生产中的大量使用, 其在环境中的农药残留问题日益严重, 对人体健康及生态环境安全的威胁也日益突出。在特定环境中长期使用某种农药会对该环境中微生物的种群结构及数量带来巨大影响, 同时, 也会对环境微生物进行驯化, 导致可降解、利用这些异源物质的微生物成为优势物种, 或可导致微生物发生进化而能降解周边的农药[21]。因此, 从长期使用敌草隆的环境中分离降解菌成为敌草隆降解菌资源获得的重要方法。
本研究从长期使用敌草隆除草剂的棉花田中采集土壤样品, 经过多次富集、驯化, 最终分离获得了一株可高效降解敌草隆的微生物菌株LX-C-06, 通过形态学特征、生理生化特征和16S rRNA基因序列分析确定菌株为木糖氧化无色杆菌, 这也是首次分离、获得可降解敌草隆的无色杆菌。通过单因素试验法分析了不同环境因素对菌株LX-C-06降解敌草隆能力的影响, 确定了最适降解温度和pH值分别为30℃和7.0;同时, 发现菌株可耐受较高浓度的NaCl, 在NaCl浓度≤ 7%时, 均可高效降解敌草隆;且菌株对较高浓度的敌草隆同样表现出良好的降解能力, 当敌草隆浓度≤ 600 mg/L时, 降解率均在90%以上。
菌株LX-C-06对敌草隆的代谢途径与已有报道的微生物降解敌草隆代谢途径相似, 均是通过酯键的水解将敌草隆转化为3, 4-二氯苯胺, 进一步通过逐步的脱氨、羟基化、开环等过程, 最终生成琥珀酸被生物体所利用。已有报道的菌株Bacillus licheniformis SDS12是一株可高效降解敌草隆的植物内生菌, 基于LC-MS的分析发现该菌通过相同途径将敌草隆进行逐步转化利用[2]。分离自甘蔗地的Neurospora intermedia DP8-1同样通过3, 4-二氯苯胺代谢途径对敌草隆进行降解, 同时作者开展了菌株DP8-1在敌草隆生物修复中的应用探索[17]。这些研究结果表明基于代谢中间产物3, 4-二氯苯胺的代谢途径可能是普遍存在于敌草隆降解菌中的代谢途径, 这也为进一步阐明敌草隆在环境中的转化过程及克隆获得参与敌草隆降解的相关基因提供了重要的理论参考。
在模拟土壤原位修复的探索中, 菌株LX-C-06同样表现出良好的降解性能, 30 d内对土壤中50 mg/kg敌草隆的最高降解率为90.7%。同时, 值得注意的是, 未灭菌的土壤中敌草隆的降解率高于灭菌土壤中的敌草隆的降解率, 这可能的原因是土壤中的原有微生物对敌草隆的降解具有协同、促进作用, 这在已有报道的其他污染物生物降解过程中有类似情况[21-23], 这表明菌株LX-C-06具有良好的应用潜能。
4 结论从长期使用敌草隆的棉花田土壤中分离获得了一株可高效降解敌草隆的降解菌LX-C-06, 通过形态学、生理生化特征及16S rRNA基因序列分析, 确定了该菌为木糖氧化无色杆菌。菌株LX-C-06对环境温度、pH值及NaCl浓度均表现出良好的适应性。通过代谢中间产物的质谱分析确定了菌株LX-C-06对敌草隆的代谢途径, 并通过模拟原位土壤修复探索了菌株的实际应用潜能。本研究从菌株降解特性、污染物代谢途径及菌株应用潜能3个方面对菌株LX-C-06对敌草隆的降解及应用进行了系统研究, 结果表明菌株LX-C-06对敌草隆具有高效降解能力、良好的环境适应性及较好的应用潜能。
| [1] |
吕翻洋, 许泽华, 毛晓洁, 等. 咪唑乙烟酸降解菌的分离鉴定及降解条件优化[J]. 生物技术通报, 2017, 33: 163-168. |
| [2] |
Singh AK, Singla P. Biodegradation of diuron by endophytic Bacillus licheniformis strain SDS12 and its application in reducing diuron toxicity for green algae[J]. Environmental Science and Pollution Research, 2019. DOI:10.1007/s11356-019-05922-4 |
| [3] |
Egea TC, da Silva R, Boscolo M, et al. Diuron degradation by bacteria from soil of sugarcane crops[J]. Heliyon, 2017, 3: e00471. DOI:10.1016/j.heliyon.2017.e00471 |
| [4] |
Villaverde J, Rubio-Bellido M, Merchán F, et al. Bioremediation of diuron contaminated soils by a novel degrading microbial consortium[J]. Journal of Environmental Management, 2017, 188: 379-386. |
| [5] |
赵勇, 罗志明, 朱建荣, 等. 甘蔗叶片莠灭净和敌草隆的检测及其残留降解[J]. 浙江农业科学, 2019, 60: 614-616. |
| [6] |
封国君, 王彦辉, 唐文伟, 等. 敌草隆内生降解真菌筛选[J]. 农药, 2017, 56: 339-343. |
| [7] |
Mansano AS, Moreira, Raquel AD, Hugo C, et al. , Acute and chronic toxicity of diuron and carbofuran to the neotropical cladoceran Ceriodaphnia silvestrii[J]. Environmental Science and Pollution Research, 2018, 25: 13335-13346. DOI:10.1007/s11356-016-8274-9 |
| [8] |
Sorensen SR, Juhler RK, Aamand J. Degradation and mineralisation of diuron by Sphingomonas sp. SRS2 and its potential for remediating at a realistic μg L-1 diuron concentration[J]. Pest Management Science, 2013, 69: 1239-1244. |
| [9] |
Fuch G, Boll M, Heider J. Microbial degradation of aromatic compounds-from one strategy to four[J]. Nature Reviews Microbiology, 2011, 9(11): 803-816. DOI:10.1038/nrmicro2652 |
| [10] |
Buttiglieri G, Peschka M, Frömel T, et al. Environmental occurrence and degradation of the herbicide n-chloridazon[J]. Water Research, 2009, 43: 2865-2873. DOI:10.1016/j.watres.2009.03.035 |
| [11] |
Sorensen SR, Albers CN, Aamand J. Rapid mineralization of the phenylurea herbicide diuron by Variovorax sp. strain SRS16 in pure culture and within a two-member consortium[J]. Appl Environ Microbiol, 2008, 74: 2332-2340. DOI:10.1128/AEM.02687-07 |
| [12] |
Sharma P, Chopra A, Cameotra SS, et al. Efficient biotransformation of herbicide diuron by bacterial strain Micrococcus sp. PS-1[J]. Biodegradation, 2010, 21(6): 979-987. DOI:10.1007/s10532-010-9357-9 |
| [13] |
Coelho M, Jaqueline da S, Brugnari T, et al. Evaluation of diuron tolerance and biotransformation by the white-rot fungus Ganoderma lucidum[J]. Fungal Biology, 2018, 122: 471-478. DOI:10.1016/j.funbio.2017.10.008 |
| [14] |
Oliveira BR, Penetra A, Cardoso VV, et al. Biodegradation of pesticides using fungi species found in the aquatic environment[J]. Environmental Science and Pollution Research, 2015, 22: 11781-11791. DOI:10.1007/s11356-015-4472-0 |
| [15] |
Perissini L, Bruna E, Tássia CM, et al. Evaluation of diuron tolerance and biotransformation by fungi from a sugarcane plantation sandy-loam soil[J]. Journal of Agricultural and Food Chemistry, 2016, 64: 9268-9275. DOI:10.1021/acs.jafc.6b03247 |
| [16] |
Ellegaard JL, Aamand J, Kragelund BB, et al. Strains of the soil fungus Mortierella show different degradation potentials for the phenylurea herbicide diuron[J]. Biodegradation, 2013, 24: 765-774. DOI:10.1007/s10532-013-9624-7 |
| [17] |
Wang Y, Li H, Feng G. Biodegradation of diuron by an endophytic fungus Neurospora intermedia DP8-1 isolated from sugarcane and its potential for remediating diuron-contaminated soils[J]. PLoS One, 2017, 12: e0182556. DOI:10.1371/journal.pone.0182556 |
| [18] |
Kumar S, Stecher G, Tamura K. MEGA7:Molecular evolutionary genetics analysis version 7. 0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33: 1870-1874. DOI:10.1093/molbev/msw054 |
| [19] |
George MG, Don JB, Noel RK, et al. Bergey's manual of systematic bacteriology[M]. 2nd edition. New York: Springer Publishing Press, 2001.
|
| [20] |
东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [21] |
卫正, 冯为民, 史延华, 等. 氟氯氰菊酯降解菌的筛选与降解特性的研究[J]. 生物技术通报, 2016, 32: 114-122. |
| [22] |
Silambarasan S, Abraham J. Efficacy of Ganoderma sp. JAS4 in bioremediation of chlorpyrifos and its hydrolyzing metabolite TCP from agricultural soil[J]. Journal of Basic Microbiology, 2014, 54: 44-55. DOI:10.1002/jobm.201200437 |
| [23] |
Hu J, Nakamura J, Richardson SD, et al. Evaluating the effects of bioremediation on genotoxicity of polycyclic aromatic hydrocarbon-contaminated soil using genetically engineered, higher eukaryotic cell lines[J]. Environmental Science & Technology, 2012, 46: 4607-4613. |