2. 北京工商大学食品与健康学院,北京 100048
2. School of Food and Health Engineering, Beijing Technology and Business University, Beijing 100048
抗菌肽(Antimicrobial peptide,AMP),是一种普遍存在于动植物及微生物体内的具有抗菌生物活性的小分子多肽类物质的总称[1]。相关研究表明,抗菌肽的抗菌机制和抗生素的不同,相较于抗生素而言,其不易产生耐药性,且抗细菌、真菌病毒以及肿瘤[2]。近几年,关于抗菌肽作为抗生素理想替代品的研究引发了学者们的极大兴趣[3]。
抗菌肽种类多样,常见的有植物防御素、天蚕素、杆菌肽、乳酸链球菌素、多黏菌素B等[4],杆菌肽是其中较为重要的一种。杆菌肽(Bacitracin)是由地衣芽孢杆菌和枯草芽孢杆菌等微生物通过发酵合成的短肽类抗菌素,可有效抑制革兰氏阳性菌和部分革兰氏阴性菌,具有抗菌谱广的特点[5]。1943年,美国哥伦比亚大学研究人员首次从患者的胫骨创伤污染物中分离得到产生抗菌物质的地衣芽孢杆菌,并经发酵获得了杆菌肽的成品[6]。1960年,美国批准将杆菌肽作为饲料添加剂,这使得杆菌肽的开发和应用得到了快速发展[7]。随着科学的不断进步,人们对杆菌肽特性的了解也越来越深入,杆菌肽的应用必将会随着研究的不断深入而更加广泛[8]。国外杆菌肽定量测定方法常采用微生物检定法,如管碟法、浊度法以及高效液相色谱定量测定法[9-10],且这些方法均已被国际药典和各国药典收录[11-13]。国内常用的方法参考药典,有管碟法、浊度法等[14-15],但是药典中没有对试验菌的初始浓度和培养时间等因素的具体规定[16]。因此,如何准确的测定杆菌肽的抗菌活性就成为了一个有待解决的问题。
长期以来,管碟法由于不需要特殊材料,成本低[17],而成为测定抗菌物质活性最常用的方法,但是该法耗时长、对操作人员经验要求较高、人为影响因素多。与管碟法相比,比浊法有灵敏度高、耗时短、易操作、采用液体培养法无扩散因素影响、人为因素少等优点[18]。比浊法是利用抗菌物质在液体培养基中对指示菌生长的抑制作用,其浑浊程度与活菌数的增加、菌体质量的增加等存在着直接的关系,通过测定培养后细菌浊度值的大小来表示对实验菌生长抑制的程度[19]。《中国药典》2005年版抗生素微生物检定法新增了浊度法测定方法[20]。1952年,Berridge和Barrett [21]首次应用微孔比浊法来测定抗生素效价,经过不断改进,该法已成为可以定量测定抗菌物质的一种方法[22],但是,必须使用酶标仪这一条件限制了微孔比浊法的广泛应用,若可以利用分光光度计比浊法必然会极大提高其应用普遍性[23]。
本实验采用分光光度计比浊法,以杆菌肽和沙门氏菌为例,以重复性和精密度作为指标,对比浊法试验中所涉及的指示菌初始浓度、杆菌肽溶液与菌悬液的比例、培养时间的影响进行探讨,并对各影响因素进行优化,确定其定量测定的最佳试验条件。同时,采用杆菌肽和大肠杆菌、金黄色葡萄球菌进行重复验证试验,期望得到重复性好、精密度高、具有高适用性的杆菌肽定量测定方法。
1 材料与方法 1.1 材料 1.1.1 菌株沙门氏菌ATCC 14028、大肠杆菌ATCC 44752、金黄色葡萄球菌ATCC 25923:购自中国工业微生物菌种保藏管理中心。
1.1.2 培养基营养肉汤培养基:蛋白胨10 g,牛肉膏3 g,氯化钠5 g,加水至1 000 mL,115℃灭菌30 min。
1.1.3 试剂杆菌肽(效价 > 60 U/mg):上海麦克林生化科技有限公司;磷酸盐缓冲液(pH 6.0):取磷酸氢二钾2 g与磷酸二氢钾8 g,加水至1 000 mL,115℃灭菌30 min。
1.1.4 仪器设备紫外可见分光光度计:美国Thermo公司;超净工作台:苏州安泰空气技术有限公司;恒温摇床:上海智城分析仪器制造公司。
1.2 方法 1.2.1 菌悬液的制备将活化后的沙门氏菌菌株以1%的接种量接种于营养肉汤培养基中培养至稳定期,10 000 r/min离心5 min取菌体,用生理盐水洗涤3次,将菌体重悬于生理盐水中,再按一定比例加入液体培养基备用。
1.2.2 杆菌肽溶液的配制准确称取杆菌肽100 mg,溶于10 mL磷酸缓冲液中配制成10 mg/mL的母液,再精确吸取适量母液,用磷酸缓冲液稀释成不同浓度备用。
1.2.3 培养方式选择按照1.2.1的实验方法制备初始浓度相同的菌悬液,37℃,分别静置培养和振荡培养4 h,比较细菌生长情况。
1.2.4 杆菌肽浓度与吸光度线性关系的验证在各试验管内加入含有沙门氏菌悬液的培养基9.0 mL,再分别加入各浓度杆菌肽溶液1.0 mL,立即摇匀,每一剂量采用3个试管,于37℃恒温摇床培养4 h,取出,立即于紫外分光光度计600 nm处测定吸光度;同时另取2支试管分别加入磷酸缓冲液1.0 mL,再分别加入含有沙门氏菌悬液的培养基9.0 mL,其中一支试管与上述各管同法操作作为细菌生长情况的阳性对照,另一支立即混匀,作为吸光度测定的空白液。
以杆菌肽终浓度的对数值为横坐标,以OD600为纵坐标,绘制抗菌肽浓度对数值与OD600之间的线性关系,验证二者之间是否存在线性关系。
1.2.5 抑菌测定方法的优化 1.2.5.1 指示菌初始浓度优化按照1.2.1的实验方法分别制备初始浓度为106、107、108 CFU/mL的菌悬液,然后按照1.2.4的实验方法进行实验
1.2.5.2 杆菌肽溶液与菌悬液比例优化按照1.2.1的实验方法制备指示菌初始浓度为107 CFU/mL的菌悬液,调整杆菌肽溶液与菌悬液比例分别为1:1、1:4、1:9,其余条件然后按照1.2.4的实验方法进行。
1.2.5.3 培养时间优化按照1.2.1的实验方法制备指示菌初始浓度为107 CFU/mL的菌悬液,调整培养时间分别为4 h、6 h、8 h,其余条件按照1.2.4的实验方法进行。
以上优化,每个试验设置3个平行,每个平行重复3次。建立杆菌肽浓度对数值与吸光度之间的线性回归方程,以回归方程的相关系数R2、斜率、截距以及相对标准偏差为依据,进行方法重复性、精密度、准确度的优化。
1.2.6 验证试验为进一步验证试验的可行性,选用大肠杆菌和金黄色葡萄球菌分别进行实验。
2 结果 2.1 培养方式选择指示菌初始浓度保持一致,其他培养条件一样,分别振荡和静置培养相同时间,比较OD600的变化情况,结果见图 1。振荡培养相较于静置培养OD值增量明显,静置培养OD值增量太小,会导致后续实验结果误差较大,因此培养方式选择振荡培养。

|
| 图 1 振荡培养和静置培养OD增量比较 |
本实验参考中国药典,采用比浊法,利用杆菌肽在液体培养基中对试验菌生长的抑制作用,通过测定培养后细菌浊度值的大小,寻找合适的杆菌肽浓度,使杆菌肽浓度对数值与吸光度OD值呈现线性关系,结果见图 2和表 1。结果表明,在杆菌肽溶液终浓度为0.4-0.8 mg/mL浓度范围内,杆菌肽浓度的对数值与OD600之间存在良好的线性关系,其相关系数R2均达到0.99以上。3次重复测定的结果相对偏差均较小,可见其准确性和精密度较好。

|
| 图 2 杆菌肽浓度对数值与OD600的线性关系 |
分别制备106、107、108 CFU/mL的菌悬液,进行抑菌实验,绘制杆菌肽浓度对数值与OD600之间的线性回归方程,结果见图 3。不同的指示菌初始浓度对斜率、截距及线性相关系数的结果见表 2。
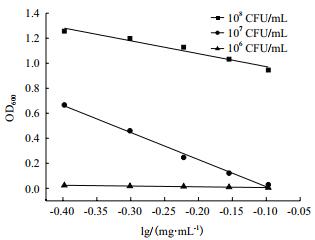
|
| 图 3 指示菌初始浓度对杆菌肽抑制沙门氏菌ATCC 14028的影响 |
当指示菌初始浓度为106、108 CFU/mL时,线性关系较差,线性相关系数均低于0.99,且当指示菌初始浓度为106 CFU/mL时,截距的RSD%超出范围;当指示菌浓度为107 CFU/mL时,斜率和截距的相对偏差均较小,线性相关系数为0.991 4,精密度良好,因此选择107 CFU/mL为最佳指示菌初始浓度。另外由图 3可以看出,指示菌初始浓度太高,抑制作用不明显;指示菌初始浓度太低,低浓度的杆菌肽就可以完全抑制菌体的生长。
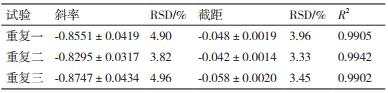
2.3.2 杆菌肽溶液与菌悬液比例优化杆菌肽溶液与菌悬液比例分别为1:1、1:4、1:9,进行抑菌实验,绘制杆菌肽浓度对数值与OD600之间的线性回归方程,结果见图 4。不同的杆菌肽溶液与菌悬液比例对斜率、截距及线性相关系数的结果见表 3。
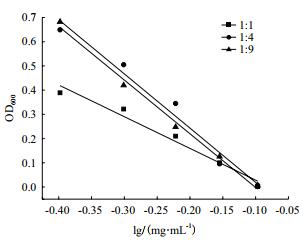
|
| 图 4 杆菌肽与菌悬液比例对杆菌肽抑制沙门氏菌ATCC 14028的影响 |
当杆菌肽溶液与菌悬液比例为1:1、1:4时,线性关系较差,精密度差,且截距的相对标准偏差超出范围;当杆菌肽溶液与菌悬液比例为1:9时,线性关系系数为0.991 5,斜率和截距的相对偏差均较小,因此选择杆菌肽溶液与菌悬液的最佳比例为1:9。
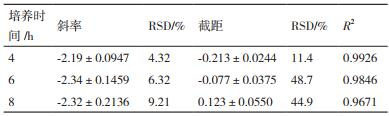
2.3.3 培养时间优化培养时间分别为4 h、6 h、8 h,进行抑菌实验,绘制杆菌肽浓度对数值与OD600之间的线性回归方程,结果见图 5。不同的培养时间对斜率、截距及线性相关系数的结果见表 4。
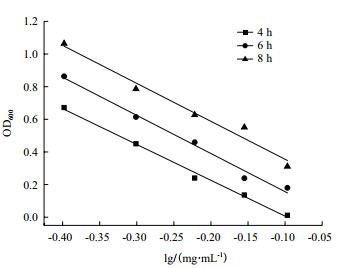
|
| 图 5 培养时间对杆菌肽抑制沙门氏菌ATCC 14028的影响 |
当培养时间为6 h和8 h时,线性关系较差,线性相关系数均低于0.99,且此时截距的RSD%超出范围;当培养时间为4 h时,斜率和截距的相对偏差均较小,线性相关系数为0.992 6,精密度良好,因此选择4 h为最佳培养时间。
实验所用的菌悬液必须新鲜配制,否则实验误差大,因实验菌放置一段时间后,细胞老化死亡,但浊度不会因此改变,从而影响实验时的活菌数[24]。
2.4 验证试验采用大肠杆菌ATCC 44752和金黄色葡萄球菌ATCC 25923对上述建立的抑菌定量测定方法进行验证,结果见图 6、7和表 5、6。
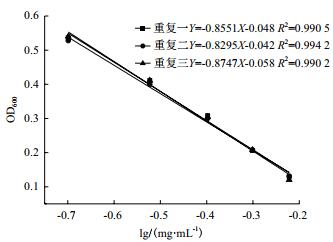
|
| 图 6 大肠杆菌验证试验的杆菌肽浓度对数值与OD600的线性关系 |

|
| 图 7 金黄色葡萄球菌验证试验的杆菌肽浓度对数值与OD600的线性关系 |
通过大肠杆菌验证试验,可以得出,杆菌肽溶液终浓度为0.2-0.6 mg/mL范围内时,OD600为0.1-0.6,杆菌肽浓度的对数值与OD600之间存在良好的线性关系,其相关系数R2均达到0.99以上;通过金黄色葡萄球菌验证试验,可以得出,杆菌肽溶液终浓度为0.003-0.007 mg/mL范围内时,OD600为0.0-0.4,杆菌肽浓度的对数值与OD600之间存在良好的线性关系,其相关系数R2均达到0.99,以上得出结果表明精密度和重复性均良好,验证了此方法的可行性。
3 讨论比浊法与管碟法相比,采用液体培养基,无扩散因素的影响;试验培养3-4 h,当天就可获得结果,具有快速灵敏、精密度好的优点[25]。比浊法常用于抗生素的抑菌性能研究中。潘强等[26]建立了比浊法测定可利霉素片效价的方法,以金黄色葡萄球菌为试验菌,菌悬液添加量为0.5%,温度为(37±0.5)℃,培养时间3.5-4.0 h测定,抗生素线性最佳浓度范围为6.4-15.7 U/mL。周志敏等[27]采用比浊法测定氯霉素效价,氯霉素溶液在3-8 U/mL浓度范围内,浓度与吸收度呈良好的线性关系。国内该方法一般用于抗生素的效价测定中,而进行抗菌肽的定量测定的研究还较少。佟斌等[28]建立了硫酸多黏菌素E的比浊法快速测定方法,当硫酸多黏菌素E的效价为30-100 U/mL时,试验菌液接种浓度为5%,培养时间为4 h,吸光度对数值与硫酸多黏菌素E效价具有良好的线性关系。目前,国内采用比浊法测定杆菌肽抑菌活性的研究较少,还未形成完善的定量测定标准。
4 结论通过比浊法优化,获得杆菌肽抑制沙门氏菌ATCC 14028的最佳测定条件:指示菌的初始浓度为107 CFU/mL,杆菌肽终浓度为0.4-0.8 mg/mL,杆菌肽溶液与菌悬液比例为1:9,培养时间为4 h。在此条件下,线性关系良好,R2达到0.99以上,为进一步验证此方法的可行性,选用大肠杆菌ATCC 44752和金黄色葡萄球菌ATCC 25923进行研究,结果重复性好,精密度高。
本研究建立的基于杆菌肽浓度对数值与吸光度之间线性关系的定量测定方法具有快速准确、操作简便、重复性好、普适性高等特点,可以广泛应用于杆菌肽的相关研究。
| [1] |
Cézard C, Silva -Pires V, Mullié C, et al. Antibacterial peptides:A review[J]. Formatex Research Center, 2011, 2011: 926-937. |
| [2] |
Hisako S, Jun I, Eiichi M, et al. In vitro and in vivo activity of antimicrobial peptides synthesized based on the insect defensin[J]. Peptides, 2003, 25(1): 19-27. |
| [3] |
苏蕾, 马玉贞, 张广洲. 新型抗生素的研究进展及研发趋势探讨[J]. 齐鲁药事, 2007, 26(8): 482-483. |
| [4] |
白永强. 抗菌肽的分类及作用[J]. 北方牧业, 2014(1): 27-29. |
| [5] |
李阳, 吴非, 蔡冬波, 等. 地衣芽胞杆菌DW2中敲除氨基酸转运蛋白基因yhdG提高杆菌肽产量[J]. 生物工程学报, 2018, 34(6): 916-927. |
| [6] |
Haavik HI. Studies on the formation of bacitracin by Bacillus licheniformis:role of catabolite repression and organic acids[J]. Journal of General Microbiology, 1974, 84(2): 321-326. DOI:10.1099/00221287-84-2-321 |
| [7] |
金光耀. 杆菌肽产品在动物饲料中的应用研究进展[J]. 畜牧与饲料科学, 2014, 35(5): 39-40. |
| [8] |
何晶晶, 朱倩倩, 许艺珊, 等. 杆菌肽研究进展及其应用[J]. 畜牧与饲料科学, 2015, 36(3): 36-37. DOI:10.3969/j.issn.1672-5190.2015.03.016 |
| [9] |
Potts AR, Psurek T, Jones C, et al. Validation of a quantitative HPLC method for bacitracin and bacitracin zinc using EDTA as a mobile-phase modifier[J]. J Pharm Biomed Anal, 2012, 70: 619-623. DOI:10.1016/j.jpba.2012.06.016 |
| [10] |
Capitan-Vallvey L, Titos A, Checa R, et al. High-performance liquid chromatography determination of Zn-bacitracin in animal feed by post-column derivatization and fluorescence detection[J]. Journal of Chromatography, 2002, 943(2): 227-234. DOI:10.1016/S0021-9673(01)01442-X |
| [11] |
The European Pharmacopeia Commission. The European Pharmacopeia(9. 0)[S]. Strasbourg: Council of Europe, 2017.
|
| [12] |
The United States Pharmacopeia Commission. The United States Pharmacopeia(USP41)[S]. Rockville M: the United States Pharmacopeia Convention, 2018.
|
| [13] |
The British Pharmacopeia Commission. The British Pharmacopeia(2017)[S]. British Pharmacopeia Commission Laboratory, 2017.
|
| [14] |
贾英民, 刘杨柳, 陈洲. 抗菌肽研究现状及其在食品安全中的应用前景[J]. 食品科学技术学报, 2017, 35(6): 1-9. |
| [15] |
Wiegand I, Kai H, Hancock R. Agar and broth dilution methods to determine the minimal inhibitory concentration(MIC)of antimicrobial substances[J]. Nature Protocols, 2008, 3(2): 163-175. DOI:10.1038/nprot.2007.521 |
| [16] |
国家药典委员会.中华人民共和国药典(2015版)[S].北京: 中国医药科技出版社, 2015.
|
| [17] |
Lalpuria M, Karwa V, Anantheswaran RC, et al. Modified agar diffusion bioassay for better quantification of Nisaplin[J]. Journal of Applied Microbiology, 2013, 114(3): 663-671. DOI:10.1111/jam.12078 |
| [18] |
应茵, 楼娉婷. 比浊法测定多西环素效价含量[J]. 药学实践杂志, 2013, 31(5): 368-370. DOI:10.3969/j.issn.1006-0111.2013.05.014 |
| [19] |
蔡姗英, 王妤, 蔡小惠. 比浊法测定复方地喹氯胺含片中短杆菌素的效价[J]. 海南医学院学报, 2007, 13(3): 218-220. DOI:10.3969/j.issn.1007-1237.2007.03.006 |
| [20] |
杨亚莉, 胡昌勤. 中国药典2005年版微生物检定法的增修订情况及要点[J]. 中国抗生素杂志, 2005, 30(12): 721-726. DOI:10.3969/j.issn.1001-8689.2005.12.005 |
| [21] |
Berridge NJ, Barrett J. A rapid method for the turbidimetric assay of antibiotics[J]. J Gen Microbiol, 1952, 6(1-2): 14-20. DOI:10.1099/00221287-6-1-2-14 |
| [22] |
张恩户, 乔慧, 王光建, 等. 微孔比浊法测定牛黄上清片的抗菌效价[J]. 中药药理与临床, 2012, 28(3): 23-25. |
| [23] |
王凯旋, 卫兰兰, 洪婷, 等. 分光光度计比浊法测定抗菌物质效价[J]. 食品与发酵工业, 2015, 41(3): 209-214. |
| [24] |
杨天赐, 彭宣宪. 微生物比浊法检定抗生素G-418效价[J]. 中国抗生素杂志, 2008, 33(2): 90-92. |
| [25] |
文晓玲, 刘兴兰, 任玺如. 比浊法测定阿奇霉素效价[J]. 中国药事, 2005, 19(6): 349-350. DOI:10.3969/j.issn.1002-7777.2005.06.015 |
| [26] |
潘强, 徐秋阳, 潘智鹏, 等. 比浊法自动测定可利霉素片的效价[J]. 中国药品标准, 2012, 13(5): 354-357. DOI:10.3969/j.issn.1009-3656.2012.05.010 |
| [27] |
周志敏, 陈少萍. 比浊法测定氯霉素效价的研究[J]. 临床合理用药杂志, 2010, 3(16): 63-64. DOI:10.3969/j.issn.1674-3296.2010.16.040 |
| [28] |
佟斌, 吴兆亮, 殷昊, 等. 比浊法快速测定硫酸多黏菌素E效价[J]. 中国抗生素杂志, 2007, 3(5): 300-302. DOI:10.3969/j.issn.1001-8689.2007.05.012 |