2. 浙江省农业科学院农产品质量标准研究所 省部共建农产品质量安全国家重点实验室,杭州 310021
2. Zhejiang Academy of Agricultural Sciences, State Key Laboratory for Quality and Safety of Agro-products, Hangzhou 310021
食品安全关乎人们的身体健康和生命安全,已经成为当前全社会关注的热点问题。近年来肉制品掺假屡禁不止,肉制品以次充好,引起人们对食品安全的高度关注[1]。肉及肉制品动物源性成分核酸检测是判断掺假肉的最常用技术之一[2]。与核DNA相比,线粒体DNA具有其特殊的母系遗传方式和胞内多拷贝带来的高灵敏度检测的特征,因此,除被广泛用于饲料、生鲜及肉制品的来源追踪和物种成分鉴别等研究外,线粒体DNA在国内外还被用于掺假肉类的定量检测[3-7]。
鸭肉是我国较为便宜的畜牧业肉类品种,也是最常见的被用于掺假的肉品。近年来,在国内外PCR技术在肉类掺假以及肉类品种来源分析中以及得到广泛应用[8-9]。林霖等[10]构建了实时荧光PCR检测方法用于检测番鸭、家鸭DNA成分,为识别掺假肉类提供了技术支持。但是,荧光定量PCR需要依赖标准曲线,由于不同组织中线粒体的拷贝数不同[11-12],使得基于线粒体DNA的肉类掺假定量检测存在客观的技术局限性。微滴式数字PCR可以通过对样品进行微滴化处理,对每个微滴逐个进行检测,从而实现绝对定量。
本研究通过数字PCR技术测定不同品种鸭不同组织中线粒体DNA和核DNA的拷贝数,对线粒体和核DNA的拷贝数比值进行分析,旨在探寻鸭肉制品掺假定量检测的最佳组织来源,并为检测机构定量鸭肉掺假比例筛选合适的靶DNA提供一定的借鉴。
1 材料与方法 1.1 材料不同品种(绍兴鸭、北京鸭、缙云麻鸭、攸县麻鸭、高邮麻鸭、金定麻鸭、山麻鸭、GD-绍兴鸭和马太湖鸭)的生鲜鸭来源于浙江省农业科学院畜牧兽医研究所和中国农业科学院北京畜牧兽医研究所,其中北京鸭和绍兴鸭的取样组织包括鸭血、鸭胸、鸭肝、鸭皮、鸭心及鸭腿;缙云麻鸭、攸县麻鸭、高邮麻鸭和GD-绍兴鸭的取样组织包括鸭胸和鸭腿;山麻鸭、金定麻鸭、攸县鸭和马太湖鸭的取样组织为鸭血。
动物组织DNA试剂盒购自杭州新景生物试剂开发有限公司;血液DNA提取试剂盒购自浙江易思得生物科技有限公司;预混液ddPCR Supermix for Probes和Droplet Generation Oil for Probes购自美国Bio-Rad;引物和探针由杭州尚亚赛生物科技有限公司合成。
1.2 方法 1.2.1 样品处理和DNA提取用无菌手术刀将试验材料切成小块,先在液氮中将样品迅速冷冻并研磨成粉末。按照试剂盒说明书的要求称取一定量的样品,采用相应的试剂盒对所有样品进行DNA提取,每个样品设置3个平行重复。
1.2.2 DNA浓度、纯度和盐残留测定各取1 μL的DNA样品溶液用Qubit 2.0进行DNA的浓度检测,利用NanoDrop 2000进行纯度和盐残留等指标的检测。
1.2.3 鸭源性微滴式数字PCR检测体系的建立鸭线粒体基因和核单拷贝基因的PCR引物和探针序列参考文献合成[13],线粒体12S rRNA基因的上游引物序列为5'-GATCAAAATGCAACTAAGCTGTCGC-3';下游引物序列为5'-GACCTGTCTTATTAGCGGGGTG-CTG-3';探针序列为FAM-CCCTAAATCTTGATACT-TACCCTACCGAA-BHQ1;IL-2核基因的上游序列为5'-GGAGCACCTCTATCAGAGAAAGACA-3',下游序列为5'-GTGTGTAGAGCTCAAGATCAATCCC-3',探针序列为FAM-TGGGAACAAGCATGAATGTAAGTG-GATGGT-BHQ1。将上述提取的不同鸭组织DNA稀释至同一浓度后作为模板,进行微滴式数字PCR反应。PCR体系为20 μL,含前述步骤所得的DNA模板2 μL,2×ddPCR Supermix for Probes反应液10 μL,10 μmol/L的上下游引物各1 μL,10 μmol/L的探针0.5 μL,其余用ddH2O补足到20 μL。
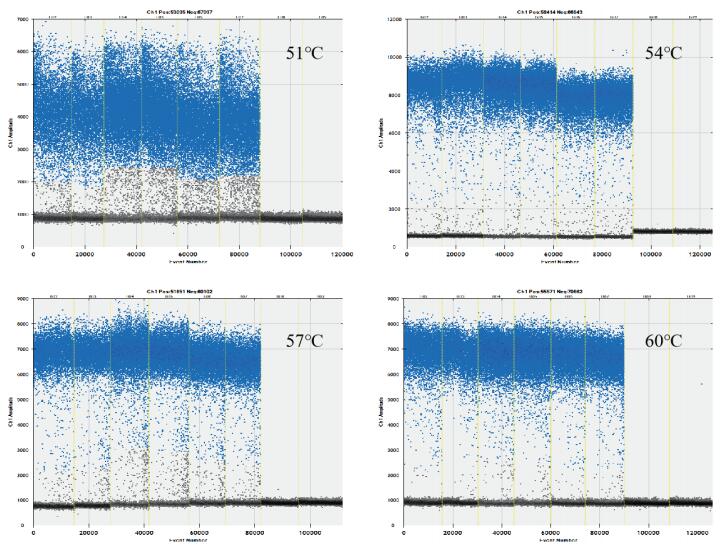
PCR反应程序中退火温度的高低对微滴下雨现象有显著的影响,在反应程序的退火环节,设置了温度梯度。根据PCR反应的热图,鸭源性基因组DNA在不同的退火温度下,微滴的荧光强度存在较显著差异(图 1)。比较不同退火温度的数字PCR扩增热图,发现在退火温度为60℃时,没有明显的下雨现象,确定数字PCR的最佳退火温度60℃。最终,确定微滴式数字PCR反应程序如下:95℃预变性10 min;40个循环(94℃变性15 s,60℃退火延伸1 min);98℃变性10 min;4℃保存。
|
| 图 1 微滴式数字PCR退火温度优化扩增热图 |
微滴式数字PCR结束后,将96孔板置入微滴读取仪中读取信号,使用软件QuantaSoft Version 1.6.6.0320分析实验数据,获得DNA模板拷贝数的绝对定量结果。
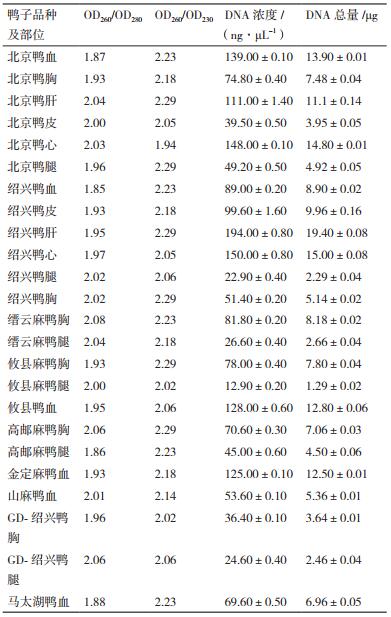
2 结果 2.1 DNA质量测定采用荧光计Qubit 2.0测定DNA浓度,利用NanoDrop 2000核酸蛋白测定仪来测定DNA纯度和盐残留情况,提取DNA的浓度及纯度等参数见表 1。结果显示,提取的DNA浓度在20 ng/μL-200 ng/μL之间,说明在不同组织中都能提取到较理想的DNA;OD260/OD280比值基本都在1.8-2.0之间,说明蛋白质和RNA等杂质残留少;OD260/OD230比值普遍大于2.0,说明核酸中盐分等杂质残留少,提取的DNA质量较好。鉴于所提取组织的DNA浓度不同,因此将工作浓度统一调整为8.89 ng/μL,并用于后续实验。
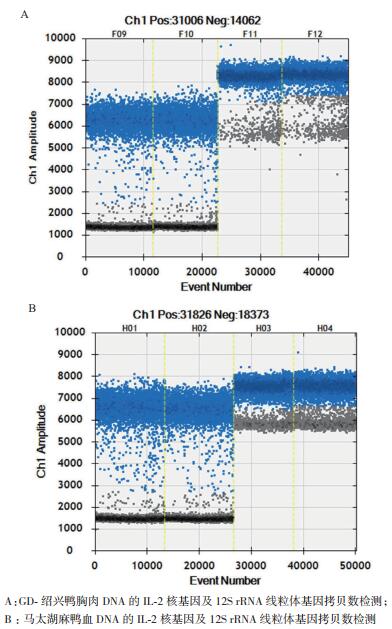
微滴式数字PCR可实现对基因拷贝数的绝对定量,如在反应体系中加入GD-绍兴鸭胸和马太湖麻鸭血的DNA,利用微滴式数字PCR分别读取IL-2核基因和12S rRNA线粒体基因的拷贝数。从图 2可知,灰色为阴性微滴,蓝色为阳性微滴,在FAM荧光通道上均扩增出鸭源性的信号,且得到良好的扩增,满足分析要求。从实验结果来看,不同鸭品种间的DNA其IL-2核基因的拷贝数较为稳定,而12S rRNA线粒体基因的拷贝数变化较大,表明线粒体的丰度存在较大差异。
|
| 图 2 微滴式数字PCR检测不同品种鸭组织DNA核和线粒体DNA的拷贝数 |
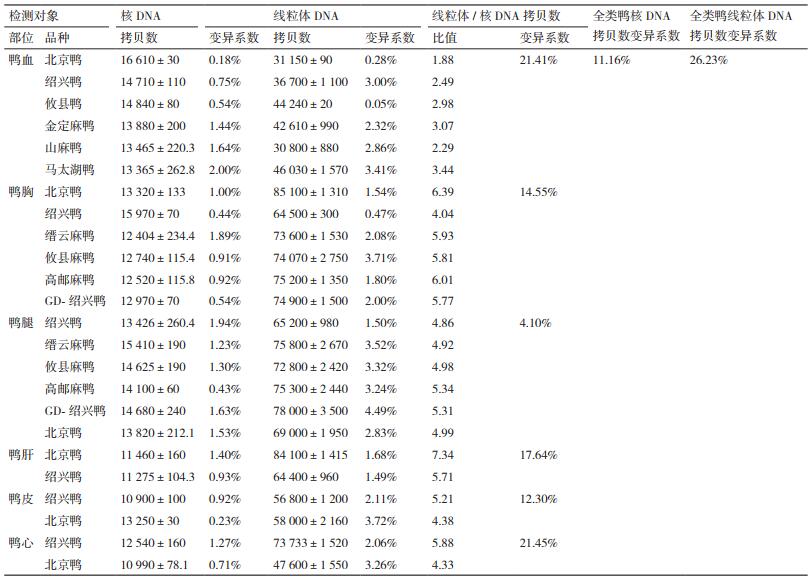
结果如表 2所示,微滴式数字PCR反应测得8.89 ng/μL的DNA中含有的核DNA拷贝数平均值为13 470,与理论值[14]接近,所有组织中核DNA拷贝数的变异系数为11.16%,小于线粒体DNA拷贝数的变异系数(26.23%),表明核DNA是开展鸭肉制品掺假定量检测的最适DNA来源。线粒体DNA的拷贝数在不同鸭品种乃至同一品种不同组织间存在较大差异。整体而言,鸭肝中线粒体拷贝数最高;鸭心、鸭胸肉、鸭腿肉和鸭皮中的线粒体拷贝数次之;鸭血中的线粒体拷贝数最低。
线粒体DNA的拷贝数和核DNA拷贝数的比值能反映提取DNA中线粒体的相对丰度。如表 2所示,鸭肝中线粒体/核DNA拷贝数比值最高;鸭心及鸭胸/腿肉中的拷贝数比值次之;鸭皮的拷贝数比值再次之;鸭血的拷贝数比值最低。分析6个不同组织中线粒体/核DNA拷贝数比值后可知,鸭肝中线粒体/核DNA拷贝数比值的变异系数最大;鸭血和鸭心次之;而鸭腿肉的变异系数最小(4.10%)。
3 讨论以DNA为基础的PCR技术被广泛用于食品中动物源性成分的鉴别,目前国内外学者常利用线粒体基因来开展肉类掺假的定性和定量检测[15-18]。众所周知,线粒体是产生ATP的细胞器,在能量代谢旺盛的细胞中,线粒体的数量相对丰富[19]。然而,由于不同组织的能量代谢水平不同,其线粒体的丰度也不尽相同,这势必影响基于线粒体DNA的肉类掺假定量检测的准确性。本研究提取了9个鸭品种不同组织的总DNA,并测定了线粒体DNA和核DNA的拷贝数及其比例情况。
从检测结果可知,不同品种鸭源性核DNA的拷贝数稳定性好,而线粒体DNA拷贝数在不同组织中存在较大的差异,核DNA是开展鸭肉掺假定量检测的最优选择。在检测的6个组织中,鸭肝中线粒体/核DNA拷贝数比值及其最大,这与肝脏是重要的代谢器官密切相关[20];鸭胸肉、鸭心、鸭腿肉和鸭皮次之,这与心肌细胞参与心脏舒缩活动和骨骼肌参与机体运动密不可分[21];鸭血中拷贝数比值最低,说明在开展基于线粒体DNA的掺假比例定量检测时须充分考虑掺假物的组织来源,以免影响检测的准确性。本研究发现鸭腿肉的变异系数最小,这可能与腿部骨骼肌在鸭子日常运动中发挥动力作用紧密相关[22]。因此,在开展基于核DNA的鸭肉掺假比例定量检测时,不同品种以及组织均可进行测定;线粒体DNA作为靶基因的鸭肉掺假比例定量检测时,鸭腿肉来源的肉制品是最佳选择。本文为鸭肉制品甚至其他肉制品开展掺假定量检测选择合适的靶DNA提供参考。
4 结论核DNA的拷贝数在不同品种鸭组织中具有良好的稳定性,是开展鸭肉制品掺假定量检测的最适DNA来源。在开展利用线粒体DNA为参比的掺假定量检测时,需充分考虑不同组织中线粒体的丰度问题,以免影响检测的准确性。不同品种鸭腿肉中线粒体/核DNA拷贝数比值的变异系数最小。
致谢: 感谢浙江省农业科学院畜牧兽医研究所和中国农业科学院北京畜牧兽医研究所提供实验材料。
| [1] |
王萍, 乔勇升, 韩芷玲. 猪源性成分检测中3种DNA提取方法比较[J]. 生物加工过程, 2015(6): 61-64. |
| [2] |
石盼盼, 谢文佳, 魏法山. 肉及肉制品牛源性成分核酸检测试剂盒评价技术的研究[J]. 食品安全质量检测学报, 2018(9): 625-629. |
| [3] |
马西亚.乳及乳制品中牛羊源性成分的PCR高分辨熔解检测方法研究[D].西安: 陕西科技大学, 2019.
|
| [4] |
陈睿赜.一种利用线粒体DNA鉴别羊肉、鸡肉、鸭肉、猪肉的PCR检测方法[D].保定: 河北农业大学, 2013.
|
| [5] |
刘少宁, 陈智, 高迎春, 等.一种利用线粒体DNA鉴别牛羊肉中貂肉的LAMP检测方法: 中国, ZL. 20151041167-1[P]. 2015-11-04.
|
| [6] |
Hu L, Yang YJ, Zhao Y, et al. DNA barcoding for molecular identification of Demodex based on mitochondrial genes[J]. Parasitology Research, 2017, 116(12): 3285-3290. DOI:10.1007/s00436-017-5641-5 |
| [7] |
Sunutcha S, Lawan C, Montri S. Identification of sea snake meat adulteration in meat products using PCR-RFLP of mitochondrial DNA[J]. Food Science and Human Wellness, 2018, 7(2): 170-174. DOI:10.1016/j.fshw.2018.04.002 |
| [8] |
张晶鑫, 樊艳凤, 唐修君, 等. 基于线粒体DNA16SrRNA基因鉴别畜禽肉中鸭源性成分研究[J]. 中国家禽, 2016, 38(17): 41-44. |
| [9] |
杨滴, 刘彦泓, 刘岑杰, 等. 饲料中鸭源组织成分PCR检测方法的研究[J]. 饲料研究, 2013(10): 74-76. |
| [10] |
林霖, 陈国培, 何永盛, 等. 基于多重荧光PCR检测的肉及其制品中鸭DNA成分的鉴别方法[J]. 食品与机械, 2017(5): 95-98. |
| [11] |
戴纪刚, 肖颖彬, 闵家新, 等. 精确定量肺组织细胞线粒体DNA拷贝数方法的建立[J]. 第三军医大学学报, 2010, 32(18): 2033-2034. |
| [12] |
Floren C, Wiedemann I, Brenig B, et al. Species identification and quantification in meat and meat products using droplet digital PCR(ddPCR)[J]. Food Chemistry, 2015, 173: 1054-1058. DOI:10.1016/j.foodchem.2014.10.138 |
| [13] |
程欣.应用实时荧光PCR方法鉴别食品中的鸭源性成分[D].南京: 南京农业大学, 2015.
|
| [14] |
The duck genome and transcriptome provide insight into an avian influenza virus reservoir species[J]. Nature Genetics, 2013, 45(7):776-783.
|
| [15] |
Chandrika M, Zainon Mohd N, Maimunah M, et al. Meat species identification and Halal authentication analysis using mitochondrial DNA[J]. Meat Science, 2009, 83(1): 57-61. DOI:10.1016/j.meatsci.2009.03.015 |
| [16] |
Dai ZY, Qiao J, Yang SR, et al. Species authentication of common meat based on PCR analysis of the mitochondrial COI gene[J]. Applied Biochemistry and Biotechnology, 2015, 176: 1770-1780. DOI:10.1007/s12010-015-1715-y |
| [17] |
Wang LP, Geng RQ. Molecular detection of chevon and mutton adulteration by species-specific PCR assay targeting mitochondrial COI gene[J]. Journal of Applied Biotechnology, 2017, 5(2): 99-109. DOI:10.5296/jab.v5i2.12212 |
| [18] |
Spychaj A, Szalata M, S, Omski R, et al. Identification of bovine, pig and duck meat species in mixtures and in meat products on the basis of the mtDNA cytochrome oxidase subunit I(COI)gene sequence[J]. Polish Journal of Food and Nutrition Sciences, 2016, 66(1): 31-36. DOI:10.1515/pjfns-2015-0051 |
| [19] |
赵永才, 高炳宏. 线粒体动力学与细胞能量代谢的关系及运动干预研究进展[J]. 生理学报, 2019, 71(4): 625-636. |
| [20] |
陈倩, 王瑶, 焦方舟, 等. 线粒体凋亡在肝脏疾病中的研究进展[J]. 医学综述, 2018, 24(20): 20-24. |
| [21] |
邓洁, 倪晶宇, 黄鈺婷, 等. 心力衰竭时心肌能量代谢的研究进展[J]. 中国临床药理学杂志, 2009, 35(11): 1213-1216. |
| [22] |
蔡洁琼.运动训练对肉鸡生长性能、肉质性状及宰后肌肉腺苷酸代谢的影响[D].南京: 南京农业大学, 2016.
|