2. 动物疫病与人类健康四川省重点实验室,成都 611130
2. Key Laboratory of Animal Disease and Human Health of Sichuan Province, Chengdu 611130
猪繁殖与呼吸综合征(Porcinere productive and respiratorysyndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome,PRRSV)引起的一种病毒病。它以母猪发热、厌食和流产、死产、产弱仔等繁殖障碍以及仔猪的呼吸道症状和高死亡率为特征[1]。1996年我国首次报道了PRRS[2],毒株为以CH-1a、BJ-4株等为代表的经典PRRSV;在2006年出现了高致病PRRSV变异株[3],并迅速成为优势流行毒株,代表株为JXA1、HuN4和JXwn06等;在2013年发现了PRRSV的新毒株与美国的NADC30毒株具有较高的同源性,因此称为PRRSV NADC30-like[4]。近几年在中国吉林、黑龙江、河南、北京、天津、山西和浙江等地相继报道PRRSV NADC30-like毒株爆发。随着临床检出率大幅提高,NADC30-like逐渐成为PRRSV主要流行毒株[5-6],给中国养猪业造成了严重的经济损失。目前已有多个PRRSV检测方法,如温青娜[7]等基于qPCR建立了鉴别欧洲型、美洲型和高致病性PRRSV检测方法,但尚无基于SYBR Green I qPCR鉴定NADC30-like毒株的方法,毒株类型确定还需依靠ORF5序列测定和分子进化树分析[8],这需要更高技术要求和更长时间得出结果。
本研究基于NADC30-Like毒株在Nsp2基因存在“111+1+19”aa氨基酸不连续缺失且该种缺失在PRRSV基因分类使用时极为保守的特点[9],自行设计特异性引物,建立了鉴定PRRSV NADC30-Like毒株荧光定量PCR方法。面对国内多种类型PRRSV毒株共存的局面,该方法较于探针法有更低的价格,较于普通PCR有更高的灵敏度而在市场中更容易推广,可快速、精确鉴定出PRRSV NADC30-Like毒株,旨为临床诊断提供快速、精确的科学依据。
1 材料与方法 1.1 材料 1.1.1 病毒及疫苗高致病性猪呼吸与繁殖综合征活疫苗(HuN4-F112株)、猪瘟活疫苗(兔源)购自上海海利公司,PRRSV NADC30-like、猪圆环2型病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪伪狂犬病病毒、猪轮状病毒均由四川农业大学动物医学院动物疫病与人类健康四川省重点实验室保存。
1.1.2 主要试剂大肠杆菌DH5α购自北京天根公司;T-Vector pMD19(Simple)购自大连TakaRa公司;AceQⓇ qPCR SYBRⓇ Green Master Mix购自南京诺唯赞公司;病毒基因组DNA提取试剂盒、病毒基因组RNA提取试剂盒、DNA胶回收纯化试剂盒、质粒提取试剂盒购自北京天根公司;1×T3 Super PCR Mix购自成都擎科梓熙公司;氨苄青霉素购自美国Amresco公司;T4连接酶、Prime Script TMRT-Reagent Kit购自大连TaKaRa公司。
1.2 方法 1.2.1 引物的设计与合成根据NCBI GenBanK中PRRSV NADC30-like(登录号:JN654459)的Nsp2基因序列,使用Snapgene 3.2.1软件自行设计特异性引物,上游引物P1-F:5'-TCCAGGTGTGGTAGTTT-GGT-3',下游引物P1-R:5'-GGGACAGGCACAGGT-TCATT-3',预期扩增片段大小为131 bp。引物由生工生物工程(上海)股份有限公司合成。
1.2.2 荧光定量PCR标准品的制备以病毒基因组RNA提取试剂盒提取PRRSV NADC30-like的RNA,用反转录试剂盒制备出cDNA,用引物P1-F和P1-R进行PCR扩增,通过DNA纯化回收试剂盒进行胶回收,连接pMD19-T载体,转化DH5α感受态细胞,将经过PCR鉴定并且测序正确的重组质粒用以配制标准品,在配制之前用核酸蛋白检测仪测定其浓度并换算成拷贝数,作为荧光定量PCR的标准品。
1.2.3 荧光定量PCR样品的制备用病毒基因组DNA提取试剂盒和病毒基因组RNA提取试剂盒分别提取猪圆环2型病毒、猪伪狂犬病病毒、高致病性猪呼吸与繁殖综合病毒、猪瘟病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒的DNA或者制备其cDNA作为荧光定量PCR反应的模板,于-20℃保存备用。
1.2.4 荧光定量PCR反应条件的优化及标准曲线的绘制以标准品作为模板进行反应条件的优化,改变引物终浓度(2-20 μmol/L),同时改变退火温度(52-62℃),通过不同条件的反应对反应体系与条件进行优化。最终,以最佳反应条件与体系进行反应,延伸时检测荧光信号,确定最佳引物的反应终浓度。以ddH2O将标准品以10倍系列稀释成10成个梯度(2.25×1010-2.25×101 copies/μL),取其中6梯度(2.25×107-2.25×102 copies/μL)的标准品分别作为模板,每个浓度度设立3个重复,同时设立阴性对照,以最佳反应条件进行扩增。反应结束后,利用ABI 7500 Software v2.0.1分析软件自动生成扩增动力学曲线与标准曲线。
1.2.5 灵敏度实验将制备的初始浓度标准品10倍稀释至2.25×10-2 copies/μL,以梯度稀释的质粒为模板,按最佳反应条件进行灵敏度实验。使用同样的模板和引物进行普通PCR检测,比较两种方法的灵敏度。
1.2.6 特异性实验利用上述所提取的病毒的DNA或cDNA分别作为样品模板,以引物P1-F和P1-R进行荧光定量PCR检测,同时设立阴性对照,用最佳反应条件与体系进行扩增,根据扩增曲线评价此反应的特异性。
1.2.7 重复性实验 1.2.7.1 批内重复实验将制备的初始浓度标准品以10倍系列稀释成10个梯度(2.25×1010-2.25×101 copies/μL),取其中3个稀释度的DNA样品作为模板。每个稀释度做4个重复,以最佳反应条件进行1次荧光定量PCR反应,根据每个稀释度的Ct值计算批内变异系数(CV)。
1.2.7.2 批间重复实验将制备的初始浓度标准品以10倍系列稀释成10个梯度(2.25×1010-2.25×101 copies/μL),取其中3个稀释度的DNA样品作为模板。以最佳反应条件进行4次荧光定量PCR反应,根据每个稀释度的Ct值计算批间变异系数(CV)。以批内、批间的变异系数评价该荧光定量PCR的稳定性。
1.2.8 临床样品的检测将2018年以来四川部分地区送检的35份疑似PRRSV感染样品,提取总RNA,制备cDNA,采用本研究建立的荧光定量方法进行检测,同时用同样的引物进行常规PCR检测。同时设置阴性对照和阳性对照,计算两者阳性检出率。
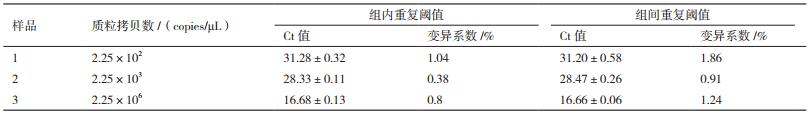
2 结果 2.1 标准品的制备以P1-F、P1-R对重组质粒进行PCR扩增,得到约131 bp的克隆片段(图 1),测序结果正确并且未发生突变。经核酸蛋白检测仪测定重组质粒的浓度,换算成拷贝数为2.25×1010 copies/μL,作为荧光定量PCR的标准品。
|
| M:DL2000 DNA Marker;1.重组质粒;2:阴性对照 图 1 重组质粒的PCR鉴定 |
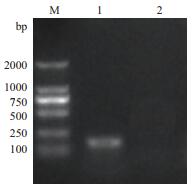
经优化后确定了最佳反应体系和条件,反应体系为20 μL:2×SG Fast qPCR Master Mix 10 μL:RNase-Free ddH2O 7μL,引物P1-F和P1-R各1μL,模板1 μL。最佳反应条件:95℃预变性3 min;95℃变性10 s,53℃退火10 s,72℃延伸30 s,40个循环;95℃终延伸10 s。以最佳反应体系和反应条件,取标准品的6个稀释度(2.25×107-2.25×102 copies/μL)进行检测,ABI 7500Softwarev2.0.1分析软件自动生成扩增动力学曲线(图 2-A)与标准曲线(图 2-B)。可见标准品浓度在2.25×107-2.25×102 copies/μL范围内具有良好的线性关系,斜率为-3.304,截距为36.999,扩增效率R2为100.7%,即标准曲线y=-3.304x+36.999,其中x代表模板的起始拷贝浓度(copies/μL)的对数,y代表样品扩增的Ct值。
|
| 1-6:不同稀释度的重组质粒pMD-NADC30(2.25×107-2.25×102 copies/μL);7:阴性对照 图 2 不同稀释梯度标准品扩增曲线(A)、荧光定量PCR标准曲线(B) |
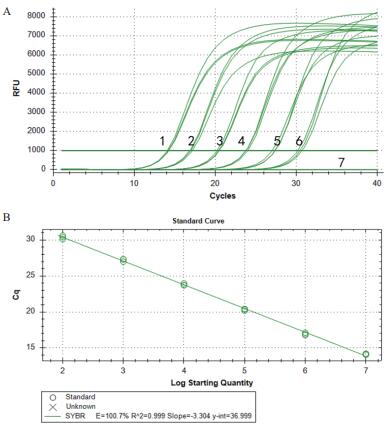
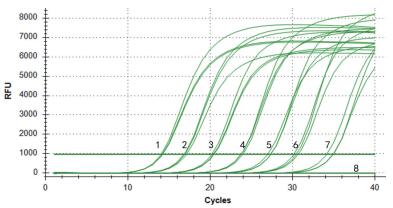
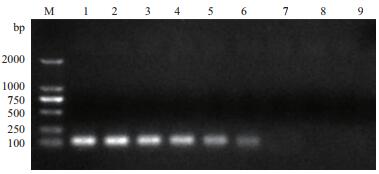
将阳性重组质粒从2.25×1010 copies/μL开始进行10倍梯度稀释,以每个稀释度的质粒为模板,用本研究设计的特异性引物分别进行实时荧光PCR和普通PCR。结果(图 3)显示荧光PCR的最大检出量的稀释度为101,且阴性对照未出现任何曲线;普通PCR的最大检出量的稀释度为103,且阴性对照未出现条带(图 4),表明该荧光PCR的敏感性是普通PCR的100倍。
|
| 1-7:不同稀释浓度(2.25×107-2.25×101 copies/μL)重组质粒pMD-NADC30扩增曲线;8:阴性对照 图 3 荧光定量PCR的灵敏性实验 |
|
| M:DNA分子质量标准;1-8:不同稀释浓度(2.25×108-2.25×101 copies/μL)重组质粒pMD-NADC30的扩增曲线;9:阴性对照 图 4 普通PCR的灵敏性实验 |
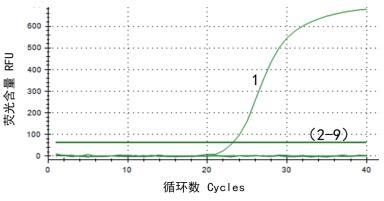
以上述所提取的病毒的DNA或cDNA分别作为样品模板,以引物P1-F和P1-R进行荧光定量PCR检测,同时设立阴性对照,以最佳反应条件进行荧光定量PCR检测。结果(图 5)显示,仅PRRSV NADC30-Like检测为阳性;其他病毒以及阴性对照未出现任何明显的扩增曲线,检测结果均为阴性。表明该方法具有良好的特异性。
|
| 1-9:NADC30-Like猪呼吸与繁殖综合征病毒、猪圆环2型病毒、猪伪狂犬病病毒、高致病性猪呼吸与繁殖综合征病毒、猪瘟病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒、阴性对照 图 5 荧光定量PCR的特异性实验 |
取释浓度为2.25×106、2.25×103、2.25×102 copies/μL的PRRSV NADC30-Like的cDNA作为模板,以最佳反应条件与体系进行荧光定量PCR的批内与批间的重复性实验。结果(表 1)显示,3批4次重复的批内重复性实验变异系数(CV)分别为1.04%、0.38%、0.8%;4次单独批间重复性实验变异系数(CV)分别为1.86%、0.91%、1.24%。批内与批间的变异系数(CV)均小于1.9%,表明该方法有良好的重复性。
选取2018年以来四川部分地区送检的疑似存在PRRSV感染病料,共计35份,采用本研究建立的荧光定量方法进行检测,同时进行常规PCR检测。最终以本研究建立的SYBR Green I qPCR方法在35份病料样本中检出7份阳性样品,阳性检出率为20%(7/35);常规PCR检出4份样品,阳性检出率为11.43%(4/35)。对本研究建立的SYBR Green I qPCR检测方法中多检测出3份阳性产物进行测序鉴定,NCBI blast结果显示均为PRRSV NADC30-Like毒株。综上,本实验建立的SYBR Green Ⅰ qPCR方法具有更高的灵敏度与特异性,能较好的应用于临床样品的检测。
3 讨论PRRSV NADC30-like毒株近几年临床检出率逐渐增高,成为PRRSV主要流行毒株,发病猪场母猪流产率高达40%左右,断奶仔猪呼吸道症状严重,容易继发链球菌、副猪嗜血杆菌、放线杆菌及巴氏杆菌等细菌感染,部分猪场死淘率高达20%以上,这给我国生猪产业带来了新的挑战[10-11]。NADC30-Like与以往的毒株不同,该类病毒与其他PRRSV重组机率显著提升,重组后毒株之间毒力差异较大,导致现有的商品化疫苗不能对其提供有效的免疫保护[12]。PRRSV疫苗毒株、田间野毒株分布广泛,对于准确诊断加大不少难度,因此建立NADC30-Like毒株高效、快速且准确的检测方法对于防控PRRSV就显得十分必要,且在不使用探针的基础上灵敏而快捷的优点使得该检测方法更具广阔的应用前景。
PRRSV Nsp2基因具有高度的变异度,因此一直是PRRSV用以基因分型鉴定的重要基因之一。NADC30-Like毒株Nsp2基因基于VR-2332毒株株序列在aa 323-433、aa 481、aa 533-551存在“111+1+19”aa氨基酸不连续缺失的特点[13],这在PRRSV基因分类使用时极为保守,针对此特点设计特异性引物。通过对反应体系与反应条件的优化,确定了最佳反应体系与反应条件,从而建立了PRRSV NADC30-Like荧光定量PCR检测方法。在特异性实验时,利用此方法对本实验室分离保存的NADC30-Like毒株进行检测,结果为阳性;同时对8种常见感染猪的病毒进行检测,结果无任何明显非特异性扩增,表明此方法具有较好的特异性,有利于NADC30-Like的专一性检测。本实验建立的荧光定量PCR在标准品拷贝数为2.25×107-2.25×102 copies/μL范围内具有良好的线性关系,y=-3.304x+36.999,其扩增效率R2为100.7%,可通过此关系(方程式)来准确计算出样品的拷贝数(即浓度)或者Ct值,此方法简便快速,且十分精确。在灵敏度实验中此荧光PCR最低可检测到2.25×101 copies/μL的标准阳性质粒,而普通PCR只能检测到2.25×103 copies/μL的标准品,荧光定量的灵敏性比普通PCR高约100倍,由此可见其具有高度的灵敏性,对低含量的NADC30-Like也十分有效。批内与批间的变异系数均小于1.9%,表明其具有高度的重复性,在不同的外界条件下,其检测结果基本一致,增加了此检测NADC30-Like荧光PCR技术的可靠性。在临床样品的检测中,用荧光定量PCR对35份疑似PRRSV感染样品进行检测,结果7份样品与阳性对照检测为NADC30-Like阳性,而普通PCR只检测出3份阳性样品,这也证实了该建立的荧光PCR方法的灵敏性高于普通PCR,表明该方法可直接用于临床样品中PRRSV NADC30-Like的快速检测,实现定量检测,操作简便,对疾病的诊断、开展流行病学调查与疫苗研发等方面具有重大意义。
4 结论本研究根据PRRSV NADC30毒株Nsp2基因保守序列设计特异性引物,通过优化确定最佳反应条件,并进行灵敏度、特异性、重复性实验以及临床样品的检测,建立了PRRSV NADC30-Like毒株荧光定量PCR检测方法,标准品在107 copies/μL到102 copies/μL浓度范围内具有良好的线性关系,最低可检测到2.25×101 copies/μL的标准品阳性质粒;该方法与HP-PRRSV、PCV、PEDV、TGEV、PRV、CSFV、PoRV无交叉反应,批内和批间的变异系数(CV)小于1.9%,在临床样品的检测中较普通PCR有更高的检出率。该方法具有敏感性高、特异性强、稳定性好、准确度高和检测快速等优点,可用于PRRSV NADC30-Like感染的早期诊断、样品的快速检测与定量分析。
| [1] |
梁雪芽, 方维焕. 猪生殖与呼吸综合征病毒的分子生物学研究进展[J]. 中国兽医科学, 2001(8): 14-17. |
| [2] |
郭宝清, 陈章水. 从疑似PRRS流产胎儿分离PRRSV的研究[J]. 中国预防兽医学报, 1996(2): 1-5. |
| [3] |
Tian K, Yu X, Zhao T, et al. Emergence of Fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J]. PLoS One, 2007, 2(6): e526. DOI:10.1371/journal.pone.0000526 |
| [4] |
Li C, Zhuang J, Wang J, et al. Outbreak investigation of NADC30-like PRRSV in south-east China[J]. Transboundary and Emerging Diseases, 2016, 63(5): 474-479. DOI:10.1111/tbed.12530 |
| [5] |
Li X, Wu J, Tan F, et al. Genome characterization of two NADC30-like porcine reproductive and respiratory syndrome viruses in China[J]. SpringerPlus, 2016, 5(1): 1677. DOI:10.1186/s40064-016-3336-5 |
| [6] |
Zhou L, Wang ZC, Ding YP, et al. NADC30-like strain of porcine reproductive and respiratory syndrome virus, China[J]. Emerging Infectious Diseases, 2015, 21(12): 2256-2257. DOI:10.3201/eid2112.150360 |
| [7] |
温青娜, 周玲玲, 申红, 等. 多重实时荧光定量PCR鉴别欧洲型、美洲型和高致病性PRRSV检测方法的建立[J]. 动物医学进展, 2015(6): 7-14. |
| [8] |
崔丹丹, 彭志锋, 王傲杰, 等. 1株田间自然重组PRRSV类NADC30毒株的分离鉴定及序列分析[J]. 中国兽医学报, 2018(6): 1071-1076. |
| [9] |
Wang L, Wan B, Guo Z, et al. Genomic analysis of a recombinant NADC30-like porcine reproductive and respiratory syndrome virus in China[J]. Virus Genes, 2018, 54(1): 86-97. DOI:10.1007/s11262-017-1516-1 |
| [10] |
杨汉春. 2014年猪病流行情况与2015年流行趋势及防控对策[J]. 猪业科学, 2015(2): 38-40. DOI:10.3969/j.issn.1673-5358.2015.02.017 |
| [11] |
Zhao K, Ye C, Chang X, et al. Importation and recombination are responsible for the latest emergence of highly pathogenic porcine reproductive and respiratory syndrome virus in China[J]. Journal of Virology, 2015, 89(20): 10712-10716. DOI:10.1128/JVI.01446-15 |
| [12] |
Tian K. NADC30-Like porcine reproductive and respiratory syndrome in China[J]. The Open Virology Journal, 2017, 11(S1): 59-65. |
| [13] |
Bian T, Sun YF, Hao M, et al. A recombinant type 2 porcine reproductive and respiratory syndrome virus between NADC30-like and a MLV-like:Genetic characterization and pathogenicity for piglets[J]. Infection Genetics & Evolution, 2017, 54: 279-286. |