猪瘟(Classical swine fever,CSF)是一种由猪瘟病毒(Classical swine fever virus,CSFV)引起的高度接触性传染病,对全球范围内的养猪业造成巨大经济损失[1-2]。《国家中长期动物疫病防治规划(2012-2020年)》中将其列为5种优先防治的动物疫病之一[3]。当前CSF防治的主要手段是疫苗接种,其中中国研制的猪瘟兔化弱毒疫苗在中国乃至世界范围内CSF的防控起到了积极作用[4]。CSFV基因组编码4个结构蛋白(Npro、Nrns、E1和E2)和8个非结构蛋白(C、p7、NS2、NS3、NS4A、NS4B、NS5A和NS5B)[5-6]。E2是CSFV最重要的具有免疫原性的蛋白之一,诱导机体产生的中和抗体可以抵抗病毒感染,是研究新型基因工程疫苗和血清学抗体检测方法的首选靶蛋白[7-10]。蔺辉星等[11]以原核表达的E2蛋白建立了检测CSFV血清抗体的间接ELISA检测方法,其敏感性、特异性和符合率分别为89.07%、77.59%和84.65%。肖丽等[12]通过液相芯片新技术分别以原核表达CSFV E2蛋白和PCV2 Cap蛋白,与荧光微球偶联建立了一种同时检测CSFV、猪圆环病毒2型(Porcine circovirus type 2,PCV2)抗体的方法临床样品符合率分别是90.48%、60.32%。袁莉等[13]利用重组抗原E2、Nrns和C蛋白建立的CSFV血清抗体ELISA检测方法,可以用于评价CSF疫苗免疫后血清中针对3种结构蛋白的抗体消长特点,从而为临床猪瘟疫苗免疫程序的制定提供参考。
本研究基于镧系元素Eu微球标记技术建立了一种CSFV抗体检测的免疫层析方法,结合荧光分析仪,可以快速方便的对猪场的血清样品进行检测,无需大型昂贵的仪器。解决了中小型养殖场实验室简陋问题,可广泛的应用于猪场中CSFV抗体的监测。
1 材料与方法 1.1 材料CSFV E2抗原由中国兽医药品监察所表达纯化后提供;鼠IgG、羊抗鼠IgG购自于杭州隆基公司;Eu纳米微球购自于Bangs公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS)购自于赛默飞世尔科技有限公司;活化缓冲液:50 mmol/L MES用NaOH调pH为6.0;偶联缓冲液:50 mmol/L HEPES用NaOH调pH为8.0;封闭液:用水溶解酪蛋白钠,终浓度为5%;样本处理液:0.1 mol/L Tris、0.1% Casein、0.1% Tween-20用盐酸调pH到7.4;P:CSFV抗体阳性猪血清;N:CSFV抗体阴性猪血清;猪瘟阳性血清国家参考品购自中国兽医药品监察所,细胞中和效价为1:(2 138±2)。猪瘟病毒抗体ELISA检测试剂盒购自于北京世纪元亨动物防疫技术有限公司。CSFV强阳性样本(CV1),CSFV中阳性样本(CV2),CSFV弱阳性样本(CV3)。
AFS-1000干式荧光分析仪(广州蓝勃公司);XL-2120超声波清洗仪(北京协力共创公司);D-37520osterode高速台式冷冻离心机(赛默飞世尔科技有限公司);XYZ30600128划膜仪(Biodot公司);ZQ400斩切机(购自于上海金标公司);硝酸纤维素膜(Sartorius公司);玻璃纤维、吸水纸、PVC板(上海杰一生物有限公司)。
1.2 方法 1.2.1 试纸条的制备 1.2.1.1 微球标记(1)用500 μL活化缓冲液洗涤10 μL(0.1 mg)微球溶液1次,离心,去上清;取出EDC放室温(要扭紧盖子);(2)分别用250 μL活化缓冲液洗涤重悬颗粒,超声1 min,务必使微球充分悬浮;(3)分别加入250 μL含0.005 mg EDC的活化缓冲液,使终体积均为500 μL;(4)室温下(18-25℃)持续混匀反应25 min,离心;(5)分别用偶联缓冲液洗涤2次,离心,去上清;重悬于250 μL偶联缓冲液中,充分悬浮;(6)加入250 μL的抗原-偶联缓冲液,立即轻轻上下混匀;(7)室温下持续混匀反应3 h,离心,去上清;(8)分别加入500 μL封闭液,洗涤2次,沉淀用500 μL封闭液重悬,超声1 min,室温下持续混匀反应过夜,离心,去上清;加入500 μL保存液,洗涤2次,用500 μL保存液重悬,超声1 min;(9)保存在2-8℃冰箱备用。
1.2.1.2 NC膜制备将划线抗原用含1%蔗糖,pH=8的5 mmol/L硼酸缓冲液稀释,羊抗鼠IgG抗体用含1%蔗糖,pH8的5 mmol/L硼酸缓冲液稀释为1.5 mg/mL。用喷膜仪以50 mm/s的速度、1 μL/cm的浓度,在室内环境中,分别将划线抗原、羊抗鼠IgG抗体喷在NC膜(2.5 cm×30 cm)的T线、C线位置,37℃烘箱中烘干2 h备用。
1.2.1.3 结合垫的制备以聚脂纤维膜(1 cm×2.5 cm)作为结合垫材料,用结合垫处理缓冲液浸湿,37℃烘箱中烘干后将自制的荧光微球-标记抗原复合物溶液用喷膜仪以50 mm/s、6 μL/cm的浓度喷于结合垫上,37℃烘箱中烘干3 h备用。
1.2.1.4 样品垫的制备以玻璃纤维素膜(1.5 cm×30 cm)作为样品垫材料,用样品处理缓冲液浸湿,37℃烘箱中烘干4 h备用。
1.2.1.5 吸水纸的剪切剪好1.5 cm×30 cm的吸水纸,备用。
1.2.1.6 检测试纸的组装组装环境要求:常温,湿度低于30%。根据上述步骤制备的样品垫、结合垫、NC膜和吸水纸依照图 1所示的重叠关系将其依次贴在带有粘合剂的PVC底板(8 cm×30 cm)上,具体为:将NC膜非点样面粘贴于PVC底板;荧光垫粘贴在NC膜的上方,覆盖NC膜1 mm;吸水垫粘贴在NC膜的上方,覆盖NC膜2 mm;样品垫粘贴在荧光垫的上方,覆盖荧光垫2 mm;在斩切机中将粘贴好的检测板剪切成4 mm宽的试纸条,装在试纸条外壳中,制成带有结果观察窗和加样口的检测卡。用AFS-1000荧光分析仪检测荧光信号,记录T/C读值(图 1)。

|
| 图 1 荧光试纸条结构示意图 |
按照1.2.1标记抗原,纳米微球标记好的抗原用结合垫处理液复溶,复溶浓度选择2、4、6、8、10倍复溶,喷膜仪以50 mm/s、6 μL/cm的浓度喷于结合垫上,37℃烘箱中烘干3 h备用。然后组装成试纸条检测临床样本,依据荧光信号值、P/N比值确定合适的复溶浓度。
1.2.2.2 包被浓度优化包被抗原含量优化:将划线抗原用含1%蔗糖,pH=8的5 mmol/L硼酸缓冲液稀释为0.05 mg/mL、0.1 mg/mL、0.2 mg/mL、0.4 mg/mL,羊抗鼠IgG抗体用含1%蔗糖,pH=8的5 mmol/L硼酸缓冲液稀释为1 mg/mL。用喷膜仪以50 mm/s的速度、1 μL/cm的浓度,在室内湿度为45%-65%的条件下,分别将划线抗体、羊抗鼠IgG抗体喷在NC膜(2.5 cm×30 cm)的T线、C线位置,37℃烘箱中烘干2 h备用。
1.2.2.3 反应时间优化加样后5 min、8 min、10 min、13 min、15 min、20 min、25 min、30 min读取数据,绘制时间曲线,以P/N、读数稳定且时间最短为优,确定加样反应时间。
1.2.3 性能评价 1.2.3.1 敏感性试验对猪瘟阳性血清国家参考品按照1:4、1:8、1:16、1:32、1:64、1:128、1:256进行稀释,记录结果。
1.2.3.2 特异性试验与猪繁殖与呼吸综合征病、猪I型疱疹病毒、猪口蹄疫病、猪圆环2型、猪流行性腹泻、牛病毒性腹泻病毒、羊边界病毒等阳性血清进行交叉反应试验。
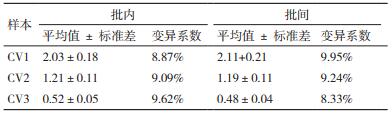
1.2.3.3 重复性试验对CSFV抗体阳性样本P连续加样10次,计算试纸条变异系数(CV)。
1.2.3.4 临床评价采用试纸条、猪瘟病毒抗体ELISA检测试剂盒(Anheal-ELISA)以及荧光抗体中和试验(FVNT)同时检测131份猪血清,计算试纸条与Anheal-ELISA和FVNT符合率。
2 结果 2.1 试纸条反应体系的优化 2.1.1 结合垫复溶浓度的优化从图 2中可以看出在复溶度稀释6倍的时候,T/C比值较高,P/N比值最大。因此选择复溶度为6倍时稀释度最佳。

|
| 图 2 不同复溶度与T/C比值、P/N比值的变化 |
从下图 3中可以看出,在T线浓度为0.1 mg/mL时,P/N比值最大。因此T线浓度选择0.1 mg/mL为最佳浓度。

|
| 图 3 不同包被浓度与T/C比值、P/N比值变化 |
从图 4可以看出在15-20 min时,T/C比值变化不大,13 min以后P/N比值逐渐降低,综合考虑选择检测时间为15 min。

|
| 图 4 不同检测时间与T/C比值、P/N比值变化 |
以T/C≥0.1时为阳性,将猪瘟阳性血清国家参考品按照倍比稀释到128倍仍为阳性,如图 5。

|
| 图 5 猪瘟阳性血清稀释倍数与T/C比值的关系 |
从图 6可以看出猪瘟阴性血清的测定值与猪繁殖与呼吸综合征病、猪I型疱疹病毒、猪口蹄疫病、猪圆环2型、猪流行性腹泻、牛病毒性腹泻病毒、羊边界病毒等阳性血清测定值小于0.1。故本方法针对这7种动物疫病阳性血清无交叉反应。

|
| A:猪瘟阴性血清;B:猪繁殖与呼吸综合征病抗体阳性血清;C:猪I型疱疹病毒抗体阳性血清;D:猪口蹄疫病抗体阳性血清;E:猪圆环2型抗体阳性血清;F:猪流行性腹泻病抗体阳性血清;G:牛病毒性腹泻病毒抗体阳性血清;H:羊边界病毒抗体阳性血清 图 6 CSFV-Ab纳米荧光试纸条交叉反应性 |
从表 1中看出,CSFV抗体荧光试纸条批内和批间CV均小于10%。
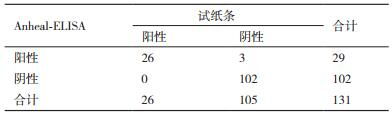
从表 2中可以看出试纸条与FVNT的阴性符合率为100%,阳性符合率为93%,总符合率为98.5%。从表 3中可得出试纸条与Aheal-ELISA的阴性符合为100%,阳性符合率为90%,总符合率为97.7%。
阳性符合率=26/(26+2)×100%=93%
阴性符合率=103/(103+0)×100%=100%
总符合率=(103+26)/131×100%=98.5%
阳性符合率=26/(26+3)×100%=90%
阴性符合率=102/(102+0)×100%=100%
总符合率=(102+26)/131×100%=97.7%
3 讨论猪瘟是一种高度传染性疫病,是威胁养猪业的主要传染病之一[14-15]。急性型猪瘟呈败血性变化,实质器官出血,坏死和梗死;慢性型猪瘟呈纤维素性坏死性肠炎。目前主要通过扑杀与疫苗预防接种相结合等手段,北美、加拿大、新西兰等很多国家已成功实现猪瘟净化,但在中国猪瘟仍是严重危害养猪业的重大传染病之一,存在不间断流行[16]。CSFV为有囊膜、直径40-60 nm、单股正链RNA病毒[17]。目前已经定位的CSFV蛋白有5种,即Npro、C、Nrns(E0)、E1和E2。它们均由CSFV的RNA-ORF 5'一端所编码。在结构蛋白中,最具有免疫研究价值的是Nrns和E[9, 18-19]。E2蛋白是CSFV主要的抗原蛋白,可诱导猪机体产生病毒中和抗体,从而预防集落刺激因子(Colony stimulating factor,CSF)[20]。
目前市场上猪瘟抗体的检测方法,以酶联免疫吸附试验和胶体金免疫层析技术的方法为主。商品化的猪瘟抗体酶联免疫吸附试验检测试剂主要厂家有IDEXX、Biocheck等,酶联免疫吸附试验的方法需要专业的设备,对人员的操作技能要求比较高,不利于在基层开展工作。商品化的猪瘟抗体胶体金检测试剂的厂家有北京世纪元亨、武汉科前等,胶体金的方法不可以准确的定量,且灵敏度不高,准确性差。而时间分辨荧光分析法是一种新型的非放射性微量分析技术[21]。它是目前最灵敏的微量分析技术之一,其灵敏度高达10-12 g/mL,较胶体金法(Colloidal gold immunoassay,GIA)高出3个数量级[22]。本技术利用镧系微球通过共价偶联标记抗原或抗体,相对物理偶联,化学偶联更加结实,不易脱落。用荧光分析仪测量荧光,同时检测波长和时间两个参数进行信号分辨,可有效地排除非特异荧光的干扰,极大地提高了分析灵敏度。本技术除满足了高灵敏检测的需求,同时也不需要复杂的设备,操作简单方便,符合基层的工作情景。在市场上,并没有发现具有农业部备案的商品化猪瘟病毒抗体荧光检测试剂。因此本文建立的猪瘟抗体的荧光检测方法具有一定的技术优势。
冯春花等[23]利用E2建立了一种猪瘟病毒血清抗体间接ELISA检测方法,该方法与猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome,PRRSV)、猪I型疱疹病毒(Pseudorabies virus,PRV)、猪圆环病毒(Porcine circovirus,PCV)、猪细小病毒(Porcine parvovirus,PPV)阳性血清均无交叉反应;随机检测80份猪血清样品,与进口阻断ELISA试剂盒相比其阳性符合率为83.58%、阴性符合率为76.92%,总体符合率为80.25%。本研究的试纸条测定临床血清阳性符合为90%、阴性符合率为100%,总符合率为98%。本试纸研制采用双抗原夹心的方法,利用常用的Eu微球作为标记物,对E2抗原进行共价耦合连接标记,在NC膜上包被真核表达的猪瘟E2抗原,经优化最终确定包被浓度为0.1 mg/mL,复溶浓度为6倍稀释,检测时间为15 min。通过对试纸条的性能评价可以得出,猪瘟抗体荧光检测试纸条的敏感性为猪瘟阳性血清国家参考品稀释128倍仍可以检测到,对常见的猪繁殖与呼吸综合征病、猪I型疱疹病毒病、猪口蹄疫病、猪圆环、猪流行性腹泻、牛病毒性腹泻病毒、羊边界病毒等疾病抗体阳性血清无交叉反应,批内和批内的变异系数均小于10%,试纸条与Anheal-ELISA的阴性符合为100%,阳性符合率为90%,总符合率为97.7%。试纸条与FVNT的阴性符合率为100%,阳性符合率为93%,总符合率为98.5%。
4 结论基于镧系元素Eu微球标记技术,经一系列反应体系的优化,建立了一种猪瘟病毒抗体检测的免疫层析方法,并经对试纸条灵敏度、特异性、重复性等性能指标的优化,结果满足试剂性能要求,表明可广泛的用于猪场中猪瘟病毒抗体的免疫评估,辅助进行疫苗免疫策略的调整,建立合理的免疫程序。
| [1] |
Yang L, Lu X, Fang W. Expression and purification of classical swine fever virus E2 protein from Sf9 cells using a modified vector[J]. Biotechnology Letters, 2017, 39(27): 1821-1825. |
| [2] |
任世斌, 赵亮, 郭抗抗, 等. 猪瘟综合防控研究进展[J]. 动物医学进展, 2018, 39(9): 100-106. DOI:10.3969/j.issn.1007-5038.2018.09.021 |
| [3] |
Ling J, Deng M, Chen Z, et al. Yeast expressed classical swine fever E2 subunit vaccine candidate provides complete protection against lethal challenge infection and prevents horizontal virus transmission[J]. Vaccine, 2012, 30(13): 2336-2341. DOI:10.1016/j.vaccine.2012.01.051 |
| [4] |
胡玲玲, 汤德元, 曾智勇, 等. 猪瘟病毒GZA株的分离鉴定及遗传变异分析[J]. 中国兽医学报, 2019, 39(2): 204-208. |
| [5] |
Gong W, Li J, Wang Z, et al. Commercial E2 subunit vaccine provides full protection to pigs against lethal challenge with 4 strains of classical swine fever virus genotype 2[J]. Veterinary Microbiology, 2019, 237: 108403. DOI:10.1016/j.vetmic.2019.108403 |
| [6] |
侯金秀, 郑阳, 李照耀, 等. 猪瘟病毒非结构蛋白NS3和NS5B多克隆抗体的制备和鉴定[J]. 南京农业大学学报, 2018, 41(6): 1093-1099. |
| [7] |
李亚菲.猪瘟病毒E2蛋白纳米疫苗的初步研究[D].杨凌: 西北农林科技大学, 2018.
|
| [8] |
孙永芳.猪瘟病毒E2蛋白单克隆抗体的制备及其表位鉴定分析[D].北京: 中国兽医药品监察所, 2017.
|
| [9] |
任鹏举.猪瘟病毒E2蛋白抗原区可溶性表达及鉴定[D].郑州: 郑州大学, 2018.
|
| [10] |
徐和敏.猪瘟病毒E2基因噬菌体展示多肽库的构建及表位研究[D].北京: 中国兽医药品监察所, 2007.
|
| [11] |
蔺辉星, 周红, 童泽鑫, 等. 猪瘟病毒血清抗体间接ELISA检测方法的建立[J]. 中国兽医科学, 2017, 47(1): 9-15. |
| [12] |
肖丽, 石欣鹭, 练月晓, 等. 同时检测猪瘟病毒、圆环病毒2型抗体的液相芯片法[J]. 中国兽医学报, 2018, 38(12): 2267-2270. |
| [13] |
袁莉, 杨顺利, 尚佑军, 等. 猪瘟病毒结构蛋白抗体间接ELISA检测方法的建立及评价[J]. 西北农业学报, 2018, 27(9): 1273-1279. |
| [14] |
石广金. 浅谈母猪繁殖障碍综合症的临床防治[J]. 畜禽业, 2019, 30(4): 53-54. |
| [15] |
谢晓方. CSFV抗体间接ELISA方法的建立及初步应用[D].长沙: 湖南农业大学, 2016.
|
| [16] |
李玲.猪瘟病毒新型反向遗传操作技术平台的建立和病毒复制调控研究[D].武汉: 武汉大学, 2015.
|
| [17] |
Wu C, Hsuan S, Chen Z. Expression and immunological studies of classical swine fever virus glycoprotein E2 in the bi-cistronic baculovirus/larvae expression system[J]. Bioscience, Biotechnology and Biochemistry, 2010, 74(7): 1343-1349. DOI:10.1271/bbb.90894 |
| [18] |
Zhang H, Cao H, Wu Z, et al. A review of molecular characterization of classical swine fever virus(CSFV)[J]. Israel Journal of Veterinary Medicine, 2011, 66(3): 89-95. |
| [19] |
李少丽.基于E2蛋白的猪瘟病毒IFA检测方法建立及亚单位疫苗的初步研制[D].扬州: 扬州大学, 2018.
|
| [20] |
杨庆宝, 祁艳华, 王爱萍.猪瘟病毒E2蛋白的研究进展[C].中国免疫学会第十二届全国免疫学学术大会摘要汇编. 2017.
|
| [21] |
高松红. 现代药物分析最新进程[J]. 中国卫生产业, 2017, 14(35): 193-194. |
| [22] |
Xie Q, Wu Y, Xiong Q, et al. Advantages of fluorescent microspheres compared with colloidal gold as a label in immunochromatographic lateral flow assays[J]. Biosensors & Bioelectronics, 2014, 54: 262-265. |
| [23] |
冯春花, 朱艳平, 郭东光, 等. 猪瘟病毒抗体间接ELISA检测方法的建立及优化[J]. 中国畜牧兽医, 2016, 43(3): 608-614. |