2. 天津市农业质量标准与检测技术研究所,天津 300381
2. Tianjin Institute of Agricultural Quality Standard and Testing Technology, Tianjin 300381
根据农业生物技术应用国际服务组织(International Service for the Acquisition of Agri-Biotech Applications,ISAAA)最新统计显示,2017年全球转基因玉米种植面积达到5 970万hm2[1]。转基因技术已成为新的农业科技革命的强大动力。随着转基因作物种植面积的持续增长和全球公众对于转基因植物及其产品安全性的关注度不断提升,包括我国在内的全球62个国家相继颁布实施了转基因生物标识管理制度[2-3]。根据我国《农业转基因生物安全管理条例》及其配套管理规章的规定,我国对农业转基因生物及其产品实行安全评价、产品标识、生产许可、经营许可、进口许可、加工许可等制度。其中,针对各个转基因作物转化体建立特异、灵敏、标准化的检测方法是保证标识管理制度顺利实施的重要技术支撑[4]。
转基因抗虫耐除草剂玉米GH5112E-117C是由北京奥瑞金公司研发的转mG2-aroA基因和mcry1Ah基因抗虫耐除草剂玉米新品系。研发人采用农杆菌转化法,将mG2-aroA和mcry1Ah两个外源基因的表达框导入玉米受体中,然后通过多代筛选获得对玉米螟、黏虫等鳞翅目害虫具有抗性、耐草甘膦除草剂的转基因玉米GH5112E-117C转化体[5],该转化体正在申请生产应用安全证书阶段,在我国具有重要产业化应用前景。建立GH5112E-117C玉米的检测方法,将对该转化体的安全评价、行政监管和知识产权保护提供重要的技术支撑。
1 材料与方法 1.1 材料 1.1.1 材料与试剂转基因玉米GH5112E-117C、转基因玉米混合样品(Bt11、Bt176、MON810、MON863、GA21、NK603、T25、TC1507、MON88017、MIR604每种转化体含量为1%,以非转基因玉米为填充物);转基因大豆混合样品(包括GTS40-3-2、MON89788、A2704-12、A5547-127、356043、305423、CV127每种转化体含量为1%,以非转基因大豆为填充物);转基因水稻混合样品(包括科丰6号、科丰8号、克螟稻、M12、TT51-1每种转化体含量为1%,以非转基因水稻为填充物);转基因棉花混合样品(包括MON1445、MON531、MON15985、LLCOTTON25、MON88913每种转化体含量为1%,以非转基因棉花为填充物);转基因油菜混合样品(包括MS1、MS8、RF1、RF2、RF3、T45、Oxy235、Topas19/2每种转化体含量为1%,以非转基因油菜为填充物);非转基因玉米样品。以上样品均由本实验室收集保存。
植物基因组DNA提取试剂盒;Taq DNA聚合酶、dNTPs等PCR试剂;其他生化试剂(分析纯)。
1.1.2 仪器与设备C1000型梯度PCR仪;GelDoc XR+凝胶成像系统;ND8000紫外可见光分光光度仪。
1.2 方法 1.2.1 基因组DNA提取将所有样品研磨成粉末,按照北京天根公司的植物基因组DNA提取试剂盒操作说明书,提取样品基因组DNA,用紫外可见光分光光度仪测定DNA质量和浓度,用1×TE缓冲液将纯化的DNA溶液稀释至25 mg/L,4℃保存备用。
1.2.2 引物设计根据奥瑞金公司提供的GH5112E-117C玉米外源载体插入片段的5'端和3'端侧翼序列信息,采用引物设计软件Primer Premier 5.0,综合考虑核苷酸序列GC含量和引物Tm值,设计了1对PCR检测引物,GH5112-117C-F:5'- ACCAGCACCAGGTCCGAGTTGAGA -3';GH5112-117C -R:5'- CCCAGGTACATTAAAAACGTCCGC -3',扩增产物大小为179 bp。引物由上海生工有限公司合成,用1×TE缓冲液稀释至10 μmol/L的工作液。
1.2.3 PCR反应优化后的PCR反应体系包括:10×PCR buffer 2.5 μL、10 mmol/L dNTPs混合溶液2 μL、10 μmol/L上下游引物各0.5 μL、HS Taq DNA聚合酶0.625 U、DNA模板50 ng,用ddH2O补齐至25 μL。优化后的PCR扩增程序为:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 30 s,进行35个循环;72℃ 5 min;10℃保存。PCR扩增结束后,取10 μL扩增产物用2%的琼脂糖凝胶进行电泳分析。
2 结果 2.1 特异性检测将抗虫耐除草剂玉米GH5112E-117C制备成质量分数为1%的粉末作为测试样品,利用5种转基因作物混合样作为比对样品,对建立的抗虫耐除草剂玉米GH5112E-117C定性PCR方法进行特异性测试,测试样品和比对样品均以转基因材料与非转基因材料作为填充物进行混合磨制而成,提取DNA按照要求进行PCR反应。
检测结果(图 1)表明,仅从含有GH5112E-117C玉米的测试样品中扩增到179 bp的预期DNA片段,而在其他样品中均未扩增到预期大小的条带,表明建立的抗虫耐除草剂玉米GH5112E-117C玉米检测方法具有高度特异性。

|
| M:DL2000 marker;1:空白对照;2:非转基因玉米;3:1% GH5112E-117C;4:转基因玉米混合样;5:转基因水稻混合样;6:转基因大豆混合样;7:转基因棉花混合样;8:转基因油菜混合样 图 1 抗虫耐除草剂玉米GH5112E-117C检测方法的特异性测试 |
将抗虫耐除草剂玉米GH5112E-117C与其非转基因按不同质量比混合,制成GH5112E-117C转化体质量分数分别为1%、0.5%、0.1%、0.05%、0.01%的样品,提取基因组DNA,进行PCR扩增。
结果(图 2)显示,利用建立的方法在PCR检测反应体系中加入50 ng DNA模板,在GH5112E-117C转化体含量为0.05%及以上的样品中均能稳定得到与预期大小一致的扩增产物,表明方法的灵敏度可达到0.05%。
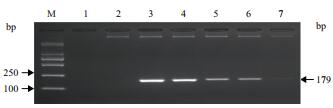
|
| M:DL2000 marker;1:空白对照;2:非转基因玉米;3:1% GH5112E-117C;4:0.5% GH5112E-117C;5:0.1% GH5112E-117C;6:0.05% GH5112E-117C;7:0.01% GH5112E-117C 图 2 抗虫耐除草剂玉米GH5112E-117C检测方法的灵敏度测试 |
在使用普通PCR进行转基因成分定性检测时,一般要求方法的检测限应稳定达到0.1%。根据国际公认的检测限判定程序,随机称取60份GH5112E-117C玉米质量分数为0.1%的样品,提取基因组DNA,用本方法进行测试。结果如图 3所示,60份试样中连续59次检出预期片段,表明在PCR检测反应体系中加入50 ng DNA模板时,本方法的检出限为0.1%,适用于对抗虫耐除草剂玉米GH5112E-117C品系的高灵敏检测。
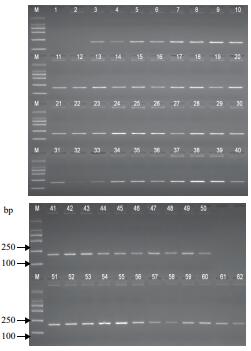
|
| M:DL2000分子量标准;1:空白对照;2:阴性对照;3~62:GH5112E- 117C玉米质量分数为0.1%的样品 图 3 抗虫耐除草剂玉米GH5112E-117C检测方法的检出限测试 |
加工品中的高温处理过程往往会降解DNA,对转基因检测有较大的影响。为测试本研究建立的GH5112E-117C玉米检测方法对加工品的适用性,采用两种常用的高温方法制备了2份GH5112E-117C玉米加工品,1份是将质量分数为1.0%的GH5112E-117C玉米粉末制成玉米面窝头,并蒸熟;另一份是将质量分数为1.0%的GH5112E-117C玉米粉末在121℃下高温高压处理20 min。提取2份加工品的基因组DNA,进行PCR扩增。结果(图 4)表明,利用建立的方法在2份加工品中均能特异性地扩增到179 bp的预期产物,表明该方法适用于GH5112E-117C玉米加工品的定性PCR检测。

|
| M:DL2000 marker;1:空白对照;2:非转基因玉米;3:1% GH5112E-117C;4:玉米窝头;5:玉米高压灭菌 图 4 抗虫耐除草剂玉米GH5112E-117C检测方法对加工品的测试 |
针对PCR检测方法的反应体系和反应程序,选择退火温度和引物浓度梯度两个关键参数进行正交试验。设置50、52、54、56、58和60℃等6个退火温度,0.1 μmol/L、0.2 μmol/L、0.3 μmol/L、0.4 μmol/L和0.5 μmol/L等5个引物浓度梯度,每对引物共测试30个退火温度/浓度梯度组合。结果(图 5)表明,在不同的引物浓度和退火温度处理中本方法均表现出非常好的扩增特异性,而且,当引物终浓度为0.2 μmol/L时,不同退火温度表现出较为一致的扩增效率,特异性扩增条带清晰、无非特异扩增、引物二聚体较少。综合考虑玉米内标准基因zSSIIb的定性PCR检测方法的反应体系和反应程序,结合本研究结果,反应体系中的引物终浓度确定为0.2 μmol/L,反应程序中的退火温度设定为58℃。
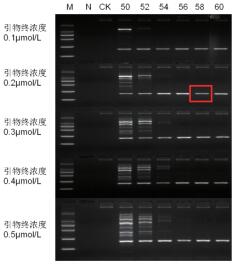
|
| M:DL2000分子量标准;N:空白对照;CK:非转基因玉米 图 5 抗虫耐除草剂玉米GH5112E-117C检测方法退火温度的稳定性测试 |
随着转基因技术的发展,全球转基因玉米种植面积持续增长和全球公众对于转基因植物及其产品安全性的关注度不断提升,转基因玉米的研发也迅速发展[6]。转基因玉米检测方法的研发,对农业转基因生物及其产品实行安全评价、产品标识、生产许可、经营许可、进口许可、加工许可等制度的实施提供了重要技术支撑[7]。
在转基因产品检测过程中,PCR技术因其特异性强、灵敏度高、重现性好,应用最为广泛[8]。根据所检测的目的DNA片段的特异性差异,转基因产品PCR检测方法又可分为筛选、基因特异性、构建特异性和转化体特异性4类[9]。其中,转化体特异性PCR检测方法以转基因生物的旁侧序列(与外源插入片段连接的受体基因组序列)与外源插入片段的连接即转化体特异序列为检测对象,具有高度特异性,已逐步成为国际上转基因产品检测方法标准的首选[10],我国近年来发布的检测方法标准绝大多数为转化体特异性检测方法。本研究开发的方法是精准检测转基因抗虫耐除草剂玉米GH5112E-117C的一种新的技术手段。该方法具有低成本、便利、普及性高的技术优势,但是检测通量、精准定量和自动化检测方面。还存在一定的技术弊端。因此,本研究下一步将开发该转化体实时荧光PCR[11]和数字PCR方法[12]。
4 结论本方法以转基因抗虫耐除草剂玉米GH5112E-117C转化体特异性DNA序列为靶标,能特异性地检测样品中是否含有GH5112E-117C,检测灵敏度可稳定达到0.1%。
| [1] |
国际农业生物技术应用服务组织. 2017年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2018, 38(6): 1-8. |
| [2] |
汪智, 卢宝荣. 生物安全评价系列之三:各国转基因生物应用的相关法规[J]. 人与生物圈, 2018, 6: 65-67. DOI:10.3969/j.issn.1009-1661.2018.06.016 |
| [3] |
董悦.各国转基因农产品安全管理的国际比较及综合评价[D].武汉: 华中农业大学, 2011.
|
| [4] |
张正岩.中国转基因玉米技术商业化的风险预判研究[D].哈尔滨: 东北农业大学, 2018.
|
| [5] |
Han SW, Zou SY, He XY, et al. Potential subchronic food safety of the stacked trait transgenic maize GH5112E-117C in Sprague-Dawley rats[J]. Transgenic Research, 2016, 25(4): 1-11. |
| [6] |
展进涛, 邓鹏程, 谢锐. 中国转基因玉米生物技术创新及其产业化经济效应研究[J]. 农业经济问题, 2017, 10: 18-26. |
| [7] |
湖南省农业委员会科技教育处. 中国转基因生物安全管理制度和技术支撑体系[J]. 湖南农业, 2018, 9: 42-42. |
| [8] |
熊娟, 蔡大川, 张志军, 等. 浅析PCR技术的原理及食品检测应用[J]. 中外食品工业:下, 2015(1): 38. |
| [9] |
李飞武, 李葱葱, 等. 转基因大豆MON89788转化体特异性定性PCR检测[J]. 安徽农业科学, 2010, 11(3): 82-86. |
| [10] |
杨华, 彭城, 肖英平, 等. 转基因大豆SHZD32-1转化体普通PCR和qRT-PCR检测方法的研究[J]. 农业生物技术学报, 2018, 26(3): 492-501. |
| [11] |
辛艳, 刘何, 等. 农作物种子转基因成分实时荧光PCR盲检技术要点与应用[J]. 天津农林科技, 2018(1): 35-38. DOI:10.3969/j.issn.1002-0659.2018.01.014 |
| [12] |
王永, 兰青阔, 赵新, 等. 数字PCR在转基因水稻拷贝数鉴定中的应用[J]. 生物技术通报, 2018, 34(3): 53-58. |




