2. 农业农村部科技发展中心, 北京 100176
2. Development Center of Science and Technology, Ministry of Agriculture and Rural Affairs, Beijing 100176
2018年全球转基因作物种植面积已达1.917亿hm2,其中玉米面积仅次于大豆,占5 890万hm2[1]。据国际农业生物技术应用服务组织(ISAAA)统计,目前全球已商业化的31种转基因作物的转化体数量已达到517种,其中玉米转化体237种[2],超过1/3,其种类最多也最复杂。不断涌现的新型转基因玉米品系给监管工作带来了巨大挑战。
在转基因作物商业化的二十几年间,虽然针对转基因成分的筛查已经开发出如酶联免疫吸附(Enzyme linked immunosorbent assay,ELISA)、环介导等温扩增(Loop-mediated isothermal amplification,LAMP)、核酸序列依赖性扩增(Nuleic and sequerce based amplipicain,NASBA)、重组酶聚合酶扩增(Recombinase polymerase amplification,RPA)等大量的新型检测技术,但从成本、适用性、准确性与通量等多方面综合考虑,目前世界范围内主流的转基因检测手段依然是传统的、以核酸为目标的PCR方法[3-6]。
面对复杂的玉米转化事件,近年来一些研究机构有针对性的研发出基于PCR方法的筛查策略。张海波等[7-8]分别使用定性和定量PCR方法建立了以P-CaMV35S和T-NOS序列为目标的转基因玉米定性检测方法,吴明生等[9]研发了以P-CaMV35S、T-NOS和Bar基因为目标的转基因玉米三重实时荧光PCR检测方法;Frederic等[10]测试了6种启动子和4终止子在不同转基因作物中的特异性,包含7种不同的玉米转化体。
当前,绝大多数筛查策略均以P-CaMV35S和T-NOS为主要目标序列,这是由于它们是目前转基因产品中使用率和覆盖度最高的两种元件[11],然而为了提高启动子的效率,P-CaMV35S一直在不断被改造,许多研究人员详细比对过不同类型的P-CaMV35S,并对已有的特异性引物进行了验证,这些研究结果显示大量转化事件中所用的P-CaMV35S序列都不完全一致的,这种差异造成相同的引物在不同转化事件中检测效率有很大不同,有时会严重影响对检测结果的判定[12-14]。所有常见的转基因元件和功能基因在不同转化事件中都存在这种序列差异问题,因此为了使检测结果更加真实可靠,有必要在进行筛查策略研发的时候对转基因材料进行实验室验证工作,而不仅仅是对数据的分析整理。本研究基于此目的,利用常见的9种目标元件或基因对32种玉米转化事件进行了实时荧光PCR方法的验证,同时还开发出了可配套使用的阳性质粒分子。
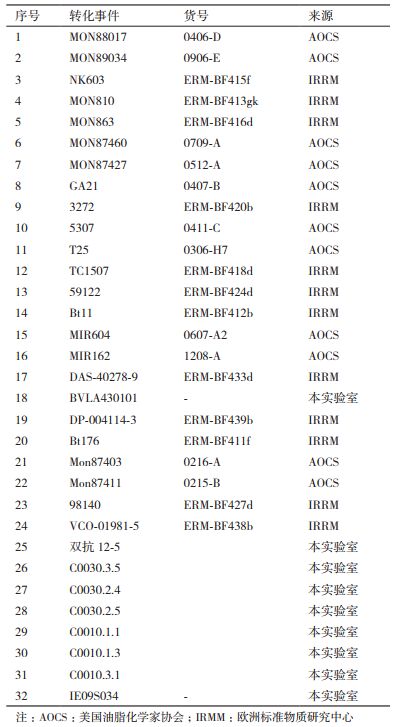
1 材料与方法 1.1 材料 1.1.1 材料与试剂本研究共使用了32种转基因玉米材料,具体信息见表 1。
快速质粒小提试剂盒康为世纪;DNeasy Plant Mini Kit植物DNA提取试剂盒Qiagen公司;内切酶NEB公司;质粒合成通用公司;iTaq Universal Probes Supermix实时荧光PCR试剂盒及PCR板Bio-Rad公司;QuantStudioTM 3D Digital PCR 20K Chip Kit v2数字PCR芯片套装、QuantStudioTM 3D Digital PCR Master Mix v2数字PCR酶试剂盒Thermo Fisher Scientific公司。Easy Dilution TAKARA公司。
1.1.2 仪器与设备Nanodrop ND-2000核酸定量仪、QuantStudio 7 实时荧光PCR仪、ProFlex PCR仪、QuantStudioTM 3D数字PCR仪 Thermo Fisher Scientific公司;VX-200旋涡混匀仪 Labnet公司;5424R台式离心机 Eppendorf公司;H2O3-PRO金属浴 北京卡尤迪公司。
1.2 方法 1.2.1 DNA提取转基因材料的基因组DNA提取方法参照试剂盒说明书。
1.2.2 元件/基因的确定查询ISAAA、转基因检测数据库(GMDD,http://gmdd.sjtu.edu.cn/)、改性活性生物体登记数据库(LMO,http://bch.cbd.int/database/organisms/)等网站提供的信息,对已经商业化及可能商业化的玉米转化体进行分子特征的分析研究,比对各种元件和基因出现的频率。
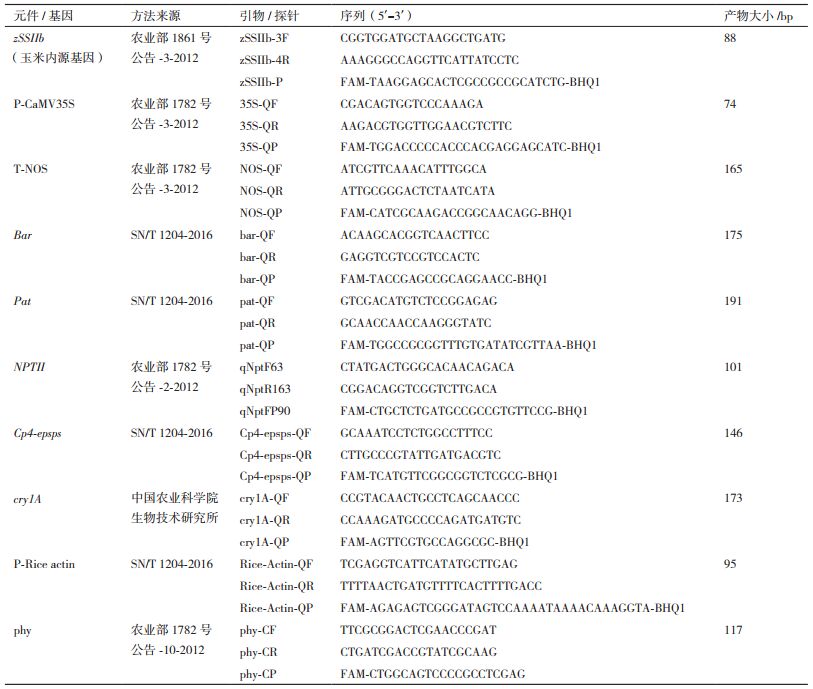
1.2.3 引物及探针实时荧光PCR方法和普通PCR相比其特异性更高,反应后不需要电泳检测,能有效的避免出现污染,加之可以使用384通道,使其通量和效率得到极大提升,随着试剂耗材成本的下降,未来必将逐渐取代普通PCR成为主流检测手段,因此本研究方案中全部使用实时荧光PCR方法。结合日常检测中的实验数据,最终选出了同一种元件/基因中覆盖范围更广、适用性更高的引物探针组合。本研究中所涉及的引物和探针均由Thermo Fisher Scientific公司合成,具体序列及所使用的荧光标记见表 2,所有探针5'端用6-羧基荧光素(FAM)标记,3'端用黑洞猝灭基团(BHQ1)标记。
总体系为15 μL,其中iTaq Universal Probes Supermix 7.5 μL、正向引物0.5 μmol/L、反向引物0.5 μmol/L、探针0.25 μmol/L、模板DNA为每个反应体系中50 ng,用双蒸水将总体积补足至15 μL;反应程序为95℃预变性10 min;95℃变性15 s,60℃退火延伸60 s,共40个循环;在第二阶段的退火延伸(60℃)时段收集荧光信号。
1.2.5 阳性质粒构建根据查询数据库获得的P-CaMV35S、T-NOS、Bar基因、Pat基因、Cp4-epsps基因、NPTⅡ基因、cry1A基因、P-Rice actin、phy结构特异性片段连同玉米内标基因zSSIIb共10种目标元件/基因的序列,经过人工合成并克隆到质粒载体pUC18中。
1.2.6 阳性质粒测序及纯度验证将重组质粒转运至大肠杆菌感受态细胞中,挑取单克隆测序验证后提取质粒。用紫外分光光度法测定纯化后的质粒在A230、A260和A280处的吸光值。纯净dsDNA的A260/A280应为1.8-2.0,而A260/A230应在2.0左右。
1.2.7 阳性质粒数字PCR拷贝数测试将阳性质粒进行梯度浓度稀释,使用数字PCR进行拷贝数定量,数字PCR反应包括5个步骤:体系配制、样品加载及芯片密封、PCR扩增、芯片读取及分析。反应体系为:1×3D Digital PCR Master Mix v2,正反向引物终浓度均为0.50 μmol/L,探针终浓度0.27 μmol/L,模板DNA 2 μL,双蒸水补足至14.5 μL。配置好的体系通过上样仪自动加载到芯片各微孔中,体系加载完成后使用Immersion Fluid覆盖芯片表面并将芯片密封,将芯片放置于平板PCR仪上进行扩增。扩增程序:96℃,10 min预变性;98℃变性30 s,60℃退火2 min,共40个循环。
1.2.8 阳性质粒实时荧光PCR可替代性测试将数字PCR验证过的质粒进行实时荧光PCR可替代性测试,反应程序和体系见1.2.4。
2 结果 2.1 筛查元件/基因的确定经过数据库的查询和比对,共发现237种玉米转化体,其中包含53种独立性状转化体和184种复合性状转化体;同时,据统计我国处在申请安全证书和和生产性试验阶段的转基因玉米转化体数量已达到48种,国内外总计有285种转化体。
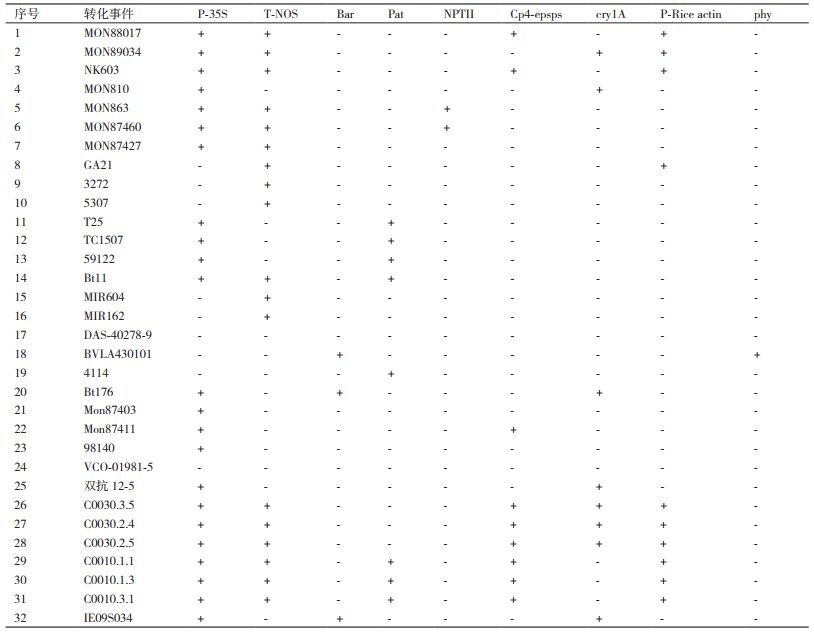
通过对元件/基因使用率及国内外检测标准方法的研究,最终确定了9个外源元件/基因的筛查策略,分别是:P-CaMV35S、T-NOS、Bar基因、Pat基因、Cp4-epsps基因、NPTⅡ基因、cry1A基因、P-Rice actin、phy结构特异性片段,按照数据库提供的信息推测,使用这9种元件/基因策略可以筛查出包括复合性状在内的261种转基因玉米,覆盖了全部285种玉米转化体的91.6%。
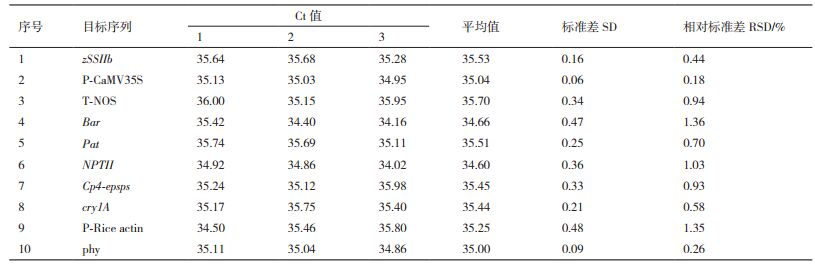
2.2 实时荧光PCR方法对不同转基因玉米材料的筛查测试为验证9种元件/基因筛选策略是否适合对玉米中的转基因成分进行筛查,利用表 2中所述引物探针对实验室前期收集到的32种玉米转化体进行验证。首先提取32种材料的DNA,根据其标注含量进行稀释,使DNA溶液中转基因成分的相对含量全部达到1%,之后进行实时荧光PCR实验,测试结果见表 3。
表 3中1-20号玉米转化体样品已获得我国发放的转基因生物安全证书,从测试结果中可以看出,除DAS-40278-9外其余19种转化体可以被9种元件的筛查方法完全覆盖;21-32号样品尚未获得我国发放的生物安全证书,其中21-24号为国外商业化转化体,25-32号为国内研发、处于申请证书或生产性试验阶段的转化体,其中VCO-01981-5无法被本筛查方法覆盖。
2.3 筛查阳性质粒分子的构建和验证将10种元件/基因人工合成并克隆到pUC18载体中,获得筛查用阳性质粒分子pYMSC-1905(图 1),其总长度为6 808 bp,由合成公司经测序验证与设计序列相符,且10种目标片段比值均为1。提取纯化质粒分子获得了50 ng/μL的样品并在Nanodrop ND-2000上进行检测,其A260/A280值为1.81,A260/A230为2.01,均符合紫外分光光度测试对DNA纯度的相关要求。

|
| 图 1 玉米转基因成分筛查阳性质粒pYMSC-1905图谱 |
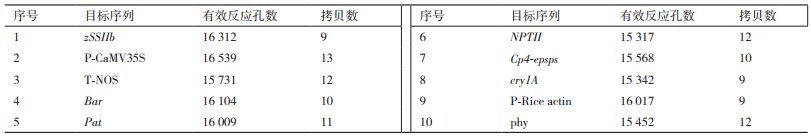
经过初步计算和评估,将获得的质粒阳性DNA样品进行梯度稀释,使用10种引物探针组合对其进行拷贝数测试,最终显示10种目标序列均获得了良好的结果,其有效反应孔数在15 000-17 000 cp/μL(图 2),符合数字PCR反应的相关参数要求,检测出的阳性质粒分子浓度在600-1 000 cp/μL(表 4)。

|
| A :zSSIIb ;B :P-CaMV35S ;C :T-NOS ;D :Bar ;E :Pat ;F :NPTII ;G :Cp4-epsps ;H :cry1A ;I :P-Rice actin ;J :phy,下同 图 2 阳性质粒分子3D-dPCR验证荧光信号 |
将数字PCR测试的同一质粒样品进行实时荧光PCR反应的可替代性测试,其检测均获得了正常的扩增曲线(图 3),结果Ct值均在36以下(表 5),与测试出的拷贝数具有良好的一致性,表明其可用作实时荧光PCR检测的阳性对照使用。

|
| 图 3 阳性质粒分子实时荧光PCR验证信号 |
截止2019年11月,我国对植酸酶玉米BVLA430101发放了生产用安全证书,并且对20种国外玉米转化体发放了进口用作加工原料安全证书,其中包括本次实验未参与验证的Bt11 X GA21,这21种转化体中除DAS-40278-9外均可以被本方法覆盖。
在转基因作物的研发过程中,为使外源基因适合在宿主植物中进行表达,经常需要根据宿主密码子的偏好对目标元件的密码子进行修饰,从而造成相同名称的基因不一定具有完全相同的核苷酸序列。因此,在设计检测方法时必须考虑同名的基因元件其DNA序列是否有差异,检测靶标在不同转化事件中是否一致,能否用同样的引物进行检测。
Cry1A基因由于被改造和使用的最多,其情况最为复杂,包含了Cry1Ab、Cry1Ac、Cry1A105等多种同源基因,本次筛查中选用的引物和探针组合可以特异性的检出MON810、Bt176等常见转化体,但无法检出Bt11,这是在日常检测中需重点关注的问题。MON87427在ISAAA数据库中显示包含Cp4-epsps基因,但测试结果中并未出现阳性结果,我们将其序列与I型Cp4-epsps基因进行了比对,发现其同源性有较大的差异(结果未列出),而这在各数据库中并未有提示,容易给依赖目标名称和数据库信息进行日常检测的机构带来误判。
本研究中构建的筛查质粒按照理论计算获得的数值与数字PCR实际测试结果具有较大的差异,推测这可能是由质粒分子本身结构造成的,在实际应用中一般倾向于以数字PCR测试值为准。由于该质粒的研发目的是作为定性检测的阳性物质,其量值的准确性及均匀性并未进行进一步测试,这也是后续工作的重点研究内容。
4 结论建立了以9种常用元件/基因为目标的基于实时荧光PCR技术的玉米转基因筛查方法,可覆盖30种独立性状玉米转化体,同时研制了可与该方法配套使用的阳性质粒分子。
| [1] |
国际农业生物技术应用服务组织. 2018年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2016, 39(8): 1-6. |
| [2] |
ISAAA. GMapprovaldatabase.http://www.isaaa.org/gmapprovaldatabase/advsearch/default.asp?CropID=6&TraitTypeID=Any&DeveloperID=Any&CountryID=Any&ApprovalTypeID=Any, 2019年8月30日更新.
|
| [3] |
Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): e63. DOI:10.1093/nar/28.12.e63 |
| [4] |
周杰, 黄文胜, 邓婷婷, 等. 环介导等温扩增法检测6种转基因大豆[J]. 农业生物技术学报, 2017, 25(2): 335-344. |
| [5] |
王颢潜, 陈锐, 李夏莹, 等. 转基因产品成分检测技术研究进展[J]. 生物技术通报, 2018, 34(3): 31-38. |
| [6] |
Salisu B, Shahid A, Yaqoob A. Molecular approaches for high throughput detection and quantification of genetically modified crops[J]. Frontiers in Plant Science, 2017, 8: 1670. DOI:10.3389/fpls.2017.01670 |
| [7] |
张海波, 张英, 刘冰, 等. 玉米中转基因成分筛查策略[J]. 西北农业学报, 2015, 24(12): 57-63. DOI:10.7606/j.issn.1004-1389.2015.12.009 |
| [8] |
张海波, 刘冰, 杨娟妮, 等. 利用实时荧光PCR快速筛查玉米中转基因成分[J]. 西北农业学报, 2017, 26(6): 840-848. |
| [9] |
吴明生, 云晓敏, 宋歌, 等. 转基因玉米种子快速筛查方法研究与应用[J]. 生物技术通报, 2013(1): 102-106. |
| [10] |
Frederic D, Eric J, Gilbert B. Development of 10 new screening PCR assays for GMO detection targeting promoters(pFMV, pNOS, pSSuAra, pTA29, Pubi, Price actin)and terminators(t35S, tE9, tOCS, tg7)[J]. European Food Research and Technology, 2013, 236(4): 659-669. DOI:10.1007/s00217-013-1921-1 |
| [11] |
Maddalena Q, Nicoletta F, Alessia B, et al. Real-time PCR-based ready-to-use multi-target analytical system for GMO detection[J]. Food Analytical Methods, 2009, 2(4): 325-336. DOI:10.1007/s12161-009-9093-0 |
| [12] |
汤婷, 谢实龙, 祝旋, 等. CaMV 35S启动子及其在转基因作物中的应用和检测[J]. 浙江农业学报, 2019, 31(1): 161-170. DOI:10.3969/j.issn.1004-1524.2019.01.21 |
| [13] |
徐俊锋, 王鹏飞, 李玥莹, 等. 转基因植物中CaMV 35S和tNOS元件的4种定性PCR检测方法的比较[J]. 农业生物技术学报, 2015, 23(3): 397-407. DOI:10.3969/j.issn.1674-7968.2015.03.014 |
| [14] |
Wu Y, Wang Y, Li J, et al. Development of a general method for detection and quantification of the p35S promoter based on assessment of existing methods[J]. Scientific Reports, 2014, 4(5): 7358-7369. DOI:10.1038/srep07358 |