2. 宁波大学食品与药学学院, 宁波 315832
2. College of Food and Pharmaceutical Sciences, Ningbo University, Ningbo 315832
病原微生物是指可以侵犯人体与动植物、引发感染甚至传染现象的微生物,其中以细菌和病毒的危害性最大[1-4]。病原微生物威胁着人类公共卫生系统,它们通过环境(空气、水源)或食物进入到动物或人体,引发多种疾病,甚至爆发大面积、突然的疫情,严重威胁动物和人类的生命,因此,对病原微生物的防控至关重要,而针对病原微生物的准确快速的检测技术是防控病原微生物的必要手段。
对病原微生物检测的传统策略主要是微生物培养及鉴定方法,操作繁琐,费时费力。然而准确的判定致病微生物来源具有时间关键性(Time-critical)[5-6],若不能及时得出正确的结论,很可能错过最佳时机。这样的延迟是造成发病率和死亡率上升的重要原因,不适当的抗菌疗法已被证明能使严重感染的存活率降低5倍[5]。而且传统培养法只适用于可培养的活菌,对于活的但非可培养(Viable but non-culturable,VBNC)状态下的微生物或者对生长培养环境非常挑剔的微生物无法进行分离、培养和鉴定,这就需要其他的检测手段。
核酸体外扩增技术的发明补充了传统检测方法的不足,相关技术被大量应用于传染病、食源性致病菌污染、环境污染、肿瘤的遗传标记物等分析中[7]。其中PCR是比较成熟的一项技术,通过快速扩增病原微生物中带有其物种特异性信息的核酸,在几个小时内就能将病原微生物鉴定出来。但是因为PCR需要精密控温的温度循环器,该仪器的价格比较昂贵,又不够便携。而且,由于许多样品中含有PCR反应抑制物,使得PCR检测中通常对样品准备的要求比较严苛。以上这些因素使PCR技术往往在实验室中使用,而不能在现场检测中发挥作用。所以,不依赖热循环仪的等温扩增技术得到了广泛关注。等温扩增技术对仪器要求简单,在保证较高的灵敏度和特异性基础上,对样品中抑制剂的抗性也较强,扩增时间短,便于实现现场实时监控,非常适用于病原微生物的现场快速检测。
通常,基于核酸等温扩增技术的快速检测有3个关键步骤:核酸提取、等温扩增和产物检测。核酸等温扩增技术发展过程中需要解决一些问题,比如如何进一步简化并提高核酸提取效率、尽可能摆脱仪器约束以适应条件有限的现场环境、拓宽等温扩增的反应温度范围、提高反应体系的稳定性和对抑制剂的抗性、提高核酸扩增效率、降低检测成本等。为了解决这些困难,诸多研究者针对核酸扩增技术的3个关键步骤进行了优化与改进,使该类技术在准确度、灵敏度、便携性等方面的优势更加突出,促进核酸等温扩增技术的科学、快速发展。本文分别从这3个环节出发,详细阐述基于等温扩增的核酸快速检测技术的发展,介绍本课题组研究涉及到的两项等温扩增技术:环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)和重组酶聚合酶扩增技术(Recombinase polymerase amplification,RPA),主要关注其在病原微生物快速检测领域的应用研究进展,并结合最新研究成果,对核酸快速检测技术未来发展进行思考和展望,以期对相关研究起到推动作用。
1 核酸快速提取技术研究核酸提取是核酸扩增技术中的关键步骤,但因为从生物样品中提取核酸的实验室方法通常比较繁琐,其在现场检测的使用常受到限制。研究者试图寻找一种简便、快速、高效、低耗能的核酸提取方法。
常用的固相提取试剂盒快速提取核酸的原理是在离液序列高的环境(Chaotropic agents)下[8]将核酸结合在固相二氧化硅支持物上,杂质则通过一系列的清洗和离心步骤去除,最后在低浓度盐溶液中将核酸从支持物中洗脱下来。但是这样的方法仍然依靠离心机。而且膜基质上残留的物质(如乙醇、Chaotropic agents)可能抑制下游DNA的扩增[9]。另外,磁珠法提取核酸采用经过特殊修饰的磁珠进行核酸的特异性捕捉和纯化[10],摆脱了对离心的依赖,通过外磁场作用分离固液相,防止在清洗和洗脱过程中核酸的流失,磁珠法能够快速地提取核酸,约需10 min,而且不需要电器设备。因此,磁珠法通常适合基质成分复杂的样品检测,如用于提取粪便标本的核酸[11-12],但因为磁珠处理成本较高,限制了此方法在快速检测领域的应用。由此,研究者致力于筛选稳定、灵敏的抗体的同时,需要考虑该方法在实际应用中的成本问题,或考虑寻找成本更加低廉的核酸提取材料,以满足经济条件较差的地区的要求。
目前有一些关于膜法快速提取核酸的报道,包括氧化铝膜[13]、基于二氧化硅的Fusion 5号膜[14-15]、基于纤维素膜的FTA卡纸[16]。这些新的方法直接将核酸从膜上转移到扩增体系中,省去核酸洗脱步骤,达到简化核酸纯化的目的。尽管这样,这些方法仍然因为复杂的制造工艺或实验前处理而限制其在核酸快速检测中得到更实际有效的应用。然而纤维素膜便宜、易得、一次性且易修饰,显然是非常理想的材料[17-19]。因此,如何发挥纤维素膜材料的自身优势,开发既操作简便,又能与下游核酸扩增反应顺利衔接的膜法核酸快速提取方法,是核酸快速提取技术发展中非常有意思的切入点。从这一点来看,纤维素膜材料的筛选、改性以及核酸提取试剂的优化将是未来值得研究的方向。
2 核酸等温扩增技术研究核酸扩增是关系到后续检测准确性的一个必要步骤,因为核酸指数扩增步骤为结果判断提供了足够的核酸浓度,能够避免由于样品浓度过低或受到背景值影响较大而被判断为假阴性的情况。近几年,一些等温扩增技术已有商业化的产品,如环介导等温扩增(LAMP)[20]、重组酶聚合酶扩增(RPA)[21]、等温指数扩增反应(Isothermal exponential amplification reaction,EXPAR)[22]、依赖解旋酶恒温扩增反应(Helicase-dependent amplification,HDA)[23]、链置换扩增(Strand displacement amplification,SDA)[24]、依赖核酸序列型扩增(Nucleic acid sequence-based amplification,NASBA)[25]、滚环扩增(Rolling circle amplification,RCA)[26]等。等温扩增技术是核酸快速检测发展中的后起之秀,兼具准确性和现场检测适用性,在环境监测、食品安全、疾病诊断等相关病原微生物快速检测领域发挥着越来越重要的作用。
2.1 环介导等温扩增技术的应用研究在等温扩增技术中,LAMP是研究较多的一种方法,该方法最初由Notomi等[20]设计,通过针对靶基因的6个区域设计了4种特异性引物,利用具链置换活性的Bst DNA聚合酶在恒温条件下(60-65℃)高效(0.5-1 h)扩增目标DNA。如今,LAMP技术被广泛应用于食品过敏源、转基因成分及致病菌的快速检测中。不仅如此,结合了LAMP的快速、高效与侧向流层析试纸条(Lateral flow dipstick,LFD)的便携、灵敏、结果可视化等优势,LAMP-LFD技术应用于病原微生物快速检测领域的相关研究已蔚然成风(表 1),检测灵敏度能够达到pg数量级的DNA,甚至更微量,或者是单拷贝数和单菌落的病原微生物等。
本课题研究者主要关注LAMP技术在有毒有害藻类快速检测中的应用(表 1),在此基础上拓宽LAMP技术的应用范围将是未来的一个意义重大的研究方向。而且LAMP已成为商检行业推荐标准常用方法。根据国家质量监督检验检疫总局发布的食品安全行业标准,LAMP方法已被应用于23个行业标准涉及20种食源性致病菌的快速检测[27-49],这说明LAMP方法得到了制度层面的认可。为了保护我国的食品安全,需要研究者开发更多针对食源性致病菌的基于LAMP方法的稳定、高效、快速的适用于野外现场条件的快速检测方法,以促进相关标准更快、更科学的制定。
2.2 核酸等温扩增技术与基因编辑技术结合的创新研究重组酶聚合酶扩增技术是本实验室关注的另一种非常适用于现场快速检测的核酸等温扩增技术。RPA于2006年被发明出来,该方法反应条件温和(37-42℃),并且能在20 min以内完成核酸扩增,检测灵敏度却可与LAMP相媲美,针对RPA的原理及其在医疗诊断、食品、农业等方面的研究进展我们已经做过专题综述[75],本文将关注等温扩增技术与基因编辑技术的创新结合,期望对核酸等温扩增检测技术的未来发展带来启发。
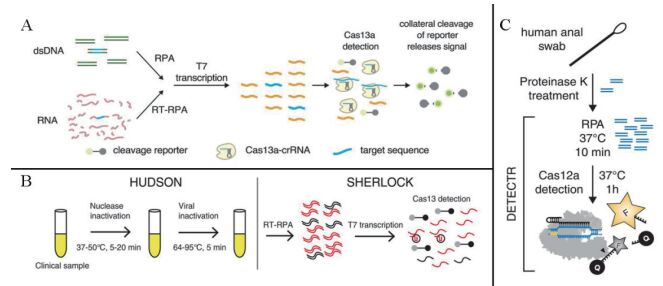
2.2.1 RPA与基因编辑技术的结合2017年,美国麻省理工学院张锋教授所在团队对RPA技术的检测能力做了全新诠释,即等温扩增技术与基因编辑技术的双剑合璧为核酸等温扩增检测技术的发展创建了一个新的平台。研究表明,RPA能与一种被称为CRISPR(Clustered regularly interspaced short palindromic repeats)/ Cas13a的基因编辑系统相结合,其检测灵敏度达到了attomolar级(attomolar =10-3 fmol),能够识别单个碱基差异[76]。检测的原理是通过RPA或RT-RPA实现目标核酸的指数扩增,反转录成RNA,Cas13a蛋白在crRNA引导下定位目标RNA,切割核酸,同时激活Cas13a蛋白的附属效应(Collateral effect),切割带有荧光和猝灭基团标记的二核苷酸(Di-nucleotide motifs),使反应体系发出荧光,荧光信号被捕捉,实现目标基因的检测。研究者赋予这种结合一个新的名称:SHERLOCK(Specific High Sensitivity Enzymatic Reporter UnLOCKing)(图 1-A),并将其应用于寨卡病毒、登革热病毒、病原菌、人类基因分型及游离DNA癌变基因检测,灵敏度和特异性都非常理想[76]。2018年,张峰团队对SHERLOCK进行完善[77],降低反应体系引物浓度为240 nmol/L,开发多重荧光定量检测多个靶标的方法,定量检测限低至2 amol/L的寨卡病毒RNA。
同年,张峰团队与哈佛大学研究人员合作,进一步推进SHERLOCK在病毒快速检测方面的实际应用。采用RPA扩增20 min后,用CRISPR/ Cas13系统孵育1 h即可完成寨卡病毒cDNA的检测,灵敏度达到0.9 amol/L,也就是说能够检测到1 μL里的单拷贝数的寨卡病毒[78]。同时,他们提出,通过加热消除核酸酶但不对核酸进行专门的提取纯化(Heating Unextracted Diagnostic Samples to Obliterate Nucleases,HUDSON)(图 1-B)也可以实现微生物核酸的高灵敏检测,即通过加热使病毒和核酸酶失活。研究者采用HUDSON处理样品,结合SHERLOCK,并通过试纸条显色将检测结果可视化,实现2 h内体液中寨卡病毒的RNA快速检测,全血、血清、唾液、尿液4种不同基质中的灵敏度分别为90 amol/L、90 amol/L、0.9 amol/L和20 amol/L。
不仅如此,美国加利福尼亚大学Doudna研究团队通过实验证明,Cas12a也可以与RPA结合(图 1-C),他们将这种结合起名为“DNA Endonuclease Targeted CRISPR Trans Reporter(DETECTR)”[79]。DETECTR被用于HPV病毒的快速检测,灵敏度达到了attomolar水平,特异性为≤ 7个碱基。因为Cas12a-crRNA能够识别单链或双链DNA,DETECTR不需要将底物转换成RNA,省去了反转录步骤,因此,与SHERLOCK相比,DETECTR的操作更加简便。2018年10月,Doudna团队将新发现的一种更小的Cas14蛋白[80]与RPA结合,进行高灵敏度、高特异性的诊断和检测方法研究。实验证明,Cas14-DETECTR比Cas12-DETECTR的特异性更高,能达到单碱基。作者将该方法应用于SNP基因分型,进行核酸等温扩增技术在分子诊断领域的创新探究。
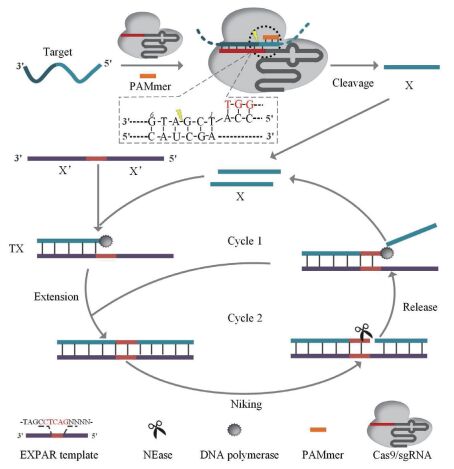
2.2.2 EXPAR与基因编辑技术的结合华南师范大学周小明研究团队[81]利用Cas9能作用于ssDNA的特性,将CRISPR/ Cas9与等温指数扩增反应(EXPAR)结合(图 2),特异性高,检测灵敏度为0.82 amol/L,并将此方法成功应用于DNA甲基化和单增李斯特菌mRNA的快速检测。
Cas12、Cas13、Cas14及Cas9,都将等温扩增技术的检测水平提升到了更灵敏、更特异、更高效、更便捷的水平。因此,等温扩增技术与基因编辑技术的结合在检测领域的发展潜力可能超乎想象,相关的应用研究意义重大。期望这两项技术的结合在未来能够被更加广泛地应用于病原微生物的快速检测、SNP检测、肿瘤筛选、抗生素抗性筛选等领域中,发挥核酸等温扩增技术最大的优势。
3 扩增产物检测技术研究核酸等温扩增产物有多种检测方法,繁简程度不同,有研究者将其分为电化学检测方法和光学检测方法[82]。然而适用于现场快速检测场合的理想方法是操作简单、不需要昂贵的仪器,甚至是不借助任何仪器,比如用肉眼就可以读出结果,而且结果的呈现方式便于使用者进行判断。从这个角度来说,基于比色和荧光的光学检测方法更加适合配搭核酸等温扩增技术在现场快速检测领域的应用[83]。
常用的核酸等温扩增产物的便携的光学检测方法有实时荧光法、可视化荧光染料法、免疫试纸条法、浊度法、比色法等。有学者对核酸等温扩增产物的检测方法做了详细的介绍[82, 84],这里不再赘述。这里将探讨既廉价又方便的纸质材料在核酸等温扩增产物检测中的应用前景。
纸质材料作为最便宜的基质,具有轻、薄、灵活、便于储存、环保的特点,其白色的表面非常适用于比色检测。而且纸能够利用毛细作用推动液体流动,省去了对泵的需求。因此,纸质材料是目前低廉核酸等温扩增检测设备的最理想材料。侧向流层析试纸条(LFD)是纸基检测设备中深受欢迎、应用频繁的一种核酸扩增产物分析工具[83],非常适用于未经专业训练的操作者使用,而且具有至少一年的保存期,这些优点推动了LFD的商业化发展。但是直接使用试纸条检测存在灵敏度不足的问题。
解决这个难题的一种途径是将纸基材料与其他工具结合起来,实现相得益彰的效果。事实上,这一方面的研究已取得进展,比如联合量子点技术检测妊娠测试中的人绒毛膜促性腺激素[85],联合生物传感器检测兽药残留[86],以及联合等温扩增技术检测致病菌[77, 87-89]等。这些LFD主要采用的是胶体金作为标记物,借助核酸等温扩增技术快速、便携等优势,核酸等温扩增-LFD技术在病原微生物的检测方面得到了快速发展,涉及医疗诊断、药物测试以及食品质量监督等多个领域。由此可见,核酸等温扩增-LFD技术的创新开发与研究将仍是未来快速检测研究的热点。
4 总结与展望为了满足核酸等温扩增检测的需要,必须明确三大关键步骤相关技术上的短板,才能针对每一个环节选择正确的材料和技术。随着研究的发展,新的技术与材料扩宽了研究思路,并且已有的研究表明,创新的尝试有很多惊喜的发现和突破。比如纸基材料在核酸提取和检测方面的创新增加了现场检测设备的灵活性,为现场快速检测提供更多的可能;随着研究的不断深入,核酸等温扩增技术被广泛应用于多种微生物快速检测,还有更多领域值得探究;以及核酸等温扩增技术与最新的基因编辑技术的结合,将检测诊断技术的靶标精准性与检测速度都提升到了更高的水平。总而言之,不论是从技术方面,还是材料改进方面,已经报道出来的研究都表明研究者正努力推动着核酸等温扩增技术快速发展,为中心实验室外的病原微生物快速检测领域的应用创造更多的便利,为进一步实现核酸等温扩增检测技术更低的材料成本、更简化的操作步骤提供新思路。
| [1] |
李成庭, 李丽蒙, 高子文. 实时荧光PCR和普通PCR方法检测病原微生物的灵敏度比较[J]. 世界最新医学信息文摘, 2016, 16(64): 179-180. DOI:10.3969/j.issn.1671-3141.2016.64.151 |
| [2] |
王一娴, 叶尊忠, 斯城燕, 等. 适配体生物传感器在病原微生物检测中的应用[J]. 分析化学, 2012, 40(4): 634-642. |
| [3] |
钟岸, 蔡蓁, 王毅. 实时荧光PCR和普通PCR方法检测病原微生物的灵敏度比较[J]. 海南医学, 2013, 24(13): 1956-1958. DOI:10.3969/j.issn.1003-6350.2013.13.0809 |
| [4] |
彭奕欣, 魏群, 徐向忱, 等. 中国中学教学百科全书·生物卷[M]. 沈阳: 沈阳出版社, 1990.
|
| [5] |
Craw P, Balachandran W. Isothermal nucleic acid amplification technologies for point-of-care diagnostics:a critical review[J]. Lab on a Chip, 2012, 12(14): 2469-2486. DOI:10.1039/c2lc40100b |
| [6] |
Hassan MM, Ranzoni A, Cooper MA. A nanoparticle-based method for culture-free bacterial DNA enrichment from whole blood[J]. Biosensors & Bioelectronics, 2018, 99: 150-155. |
| [7] |
Zhang L, Ding B, Chen Q, et al. Point-of-care-testing of nucleic acids by microfluidics[J]. TrAC Trends in Analytical Chemistry, 2017, 94: 106-116. DOI:10.1016/j.trac.2017.07.013 |
| [8] |
Boom R, Sol CJ, Salimans MM, et al. Rapid and simple method for purification of nucleic acids[J]. Journal of Clinical Microbiology, 1990, 28(3): 495-503. DOI:10.1128/JCM.28.3.495-503.1990 |
| [9] |
Kim J, Mauk M, Chen D, et al. A PCR reactor with an integrated alumina membrane for nucleic acid isolation[J]. Analyst, 2010, 135(9): 2408-2414. DOI:10.1039/c0an00288g |
| [10] |
Nargessi D, Ou CY. Magazorb:A simple tool for rapid isolation of viral nucleic acids[J]. J Infect Dis, 2010, 201(S1): S37-S41. DOI:10.1086/650391 |
| [11] |
李万水, 陈松, 涂政. 粪便DNA提取及检验[J]. 中国法医学杂志, 2004, 19(4): 219-221. DOI:10.3969/j.issn.1001-5728.2004.04.007 |
| [12] |
刘宇轩, 邱晓明, 程萍萍, 等. 利用PrepFiler ExpressTM提取粪便DNA1例[J]. 中国法医学杂志, 2017, 32(1): 79-80. |
| [13] |
Oblath EA, Henley WH, et al. A microfluidic chip integrating DNA extraction and real-time PCR for the detection of bacteria in saliva[J]. Lab on a Chip, 2013, 13(7): 1325-1332. DOI:10.1039/c3lc40961a |
| [14] |
Mcfall SM, Wagner RL, Jangam SR, et al. A simple and rapid DNA extraction method from whole blood for highly sensitive detection and quantitation of HIV-1 proviral DNA by real-time PCR[J]. Journal of Virological Methods, 2015, 214: 37-42. DOI:10.1016/j.jviromet.2015.01.005 |
| [15] |
Govindarajan AV, Ramachandran S, Vigil GD, et al. A low cost point-of-care viscous sample preparation device for molecular diagnosis in the developing world; an example of microfluidic origami[J]. Lab on a Chip, 2011, 12(1): 174-181. |
| [16] |
Liu C, Geva E, Mauk M, et al. An isothermal amplification reactor with an integrated isolation membrane for point-of-care detection of infectious diseases[J]. Analyst, 2011, 136(10): 2069-2076. DOI:10.1039/c1an00007a |
| [17] |
Gerbers R, Foellscher W, Chen H, et al. A new paper-based platform technology for point-of-care diagnostics[J]. Lab on a Chip, 2014, 14(20): 4042-4049. DOI:10.1039/C4LC00786G |
| [18] |
Rivas L, Medina-Sánchez M, de la Escosura-Muñiz A, et al. Improving sensitivity of gold nanoparticle-based lateral flow assays by using wax-printed pillars as delay barriers of microfluidics[J]. Lab on a Chip, 2014, 14(22): 4406-4414. DOI:10.1039/C4LC00972J |
| [19] |
Mahadeva SK, Walus K, Stoeber B. Paper as a platform for sensing applications and other devices:a review[J]. ACS Applied Materials & Interfaces, 2015, 7(16): 8345-8362. DOI:10.1021/acsami.5b00373 |
| [20] |
Notomi T, Okayama H, et al. Loop-mediated isothermal amplifica-tion of DNA[J]. Nucleic Acids Res, 2000, 28(12): E63. DOI:10.1093/nar/28.12.e63 |
| [21] |
Piepenburg O, Williams C, Stemple D, et al. DNA detection using recombination proteins[J]. PLoS Biol, 2006, 4(7): 1115-1121. |
| [22] |
Van Ness J, Van Ness LK, Galas DJ. Isothermal reactions for the amplification of oligonucleotides[J]. PNAS, 2003, 100(8): 4504-4509. DOI:10.1073/pnas.0730811100 |
| [23] |
Vincent M, Xu Y, Kong H. Helicase-dependent isothermal DNA amplification[J]. EMBO Reports, 2004, 5(8): 795-800. DOI:10.1038/sj.embor.7400200 |
| [24] |
Zhang L, Zhu G, Zhang C. Homogeneous and label-free detection of microRNAs using bifunctional strand displacement amplification-mediated hyperbranched rolling circle amplification[J]. Analytical Chemistry, 2014, 86(13): 6703-6709. DOI:10.1021/ac501645x |
| [25] |
Compton J. Nucleic acid sequence-based amplification[J]. Nature, 1991, 350(6313): 91-92. DOI:10.1038/350091a0 |
| [26] |
Li N, Jablonowski C, Jin H, et al. Stand-alone rolling circle amplification combined with capillary electrophoresis for specific detection of small RNA[J]. Anal Chem, 2009, 81(12): 4906. DOI:10.1021/ac900578a |
| [27] |
中华人民共和国上海出入境检验检疫局, 中华人民共和国山东出入境检验检疫局, 中华人民共和国天津出入境检验检疫局, 等.国境口岸环介导恒温扩增(LAMP)检测方法第1部分: 鼠疫杆菌: SN/T 3306. 1-2012[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2012.
|
| [28] |
中华人民共和国上海出入境检验检疫局, 中华人民共和国天津出入境检验检疫局, 中国疾病预防控制中心, 等.国境口岸环介导恒温扩增(LAMP)检测方法第2部分: 产毒素霍乱弧菌: SN/T 3306. 2-2012[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2012.
|
| [29] |
中华人民共和国天津出入境检验检疫局, 中华人民共和国山东出入境检验检疫局, 正元盛邦(天津)生物科技有限公司.国境口岸环介导恒温扩增(LAMP)检测方法第3部分: 志贺氏菌: SN/T 3306. 3-2012[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2012.
|
| [30] |
中华人民共和国天津出入境检验检疫局, 中华人民共和国黑龙江出入境检验检疫局, 中华人民共和国上海出入境检验检疫局, 等.国境口岸环介导恒温扩增(LAMP)检测方法第4部分: 嗜肺军团菌: SN/T 3306. 4-2012[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2012.
|
| [31] |
中华人民共和国上海出入境检验检疫局, 中国疾病预防控制中心, 广州华峰生物科技有限公司.国境口岸环介导恒温扩增(LAMP)检测方法第5部分: 布鲁氏菌: SN/T 3306. 5-2013[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2013.
|
| [32] |
中华人民共和国广东出入境检验检疫局, 广州华峰生物科技有限公司, 中华人民共和国黑龙江出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第1部分: 金黄色葡萄球菌: SN/T 2754. 1-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [33] |
中华人民共和国天津出入境检验检疫局, 中华人民共和国北京出入境检验检疫局, 中华人民共和国江门出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第2部分: 大肠杆菌O157: SN/T 2754. 2-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [34] |
中华人民共和国天津出入境检验检疫局, 中华人民共和国北京出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第3部分: 志贺氏菌: SN/T 2754. 3-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [35] |
中华人民共和国福建出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 中华人民共和国浙江出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第4部分: 单核细胞增生李斯特菌: SN/T 2754. 4-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [36] |
中华人民共和国珠海出入境检验检疫局, 中华人民共和国北京出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第5部分: 副溶血性弧菌: SN/T 2754. 5-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [37] |
中华人民共和国天津出入境检验检疫局, 中华人民共和国山东出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第6部分: 小肠结肠炎耶尔森氏菌: SN/T 2754. 6-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [38] |
中华人民共和国江苏出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 广州华峰生物科技有限公司, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第7部分: 空肠弯曲菌: SN/T 2754. 7-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [39] |
中华人民共和国广东出入境检验检疫局, 中华人民共和国上海出入境检验检疫局, 广州华峰生物科技有限公司, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第8部分: 肺炎克雷伯氏菌: SN/T 2754. 8-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [40] |
中华人民共和国珠海出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 中华人民共和国浙江出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第9部分: 溶血性链球菌: SN/T 2754. 9-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [41] |
中华人民共和国珠海出入境检验检疫局, 中华人民共和国盐城出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第10部分: 产气荚膜梭菌: SN/T 2754. 10-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [42] |
中华人民共和国北京出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 中华人民共和国珠海出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第11部分: 产霍乱毒素的霍乱弧菌: SN/T 2754. 11-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [43] |
中华人民共和国北京出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 中华人民共和国湖北出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第12部分: 溶藻弧菌: SN/T 2754. 12-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [44] |
中华人民共和国北京出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 中华人民共和国珠海出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第13部分: 创伤弧菌: SN/T 2754. 13-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [45] |
中华人民共和国天津出入境检验检疫局, 中华人民共和国山东出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第14部分: 假结核耶尔森氏菌: SN/T 2754. 14-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [46] |
中华人民共和国山东出入境检验检疫局, 中华人民共和国广东出入境检验检疫局, 广州华峰生物科技有限公司, 等.出口食品中致病菌环介导恒温扩增(LAMP)检测方法第15部分: 阪琦肠杆菌: SN/T 2754. 15-2011[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2011.
|
| [47] |
中华人民共和国上海出入境检验检疫局.猪瘟病毒逆转录环介导等温核酸扩增检测方法: SN/T 3327-2012[S].北京: 中华人民共和国国家质量监督检验检疫总局, 2012.
|
| [48] |
吉林省畜牧兽医科学研究院.动物源性食品中沙门菌环介导等温扩增(LAMP)检测方法: DBS22/020-2013[S].吉林: 吉林省卫生和计划生育委员会, 2013.
|
| [49] |
河北农业大学.肉及肉制品中沙门氏菌环介导等温扩增(LAMP)检测方法: DBS13/008-2017[S].河北: 河北省卫生和计划生育委员会, 2017.
|
| [50] |
Zhao Y, Jiang X, Qu Y, et al. Salmonella detection in powdered dairy products using a novel molecular tool[J]. Journal of Dairy Science, 2017, 100(5): 3480-3496. DOI:10.3168/jds.2016-12535 |
| [51] |
Wachiralurpan S, Sriyapai T, Areekit S, et al. Development of a rapid screening test for Listeria monocytogenes in raw chicken meat using loop-mediated isothermal amplification(LAMP)and lateral flow dipstick(LFD)[J]. Food Analytical Methods, 2017, 10(11): 3763-3772. DOI:10.1007/s12161-017-0949-4 |
| [52] |
李秀梅, 梁智选, 李颖, 等. 环介导等温扩增技术与横向流动试纸条法快速检测布鲁氏杆菌[J]. 食品与生物技术学报, 2017, 36(12): 1276-1282. DOI:10.3969/j.issn.1673-1689.2017.12.008 |
| [53] |
Prompamorn P, Sithigorngul P, et al. The development of loop-mediated isothermal amplification combined with lateral flow dipstick for detection of Vibrio parahaemolyticus[J]. Lett Appl Microbiol, 2011, 52(4): 344-351. DOI:10.1111/j.1472-765X.2011.03007.x |
| [54] |
李尚阳, 周前进, 张严峻, 等. 环介导等温扩增联合横向流动试纸条可视化检测志贺氏菌[J]. 微生物学通报, 2016, 43(7): 1616-1626. |
| [55] |
杨梦香, 柴方超, 周前进, 等. 应用LAMP-LFD技术可视化检测河流弧菌(Vibrio fluvialis)的研究[J]. 海洋与湖沼, 2017, 48(2): 383-391. |
| [56] |
柴方超, 周前进, 陈炯. 环介导等温扩增联合横向流动试纸条可视化检测迟缓爱德华菌[J]. 中国兽医学报, 2017, 37(6): 1103-1110. |
| [57] |
蔡怡, 周前进, 陈炯. 环介导等温扩增联合横向侧流试纸(LAMP-LFD)对嗜水气单胞菌快速检测方法的建立[J]. 中国兽医学报, 2016, 36(2): 256-264. |
| [58] |
程蝶, 柴方超, 蔡怡, 等. 环介导等温扩增联合横向流动试纸条可视化检测哈维氏弧菌的研究[J]. 生物技术通报, 2016, 32(6): 60-68. |
| [59] |
王耀焕, 王瑞娜, 周前进, 等. 环介导等温扩增联合横向流动试纸条快速检测创伤弧菌检测方法的建立[J]. 生物技术通报, 2014(6): 81-87. |
| [60] |
Surasilp T, Longyant S, Rukpratanporn S, et al. Rapid and sensitive detection of Vibrio vulnificus by loop-mediated isothermal amplification combined with lateral flow dipstick targeted to rpoS gene[J]. Mol Cell Probes, 2011, 25(4): 158-163. DOI:10.1016/j.mcp.2011.04.001 |
| [61] |
Li Z, Xiong Y, Zhu P, et al. Sensitive and rapid detection of sulfate-reducing bacteria in jet fuel by loop-mediated isothermal amplification combined with lateral flow dipstick[J]. American Journal of Biochemistry and Biotechnology, 2018, 14(2): 117-123. DOI:10.3844/ajbbsp.2018.117.123 |
| [62] |
朱俊灵, 叶佐东, 邓洁汝, 等. 猪瘟病毒RT-LAMP-LFD检测方法的建立与应用[J]. 华南农业大学学报, 2016, 37(1): 1-7. |
| [63] |
Xu C, Feng Y, Chen Y, et al. Rapid detection of measles virus using reverse transcription loop-mediated isothermal amplification coupled with a disposable lateral flow device[J]. Diagnostic Microbiology and Infectious Disease, 2016, 85(2): 168-173. |
| [64] |
刘露, 李伟哲, 肖勤. 环介导等温扩增联合横向流动试纸条检测草鱼呼肠孤病毒方法的建立[J]. 河北农业大学学报, 2018, 41(2): 99-104. |
| [65] |
Lin F, Liu L, Hao G, et al. The development and application of a duplex reverse transcription loop-mediated isothermal amplification assay combined with a lateral flow dipstick method for Macrobrachium rosenbergii nodavirus and extra small virus isolated in China[J]. Molecular and Cellular Probes, 2018, 40: 1-7. DOI:10.1016/j.mcp.2018.05.001 |
| [66] |
李秀梅, 石瑜, 朱雅宁, 等. 环介导等温扩增技术与横向流动试纸条法快速检测鸡贫血病毒的研究[J]. 中国动物传染病学报, 2018, 26(1): 25-31. |
| [67] |
蔡怡, 周前进, 顾建锋, 等. 山茶根结线虫的LAMP-LFD快速检测方法[J]. 农业生物技术学报, 2016, 24(5): 770-780. |
| [68] |
Lalle M, Possenti A, Dubey JP, et al. Loop-Mediated Isothermal Amplification-Lateral-Flow Dipstick(LAMP-LFD)to detect Toxoplasma gondii oocyst in ready-to-eat salad[J]. Food Microbiology, 2018, 70: 137-142. DOI:10.1016/j.fm.2017.10.001 |
| [69] |
Kongkasuriyachai D, Yongkiettrakul S, Kiatpathomchai W, et al. Loop-mediated isothermal amplification and LFD combination for detection of Plasmodium falciparum and Plasmodium vivax[J]. Methods in Molecular Biology, 2017, 1572: 431-443. DOI:10.1007/978-1-4939-6911-1_28 |
| [70] |
Zhu P, Zhang BF, Wu JH, et al. Sensitive and rapid detection of microcystin synthetase E Gene(mcy E)by loop-mediated isothermal amplification:A new assay for detecting the potential microcystin-producing Microcystis in the aquatic ecosystem[J]. Harmful Algae, 2014, 37: 8-16. DOI:10.1016/j.hal.2014.04.018 |
| [71] |
Huang H, Zhu P, Zhou C, et al. The development of loop-mediated isothermal amplification combined with lateral flow dipstick for detection of Karlodinium veneficum[J]. Harmful Algae, 2017, 62: 20-29. DOI:10.1016/j.hal.2016.11.022 |
| [72] |
Huang H, Zhu P, Zhou C, et al. Detection of Skeletonema costatum based on loop-mediated isothermal amplification combined with lateral flow dipstick[J]. Mol Cell Probes, 2017, 36: 36-42. DOI:10.1016/j.mcp.2017.08.003 |
| [73] |
邹怡欣, 黄海龙, 乔龙亮, 等. 基于LAMP-LFD技术的有害赤潮藻东海原甲藻(Prorocentrum donghaiense)快检方法[J]. 海洋与湖沼, 2018, 49(3): 586-593. |
| [74] |
Zhu P, Huang H, Zhou C, et al. Sensitive and rapid detection of Prymnesium parvum(Haptophyceae)by loop-mediated isothermal amplification combined with a lateral flow dipstick[J]. Aquaculture, 2019, 505: 199-205. DOI:10.1016/j.aquaculture.2019.02.059 |
| [75] |
高威芳, 朱鹏, 黄海龙. 重组酶聚合酶扩增技术:一种新的核酸扩增策略[J]. 中国生物化学与分子生物学报, 2016, 32(6): 627-634. |
| [76] |
Gootenberg JS, Abudayyeh OO, Lee JW, et al. Nucleic acid detection with CRISPR-Cas13a/ C2c2[J]. Science, 2017, 356(6336): 438-442. DOI:10.1126/science.aam9321 |
| [77] |
Gootenberg JS, Abudayyeh OO, Kellner MJ, et al. Multiplexed and portable nucleic acid detection platform with Cas13, Cas12a, and Csm6[J]. Science, 2018, 360(6387): 439-444. DOI:10.1126/science.aaq0179 |
| [78] |
Myhrvold C, Freije CA, et al. Field-deployable viral diagnostics us-ing CRISPR-Cas13[J]. Science, 2018, 360(6387): 444-448. DOI:10.1126/science.aas8836 |
| [79] |
Chen JS, Ma E, Harrington LB, et al. CRISPR-Cas12a target binding unleashes indiscriminate single-stranded DNase activity[J]. Science, 2018, 360(6387): 436-439. DOI:10.1126/science.aar6245 |
| [80] |
Harrington LB, Burstein D, Chen JS, et al. Programmed DNA destruction by miniature CRISPR-Cas14 enzymes[J]. Science, 2018, 362(6416): 839-842. DOI:10.1126/science.aav4294 |
| [81] |
Huang M, Zhou X, Wang H, et al. Clustered regularly interspaced short palindromic repeats/Cas9 triggered isothermal amplification for site-specific nucleic acid detection[J]. Analytical Chemistry, 2018, 90(3): 2193-2200. |
| [82] |
叶璟, 朱慧. 核酸等温扩增产物检测方法的研究进展[J]. 科技通报, 2019, 35(3): 215-218. |
| [83] |
Maffert P, Reverchon S, Nasser W, et al. New nucleic acid testing devices to diagnose infectious diseases in resource-limited settings[J]. Eur J Clin Microbiol Infect Dis, 2017, 36(10): 1717-1731. DOI:10.1007/s10096-017-3013-9 |
| [84] |
梁海燕, 刘文鑫, 杨志刚. 等温核酸扩增技术进展[J]. 中国医学创新, 2017, 14(16): 145-148. DOI:10.3969/j.issn.1674-4985.2017.16.042 |
| [85] |
Yan X, Wang K, Lu W, et al. CdSe/ZnS quantum dot-labeled lateral flow strips for rapid and quantitative detection of gastric cancer carbohydrate antigen 72-4[J]. Nanoscale Research Letters, 2016, 11: 138. DOI:10.1186/s11671-016-1355-3 |
| [86] |
Song C, Zhi A, Liu Q, et al. Rapid and sensitive detection of β-agonists using a portable fluorescence biosensor based on fluorescent nanosilica and a lateral flow test strip[J]. Biosensors and Bioelectronics, 2013, 50: 62-65. DOI:10.1016/j.bios.2013.06.022 |
| [87] |
王利丽, 张莉, 李秀丽, 等. 肠出血性大肠杆菌O157:H7 LAMP-LFD快速检测方法的建立及初步应用[J]. 中国兽医科学, 2015, 45(8): 807-812. |
| [88] |
Gao W, Huang H, Zhang Y, et al. Recombinase polymerase amplification-based assay for rapid detection of Listeria monocytogenes in food samples[J]. Food Analytical Methods, 2017, 10(6): 1972-1981. DOI:10.1007/s12161-016-0775-0 |
| [89] |
Zhu P, Gao W, Huang H, et al. Rapid detection of Vibrio parahaemolyticus in shellfish by real-time recombinase polymerase amplification[J]. Food Analytical Methods, 2018, 11(8): 2076-2084. DOI:10.1007/s12161-018-1188-z |