2. 中南民族大学生命科学学院, 武汉 430074;
3. 天津市农业质量标准与检测技术研究所, 天津 300381;
4. 浙江省农业科学院农产品质量标准研究所, 杭州 310021
2. School of Life Science, South-Central University for Nationalities, Wuhan 430074;
3. Tianjin Institute of Agricultural Quality Standard and Testing Technology, Tianjin Academy of Agricultural Sciences, Tianjin 300381;
4. The Institute of Quality Standards for Agricultural Products, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021
转基因产品检测标准物质在转基因生物安全监管、转基因产品定性与定量检测、检测方法研究与标准化过程中是不可缺少的物质基础。应用可靠的标准物质可有效提高转基因检测结果可比性、有效性和溯源性,是获得高质量分析测定数据的保证[1]。
转基因检测标准物质的研制过程复杂、技术要求高,目前国际上研制转基因检测标准物质的单位较少,主要有美国的油脂化学家学会(American Oil Chemists’Society,AOCS)和欧盟联合研究中心(Joint Research Center,JRC)。此外,日本国立食品综合研究所(National Food Resear ch Institute,NFRI)和墨西哥国家计量院(The National Center of Metrology,CENAM)[2]也生产少量转基因检测标准物质。为占领转基因检测标准物质研制的制高点,我国自2008年开始,在转基因生物新品种培育重大专项的支持下,也成功研制出了一系列转基因检测标准物质[3]。
根据转基因产品检测标准物质的形态特征,可分为基体标准物质、基因组DNA和质粒DNA标准物质3种类型[3]。本文主要对国内外转基因检测标准物质的研制现状,同类或同种转化体标准物质的量值表达方式进行对比分析,为我国转基因生物检测标准物质研制工作的进一步开展提供支撑。
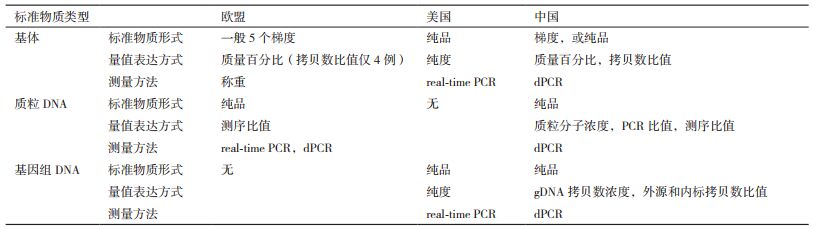
1 不同研发机构转基因检测标准物质研制现状 1.1 欧盟转基因检测标准物质研发概况欧盟研发的标准物质有基体标准物质和质粒DNA标准物质两种类型。由于欧盟法规规定转基因生物的含量是以质量百分比(mass fraction,% m/m)来衡量,因此其量值单位大多是g/kg,一般有5个不同梯度(https://ec.europa.eu/jrc/en/research-topic/reference-materials-gmo-analysis)。
欧盟研发了4个质粒分子标准物质,分别为ERM-AD413、ERM-AD415、ERM-AD425和ERMAD427。值得注意的是欧盟在标准物质使用指南中规定,在转基因定量检测中,应以质量百分比的标准物质测定结果为准,测量结果为拷贝数百分比(DNA copy number ratio,% cpT/cpE)的应转换为质量百分比。欧盟在2019年10月针对各转化体发布了拷贝数百分比转化为质量百分比的转换系数[4]。
1.2 AOCS转基因检测标准物质研发概况AOCS研制的是纯品形式的标准物质,有基体和基因组DNA两种类型。从AOCS转基因生物标准物质目录及量值表(https://www.aocs.org/crm)可以发现,AOCS所赋予的量值及不确定度主要从纯度的角度考虑。但是,无论是相同或不同类型的标准物质,其量值表达方式和单位均没有达到一致。有的量值就是该转化体本身,也不具有不确定度;有的量值和不确定度根据抽样检验的结果用统计分析的方法计算得来。有的标准物质有量值单位,有的则没有量值单位。
虽然AOCS的标准物质在量值方面具有不一致性,但其在研制过程中尽量保证标准物质的纯度,对原材料的身份和纯度进行了充分的实验验证。
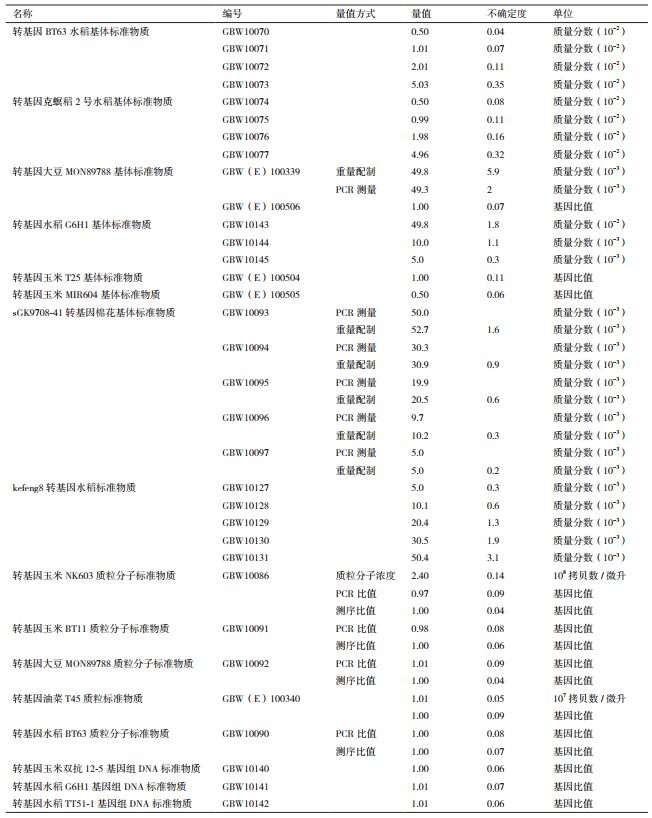
1.3 我国转基因检测标准物质研发概况我国在转基因生物新品种培育重大专项的支持下,目前也成功研制出了一些转基因生物标准物质(表 1)。我国标准物质的量值测定和不确定度评估模式与欧盟模式相似,但特性量值更多样化,不仅有质量百分比值,还有基因的拷贝数浓度值,基因的拷贝数百分比值。质量分数值可由PCR测量和重量配制两种测量方式得来。
比较国际上不同研发机构生产的转基因生物标准物质的特点,可综合为以下区别。
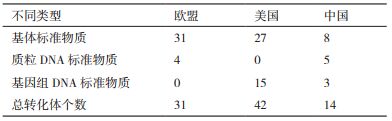
2.1 在转化体数量上的差异从表 2可以看到欧盟生产了31个转化体的标准物质,其中31个转化体的基体标准物质,4个转化体的质粒DNA标准物质。AOCS生产了42个转化体的标准物质,其中27个转化体的基体标准物质,15个转化体的基因组DNA标准物质。我国生产了14个转化体的标准物质,其中8个转化体的基体标准物质,5个转化体的质粒DNA标准物质,3个转化体的基因组DNA标准物质。
AOCS生产的标准物质转化体较全面,欧盟在制定拷贝数百分比转化为质量百分比的转化系数时,也使用了AOCS生产的纯品标准物质(如MON89788转化系数的确定)。
2.2 在标准物质量值表达方式上的差异欧盟以质量百分比作为标准物质的量值表达方式,并坚持所有的检测结果应转化成质量百分比的形式。AOCS则以纯度作为标准物质的量值表达方式。我国研发的标准物质的量值表达方式既有质量百分比,也有拷贝数百分比,标准物质既有梯度形式,也有纯品形式,但在量值测定和不确定度评估方面与欧盟更接近(表 3)。
在使用不同表达方式对转基因检测标准物质赋值时发现,对于同一个标准物质,质量分数比为100%时,拷贝数百分比不一定为100%[4]。对于基体标准物质和基因组DNA标准物质,候选物种子的遗传特性决定了量值的差异。在植物发育过程中,种子来自父本母本生殖细胞的融合,以及后期的组织分化,最终造成种子内部不同部位的染色体倍性、基因组成等遗传信息不同[5-6]。
3.1 遗传特性单子叶和双子叶植物的种子具有不同的遗传特性。单子叶的种皮发育自母本胚囊的壁,为双倍体;胚乳来自母本的双倍体和父本的单倍体,所以为三倍体;胚含有父本和母本各一半遗传物质,为二倍体;且这3种组织中DNA总量随物种和品种的不同存在差异。双子叶的种皮发育自母本胚囊壁,为二倍体;胚和胚乳(停止发育)中均含有父母本各一半遗传物质,为双倍体。
3.2 种子的纯合性制种特点例如自交、杂交、远缘杂交等影响种子的纯合性,父本或母本为转基因亲本对种子产品的影响也不同。
大豆是自交植物,因此绝大多数为纯合子;玉米为典型的杂交植物,种子为杂交种,其子代含有非转基因、纯合转基因和杂合转基因(1:2:1)。现有的转基因玉米标准物质大多数为杂交材料(即种子),而被检材料(籽粒)大多为混合样品,平均含有75%的转基因籽粒(1/3纯合,2/3杂合)。油菜有自交植物,但是在自然条件下,杂交率在5%-30%,而且其杂交品种也越来越多。菜籽多用来榨油和饲用,样品混合度很高。
3.3 DNA提取效率基体标准物质研制是由转基因阳性材料及其受体材料充分混合,形成不同重量梯度的标准物质。但是,如果阳性与受体材料的DNA提取效率不同,会造成从基体标准物质中提取DNA总量中,阳性材料DNA与非转基因受体DNA比值,与经认证的重量比(g/kg)的结果显著偏差,导致重量比值与拷贝数比值两种量值方式的结果不一致。
3.4 其他因素很多其他因素造成了外源基因含量的差异,包括食用饲用的种子组织特点、品种差异、父母本差异、种子成熟度等。
4 不同量值单位的转换在国际现行的转基因阈值标识体系中,均使用重量法来表示,因此现有转基因检测标准物质大部分以重量法来表示特性量值。但随着数字PCR等检测技术[7],质粒DNA[3]等标准物质研制技术和溯源体系的进步,拷贝数比值的表达方式越来越得到共识。为了保障检测结果的一致性和互通性,欧盟引入医疗检验中常用的参考测量系统(Reference measurement systems)的概念[8-9],提出了转换系数(Conversion factor,CF)的概念[10],对52个转化体对应的标准物质的转化系数进行确定,并提供了详细的应用说明[11]。
4.1 转换系数的确定转换系数是欧盟联合实验室(EURL-GMFF)通过试验手段确定的,其测量不确定度最终将输入到转基因检测标准物质整体不确定度当中。

其中,CFCRM为标准物质转换系数,cpT为外源基因拷贝数浓度(以cpT/μL表示),cpE为内标准基因拷贝数浓度(以cpE/μL表示),mGM为转基因成分含量(以重量法%表示),mnonGM为非转基因成分含量(以重量法%表示)。
4.2 转换系数的应用在检测过程中,通过数字PCR或其他方法获得的拷贝数比值结果,除以标准物质转换系数CFCRM即为百分比浓度结果。
其测量不确定度计算如下:

其中,ucomb为合成不确定度,um为拷贝数比值测量中的相对不确定度,uCF为标准物质转换系数的不确定度。
由于与转换系数相关的不确定度较低,因此最终结果的扩展不确定度估计数仅略微增加。
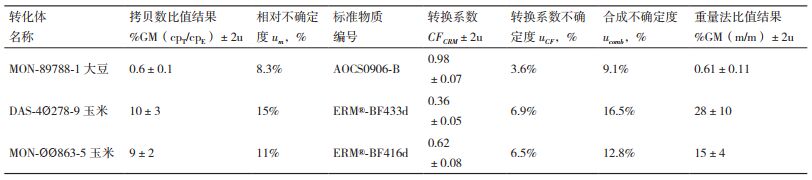
表 4展示了对模拟混合样品检测结果的转换过程。模拟样品中含有MON-89788 -1大豆、DAS-4Ø278 -9玉米、MON-ØØ863 -5玉米,经数字PCR方法检测获得拷贝数比值结果(%GM,cpT/cpE)。应用CFCRM,对定量结果进行转化,获得重量法比值结果(%GM,m/m)。
自2008年开始,我国启动了转基因生物新品种培育重大专项“转基因成分检测标准物质”,系统建立了涵盖候选物鉴定、制备、联合定值、不确定度评估、试用性评价等关键环节的转基因检测标准物质研制技术体系,发布了一系列技术标准[12-20],成功研制出了一系列转基因检测标准物质[3]。Wu等[21]在对现有技术成果总结的基础上,提出了转基因检测标准物质研制策略,为今后标准物质研制提供了思路和参考。其中,对于基体标准物质,建议以纯品为主,量值形式包括重量比值和拷贝数比值;对于基因组DNA标准物质,建议以叶片为材料,量值包括拷贝数浓度和拷贝数比值;对于质粒DNA标准物质,以多靶标、定性检测阳性对照为定位,主要用于非授权检测。
5.2 加强合作共赢,建立国内外交流机制对比欧盟、美国和我国的转基因检测标准物质研发进展发现,在标准物质类型、转化体种类、量值表达等方面均存在差异;欧盟和美国研发的转化体仅有1项重复;我国研发重点在于国内具有产业化前景的转化体;但整体求同存异,并通过转换系数等方法达到量值的统一。
为了维护我国转基因检测标准物质研发技术的先进性,避免重复研制,建议建立国内外合作交流机制,以信息交换、联合攻关为重点,在实现资源共享的同时,优势互补,不仅可以提高标准物质的质量,也对未来全球标准物质的发展、等效一致的量传溯源体系的推进意义重大。
5.3 紧跟上游研发,扩宽新型标准物质领域随着社会和经济的发展,标准物质的应用领域不断拓展。当前国内外转基因检测标准物质集中为转基因作物,而在转基因动物、新型转基因产品涉及较少。为保持技术领先地位,应紧跟转基因新产品、新技术发展态势,扩宽新型标准物质领域,做好技术储备。主要包括基因编辑产品、RNAi产品、转基因动物标准物质等。基因编辑产品标准物质的研制可以从质粒DNA构建上突破。李葱葱等[22]以MSTN基因编辑动物为研究对象,构建了编辑型和野生型质粒对照。其中编辑型含有MSTN基因序列147 bp,野生型含有149 bp,编辑型较野生型少了2个碱基,形成一个[AG]缺失的InDel标记,并以该InDel标记位点为靶标,建立了基于焦磷酸测序技术的基因编辑产品定量检测方法。
5.4 围绕产品应用,做好技术培训和应用指导转基因检测过程复杂,特别是在转基因定量检测过程中,涉及DNA提取效率、定值结果表述、测量不确定度评估等难点[23]。为更好达到测量值的准确性、一致性,转基因检测标准物质研发机构应做好标准物质应用的技术培训,在难点和细节上进行技术指导。目前国内外的标准物质均附有标准物质证书及简单的使用说明,但信息量明显不足。建议围绕转基因检测标准物质应用,结合检测技术标准,开展测量不确定度评估[24]、基于数字PCR的转基因定量检测、拷贝数比值量值标准物质应用等内容的技术培训。
| [1] |
陈锐, 朱珠, 兰青阔, 等. 转基因检测技术与标准物质研究概述[J]. 天津农业科学, 2014(3): 10-14. DOI:10.3969/j.issn.1006-6500.2014.03.003 |
| [2] |
Galvan EC, Torres M, Urquiza MP, et al. Zea maize reference materials for genetically modified organism detection in Mexico[J]. Ecology and Evolution, 2019, 9(21): 12353-12356. DOI:10.1002/ece3.5667 |
| [3] |
李亮, 王晶, 隋志伟, 等. 转基因定量检测用质粒分子标准物质研究进展[J]. 生物技术通报, 2012(2): 54-58. |
| [4] |
Corbisier P, Emons H. Towards metrologically traceable and comparable results in GM quantification[J]. Analytical and Bioanalytical Chemistry, 2019(411): 7-11. |
| [5] |
Corbisier P, Barbante A, Berben G, et al.Recommendation for the unit of measurement and the measuring system to report traceable and comparable results expressing GM content in accordance with EU legislation[R].EUR28536 EN, doi: 10.2760/177516.
|
| [6] |
Zhang D, Corlet A, Fouilloux S, et al. Impact of genetic structures on haploid genome-based quantification of genetically modified DNA:theoretical considerations, experimental data in MON 810 maize kernels(Zea mays L.)and some practical applications[J]. Transgenic Research, 2008, 17(3): 393-402. DOI:10.1007/s11248-007-9114-y |
| [7] |
王永, 兰青阔, 赵新, 等. 数字PCR在转基因水稻拷贝数鉴定中的应用[J]. 生物技术通报, 2018, 34(3): 53-58. |
| [8] |
Schimmel H, Zeghers I, Emons H. Standardization of protein biomarker measurement:is it feasible?[J]. Scandinavian Journal of Clinical and Laboratory Investigation, 2010, 242: 27-33. |
| [9] |
Schimmel H, Zegers I. Performance criteria for reference measurement procedures and reference materials[J]. Clinical Chemistry and Laboratory Medicine, 2015, 53(6): 899-904. DOI:10.1515/cclm-2015-0104 |
| [10] |
European Commission Joint Research Centre.Use of the harmonised conversion factors to transform PCR results from the DNA copy number ratio domain into the mass fraction domain[R].2019.
|
| [11] |
Dobnik D, Demsar T, Huber I, et al. Inter-laboratory analysis of selected genetically modified plant reference materials with digital PCR[J]. Analytical and Bioanalytical Chemistry, 2018, 410(1): 211-221. |
| [12] |
农业部1485号公告-19-2010.转基因植物及其产品成分检测基体标准物质候选物鉴定方法[S].2011-01-01.
|
| [13] |
农业部1782号公告-8-2012.转基因植物及其产品成分检测基体标准物质制备技术规范[S].2012-09-01.
|
| [14] |
农业部1782号公告-9-2012.转基因植物及其产品成分检测标准物质试用评价技术规范[S].2012-09-01.
|
| [15] |
农业部2259号公告-2-2015.转基因植物及其产品成分检测玉米标准物质候选物繁殖与鉴定技术规范[S], 实施日期: 2015-08-01.
|
| [16] |
农业部2259号公告-1-2015.转基因植物及其产品成分检测基体标准物质定值技术规范[S].2015-08-01.
|
| [17] |
农业部2259号公告-3-2015.转基因植物及其产品成分检测棉花标准物质候选物繁殖与鉴定技术规范[S].2015-08-01.
|
| [18] |
农业部2630号公告-13-2017.转基因植物及其产品成分检测质粒DNA标准物质定值技术规范[S].2018-06-01.
|
| [19] |
农业农村部公告第111号-1-2018.转基因植物及其产品成分检测基因组DNA标准物质制备技术规范[S].2019-06-01.
|
| [20] |
农业农村部公告第111号-2-2018.转基因植物及其产品成分检测基因组DNA标准物质定值技术规范[S].2019-06-01.
|
| [21] |
Wu Y, Li J, Li X, et al. Development and strategy of reference materials for the DNA-based detection of genetically modified organisms[J]. Analytical and Bioanalytical Chemistry, 2019, 411(9): 1729-1744. DOI:10.1007/s00216-019-01576-w |
| [22] |
李葱葱, 高越, 沈晓玲, 等. 基于焦磷酸测序技术的基因编辑位点检测方法的建立[J]. 中国农业大学学报, 2019, 24(9): 10-16. |
| [23] |
董莲华, 隋志伟, 沈平, 等. 转基因玉米NK603基体标准物质研制[J]. 农业生物技术学报, 2013, 21(1): 12-18. DOI:10.3969/j.issn.1674-7968.2013.01.002 |
| [24] |
张丽, 吴刚, 武玉花, 等. 转基因产品检测标准物质的定值和不确定度研究进展[J]. 农业生物技术学报, 2014(3): 362-371. DOI:10.3969/j.issn.1674-7968.2014.03.012 |