漆酶(Laccase,p-diphenol dioxygen oxidoreduc-tases,EC 1.10.3.2)是一类由单体糖蛋白组成的单电子含铜多酚氧化还原酶。已有资料证实,漆酶可以利用环境中氧分子作为电子接受体,催化酚类、芳香类、胺类和脂肪族等化合物的单电子氧化形成相应的反应活性自由基或醌类中间体,随后这些活性中间体自发的偶联,生成高分子自我或交叉聚合产物,该过程中仅生成唯一的副产物水[1-3]。漆酶普遍存在于细菌、真菌、高等植物和昆虫体内,其在担子菌门(Basidiomycota)的白腐真菌中分布最为广泛[4-5]。目前,漆酶介导天然高分子聚合物和低分子酚类化合物的生物分解和合成代谢路径主要涉及到木质素降解、腐殖质分解、黑色素形成、木质素合成和角质层硬化等[6-10]。
漆酶通过催化生物体内天然低分子酚类的氧化偶联反应调控生物合成代谢过程,为其在生物体外绿色合成化学中的应用提供了巨大潜力和商业价值。漆酶作为一种具有多功能属性的绿色环保型催化剂,在生物技术研究领域备受国内外学者关注[11-13]。目前,研究者已经从生物体内分离纯化出具有高活性的漆酶并将其应用于绿色化学领域,如生态修复、纸浆漂白、染料脱色、材料改性、药物改良、食品加工、化学偶联和有机合成等[3, 14-15]。尽管如此,漆酶介导生物体内低分子酚类化合物的合成代谢机理和路径及其在绿色化学中的应用仍缺乏系统性评述。本文简要综述了漆酶的酶学特性、催化机制及其在化学合成中的意义,重点分析了漆酶催化生物体内低分子酚类化合物形成黑色素、黄酮类、木质素和角质层等功能酚聚合物的合成代谢机理和路径,总结并展望了漆酶催化生物体外天然小分子酚类化合物的偶联反应在绿色合成化学中的应用前景和商业价值,旨在为拓展和研发漆酶在生物技术领域中的多功能应用提供丰富的参考价值和新颖的见解思路。
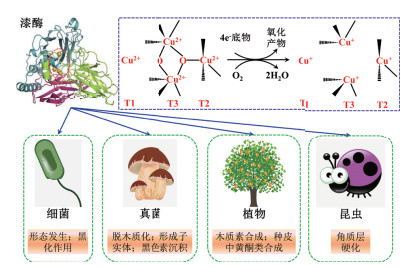
1 漆酶的酶学特性、催化机制及其在化学合成中的意义漆酶可以通过还原裂解双氧键催化底物分子的4个电子转移形成氧化产物(图 1)。该催化循环过程中,1个氧分子被还原成2个水,4个底物分子被氧化形成4个相应的反应活性自由基中间体,而铜作为漆酶催化核心中的金属原子扮演着重要角色[13, 16]。研究指出,漆酶分子的二级空间结构中包含4个铜离子,即1个T1型铜离子(T1 Cu2+)、1个T2型铜离子(T2 Cu2+)和2个T3型铜离子(T3 Cu2+)。这3种类型的铜离子呈现出三角形排列方式,有利于双氧键合[17]。其中T1 Cu2+作为漆酶催化底物的初级电子受体,能够从底物分子中获得电子并传递给氧分子,随后电子通过高度保守的His-Cys-His三肽序列转移到由T2 Cu2+和T3 Cu2+共同组成的三核铜簇中心,并利用从T1 Cu2+转移的电子将氧分子还原成水[17-18]。由于T1 Cu2+位点的铜空腔结构较宽,可以容纳大量的底物分子,导致T1 Cu2+位点可以作为控制底物电子进入漆酶催化活性中心的重要窗口,在调节底物催化速率和自身还原速度方面起着关键作用(Cu2+被还原为Cu+)[19]。
|
| 图 1 漆酶催化酚类的氧化机制及其在生物体内的代谢作用 |
漆酶在多种生物的器官和组织中普遍存在,该类酶在生物有机分解和合成代谢中扮演着重要角色[3, 15, 20]。根据漆酶的氧化还原电位高低,可以将漆酶分为具有低氧化还原电位的细菌、植物和昆虫漆酶以及具有高氧化还原电位的真菌漆酶[3, 21]。真菌漆酶不仅能够催化高分子木质素和腐殖质聚合物的氧化降解,还可以介导低分子酚类及其衍生物的自我或交叉聚合反应[17, 22-23]。真菌产漆酶能力的大小由培养环境、营养物质种类和生长发育阶段等多种因素共同控制[24-25]。此外,金属离子(如Cu2+和Mn2+)和木质素衍生物(如阿魏酸和藜芦酸)也会影响真菌生成漆酶的产量[26-27]。研究表明,漆酶能够直接将生物体内酚类化合物催化氧化为苯氧活性自由基中间体,随后这些活性自由基中间体进一步发生自我或交叉偶联反应,生成多种结构复杂的功能酚聚合产物[14-15, 28]。漆酶介导酚类偶联的合成代谢过程影响了有机体内正常的代谢活动和生理生化指标[28]。因此,明确生物体内涉及漆酶催化偶联酚类的合成代谢机制,对漆酶催化生物体外酚类偶联在绿色化学合成中的应用具有重要的参考价值和指导意义。
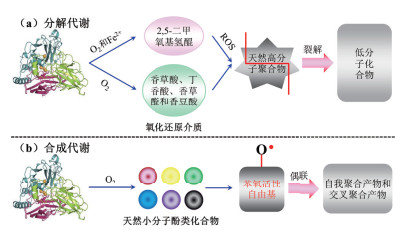
2 漆酶催化生物体内低分子酚类形成功能酚聚合物的机理和路径 2.1 漆酶介导生物体内酚类的有机分解和合成代谢漆酶不仅能够催化生物体内天然高分子聚合物的分解代谢,还可以介导低分子酚类物质的合成代谢,该过程有助于生态系统中碳循环和生物形态发生变化[23, 28-29]。漆酶参与的分解代谢过程主要包括高分子木质素和腐殖质聚合物的生物降解,而漆酶介导生物体内的合成代谢途径主要涉及真菌黑色素沉淀、植物木质化和昆虫角质层硬化等[3, 23]。漆酶催化天然高分子聚合物的分解代谢机制是活性自由基介导的氧化降解反应(图 2)。由于漆酶与高分子聚合物存在空间位阻效应;因此,该反应需要借助天然小分子酚类化合物作为氧化还原介质(如香草酸、丁香酸、香草醛和香豆酸等),以提高漆酶的氧化还原电势和催化速率[30]。研究指出,漆酶-氧化还原介质体系催化天然高分子聚合物氧化降解形成低分子化合物的反应机制主要包括两个方面[15, 31]:一是在O2和Fe2+的作用下,漆酶能够催化2, 5-二甲氧基氢醌形成相应的活性氧(Reactive oxygen species,ROS),其可以氧化降解天然高分子聚合物;二是氧化还原介质会提高漆酶活性,促进漆酶催化天然高分子聚合物形成苯氧活性自由基中间体,从而增强其氧化降解效率。因此,漆酶-氧化还原介质体系能够有效地介导生物体内高分子聚合物降解为低分子化合物的分解代谢过程。
|
| 图 2 漆酶介导生物体内有机分解和合成代谢机制 |
漆酶催化生物体内天然小分子酚类化合物的合成代谢机制是活性自由基中间体介导低分子酚类的氧化偶联反应(图 2)。漆酶以生物体内低分子酚类化合物作为底物,催化4个底物分子发生单电子氧化,形成4个不稳定的苯氧活性自由基中间体,该过程无需氧化还原介质的参与[32]。这些活性自由基中间体能够自发的通过C-C、C-O-C或C-N-C偶联,生成多种二聚体的同分异构体[33-34]。由于二聚体仍然保留着酚羟基官能团,它们可以再次被漆酶氧化形成苯氧活性自由基中间体,这些自由基中间体进一步与酚类底物氧化偶联形成结构复杂的三聚体、四聚体、低聚体和高聚体等自我聚合产物[15, 35]。此外,两种或两种以上不同的活性自由基中间体也会发生偶联反应形成交叉聚合产物[23]。漆酶催化酚类的自由基偶联反应促进了生物体内天然低分子化合物的合成代谢过程,从而形成多种高分子功能酚聚合产物[14-15, 36]。因此,通过人工模拟漆酶介导生物体内的合成代谢机理和路径,有望为合理设计和定向改造漆酶在绿色合成化学中的多功能应用提供丰富的参考价值和新颖的见解思路。
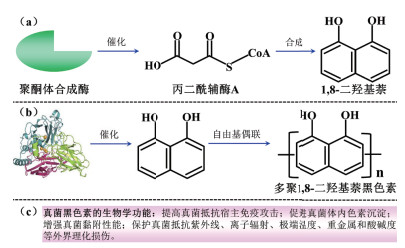
2.2 漆酶催化真菌黑色素生成真菌漆酶是研究最为广泛的一类胞外含铜多酚氧化还原酶,分泌漆酶的真菌主要包括Basidiomycota、子囊菌门(Ascomycota)和半知菌类(Deuteromycota)[37]。真菌漆酶能够介导内源或外源低分子酚类化合物的氧化偶联形成黑色素[38]。黑色素作为真菌体内一种高分子功能酚聚合物,不仅显著地提高了真菌防御外界环境的压力,还增强了真菌的抗逆性[39]。真菌体内合成的黑色素主要分为真黑色素、棕黑色素、脓黑色素和1, 8-二羟基萘黑色素等4类,其中以1, 8-二羟基萘黑色素的合成研究最为深入[40]。真菌体内1, 8-二羟基萘黑色素的合成代谢过程主要包括两步(图 3):一是聚酮体合成酶催化丙二酰辅酶A合成1, 8-二羟基萘[41];二是漆酶氧化聚合1, 8-二羟基萘形成多聚1, 8-二羟基萘黑色素[41-42]。
黑色素的合成代谢过程会引起真菌体内某些生物学特征的改变[8]。漆酶介导真菌黑色素生成的生物学功能的改变主要包含3个方面:(1)提高真菌抵抗宿主免疫攻击。漆酶催化偶联过程中形成大量的活性自由基中间体,导致生成的黑色素中含有未配对电子,它们可以清除宿主细胞产生的自由基,增强真菌防御宿主免疫效应细胞的杀伤作用[43];(2)促进真菌体内色素沉淀。漆酶催化偶联过程中经过反复的双键结合形成的生色团会影响真菌黑色素沉淀,而黑色素在附着细胞壁内层的沉积有利于病原真菌侵入宿主细胞[44];(3)增强真菌黏附性能。当真菌生成黑色素时,会导致酚类底物苯氧基官能团和芳香环结构的改变。这些变化可以增强真菌对宿主细胞的黏附作用,从而影响病原真菌的致病性[23]。此外,真菌黑色素还具有抵抗紫外线、离子辐射、极端温度、重金属和酸碱度等外界理化损伤的生物学功能[39]。由此可见,黑色素是真菌生长发展过程中应对环境变化的有效方式,其为病原真菌进攻宿主免疫系统及生存繁殖提供了重要保障。
2.3 漆酶催化植物木质素和黄酮类合成植物漆酶的主要功能是催化天然小分子酚类化合物的氧化偶联,形成高分子木质素和黄酮类聚合产物[15, 45-46]。木质素和黄酮类化合物均是植物体内重要的次生代谢产物,在植物生长发育和抗逆性等方面发挥着特殊作用[47]。例如,木质素作为植物细胞壁的主要成分,可强化细胞壁的防水性能,在植物抗虫、疾病防御和抵抗极端环境等方面发挥着重要的生物学功能,尤其在植物生长发育过程中起关键作用[48]。黄酮类化合物集中分布在植物根、茎和叶部,在植物生长发育、抗病虫害、抗紫外辐射和抗氧化胁迫等方面具有重要的生物学功能[49-51]。此外,黄酮类化合物也是形成花果和种子颜色的重要成分[51-52]。
漆酶催化酚类化合物的多重偶联生成高分子木质素和黄酮类聚合物的生物合成代谢过程极其复杂[45]。例如,漆酶催化木质素单体聚合参与细胞壁构建的代谢途径包括合成苯丙氨酸、木质素单体和木质素聚合物等3个阶段(图 4)。首先,植物利用光合作用生成合成木质素单体的初始底物,这些初始底物通过莽草酸途径合成苯丙氨酸[53];其次,苯丙氨酸经过一系列的酶促反应生成木质素单体[53-54];最后,木质素单体通过转运蛋白转移到细胞壁上,并通过漆酶介导的催化聚合反应沉积为高分子木质素聚合物[54]。由此可见,漆酶可以定位于植物细胞壁上,催化木质素单体的单电子氧化形成苯氧活性自由基中间体,随后这些活性自由基中间体发生偶联反应生成高分子木质素聚合物[55-56]。漆酶在催化木质素和黄酮类化合物的有机合成代谢过程中也会改变生物体内的某些生物学功能[15, 57]。例如,木质素不仅能够加固植物细胞壁,还可以清除植物体内自由基[55, 58]。细胞壁的加固有利于植物抵御外界病原菌、有机和无机污染物等有害物质进入细胞质,进而提高植物对外界不良环境的防御性能[55]。此外,漆酶催化木质素单体和黄酮类化合物的合成代谢途径会导致低分子酚类的双键反复结合形成生色团,该过程有利于植物细胞的色素沉淀[59]。因此,植物体内木质素和黄酮类聚合物的合成代谢过程是其响应外界环境压力的一种表现方式。
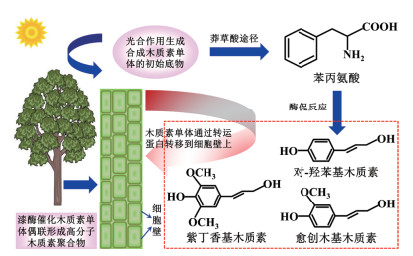
|
| 图 4 漆酶催化植物木质素合成途径 |
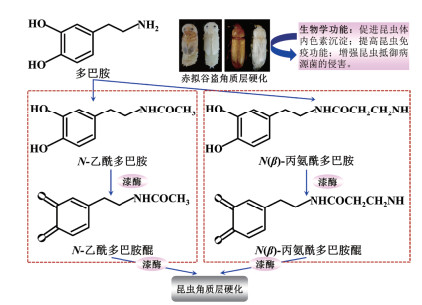
昆虫角质层是体壁主要的坚硬外层,有利于防止水分蒸发、抵御异物入侵,对维持昆虫身体结构和生长发育起到非常重要的保护作用[60]。昆虫漆酶的主要作用是促进昆虫外骨骼的角质层硬化[61]。图 5展示了漆酶基因Lac2参与控制赤拟谷盗(Tribolium castaneum)幼虫和成虫发育阶段角质层硬化的酪氨酸代谢途径[6, 62]。该合成代谢路径主要是通过催化多巴胺和二羟基苯乙醇的衍生产物邻二苯酚形成醌中间体,它们能够与昆虫前表皮中的蛋白质或甲壳素发生C-C、C-O-C和C-N-C交叉偶联反应形成致密的高分子聚合产物[63-65]。
漆酶在促进昆虫角质层硬化的合成代谢过程中也会导致昆虫的生物学功能发生改变。一方面,漆酶催化昆虫体内酚类的氧化偶联反应增强了双键结合程度,该过程可增加昆虫体内色素沉淀[64, 66]。例如,研究者采用RNAi技术沉默漆酶基因Lac2后,显著地抑制了昆虫蜕皮后的色素沉淀,导致昆虫外观颜色较白[67]。另一方面,漆酶催化昆虫角质层硬化有助于提高昆虫的免疫功能[66, 68]。由于该过程中有角质层结构蛋白的参与,致使昆虫角质层的结构更加紧密[65]。此外,角质层上形成的高分子聚合产物也具有高度疏水性和坚韧性,能够有效地提高昆虫防御外界环境中病源菌的侵害[23]。由此可见,漆酶介导昆虫角质层硬化是昆虫对抗外界有害环境胁迫的保护屏障,研究昆虫角质层硬化的合成代谢机理和路径有利于降低农业生产中病虫害的发病率。
3 漆酶催化低分子酚类偶联在绿色化学合成中的应用和价值漆酶介导真菌黑色素生成、植物木质素和黄酮类合成以及昆虫角质层硬化等过程是生物体内有机合成代谢的典型案例[3]。虽然,漆酶在不同生物体内发挥的功效差异显著[38, 45-46, 61],但是,漆酶催化不同生物体内有机合成的偶联机制类似。漆酶介导生物体内有机合成代谢过程能够增强生物体的免疫性能、黏附特性、色素沉淀和抗菌效能等生物学功能[23, 69]。明确漆酶催化生物体内有机物的合成代谢机理和路径,有望为合理设计和定向改造人工模拟的漆酶催化偶联途径在绿色合成化学中的多功能应用提供新颖的思路和见解。
3.1 人工定向调控偶联产物的合成路径、结构和功能依据漆酶催化生物体内的有机合成代谢途径,漆酶介导生物体外的绿色合成原料包括漆酶和酚类化合物[13]。一方面,微生物、植物和昆虫体内的漆酶产量、催化结构和酶学特性差异较大;与之相比,白腐真菌分泌的胞外漆酶更容易分离提纯,其已经成为获得高纯度漆酶的主要研究对象[5, 37]。采用新型固定化技术,可以有效地避免漆酶在环境中易失活、稳定性差和难以回收利用的缺陷[14, 70]。另一方面,天然低分子酚类化合物普遍存在于水果、蔬菜、谷物和树木等植物体内,它们具有抗肿瘤、抗氧化、抑菌和抗病毒等生理学功能,可以通过简单的生物制取方式进行提取纯化[71-72]。目前,研究者主要采用酶法、溶剂加热浸提法、微波辅助提取法、超声波辅助提取法和超临界流体萃取法等手段从植物体内提取低分子酚类化合物[73-74]。随后,通过柱层析和薄层层析等方法对提取物进行分离纯化[75]。漆酶和低分子酚类化合物的分离纯化制备方法具有操作简单和经济安全等优点,可大量获取并应用于生物体外的合成化学领域中[37, 75]。
通过人工模拟漆酶和低分子酚类化合物在生物体内合成代谢过程中发挥的作用,可以推测其应用于绿色化学中的反应机理和合成路线。漆酶催化生物体外的氧化偶联机制与生物体内类似,两者均可导致多羟基酚官能团和芳香环结构失去电子,形成不稳定的苯氧活性自由基中间体[1]。该过程中还原态漆酶被氧化,氧分子被还原成水[14]。随后,这些活性自由基中间体可以自发的形成低聚物,或通过长时间的反复偶联形成高分子自我或交叉聚合产物[3]。因此,通过合理设计和定向改造漆酶催化底物的类型和结构变化,可以调控合成产物的结构和功能特性[76]。一方面,由于漆酶具有底物广谱性,不同的酚类底物在化学结构和性质上的差异会导致漆酶催化偶联反应中形成的聚合产物表现出特殊的生物学功能和结构特征[13]。另一方面,漆酶介导酚类的电子转移作用可以改变苯氧活性自由基中间体的化学结构,生成多种不同的自由基中间体产物,进而增加聚合产物的种类[19, 77]。在实际生产应用中,漆酶介导的氧化偶联反应主要应用于大分子聚合材料表面功能化和有机化学合成[78-79]。聚合材料表面功能化是利用漆酶将低分子酚类化合物偶联在高分子聚合物表面形成具有特殊作用的化学功能团,从而使合成材料具有特殊的理化性能[80-81]。例如,可以利用漆酶将具有多功能的酚类化合物偶联到目标聚合物表面,制备多功能木质素纤维板[82]。有机化学合成是通过人为添加氧化还原介质形成漆酶-介质体系,促进漆酶的催化氧化效能,有望获得更高分子量的合成产物。此外,改变底物浓度、反应时间和缓冲液组分也能够控制合成产物的分子量和化学结构[23, 82]。因此,通过调控漆酶和低分子酚类化合物合成具有特殊结构和功能的聚合产物,有望拓展漆酶在新型绿色合成领域中的应用范围和商业前景。
3.2 漆酶催化酚类偶联在绿色有机化学合成中的应用漆酶催化低分子酚类的自我或交叉偶联反应形成的复杂天然有机聚合产品在医药、食品和纺织等生物技术领域具有重要的应用价值[3, 14-15]。研究表明,这些高分子聚合产物的生物学功能与酚类底物类型密切相关。与单体酚类化合物相比,合成材料和酚类衍生物具有更强的功能特性[83]。通常来说,低分子酚类化合物具有抗氧化、抗药、抗菌和抗病等生理功能,而经过合成的高分子聚合产物还会被赋予黏附性、免疫功能和抗紫外辐射等新属性[69, 84]。鉴于合成原材料具有的多功能特性,通过漆酶氧化偶联作用形成的高分子聚合产物也具有特殊的理化功能,可广泛的应用于某些生物技术领域。表 1总结了漆酶催化天然酚类偶联形成的聚合产物在有机合成领域中的应用。
目前,利用漆酶催化偶联合成的抗氧化聚合材料、抗生素聚合产品和生色团聚合物已经被应用于化妆品、医药制造和纺织等行业[14-15, 96]。(1)抗氧化聚合材料。漆酶催化体外低分子酚类氧化偶联形成的生色团化合物和抗氧化聚合材料,可用于生产绿色安全的染发剂和化妆产品。(2)聚合材料改性。由于漆酶介导木质素单体和1, 8-二羟基萘合成的植物木质素和真菌黑色素均具有抗氧化性能,且能有效吸收紫外线,提高植物和真菌对外界环境的防御作用[39, 97]。因此,将具有抗氧化性的酚类化合物偶联到目标聚合物表面,可以合成具有抗氧化能力的聚合材料[88]。例如,采用漆酶介导的交叉偶联反应将香草醛偶联到壳聚糖表面,能够显著地增强壳聚糖的抗氧化性能和抗菌性能[98]。(3)药物改良。在制药工业中,漆酶介导低分子酚类的氧化偶联反应可用于制备具有抗生素或抗菌性能的新型药剂[91]。例如,漆酶可以催化长春质碱和文朵灵的交叉偶联反应形成治疗急性白血病的长春新碱[99]。另有研究采用漆酶催化氧化反应,促使氨基β-内酰胺类抗生素和邻苯二酚发生交叉偶联形成新型抗生素,进而提高药物的抗菌性能[100]。(4)纺织染色。在纺织物染色行业中,利用漆酶催化低分子酚类的氧化偶联反应可在目标纺织物表面合成新型有色聚合染料[101]。例如,漆酶可以催化没食子酸的氧化偶联反应,实现对羊毛织物的原位染色[102]。经过染色处理后的羊毛织物具有较好的耐水洗牢度和抗菌性能,且采用不同类型的酚类化合物染色,羊毛织物的颜色呈现多样性[102-103]。(5)漆酶介导底物氧化偶联形成的功能聚合材料还可以应用于食品、摄影和生态修复等生物技术领域[3, 13-15]。例如,在食品改良方面,漆酶可以诱导甜菜果胶与大豆蛋白的氧化偶联形成双网络凝胶,改善大豆蛋白的凝胶性[104]。在摄影行业,漆酶能够催化4-氟-2-甲氧基苯酚的自我偶联生成具有低熔点、高热阻和发光功能的聚合材料,并应用于影视制作工艺中[93]。在污染修复领域,漆酶不仅可以催化水体中17β-雌二醇和三氯生等污染物的氧化偶联形成有机聚合沉淀物,还能够氧化降解废水中的合成染料,进而显著地降低母体化合物的生物可利用性和生态毒性[25, 32, 105-107]。因此,在生物体外合理设计和定向改造漆酶介导酚类化合物的自由基偶联途径,有望为开发和扩展漆酶的多功能应用提供理论依据和技术指导。
4 总结与展望漆酶作为一种绿色环保、经济安全的环境友好型催化剂,其优点在于生产成本低、反应条件温和、催化效率高、操作可控、底物广谱和无二次污染等。漆酶介导酚类化合物的自由基偶联反应,在生物技术领域具有广阔的应用价值和商业前景。例如,在生物体内,漆酶能够以天然低分子酚类化合物作为底物,催化真菌黑色素生成、植物木质素和黄酮类合成以及昆虫角质层硬化等合成代谢过程。在生物体外,漆酶介导低分子酚类的自我或交叉偶联反应也有望应用于化妆品行业、医药制造行业、纺织工业、食品加工和有机污染物转化等生物技术领域。随着研究的不断深入,漆酶催化酚类偶联已经从理论探索走向实际应用。研究者通过控制和优化漆酶催化氧化合成材料的反应条件和路径,可以强化漆酶催化酚类偶联的反应过程,合成具有特殊理化功能的新型聚合材料。
尽管如此,国内外关于漆酶催化酚类偶联在绿色合成中的应用研究仍存在诸多问题。如何突破现有的技术手段和瓶颈,开发和扩展漆酶在绿色合成化学中的潜在应用价值,已经成为研究者亟待解决的难点问题之一。鉴于此,我国研究者今后仍需从以下几个方面进行深入研究:(1)分离筛选出具有高产漆酶特性的功能真菌,揭示真菌所产漆酶的酶学性质,促进产漆酶真菌的大规模化发酵生产,满足工业、环境、生物和医药等领域对漆酶的需求;(2)通过现代分子生物学技术,解析真菌漆酶基因的结构和功能,掌握真菌调控体内漆酶基因表达的作用机制,从分子水平对产漆酶真菌进行发酵培养优化;(3)明确漆酶催化生物体内天然小分子酚类化合物的氧化偶联机制,探讨其在生物体外合成新型功能聚合材料的方法和途径;(4)采用基因工程合理设计和定向改造漆酶的编码基因,扩大漆酶的异源表达、增强漆酶的稳定性、提高漆酶对底物的催化性能,进一步挖掘漆酶在绿色化学合成领域中的应用潜力。
| [1] |
张泽雄, 刘红艳, 邢贺, 等. 漆酶可降解底物种类的研究进展[J]. 生物技术通报, 2017, 33(10): 97-102. |
| [2] |
Strong PJ, Claus H. Laccase:A review of its past and its future in bioremediation[J]. Critical Reviews in Environmental Science and Technology, 2011, 41(4): 373-434. |
| [3] |
Sharma A, Jain KK, Jain A, et al. Bifunctional in vivo role of laccase exploited in multiple biotechnological applications[J]. Applied Microbiology and Biotechnology, 2018, 102(24): 10327-10343. |
| [4] |
芦光新, 王军邦, 陈秀蓉, 等. 东祁连山高寒草地土壤产漆酶真菌的筛选, 鉴定及产酶条件的初步研究[J]. 草业学报, 2014, 23(2): 243-252. |
| [5] |
Tortella G, Durán N, Rubilar O, et al. Are white-rot fungi a real biotechnological option for the improvement of environmental health?[J]. Critical Reviews in Biotechnology, 2015, 35(2): 165-172. |
| [6] |
Asano T, Seto Y, Hashimoto K, et al. Mini-review an insect-specific system for terrestrialization:Laccase-mediated cuticle formation[J]. Insect Biochemistry and Molecular Biology, 2019, 108: 61-70. |
| [7] |
Munk L, Sitarz AK, Kalyani DC, et al. Can laccases catalyze bond cleavage in lignin?[J]. Biotechnology Advances, 2015, 33(1): 13-24. |
| [8] |
Eisenman HC, Casadevall A. Synthesis and assembly of fungal melanin[J]. Applied Microbiology and Biotechnology, 2012, 93(3): 931-940. |
| [9] |
Schuetz M, Benske A, Smith R A, et al. Laccases direct lignification in the discrete secondary cell wall domains of protoxylem[J]. Plant Physiology, 2014, 166(2): 798-807. |
| [10] |
Zavarzina AG, Semenova TA, Belova OV, et al. Laccase production and humic acids decomposition by microscopic soil fungi[J]. Microbiology, 2018, 87(3): 308-316. |
| [11] |
Abdel-Mohsen HT, Conrad J, Harms K, et al. Laccase-catalyzed green synthesis and cytotoxic activity of novel pyrimidobenzothiazoles and catechol thioethers[J]. RSC Advances, 2017, 7(28): 17427-17441. |
| [12] |
司静, 李伟, 崔宝凯, 等. 真菌漆酶性质, 分子生物学及其应用研究进展[J]. 生物技术通报, 2011(2): 48-55. |
| [13] |
Su J, Fu J, Wang Q, et al. Laccase:A green catalyst for the biosynthesis of poly-phenols[J]. Critical Reviews in Biotechnology, 2018, 38(2): 294-307. |
| [14] |
龚睿, 孙凯, 谢道月. 真菌漆酶在绿色化学中的研究进展[J]. 生物技术通报, 2018, 34(4): 24-34. |
| [15] |
孙凯, 程行, 余家琳, 等. 漆酶催化生物体内有机物合成与分解代谢的双功能机制及其在生物技术领域中的应用[J]. 农业环境科学学报, 2019, 38(6): 1202-1210. |
| [16] |
孙凯, 李舜尧. 漆酶催化氧化水溶液中三氯生转化的作用机理[J]. 中国环境科学, 2017, 37(8): 2947-2954. |
| [17] |
Baldrian P. Fungal laccases-occurrence and properties[J]. FEMS Microbiology Reviews, 2006, 30(2): 215-242. |
| [18] |
林先贵, 吴宇澄, 曾军, 等. 多环芳烃的真菌漆酶转化及污染土壤修复技术[J]. 微生物学通报, 2017, 44(7): 1720-1727. |
| [19] |
Jones SM, Solomon EI. Electron transfer and reaction mechanism of laccases[J]. Cellular and Molecular Life Sciences, 2015, 72(5): 869-883. |
| [20] |
Madhavi V, Lele SS. Laccase:Properties and applications[J]. Bio Resources, 2009, 4(4): 1694-1717. |
| [21] |
Mate DM, Alcalde M. Laccase:A multi-purpose biocatalyst at the forefront of biotechnology[J]. Microbial Biotechnology, 2017, 10(6): 1457-1467. |
| [22] |
李欣, 姚世庭, 党宁, 等. 漆酶生物转化酚类化合物的研究进展[J]. 微生物前沿, 2017, 6(3): 79-89. |
| [23] |
Jeon J R, Baldrian P, Murugesan K, et al. Laccase-catalysed oxidations of naturally occurring phenols:From in vivo biosynthetic pathways to green synthetic applications[J]. Microbial Biotechnology, 2012, 5(3): 318-332. |
| [24] |
徐鑫, 陈青君, 胡渤洋, 等. 野生槐耳的分离, 鉴定, 培养条件及产漆酶能力[J]. 应用与环境生物学报, 2018, 24(3): 570-575. |
| [25] |
Chen M, Waigi MG, Li S, et al. Fungal laccase-mediated humification of estrogens in aquatic ecosystems[J]. Water Research, 2019, 166: 115040. |
| [26] |
Luo Q, Wang Z, Feng M, et al. Factors controlling the rate of perfluorooctanoic acid degradation in laccase-mediator systems:The impact of metal ions[J]. Environmental Pollution, 2017, 224: 649-657. |
| [27] |
Rodrigues EM, Karp SG, Malucelli LC, et al. Evaluation of laccase production by Ganoderma lucidum in submerged and solid-state fermentation using different inducers[J]. Journal of Basic Microbiology, 2019, 59(8): 784-791. |
| [28] |
Jeon JR, Chang YS. Laccase-mediated oxidation of small organics:Bifunctional roles for versatile applications[J]. Trends in Biotechnology, 2013, 31(6): 335-341. |
| [29] |
Wang T, Xiang Y, Liu X, et al. A novel fluorimetric method for laccase activities measurement using Amplex Red as substrate[J]. Talanta, 2017, 162: 143-150. |
| [30] |
Baiocco P, Barreca AM, Fabbrini M, et al. Promoting laccase activity towards non-phenolic substrates:A mechanistic investigation with some laccase-mediator systems[J]. Organic & Biomolecular Chemistry, 2003, 1(1): 191-197. |
| [31] |
Wei D, Houtman CJ, Kapich AN, et al. Laccase and its role in production of extracellular reactive oxygen species during wood decay by the brown rot basidiomycete Postia placenta[J]. Applied and Environmental Microbiology, 2010, 76(7): 2091-2097. |
| [32] |
Sun K, Kang F, Waigi MG, et al. Laccase-mediated transformation of triclosan in aqueous solution with metal cations and humic acid[J]. Environmental Pollution, 2017, 220: 105-111. |
| [33] |
Chen H, Ji A, Qiu S, et al. Covalent conjugation of bovine serum album and sugar beet pectin through Maillard reaction/laccase catalysis to improve the emulsifying properties[J]. Food Hydrocolloids, 2018, 76: 173-183. |
| [34] |
Jia W, Wang Q, Fan X, et al. Mechanism and analysis of laccase-mediated coloration of silk fabrics[J]. Fibers and Polymers, 2018, 19(4): 868-876. |
| [35] |
Dou RN, Wang JH, Chen YC, et al. The transformation of triclosan by laccase:Effect of humic acid on the reaction kinetics, products and pathway[J]. Environmental Pollution, 2018, 234: 88-95. |
| [36] |
Catherine H, Penninckx M, Frédéric D. Product formation from phenolic compounds removal by laccases:A review[J]. Environmental Technology & Innovation, 2016, 5: 250-266. |
| [37] |
Rekadwad B, Khobragade C. Fungi imperfecti laccase: Biotechnological potential and perspectives[M]. Microbial Applications Vol. 2. Springer, Cham, 2017, 203-212.
|
| [38] |
陈映丹, 陆春, 冯佩英. 黑素与真菌抗药性的研究进展[J]. 中国真菌学杂志, 2016, 11(4): 248-251. |
| [39] |
朱显忠, 席丽艳, 鲁莎, 等. 真菌黑色素及其与巨噬细胞免疫研究进展[J]. 菌物学报, 2019, 38(8): 1264-1269. |
| [40] |
Langfelder K, Streibel M, Jahn B, et al. Biosynthesis of fungal melanins and their importance for human pathogenic fungi[J]. Fungal Genetics and Biology, 2003, 38(2): 143-158. |
| [41] |
Sone Y, Nakamura S, Sasaki M, et al. Identification and characterization of bacterial enzymes catalyzing the synthesis of 1, 8-dihydroxynaphthalene, a key precursor of dihydroxynaphthalene melanin, from Sorangium cellulosum[J]. Applied and Environmental Microbiology, 2018. |
| [42] |
Ma S, Cao K, Liu N, et al. The StLAC2 gene is required for cell wall integrity, DHN-melanin synthesis and the pathogenicity of Setosphaeria turcica[J]. Fungal Biology, 2017, 121(6-7): 589-601. |
| [43] |
陈映丹, 陆春, 冯佩英. 黑素与真菌抗药性的研究进展[J]. 中国真菌学杂志, 2016, 11(4): 248-251. |
| [44] |
康子腾, 姜黎明, 罗义勇, 等. 植物病原链格孢属真菌的致病机制研究进展[J]. 生命科学, 2013, 25(9): 908-914. |
| [45] |
Bao W, O'Malley DM, Whetten R, et al. A laccase associated with lignification in loblolly pine xylem[J]. Science, 1993, 260(5108): 672-674. |
| [46] |
Yan Q, Tang X, Zhang B, et al. Biocatalytic oxidation of flavone analogues mediated by general biocatalysts:Horseradish peroxidase and laccase[J]. RSC Advances, 2019, 9(23): 13325-13331. |
| [47] |
Boerjan W, Ralph J, Baucher M. Lignin biosynthesis[J]. Annual Review of Plant Biology, 2003, 54(1): 519-546. |
| [48] |
Thakur VK, Thakur MK. Recent advances in green hydrogels from lignin:A review[J]. International Journal of Biological Macromolecules, 2015, 72: 834-847. |
| [49] |
Pan X, Du L, Tao J, et al. Dynamic changes of flavonoids in Abelmoschus manihot different organs at different growth periods by UPLC-MS/MS[J]. Journal of Chromatography B, 2017, 1059: 21-26. |
| [50] |
Brunetti C, Fini A, Sebastiani F, et al. Modulation of phytohormone signaling:A primary function of flavonoids in plant-environment interactions[J]. Frontiers in Plant Science, 2018, 9: 1042. |
| [51] |
Wang T, Li Q, Bi K. Bioactive flavonoids in medicinal plants:Structure, activity and biological fate[J]. Asian Journal of Pharmaceutical Sciences, 2018, 13(1): 12-23. |
| [52] |
Guo Y, Qiu LJ. Allele-specific marker development and selection efficiencies for both flavonoid 3′-hydroxylase and flavonoid 3′, 5′-hydroxylase genes in soybean subgenus soja[J]. Theoretical and Applied Genetics, 2013, 126(6): 1445-1455. |
| [53] |
Mottiar Y, Vanholme R, Boerjan W, et al. Designer lignins:Harnessing the plasticity of lignification[J]. Current Opinion in Biotechnology, 2016, 37: 190-200. |
| [54] |
刘清泉.铜胁迫下水稻木质素合成的响应机制及水稻漆酶在植物重金属耐性中的作用[D].南京: 南京农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10307-1017034188.htm
|
| [55] |
Vanholme R, De Meester B, Ralph J, et al. Lignin biosynthesis and its integration into metabolism[J]. Current Opinion in Biotechnology, 2019, 56: 230-239. |
| [56] |
Li C, Chen C, Wu X, et al. Recent advancement in lignin biorefinery:With special focus on enzymatic degradation and valorization[J]. Bioresource Technology, 2019, 291: 121898. |
| [57] |
Verma N, Shukla S. Impact of various factors responsible for fluctuation in plant secondary metabolites[J]. Journal of Applied Research on Medicinal and Aromatic Plants, 2015, 2(4): 105-113. |
| [58] |
Ma Y, Chen K, Ma J, et al. A biomass based free radical scavenger binder endowing a compatible cathode interface for 5 V lithium-ion batteries[J]. Energy & Environmental Science, 2019, 12(1): 273-280. |
| [59] |
Senda M, Yamaguchi N, Hiraoka M, et al. Accumulation of proanthocyanidins and/or lignin deposition in buff-pigmented soybean seed coats may lead to frequent defective cracking[J]. Planta, 2017, 245(3): 659-670. |
| [60] |
刘清明, 苑园园, 林健荣, 等. 昆虫表皮蛋白及其基因表达调控机理的研究进展[J]. 昆虫知识, 2010, 47(2): 247-255. |
| [61] |
于孟兰, 倪金凤. 昆虫漆酶的研究进展[J]. 生物加工过程, 2014, 12(1): 81-85. |
| [62] |
Arakane Y, Lomakin J, Beeman RW, et al. Molecular and functional analyses of amino acid decarboxylases involved in cuticle tanning in Tribolium castaneum[J]. J Biol Chem, 2009, 284(24): 16584-16594. |
| [63] |
Kramer KJ, Kanost MR, Hopkins TL, et al. Oxidative conjugation of catechols with proteins in insect skeletal systems[J]. Tetrahedron, 2001, 57(2): 385-392. |
| [64] |
Noh MY, Muthukrishnan S, Kramer KJ, et al. Cuticle formation and pigmentation in beetles[J]. Current Opinion in Insect Science, 2016, 17: 1-9. |
| [65] |
Mun S, Noh MY, Dittmer NT, et al. Cuticular protein with a low complexity sequence becomes cross-linked during insect cuticle sclerotization and is required for the adult molt[J]. Scientific Reports, 2015, 5: 10484. |
| [66] |
Gorman MJ, Arakane Y. Tyrosine hydroxylase is required for cuticle sclerotization and pigmentation in Tribolium castaneum[J]. Insect Biochemistry and Molecular Biology, 2010, 40(3): 267-273. |
| [67] |
Du MH, Yan ZW, Hao YJ, et al. Suppression of laccase 2 severely impairs cuticle tanning and pathogen resistance during the pupal metamorphosis of Anopheles sinensis(Diptera:Culicidae)[J]. Parasites & Vectors, 2017, 10(1): 171. |
| [68] |
Nakhleh J, El Moussawi L, Osta MA. Chapter three-the melanization response in insect immunity[J]. Academic in Insect Physiology, 2017, 52: 83-109. |
| [69] |
Kudanga T, Nemadziva B, Le Roes-Hill M. Laccase catalysis for the synthesis of bioactive compounds[J]. Applied Microbiology and Biotechnology, 2017, 101(1): 13-33. |
| [70] |
Lassouane F, Aït-Amar H, Amrani S, et al. A promising laccase immobilization approach for bisphenol A removal from aqueous solutions[J]. Bioresource Technology, 2019, 271: 360-367. |
| [71] |
Laganà P, Anastasi G, Marano F, et al. Phenolic substances in foods:Health effects as anti-inflammatory and antimicrobial agents[J]. Journal of AOAC International, 2019, 102(5): 1378-1387. |
| [72] |
Izquierdo-Hernández A, Peña-Neira Á, López-Solís R, et al. Comparative determination of anthocyanins, low molecular weight phenols, and flavanol fractions in Vitis vinifera L. cv Carménère skins and seeds by differential solvent extraction and high-performance liquid chromatography[J]. Analytical Letters, 2016, 49(8): 1127-1142. |
| [73] |
华晓雨, 陶爽, 孙盛楠, 等. 植物次生代谢产物-酚类化合物的研究进展[J]. 生物技术通报, 2017, 33(12): 22-29. |
| [74] |
赵天瑶, 毛圣培, 王佑成, 等. 酚类化合物的提取方法及其生物活性研究进展[J]. 食品工业, 2017, 12: 211-215. |
| [75] |
Suwal S, Marciniak A. Technologies for the extraction, separation and purification of polyphenols:A review[J]. Nepal Journal of BioTechnology, 2018, 6(1): 74-91. |
| [76] |
Rangelov S, Nicell JA. Modelling the transient kinetics of laccase-catalyzed oxidation of four aqueous phenolic substrates at low concentrations[J]. Biochemical Engineering Journal, 2018, 132: 233-243. |
| [77] |
Marjasvaara A, Torvinen M, Hanne Kinnunen A, et al. Laccase-catalyzed polymerization of two phenolic compounds studied by matrix-assisted laser desorption/ionization time-of-flight and electrospray ionization fourier transform ion cyclotron resonance mass spectrometry with collision-induced dissociation experiments[J]. Biomacromolecules, 2006, 7(5): 1604-1609. |
| [78] |
Fillat A, Roncero MB, Vidal T. Elucidating the effects of laccase-modifying compounds treatments on bast and core fibers in flax pulp[J]. Biotechnology and Bioengineering, 2012, 109(1): 225-233. |
| [79] |
Bai R, Yu Y, Wang Q, et al. Laccase-catalyzed poly(ethylene glycol)-templated 'zip' polymerization of caffeic acid for functionalization of wool fabrics[J]. Journal of Cleaner Production, 2018, 191: 48-56. |
| [80] |
Kalia S, Thakur K, Kumar A, et al. Laccase-assisted surface functionalization of lignocellulosics[J]. Journal of Molecular Catalysis B:Enzymatic, 2014, 102: 48-58. |
| [81] |
Costa JB, Lima MJ, Sampaio MJ, et al. Enhanced biocatalytic sustainability of laccase by immobilization on functionalized carbon nanotubes/polysulfone membranes[J]. Chemical Engineering Journal, 2019, 355: 974-985. |
| [82] |
Li N, Xia Q, Niu M, et al. Immobilizing laccase on different species wood biochar to remove the chlorinated biphenyl in wastewater[J]. Scientific Reports, 2018, 8(1): 13947. |
| [83] |
Bhutto AA, Kalay Ş, Sherazi STH, et al. Quantitative structure-activity relationship between antioxidant capacity of phenolic compounds and the plasmonic properties of silver nanoparticles[J]. Talanta, 2018, 189: 174-181. |
| [84] |
Mahmoudi S, Khali M, Benkhaled A, et al. Phenolic and flavonoid contents, antioxidant and antimicrobial activities of leaf extracts from ten Algerian Ficus carica L. varieties[J]. Asian Pacific Journal of Tropical Biomedicine, 2016, 6(3): 239-245. |
| [85] |
Rättö M, Ritschkoff AC, Viikari L. Enzymatically polymerized phenolic compounds as wood preservatives[J]. Holzforschung, 2004, 58(4): 440-445. |
| [86] |
Li H, Fu S, Peng L. Fiber modification of unbleached kraft pulp with laccase in the presence of ferulic acid[J]. Bio Resources, 2013, 8(4): 5794-5806. |
| [87] |
Gogoi P, Hazarika S, Dutta NN, et al. Kinetics and mechanism on laccase catalyzed synthesis of poly(allylamine)-catechin conjugate[J]. Chemical Engineering Journal, 2010, 163(1-2): 86-92. |
| [88] |
Kim S, Lee H, Kim J, et al. Laccase-mediated grafting of polyphenols onto cationized cotton fibers to impart UV protection and antioxidant activities[J]. Journal of Applied Polymer Science, 2018, 135(6): 45801. |
| [89] |
Schröder M, Pereira L, Couto SR, et al. Enzymatic synthesis of Tinuvin[J]. Enzyme and Microbial Technology, 2007, 40(7): 1748-1752. |
| [90] |
Jeon JR, Kim EJ, Murugesan K, et al. Laccase-catalysed polymeric dye synthesis from plant-derived phenols for potential application in hair dyeing:Enzymatic colourations driven by homo- or hetero-polymer synthesis[J]. Microbial Biotechnology, 2010, 3(3): 324-335. |
| [91] |
Kidwai M, Jain A, Sharma A, et al. Laccase-a natural source for the synthesis of benzofuro[2, 3-c]pyrazolin-5-ones[J]. Catalysis Science & Technology, 2013, 3(1): 230-234. |
| [92] |
Kim S, Silva C, Evtuguin DV, et al. Polyoxometalate/laccase-mediated oxidative polymerization of catechol for textile dyeing[J]. Applied Microbiology and Biotechnology, 2011, 89(4): 981-987. |
| [93] |
López J, Alonso-Omlin EM, Hernández-Alcántara JM, et al. Novel photoluminescent material by laccase-mediated polymerization of 4-fluoroguaiacol throughout defluorination[J]. Journal of Molecular Catalysis B:Enzymatic, 2014, 109: 70-75. |
| [94] |
Jadhav SB, Singhal RS. Laccase-gum Arabic conjugate for preparation of water-soluble oligomer of catechin with enhanced antioxidant activity[J]. Food Chemistry, 2014, 150: 9-16. |
| [95] |
Adelakun OE, Kudanga T, Parker A, et al. Laccase-catalyzed dimerization of ferulic acid amplifies antioxidant activity[J]. Journal of Molecular Catalysis B:Enzymatic, 2012, 74(1-2): 29-35. |
| [96] |
Zheng F, An Q, Meng G, et al. A novel laccase from white rot fungus Trametes orientalis:Purification, characterization, and application[J]. International Journal of Biological Macromolecules, 2017, 102: 758-770. |
| [97] |
Beisl S, Friedl A, Miltner A. Lignin from micro-to nanosize:Applications[J]. International Journal of Molecular Sciences, 2017, 18(11): 2367. |
| [98] |
余成华.漆酶催化氧化促进壳聚糖-酚类物质接枝的研究[D].天津: 天津科技大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10057-1015550523.htm
|
| [99] |
Sagui F, Chirivì C, Fontana G, et al. Laccase-catalyzed coupling of catharanthine and vindoline:An efficient approach to the bisindole alkaloid anhydrovinblastine[J]. Tetrahedron, 2009, 65(1): 312-317. |
| [100] |
陈成龙, 孙澍雨, 周维增, 等. 漆酶催化合成生物活性化合物的研究进展[J]. 化学通报, 2018, 81(10): 896-902. |
| [101] |
Pezzella C, Giacobbe S, Giacobelli VG, et al. Green routes towards industrial textile dyeing:A laccase based approach[J]. Journal of Molecular Catalysis B:Enzymatic, 2016, 134: 274-279. |
| [102] |
袁萌莉, 王强, 范雪荣, 等. 羊毛织物的漆酶催化没食子酸原位染色与改性[J]. 印染, 2016, 42(22): 8-12. |
| [103] |
Bai R, Yu Y, Wang Q, et al. Effect of laccase on dyeing properties of polyphenol-based natural dye for wool fabric[J]. Fibers and Polymers, 2016, 17(10): 1613-1620. |
| [104] |
陈浩, 卓婷烨, 邱爽, 等. 漆酶诱导大豆分离蛋白-甜菜果胶双网络凝胶的构建[J]. 现代食品科技, 2016, 32(11): 162-169. |
| [105] |
Sun K, Luo Q, Gao Y, et al. Laccase-catalyzed reactions of 17β-estradiol in the presence of humic acid:Resolved by high-resolution mass spectrometry in combination with 13C labeling[J]. Chemosphere, 2016, 145: 394-401. |
| [106] |
Ma HF, Meng G, Cui BK, et al. Chitosan crosslinked with genipin as supporting matrix for biodegradation of synthetic dyes:Laccase immobilization and characterization[J]. Chemical Engineering Research and Design, 2018, 132: 664-676. |
| [107] |
Zheng F, Cui BK, Wu XJ, et al. Immobilization of laccase onto chitosan beads to enhance its capability to degrade synthetic dyes[J]. International Biodeterioration & Biodegradation, 2016, 110: 69-78. |