杜氏盐藻(Dunaliella salina)是绿藻门,盐藻属的一种极度耐盐的单细胞真核绿藻[1],在高盐等极端环境中仍然能够正常生长,因此常作为耐盐植物中的模式生物[2]。其细胞形态通常为椭圆形,具有两条鞭毛,没有细胞壁。盐藻能够积累丰富的β-胡萝卜素、蛋白质、多糖、矿物质等活性物质,是天然β-胡萝卜素的主要来源之一[3-4]。此外,还可以作为鱼虾等的饲料,在功能食品、保健等领域具有很好的开发利用前景。
在水生生态系统中,微藻和细菌之间存在密不可分的关系,它们分别扮演着重要角色,相互影响着彼此的生长及营养物质累积,共同参与水环境中物质的循环[5]。在微藻生长的过程中,藻细胞周围会形成一个特殊的藻际微环境[6],在这个藻际微环境中,藻细胞分泌的一些物质会吸引周围微生物在该环境中生长繁殖,形成了复杂独特的藻际微生物群落。细菌可以利用微藻光合作用产生的有机物,微藻可以利用微生物呼吸作用产生的CO2及营养物质[7],形成一个循环体系,称为“藻菌共生”[8]。在微藻的大规模培养过程中,这些存在于藻际环境中的细菌很难去除,且与微藻之间存在复杂的相互关系[9-10]。有些细菌对微藻有抑制作用,能够产生一些杀死藻细胞的毒素或者溶藻酶等有害物质从而抑制微藻的生长。Wang等[11]发现弧菌(Vibrio)能够产生藻毒素杀死亚历山大藻(Alexandrium tamarense)。Lee等[12]发现交替假单胞菌株(Pseudoalteromonas sp.)A28产生的胞外丝氨酸蛋白酶是杀死中肋骨条藻(Skeletonema costatum)的主要来源。但有些细菌对微藻的生长及藻细胞中物质的积累有明显的促进作用,细菌能够产生吲哚乙酸及维生素B12促进微藻的生长[13]。此外,藻菌共培养体系能够有效去除废水中氮、磷及重金属等污染物,在废水处理方面有较好的应用前景[14-17]。因此,探究微藻与其藻际细菌之间的相互作用并选择适当的促生细菌构建共培养体系对微藻的生产及藻菌共生系统的应用有重要意义。
迄今,对杜氏盐藻的培养、盐藻细胞生长、β-胡萝卜素的累积及盐藻产品等已进行诸多研究[18-20],然而,鲜有关于盐藻藻际细菌及其对盐藻生长影响的研究报道。为此,本研究以杜氏盐藻及其藻液为试材,分离并鉴定盐藻藻际共生菌群,分别构建藻菌共培养体系检测所分离的共生菌株对杜氏盐藻藻生长及代谢产物积累的影响,进而筛选能促进盐藻生长的优异共生菌株,以期为促生菌株在水生态环境调控的应用及盐藻规模化培养体系优化提供科学依据和技术支撑。
1 材料与方法 1.1 材料本研究中所用的微藻藻株为分离自运城盐湖水样的杜氏盐藻藻株Ds-SXYC-2,保存于山西农业大学分子农业与生物能源研究所,采用DM培养基培养盐藻。
1.2 方法 1.2.1 共生菌株的分离纯化取生长至对数期的盐藻藻液,用无菌水稀释。采用平板划线法将藻液接种于LB固体培养基中,置于细菌培养箱中30℃恒温倒置培养。待长出单菌落后,根据菌落的不同形态特征及时挑选单菌落,经多次平板划线直至固体培养基上无杂菌生长,并记录每种共生菌的形态特征。
1.2.2 盐藻共生菌株的鉴定取各生长至对数期菌液1.5 mL离心,采用购自安徽天根生化科技有限公司的细菌基因组DNA提取试剂盒提取杜氏盐藻共生菌的基因组DNA,采用16S rDNA通用细菌引物扩增基因组DNA。PCR扩增产物经1%琼脂糖凝胶电泳分离20 min,将条带清晰的PCR产物送至上海生物工程股份有限公司进行DNA测序。测序获得的各菌株序列分别在NCBI中进行比对和BLAST分析,选取相似性较大的序列应用MEGA7.0软件构建系统进化树,从而鉴定出分离菌株的种、属分类地位。
1.2.3 微藻生物量的测定称量离心管的重量,记作M0。取5 mL新鲜藻液经超声波破碎30 s,离心,无菌水多次冲洗去除藻液中的细菌。放入烘箱中烘干,称量最终重量,记作M1。计算出藻样的干重DW=(M1-M0)/V(V为藻液体积)。
1.2.4 盐藻色素含量的测定培养15 d后,测定盐藻藻细胞中叶绿素与β-胡萝卜素的含量。用甲醇萃取藻细胞中的色素,取3 mL藻液,8 000 r/min离心10 min,弃上清。加入等体积的甲醇在黑暗条件下萃取沉淀24 h。以甲醇为参比,采用分光光度计分别测定在波长470、653和666 nm处藻液中的色素吸光度值,计算藻细胞中的叶绿素与β-胡萝卜素的含量。
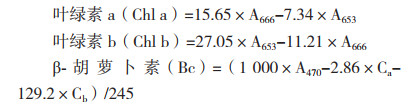
采用蒽酮硫酸比色法测定盐藻多糖含量。取5 mL盐藻藻液,离心10 min后,取上清测定胞外糖含量。藻泥中加入等体积PBS缓冲液,反复冻融3次,经超声波破碎120 s,离心。各取2 mL于试管中,加入8 mL蒽酮硫酸溶液,沸水浴15 min后,冷却至室温后采用分光光度计于625 nm测定吸光值。根据葡萄糖标准曲线,计算出多糖含量。(葡萄糖标准曲线:y=0.006 4x-0.212 9,y为吸光值;x为多糖含量,R2=0.992 7)
采用购自南京建成科技有限公司的蛋白定量测定试剂盒测定盐藻藻细胞可溶性蛋白质含量。
参考马浩天等[21]的方法测定盐藻总脂含量。
1.2.6 试验数据处理试验均设置3组生物学重复,试验数据采用Excel进行整理并作图。应用DPS软件对所获得的数据进行统计学显著性分析,P < 0.05表示差异显著。
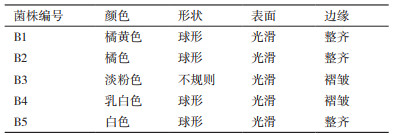
2 结果 2.1 盐藻藻际共生菌落的分离采用LB固体培养基经多次平板划线从杜氏盐藻藻液中共分离获得5株共生菌,编号为B1-B5(表 1和图 1)。3个菌落为球形,表面光滑,边缘整齐,颜色分别呈现橘黄色、橘色及白色;1个菌落为不规则形,表面光滑,边缘褶皱,为淡粉色;1个菌落为乳白色球形,表面光滑,边缘褶皱。

|
| 图 1 盐藻藻际分离的细菌菌落形态 |
提取盐藻藻液分离获得的5个菌落基因组DNA,采用通用引物扩增获得16S rDNA片段大小约为1 400 bp(图 2)。将测序获得的各自rDNA序列在NCBI数据库中进行Blast比对分析序列相似性(表 2),并进一步构建系统发育树(图 3),鉴定所测菌株的种属分类地位。结果显示,分离获得的5株共生菌分属于3个菌属:菌株B1与B2为涅斯捷连科氏菌(Nesterenkonia),菌株B3与B4为盐单胞菌(Halomonas),菌株B5为海杆菌(Marinobacter)。

|
| M:分子量标准;B1:菌株1 PCR产物;B2:菌株2 PCR产物;B3:菌株3 PCR产物;B4:菌株4 PCR产物;B5:菌株5 PCR产物 图 2 藻际菌落16S rDNA PCR产物 |
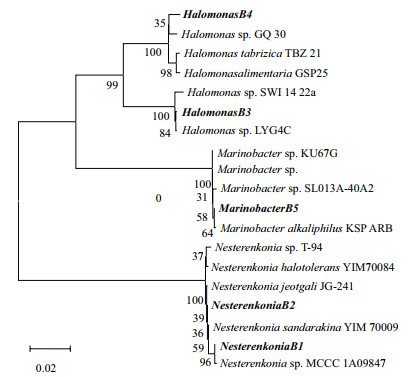
|
| 图 3 从盐藻藻际分离到的5个菌群及其他已知菌群16S rDNA序列的系统进化分析 |
以不接种任何菌液的杜氏盐藻纯培养为对照,将分离获得的5株共生菌分别与与杜氏盐藻以藻菌接种比为1:1构建共培养体系,共培养15 d,每隔3 d测定一次杜氏盐藻干重。结果如图 4显示,与对照组相比,5株共生菌株对杜氏盐藻的生长均有促进作用,其中菌株B3盐单胞菌对盐藻的生长促进作用显著。培养15 d后,盐藻生物量达到2.3 g/L,比对照组增加了28.9%;其次为菌株B1涅斯捷连科氏菌,盐藻生物量达到2.19 g/L,相比对照组增加了22.8%。
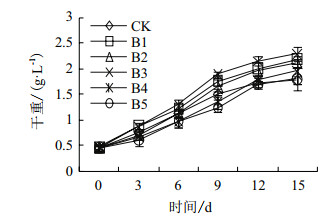
|
| 图 4 五株共生细菌对盐藻藻细胞生物量的影响 |
测定了培养15 d之后共培养体系中盐藻藻细胞的色素含量。图 5表明,与对照相比,菌株B1与B2能够使盐藻藻细胞中富集更多叶绿素a和β-胡萝卜素,但叶绿素b含量明显下降。菌株B4与B5显著抑制了盐藻藻细胞叶绿素的累积,但对β-胡萝卜素的积累无明显作用。菌株B3使盐藻藻细胞中叶绿素b含量稍有提高,但与对照相比差异不显著,而叶绿素a、β-胡萝卜素的含量则显著增加。培养15 d后叶绿素a的含量达到4.61 mg/L,相比对照组增加了36.3%,β-胡萝卜素比对照组提高了56.4%,达到3.34 mg/L。

|
| 图 5 五株共生细菌对盐藻藻细胞色素含量的影响 |
测定了共培养体系中盐藻多糖(胞外多糖与胞内多糖)的含量。结果(图 6)显示,菌株B1与B2使盐藻中胞外多糖含量有所下降,但总糖含量比对照组略高。盐藻与菌株B4共培养能够产生更多的胞内多糖,胞外多糖无显著提高。菌株B3与B5能显著促进盐藻胞外及胞内多糖的分泌。培养15 d后,盐藻多糖分别达到97.3 mg/L和90.38 mg/L,比对照组分别提高了34.8%和25.2%。
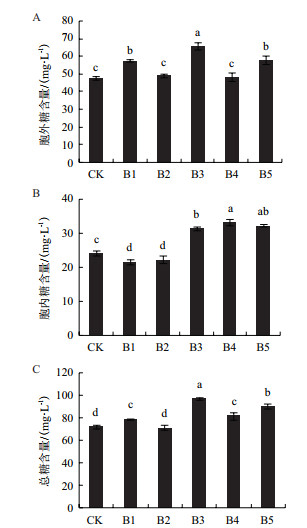
|
| 图 6 五株共生细菌对盐藻多糖含量的影响 |
测定盐藻细胞中蛋白质含量(图 7)表明,菌株B5对盐藻蛋白质的产生无显著作用,其余4株共生菌都能够显著促进杜氏盐藻蛋白质的积累,其中菌株B3(盐单胞菌)的促进效果最佳,培养15 d后,蛋白质含量达到21.89 mg/L,比对照组增加了71.2%;其次为菌株B2,蛋白质含量为20.42 mg/L。

|
| 图 7 五株共生细菌对盐藻蛋白质含量的影响 |
图 8结果表明,有4株共生菌对盐藻油脂积累的促进作用显著,其中菌株B3能够使盐藻积累更多的油脂。共培养15 d之后,与不添加任何菌株培养的对照组相比,与菌株B3共培养的体系中,盐藻总脂含量提高了37.6%,达到21.9%。

|
| 图 8 五株共生细菌对盐藻总脂含量的影响 |
在水生环境中,微藻是重要的初级生产者,而微藻在生长过程中常常伴随着藻际微生物的存在[22]。不同的微藻其藻际微生物各不相同,同一种微藻在不同的环境中其藻际微生物也存在差异。目前,许多研究者尝试探究微藻与其藻际微生物的相互关系及作用机制。本研究分离并鉴定了杜氏盐藻藻际细菌菌群,从杜氏盐藻中共分离获得5株共生菌株,经鉴定分属于3个菌属:菌株B1和B2为涅斯捷连科氏菌、菌株B3与B4为盐单胞菌和菌株B5为海杆菌。Wang等[23]从盐藻中分离获得一株麦氏交替单胞菌(Alteromonas macleodii)。Song等[24]分析发现杜氏盐藻中的优势菌株为Winogradskyella algicola sp.。本研究未从杜氏盐藻中分离获得这两株共生菌株,这可能与盐藻及菌株的生长环境及培养条件不同有关。
细菌对微藻的影响存在很大差异。曹延群等[25]发现赤细菌(Erythrobacter citreus)能显著促进三角褐指藻(Phaeodactylum tricornutum)的生长。许平平等[26]从盐生小球藻(Chlorella salina)中分离获得一株盐单胞菌Halomonas sp.,发现盐单胞菌能有效促进盐生小球藻对砷的富集。季方等[27]从黄化的螺旋藻中分离得到一株盐单胞菌,该菌能抑制螺旋藻的生长,对螺旋藻有较好的溶解作用。胡修贵等[28]从对虾养殖池的生物絮团中筛选获得2株盐单胞菌,发现胜利盐单胞菌Halomonas shengliensis对氨氮有较高的转化率。本研究发现5株共生菌均能促进杜氏盐藻的生长,其中菌株B3盐单胞菌对盐藻生长的促进作用最显著。共培养15 d后,杜氏盐藻生物量达到2.3 g/L,比对照组增加了28.9%。其次为菌株B1涅斯捷连科氏菌。而盐单胞菌菌株B4对盐藻生长促进作用不明显,且抑制藻液中叶绿素的积累。
本研究发现筛选获得的菌株B3盐单胞菌不仅可以促进盐藻藻细胞生长,还可以显著促进盐藻代谢产物的积累。共培养体系中,杜氏盐藻叶绿素a的含量达到4.61 mg/L,相比对照组增加了36.3%,β-胡萝卜素比对照组提高了56.4%。Ji等[29]构建了小球藻(Chlorella vulgaris)与地衣芽孢杆菌(Bacillus licheniformis)共培养体系,发现芽孢杆菌能促进藻细胞生长及叶绿素a积累。王书亚等[30]研究发现微小杆菌、枯草芽孢杆菌和假单胞菌明显促进小球藻的生长,叶绿素a的含量比小球藻纯培养时分别提高了1.79倍、1.58倍和1.49倍。与盐藻纯培养对照相比,与菌株B3共培养,盐藻多糖、蛋白质、总脂含量达到最高,分别比对照组增加了34.8%、71.2%和37.6%。一些研究也表明细菌对微藻代谢产物积累有促进作用。Toyama等[31]发现与Emticicia sp. EG3共培养能够提高纤细裸藻(Euglena gracilis)的生物量及油脂含量。卫治金等[32]构建了小球藻与固氮菌共培养体系,研究发现共培养体系中小球藻的生物量及油脂含量显著提高。施华升[33]研究表明污泥细菌与小球衣藻形成的菌藻聚集体胞外分泌多糖比微藻纯培养增加60.41 mg/L。Ban等[34]发现假单胞菌能够使莱茵衣藻的蛋白质含量保持在较高水平。史玉倩等[35]发现水稻内生泛菌能够显著提高小球藻生长及油脂含量且藻细胞可溶性蛋白产量比对照显著增加了30.91%。盐单胞菌对盐藻生长及代谢产物积累的促进作用,可能是在共培养过程中,盐单胞菌产生或分泌更多调控微藻代谢产物积累相关基因的物质,具体机理有待进一步研究。本实验为研究盐藻与其藻际菌群互作机制和在杜氏盐藻规模化培养中应用优势促生菌提高盐藻生产效益提供了科学参考。
4 结论从杜氏盐藻藻际分离获得5个细菌菌群/株(B1-B5),构建藻菌1:1共培体系测试表明这5个细菌能不同程度促进盐藻生长,其中盐单胞菌菌株B3为显著促进盐藻生长及β-胡萝卜素等代谢产物积累的优势菌株。
| [1] |
Bonnefond H, Moelants N, Talec, et al. Coupling and uncoupling of triglyceride and beta-carotene production by Dunaliella salina under nitrogen limitation and starvation[J]. Biotechnology for Biofuels, 2017, 10(1): 25-35. |
| [2] |
丛玉婷, 邢震宇, 岳金荣, 等. 盐藻钙依赖蛋白激酶基因DsCDPK的表达分析[J]. 水产科学, 2019, 38(2): 248-253. |
| [3] |
郭宏实, 凌娜, 刘小瑞, 等. 杜氏盐藻(Dunaliella salina)对重金属铜胁迫的生理响应[J]. 哈尔滨商业大学学报:自然科学版, 2019, 35(1): 1-5. |
| [4] |
Sk RK, Prabhakar S, Ankit KS, et al. Mass cultivation of Dunaliella salina in a flflat plate photobioreactor and its effffective harvesting[J]. Bioresource Technology, 2018, 270(12): 20-29. |
| [5] |
Edo BZ, Eyal R. Microbial metabolism of transparent exopolymer particles during the summer months along a eutrophic estuary system[J]. Frontiers in Microbiology, 2015, 6(5): 403-416. |
| [6] |
沈梅丽, 杨锐, 骆其君, 等. 坛紫菜养殖周期中的藻际微生物多样性[J]. 微生物学报, 2013, 53(10): 1087-1102. |
| [7] |
段露露, 程蔚兰, 张靖洁, 等. 共生菌促进斜生栅藻生长和油脂合成[J]. 应用生态学报, 2020, 31(2): 625-633. |
| [8] |
张晶, 侯和胜, 佟少明. 微藻与细菌作用关系的研究进展[J]. 激光生物学报, 2016, 25(5): 385-390, 417. |
| [9] |
张靖洁, 段露露, 程蔚兰, 等. 菌藻共生提高小球藻生物量和产油率[J]. 生物技术通报, 2019, 35(5): 76-84. |
| [10] |
王玉莹, 支丽玲, 马鑫欣, 等. 污水处理中的菌藻关系和污染物去除效能[J]. 环境科学与技术, 2019, 42(7): 116-125. |
| [11] |
Wang BX, Zhou YY, Bai SJ, et al. A novel marine bacterium algicidal to the toxic DinoflagellateAlexandrium tamarense[J]. Letters in Applied Microbiology, 2010, 51(5): 552-557. |
| [12] |
Lee SO, Junichi K, Noboru T, et al. Involvement of an extracellular protease in algicidal activity of the marine bacterium Pseudoalteromonas sp. strain A28[J]. Applied & Environmental Microbiology, 2000, 66(10): 4334-4339. |
| [13] |
Juan F, Garbayo I, Cuaresma M, et al. Impact of microalgae-bacteria interactions on the production of algal biomass and associated compounds[J]. Mari Drugs, 2016, 14(5): 100-116. |
| [14] |
Holmes B, Paddock MB, Vandergheynst JS, et al. Algal photosynthetic aeration increases the capacity of bacteria to degrade organics in wastewater[J]. Biotechnology and Bioengineering, 2019, 117(1): 62-74. |
| [15] |
Escapa C, Coimbra RN, Paniagua S, et al. Nutrients and pharmaceuticals removal from wastewater by culture and harvesting of Chlorella sorokiniana[J]. Bioresource Technology, 2015, 185(6): 276-284. |
| [16] |
罗智展, 舒琥, 许瑾, 等. 利用微藻处理污水的研究进展[J]. 水处理技术, 2019, 45(10): 17-23, 39. |
| [17] |
Mujtaba G, Rizwan M, Lee K. Removal of nutrients and COD from wastewater using symbiotic co-culture of bacterium, Pseudomonas putida, and immobilized microalga, Chlorella vulgaris[J]. J Ind Eng Chem, 2017, 49(1): 145-151. |
| [18] |
安茜, 周雅莉, 宋亚楠, 等. 杜氏盐藻LYCB基因克隆及在盐胁迫下的表达分析[J]. 山西农业大学学报:自然科学版, 2018, 38(10): 18-24. |
| [19] |
唐燎, 涂海峰, 伍淼, 等. 2种邻苯二甲酸酯对杜氏盐藻的生长抑制机理研究[J]. 中国海洋大学学报:自然科学版, 2018, 48(7): 40-46. |
| [20] |
Mercedes GG, José M, Manzano JC, et al. Production of Dunaliella salina biomass rich in 9-cis-β-carotene and lutein in a closed tubu-lar photobioreactor[J]. J Biotechnol, 2005, 115(1): 81-90. |
| [21] |
马浩天, 张宏江, 杭伟, 等. 埃氏小球藻去鸡场废水氮磷效果及总脂积累的研究[J]. 山西农业大学学报:自然科学版, 2018, 38(10): 43-48. |
| [22] |
张增虎, 唐丽丽, 张永雨. 海洋中藻菌相互关系及其生态功能[J]. 微生物学通报, 2018, 45(9): 2043-2053. |
| [23] |
Wang Y, Zhang CH, Lin MM, et al. A symbiotic bacterium differentially influences arsenate absorption and transformation in Dunaliella salina under different phosphate regimes[J]. Journal of Hazardous Materials, 2016, 318(11): 443-451. |
| [24] |
Song J, Lim Y, Jang HJ, et al. Isolation and genome analysis of Winogradskyella algicola sp. nov., the dominant bacterial species associated with the green alga Dunaliella tertiolecta[J]. Journal of Microbiology, 2019, 57(11): 982-990. |
| [25] |
曹延群, 李赟, 潘克厚, 等. 三角褐指藻藻液细菌的分离鉴定及其对藻细胞生长的影响[J]. 海洋湖沼通报, 2019(1): 107-112. |
| [26] |
许平平, 刘聪, 王亚, 等. 共生细菌对盐生小球藻富集和转化砷酸盐的影响[J]. 环境科学, 2016, 37(9): 3438-3446. |
| [27] |
季方, 朱毅, 郝睿, 等. 一株螺旋藻溶藻菌的分离、鉴定及溶藻特性初步研究[J]. 食品工业科技, 2012, 33(12): 221-224, 229. |
| [28] |
胡修贵, 赵培, 李玉宏, 等. 生物絮团中异养亚硝化菌的分离鉴定及其特性[J]. 渔业科学进展, 2013, 34(5): 97-103. |
| [29] |
Ji X, Jiang M, Zhang J, et al. The interactions of algae-bacteria symbiotic system and its effects on nutrients removal from synthetic wastewater[J]. Bioresour Technol, 2018, 247(1): 44-50. |
| [30] |
王书亚, 李志, 高仪璠, 等. 藻菌共培养体系优势菌株筛选及沼液处理[J]. 农业资源与环境学报, 2019(1): 121-126. |
| [31] |
Toyama T, Hanaoka T, Yamada K, et al. Enhanced production of biomass and lipids by Euglena gracilis via co-culturing with a microalga growth-promoting bacterium, Emticicia sp. EG3[J]. Biotechnology for Biofuels, 2019, 12(10): 205-217. |
| [32] |
卫治金, 李晓, 王皓楠, 等. 小球藻与固氮菌Mesorhizobium sp.共培养对小球藻生长和油脂积累的促进效果[J]. 中国生物工程杂志, 2019, 39(7): 56-64. |
| [33] |
施华升.菌藻共生关系对水环境中单细胞微藻聚集行为的影响[D].合肥: 合肥工业大学, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10359-1019231841.htm
|
| [34] |
Ban S, Lin W, Wu F, et al. Algal-bacterial cooperation improves algal photolysis-mediated hydrogen production[J]. Bioresource Technology, 2018, 251(3): 350-357. |
| [35] |
史玉倩, 赵艳. 水稻种子内生泛菌促进小球藻生长和油脂积累[J]. 中国农业科学, 2016, 49(8): 1429-1442. |