随着我国人民生活水平的提高,对于生鲜牛乳的需求日益增加。生乳中的体细胞数是衡量乳品质量的重要指标,体细胞数过高将破坏牛乳中的营养成分,同时提示奶牛乳房炎的发生。因此,体细胞的数量将成为牛乳分级的重要依据之一。利用基于不同原理的方法和不同仪器检测牛乳中的体细胞数目,如何保证结果的准确性和可比性,仍是值得关注的问题。本文中在阐述现有常见体细胞检测方法原理的基础上,进一步探讨了不同方法的性能指标和质控要求,并提出通过计量校准来保证测量结果一致性的重要意义。
1 体细胞与DHI 1.1 DHI的概念奶牛群体改良计划(Dairy herd improvement,DHI)是指通过测量并记录奶牛的产奶量、牛乳中主要成分(乳脂、乳蛋白等)、体细胞数目等多项指标,经过分析得到反映奶牛场配种、繁殖、饲养、疾病以及生产性能等信息,从而为饲养和管理工作提供科学的依据。结合DHI与遗传学分析,德国选育出的荷斯坦牛具备遗传背景优良、品质突出的特点,成为世界奶业的重要种属资源[1]。国外奶牛生产先进国家,早在19世纪末就开始进行DHI测试工作,如美国、法国、荷兰等乳业发达国家通过DHI体系为奶农提供指导服务,使牛群的遗传水平和生产性能持续提高[2]。我国的DHI起步较晚,1992年引入DHI技术,1999年中国奶业协会组织成立了“全国奶牛生产性能测定(DHI)工作委员会”[3],截止2013年,我国奶牛参加DHI测定的比例不足8%(美国、日本等发达国家的参测率已达50%以上)[4]。自2008年起,我国大规模开展DHI工作。2015年农业部根据《中国奶牛群体遗传改良计划(2008-2020)年》规定,制定了《奶牛生产性能测定工作办法》。DHI工作在我国逐步受到重视和信赖。
1.2 体细胞对乳制品的影响体细胞数测定(Somatic cell count,SCC)是指每毫升牛奶中含有的体细胞数量,牛奶中的体细胞通常包括淋巴细胞、巨噬细胞、嗜中性白细胞以及少量的上皮细胞。体细胞数作为DHI的重要检测指标之一,与乳制品的质量密切相关。优质生牛乳所具备的特征大致包括以下几个方面:(1)包括蛋白质和脂肪等的各项营养成分完整;(2)无异味;(3)检测水平之下的药物残留量,没有掺杂水或者其他添加物;(4)含有的细菌总量较低;(5)含有较低的体细胞数目[5]。体细胞的含量在衡量生牛乳质量的多个指标中受到更多的关注,因为体细胞含量高往往会提高牛乳中酶活水平,而较高的酶活水平将导致牛乳中营养成分被破坏,从而对后续加工乳制品的质量造成影响[6]。体细胞数量是诊断奶牛是否感染乳房炎或隐性乳房炎的主要指标,当奶牛乳房的炎症加剧时,乳腺分泌大量的白细胞等免疫细胞,使牛奶中的体细胞数目显著增加,而炎症消失后,体细胞数目随之减少。通过观察牛奶中体细胞数目的变化,可以帮助尽早发现并隔离治疗患有乳房炎的奶牛,不仅能够减少由于奶牛乳房炎引起的经济损失,而且是控制牧场抗生素过度使用的有效手段[7]。
1.3 国内外体细胞限量标准国际上规定以每毫升牛奶中20万个体细胞作为判断感染乳房炎的临界值,每毫升牛奶中50万个以上体细胞表明奶牛患亚临床(隐性)乳房炎[8-9]。欧盟与新西兰对生乳中体细胞数的规定是低于40万个/mL,加拿大规定是低于50万个/mL,美国规定低于75万个/mL,并且各国正在考虑将体细胞限量标准进一步提高(达到更低的体细胞数)[10]。
2016年中国农垦乳业发展峰会上发布了《中国农垦生鲜乳生产和质量标准》。该企业标准首次将我国现行标准中没有提到但反映奶牛乳房健康水平的体细胞数首次纳入到了此次新发布的标准中,限量每毫升为40万个以下。2017年中国奶业协会团体标准T/DAC 003-2017《学生饮用奶生牛乳》中规定体细胞数限量40万个/mL。2018年修订的GB 19301《食品安全国家标准生乳》(第一次讨论稿)中首次增加了体细胞限量值分级标准。说明我国已开始重视体细胞对于乳制品的重要性,这对我国奶业发展有着重要的意义。
2 体细胞检测方法及检测仪器 2.1 国内外标准规定的体细胞检测方法及检测仪器GB 19301《食品安全国家标准生乳》(第一次讨论稿)中体细胞检测方法为NY/T 800《生鲜牛乳中体细胞测定方法》。NY/T 800是修改采用ISO与IDF(国际乳品联合会)联合制定的国际标准ISO 13366-1:1997《牛奶体细胞测定第一部分显微镜法(参考方法)》、ISO 13366-2:1997《牛奶体细胞测定第二部分电子粒子计数法》和ISO 13366-3:1997《牛奶体细胞测定第三部分荧光光电计数法》。目前,ISO现行有效的是第二版的ISO 13366,包括第一部分(标准名称未改变)及第二部分《牛奶体细胞测定第二部分荧光光电计数仪操作指南》(表 1)。
显微镜法,即人工镜检法,是体细胞测定的参考方法,利用显微镜观察涂布在载玻片上的牛奶样品并进行人工的体细胞计数。该方法由人工操作,且对操作人员要求较高,不适用于大量检测[11]。
电子粒子计数法,也称库尔特计数仪计数法,该计数方法的原理是利用牛奶中体细胞在通过电极狭缝使由于增大电阻而使电压上升的现象,最终通过高于临界水平的电脉冲产生的数量来计算体细胞的数目[12]。新版的ISO标准取消了此方法相关内容,目前市场上此类仪器相对较少。
荧光光电计数法,利用荧光光电计数仪对体细胞进行计数,该类计数仪工作原理是首先利用染料(例如溴化乙锭)对体细胞的DNA进行染色,在检测过程中控制体细胞逐个通过流路系统,在相应激发光的处理下,体细胞发出荧光信号,由捕捉到的荧光信号经过光电倍增器放大并输出光脉冲,分析计算得到计数结果[13]。因为荧光光电计数法具有检测速度较快、重复测量误差范围较小等特点,且样品处理过程较简单,适合大批量牛奶样品的集中检测。
目前奶站及企业中采用较多的即是利用荧光光电计数原理的体细胞检测仪,具代表性的有丹麦Foss公司及美国Bentley公司的体细胞检测仪[14]。例如,有研究者利用丹麦Foss公司的体细胞检测仪对奶牛场的牛乳体细胞数做了相关的研究,发现乳汁比重和牛乳中的乳蛋白、乳糖和非脂固形物含量均随着体细胞数目的升高而下降,体细胞数与乳糖和非脂固形物含量呈显著的负相关性[15]。同时,研究者也证明了牛乳中体细胞数目与抗氧化指标的相关性[16]。体细胞数目是牛乳营养控制的重要指标,荧光光电计数法被广泛应用于牛乳质量的科学分析。
在具备上述优势的同时,荧光光电计数法所需的仪器和配套试剂较为昂贵,提高了牛乳中体细胞的检测成本。由于该方法中体细胞的检测是基于DNA的染色,DNA染色的效率直接影响体细胞的检测结果,有研究者利用Foss Matic检测体细胞数目,观察到在60℃对样品进行孵育染色条件下测量得到的体细胞数明显高于45℃孵育染色所得的结果[17]。如果对人工镜检法、库尔特计数仪计数法和荧光光电计数法进行比较,有研究报道了荧光光电计数法对相同牛乳样品中体细胞的测量结果高于前两种方法[18],分析其原因可能是荧光光电检测系统中背景噪声干扰引起的系统误差。测量过程中的样品处理条件和光电通路的检测效率都将影响荧光光电计数法检测的准确度。
2.2 其它体细胞检测方法及仪器根据检测对象的不同,可以将牛奶中体细胞的检测方法分为直接方法和间接方法。前面提到的标准检测方法都是直接对体细胞进行观察和测量,属于直接测量方法。另外还有基于计算机视觉的直接计数方法,该方法在对牛奶中体细胞进行染色后,通过数码显微镜采集细胞图像(彩色图像);随后将细胞突变灰度化,通过扫描并统计一定面积范围内的像素区域,来计算牛奶中的体细胞数目[19],此类体检细胞检测仪器有丹麦ChemoMetec公司的NucleoCounter SCC-400等。
体细胞的间接检测方法则是针对体细胞破裂后释放出的DNA、组蛋白等物质,以及体细胞含量上升导致的牛奶的粘稠度、pH值、介电常数、流变特性等物理化学指标的变化,对体细胞的数目进行间接的测量。其中包括:加利福尼亚细胞测定法(CMT)、DNA含量测定法、牛奶pH值测定法、黏度测定法、电容法、近红外线测定法、凝乳法以及超声波测定法等[20-23]。近年来快速发展的微流控技术也被应用于牛奶体细胞的检测,Choi等研制了可以同时检测牛奶中体细胞、微生物以及抗生素残留物的微流芯片传感器[24-25]。
牛奶体细胞的间接检测方法具有操作简单、检测成本低等优势,但其最大的问题是检测的准确度较低,国家标准未推荐使用间接检测方法。相比之下,直接检测方法的准确度较高,但往往存在仪器成本高、样品处理过程繁琐等问题[26-27],为了更好的在乳品产业中推广应用体细胞检测技术,还需要研究并改进现有的检测方法,以期实现牛奶中体细胞快速准确、成本控制在一定范围内的直接测量。
3 体细胞检测仪校准 3.1 校准的含义在JJF 1001-2011《通用计量术语及定义》[28]中,将校准定义为“在规定条件下的一组操作,其第一步是确定由测量标准提供的量值与相应示值之间的关系,第二步则是用此信息确定由示值获得测量结果的关系,这里测量标准提供的量值与相应示值都具有测量不确定度”。通常,只把上述定义中的第一步认为是校准。此定义与ISO/IEC导则99-2007(VIM)[29]中相应条款一致。因此,校准是将计量器具的示值与测量标准相比较,确定计量器具的计量特性,从而确保量值准确。通过不间断的校准链,可实现测量结果向高等级测量标准的计量溯源性。
3.2 体细胞检测仪校准的意义由于新国标已计划将体细胞数限量纳入生乳分级标准,体细胞数的准确测定将直接影响原奶奶源的正确分级。目前市场上体细胞检测采用不同原理、不同生产厂商的体细胞检测仪进行检测,仪器的检测性能主要依靠厂家提供的质控样品进行控制。但是往往质控样品存在仪器间不通用,缺乏量值溯源性等问题,造成不同原理的仪器之间检测结果没有可比性。
对测量仪器进行计量校准,就是将仪器对测量标准的实际测量值与测量标准标称值进行比较,分析测量仪器的测量性能,通过严格的计量校准环节,可提高检测结果准确性,实现检测结果的可比、统一,真正体现体细胞数限量标准的意义,从而正确区分优质奶源与一般奶源,合理引导奶源的区别加工,规范市场秩序。作为DHI测定体系的重要参数,体细胞数的准确测定有利于优化奶牛群体结构,促进乳业的科学性及规范化发展。
3.3 体细胞检测仪校准的参数基于日常开展的质控程序,体细胞检测仪需要进行校验的指标可包括空白检查,携带污染率(Carry-over,CO)检查,试剂与检测样品体积比检查,仪器短期稳定性监控与质控图绘制、重复性检查、实验室内再现性检查、实验室间再现性检查、实验室间比对等内容。在仪器校准前,需保证仪器的空白检查、携带污染率(CO)、缓冲液与样品体积比、重复性等指标满足测量要求。NY/T 800中,指出荧光光电计数法测定体细胞数需要进行校正,在体细胞含量为(40-50)万个/mL时,测定平均值与标样指标值的相对误差应≤10%。
在第二版的ISO 13366-2中,对仪器的校准及日常质控做了详细的规定。体细胞的校准主要通过标准物质实现,标准物质的生产需满足ISO导则34《标准物质生产者能力的通用要求》的要求。已有国外的研究机构报道了牛乳体细胞标准物质的研制工作,利用牛乳中分离得到的体细胞,研究者研制了含有不同浓度体细胞的全脂和脱脂牛乳标准物质,并进行了稳定性检测[30]。然而,国内还没有针对牛乳中体细胞的有证标准物质。目前体细胞检测仪器的校准主要依靠生产厂家提供的质控品进行自校准。如丹麦Foss公司提供模拟体细胞的微球(FMA样品)来监控仪器,Bentley公司提供适用于Bentley仪器校准的体细胞质控品。
ISO 13366-2中建议针对不同类型的乳品,选择覆盖体细胞测量范围的至少5个不同浓度的标准物质开展校准程序。目前市场上不同类型体细胞检测仪在研发阶段,对仪器性能指标进行评估,大多仪器选择3个不同浓度进行重复性检测,选择与人工镜检方法定值结果的相对误差来评估仪器准确性(表 2)。仪器宣称指标均满足ISO标准的限量要求。
同时ISO 13366-2中指出,在体细胞测量范围内,仪器的读数与标准物质量值之间应满足线性关系。用低体细胞数的牛奶稀释高体细胞数的牛奶,得到测量范围内一系列(至少5个)样品进行测量,每个样品至少测量4次,将理论值平均值与测量值平均值做线性回归,从回归曲线计算残差值ei=yi-(bxi+a)。ISO 13366-2中选择比例系数rc来表征线性关系。rc应≤2%。rc由以下公式计算:
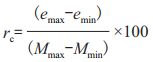
其中:emax:最大残差值;emin:最小残差值;Mmax:测量样品的上限值;Mmin:测量样品的下限值。
从以上参数可以看出,体细胞数的准确测定需要对仪器进行全面检查与质量控制,当进行大量样品或长期检测之后,仪器的示值必须经过校准,才能保证结果的准确性与可比性。
4 总结随着社会经济水平的提高和人民生活的改善,对于生牛乳的品质要求也逐渐提高,体细胞数目是牛乳质量控制的重要指标,体细胞数过高将导致牛乳中包括乳糖、乳蛋白等营养物质的含量降低,并提示乳牛出现乳房炎等健康问题。因此,低体细胞数是优质生乳的指标之一。新的国家标准将实施生乳分级,体细胞数作为重要分级指标,需要进行准确检测。荧光光电计数法由于具有检测快速、误差范围小等优势,被较多奶站和乳制品企业应用于牛乳中体细胞的检测。与此同时,还存在基于其他不同原理的体细胞检测方法。由于检测结果来源于不同的方法、不同的仪器以及不同的仪器生产厂家,因此需要进行校准来保证结果的准确性与可比性,进而指导牛乳的科学分级。
早在20世纪,国外的研究者已经开展了牛乳中体细胞标准物质的研究工作,然而国内至今还没有针对牛乳体细胞的有证标准物质,日常使用的体细胞检测仪器主要依赖于生产厂商提供的质控品进行自校准,使检测结果的准确性和一致性难以保证,无法满足牛乳质量控制与科学管理的需求。目前,中国计量科学研究院与全国畜牧总站等正在开展体细胞标准物质的研究工作,将为体细胞检测仪的校准提供溯源依据。
| [1] |
郭慧媛, 罗祎, 任发政, 等. 我国推行奶牛生产性能测定的可借鉴模式及对策[J]. 中国农业科技导报, 2017, 19(5): 1-11. |
| [2] |
王玲玲. DHI在奶牛生产中的应用[J]. 现代畜牧兽医, 2011(9): 27-29. DOI:10.3969/j.issn.1672-9692.2011.09.016 |
| [3] |
肖西山. DHI在奶牛生产中的应用[J]. 北京农业职业学院学报, 2013, 27(6): 22-25. DOI:10.3969/j.issn.1671-7252.2013.06.005 |
| [4] |
刘成果.中国奶业年鉴[M]. 2014卷.北京: 中国农业出版社, 2015.
|
| [5] |
Murphy SC, Martin NH, Barbano DM, et al. Influence of raw milk quality on processed dairy products:How do raw milk quality test results relate to product quality and yield[J]. Journal of Dairy Science, 2016, 99(12): 10128-10149. DOI:10.3168/jds.2016-11172 |
| [6] |
Ismail B, Nielsen SS. Invited review:Plasmin protease in milk:current knowledge and relevance to dairy industry[J]. Journal of Dairy Science, 2010, 93(11): 4999-5009. DOI:10.3168/jds.2010-3122 |
| [7] |
Maréchal CL, Thiéry R, Vautor E, et al. Mastitis impact on technological properties of milk and quality of milk products—a review[J]. Dairy Science & Technology, 2011, 91(3): 247-282. |
| [8] |
Koess C, Hamann J. Detection of mastitis in the bovine mammary gland by flow cytometry at early stages[J]. Journal of Dairy Research, 2008, 75(2): 225-232. DOI:10.1017/S0022029908003245 |
| [9] |
Viguier C, Arora S, Gilmartin N, et al. Mastitis detection:current trends and future perspectives[J]. Trends in Biotechnology, 2009, 27(8): 486-493. DOI:10.1016/j.tibtech.2009.05.004 |
| [10] |
赵连生, 王加启, 郑楠, 等. 牛奶质量安全主要风险因子分析Ⅶ.体细胞数和菌落总数[J]. 中国畜牧兽医, 2012, 39(7): 1-5. DOI:10.3969/j.issn.1671-7236.2012.07.001 |
| [11] |
严建军, 高炎, 高飞. 牛奶体细胞数检测的研究进展[J]. 计算机测量与控制, 2016, 24(2): 5-10, 21. |
| [12] |
Burriel AR. Somatic cell counts determined by the Coulter or Fossomatic Counter and their relationship to administration of oxytocin[J]. Small Ruminant Research, 1999, 35(1): 81-84. DOI:10.1016/S0921-4488(98)00135-7 |
| [13] |
Gonzalo C, Martinez JR, Carrledo JA, et al. Fossomatic cell-counting on ewe milk:comparison with direct microscopy and study of variation factors[J]. Journal of Dairy Science, 2003, 86(1): 138-145. DOI:10.3168/jds.S0022-0302(03)73593-0 |
| [14] |
刘广胜, 陈敏, 陈鹏. FossMatic5000检测牛乳体细胞[J]. 中国乳品工业, 2005, 33(4): 60-61. DOI:10.3969/j.issn.1001-2230.2005.04.017 |
| [15] |
邓慧芳, 韦昱, 杜玉兰, 等. 奶水牛乳中体细胞数与乳成分的相关分析[J]. 中国畜牧兽医, 2013, 40(6): 241-243. DOI:10.3969/j.issn.1671-7236.2013.06.056 |
| [16] |
杜玉兰, 邓慧芳, 黄云飞, 等. 奶水牛乳汁体细胞数与抗氧化指标的相关性分析[J]. 南方农业学报, 2014, 45(5): 882-886. DOI:10.3969/j:issn.2095-1191.2014.5.882 |
| [17] |
Miller RH, Paape MJ, Acton JC. Comparison of milk somatic cell counts by Coulter and Fossomatic Counters[J]. Journal of Dairy Science, 1986, 69(7): 1942-1946. DOI:10.3168/jds.S0022-0302(86)80621-X |
| [18] |
Lintner TJ, Heald CW, Eberhart RJ. Somatic cell reference samples for calibration of milk somatic cell counting methods[J]. Journal of Food Protection, 1984, 47(9): 694-696. DOI:10.4315/0362-028X-47.9.694 |
| [19] |
高飞, 袁晓阳, 李洪波, 等.一种基于计算机视觉的牛奶体细胞计数方法.中国, CN201210047807. 1[P]. 2012-12-12. http://cprs.patentstar.com.cn/Search/Detail?ANE=9FHF7DEA6AFA3ABA3BBA9DGA5EBA9CIF9BHGDEIA9HGEAICA
|
| [20] |
付天骄, 田雨, 管勇佳, 等. 生乳体细胞数检测方法的研究[J]. 中国乳品工业, 2012, 40(7): 57-59. DOI:10.3969/j.issn.1001-2230.2012.07.017 |
| [21] |
吴海云, 左月明, 崔传金, 等. 基于电参数和支持向量回归的牛奶体细胞数定量检测[J]. 农业机械学报, 2012, 43(8): 164-169. DOI:10.6041/j.issn.1000-1298.2012.08.030 |
| [22] |
Huang YM, Hsu HY, Hsu CL. Development of electrochemical method to detect bacterial count, Listeria monocytogenes, and somatic cell count in raw milk[J]. Journal of the Taiwan Institute of Chemical Engineers, 2016, 62: 39-44. DOI:10.1016/j.jtice.2016.01.030 |
| [23] |
Rankin SA, Christiansen A, Lee W, et al. Invited review:The app-lication of alkaline phosphatase assays for the validation of milk product pasteurization[J]. Journal of Dairy Science, 2010, 93(12): 5538-5551. DOI:10.3168/jds.2010-3400 |
| [24] |
Choi JW, Kim YK, Kim HJ, et al. Lab-on-a-chip for monitoring the quality of raw milk[J]. Journal of Microbiology & Biotechnology, 2006, 16(8): 1229-1235. |
| [25] |
Kimura S, Fukuda J, Tajima A, et al. On-chip diagnosis of subclinical mastitis in cows by electrochemical measurement of neutrophil activity in milk[J]. Lab on A Chip, 2012, 12(7): 1309. DOI:10.1039/c2lc20952g |
| [26] |
赵春娟, 赫彩霞, 高文惠. 牛奶体细胞数检测方法的研究进展[J]. 中国奶牛, 2014(13): 39-43. DOI:10.3969/j.issn.1004-4264.2014.13.012 |
| [27] |
龚瑞昆, 刘双, 崔传金. 生物传感器检测牛奶体细胞的研究进展[J]. 山东畜牧兽医, 2017, 38(1): 64-66. DOI:10.3969/j.issn.1007-1733.2017.01.042 |
| [28] |
国家质量监督检验检疫总局. JJF 1001-2011通用计量术语及定义[S].
|
| [29] |
ISO/IEC GUIDE 99: 2007, International vocabulary of metrology-basic and general concepts and associated terms(VIM)[S].
|
| [30] |
Di Marzo L, Wojciechowski KL, Barbano DM. Preparation and stability of milk somatic cell reference materials[J]. Journal of Dairy Science, 2016, 99(9): 7679-7689. DOI:10.3168/jds.2016-10848 |






