2. 波兰国家兽医研究所猪病部,波兰普瓦维 24-100
2. Department of Swine Diseases, National Veterinary Research Institute, Pu?awy, Poland 24-100
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种猪的烈性、高度接触性传染病[1]。1921年,肯尼亚首次记录了非洲猪瘟的爆发,目前非洲大陆次撒哈拉地区的大多数非洲国家均有流行[2]。该病于1957年传入欧洲南部地区,1971年传入加勒比海地区和南美洲,2007年传入高加索地区和俄罗斯,现在仍在非洲、南撒丁岛、高加索地区以及俄罗斯流行[3]。世界动物卫生组织(OIE)将其列为必须报告的动物疫病,我国将非洲猪瘟列为一类动物疫病,在《国家中长期动物疫病防治规划(2012-2020)》中,ASF被列为优先防范的13种重大外来动物疫病之一。我国于2018年也爆发了该病且呈现出继续蔓延的趋势,截至2019年9月5日,我国已有32个省、自治区、直辖市发生了ASFV疫情,有关防控部门对疫区猪群进行了扑杀政策,从而导致我国目前猪肉价格急剧攀升,使得我国对该病的防控形势十分严峻[4-5]。
ASFV属于非洲猪瘟病毒科、非洲猪瘟病毒属,是一种有囊膜的双链DNA病毒,能够在Vero细胞,PAM细胞及PAM细胞系中增殖。病毒基因组全长为170 kb-190 kb,整个基因组含有151个ORF,可以编码150-200个蛋白质,可以编码的结构蛋白有54种以上,包括P54、P72、P30等。其中P54蛋白存在于病毒粒子内层囊膜,是ASFV重要的结构蛋白,由E183L基因编码。P54蛋白的跨膜结构在病毒蛋白经内质网转化成病毒包膜前体时起十分重要的作用。P54蛋白可分泌到病毒体外,并以二硫键连接的Ⅰ型膜结合物形式感染细胞,而且感染细胞后在内质网膜处短暂表达[6]。动物实验表明,弱毒株攻毒后7-10 d即可检测到P54抗体[7]。用P54蛋白建立的ELISA抗体检测方法,具有很高的敏感性,特异性和稳定性。本研究选择P54蛋白作为靶标,建立稳定表达P54基因的单克隆Vero细胞系,可用于非洲猪瘟抗体的检测和确诊,能有效缩短检测时间且检测过程中不涉及病原感染,降低了生物安全的要求。此外,建立的稳定表达P54基因的单克隆Vero细胞系还可能进一步用于非洲猪瘟病毒的致病机理的研究。
1 材料与方法 1.1 材料 1.1.1 血清、抗体和细胞鼠抗AzamiGreen(以下简单标记为AG)的单抗、鼠抗β-Actin的单抗、辣根酶标记的山羊抗鼠IgG、TRITC标记的山羊抗鼠荧光抗体和TRITC标记的兔抗猪荧光抗体购自北京中杉金桥生物技术有限公司;灭活的ASFV猪阳性血清,波兰国家兽医研究所保存。HEK293V细胞、Vero细胞和鼠抗P54多抗,由中国检验检疫科学研究院动物检疫研究所实验室保存。
1.1.2 主要试剂DMEM,FBS购自Hyclone公司;Trypsin-EDTA(0.25%),phenol red(GibcoTM)购自赛默飞世尔科技(中国)有限公司;phmAG1-MCLinker购自上海浩然生物技术有限公司;慢病毒载体pLV-puro,辅助载体pH1、pH2,PEG慢病毒纯化试剂盒均购自北京英茂盛业生物科技有限公司;胰蛋白酶购自Amresco公司;PolyFect转染试剂,Plasmid Plus Maxi Kit质粒提取试剂盒,RNeasy Mini Kit均购自Qiagen公司;限制性内切酶MluI和NotI,T4DNA连接酶均购自TaKaRa公司;EasyPfu DNA Polymerase、TransScript Green Two-Step qRT-PCR SuperMix购自北京全式金生物技术有限公司;Hoechst33342和嘌呤霉素购自Sigma公司;ECL化学发光底物试剂盒购自Thermo Fisher Scientific公司;RIPA裂解液购自北京索莱宝科技有限公司。
1.2 方法 1.2.1 重组慢病毒载体的构建根据GenBank中已公布的ASFV P54基因序列号(GenBank:FN557520.1)设计一对用于P54基因扩增的特异性引物。其中,上游引物P54-F为:5'-CGACGCGTCGATGGATTCTGAATTTTTTCAAC-3',下划线处为MluI识别位点;下游引物P54-R为:5'-CACGCTCACCATTCCTTGGGTCGATCCTCCTCCTGAACCACCACTACCACCCGATCCTCCGCCGCCCAAGGAGTTTTC-3'(其中斜体部分为P54的基因序列,黑体加粗部分为铰链区序列,未加粗部分为载体phmAG1-MCLinker的基因序列),预期扩增片段大小为625 bp。针对phmAG1-MCLinker设计一对用于Azami Green基因序列扩增的特异性引物。其中,上游引物AG-F为:5'-GAAAACTCCTTGGGCGGCGGAGGATCGGGTGGTAGTGGTGGTTCAGGAGGAGGATCGACCCAAGGAATGGTGAGCGTG-3'(其中斜体部分为P54的基因序列,黑体加粗部分为铰链区序列,未加粗部分为载体phmAG1-MCLinker的基因序列),下游引物AG-R为:5'-ATTTGCGGCCGCTTTATTAGTCAGCGGAATTACCGGTCTT-3'(下划线处为NotI识别位点),预期扩增片段的大小为781 bp。上述引物均由北京六合华大基因科技有限公司合成。
分别以非洲猪瘟病毒DNA和phmAG1-MCLinker载体为模板,以相应的特异引物扩增ASFV P54基因序列和Azami Green基因序列,胶回收两PCR产物1:1混合后,再以引物P54-F和AG-R进行搭桥PCR扩增P54-Azami Green基因的融合片段(P54-AG),预期融合片段的大小为1 328 bp。将P54-AG融合目的片段通过MulⅠ和NotⅠ酶切克隆至慢病毒载体pLV-puro中,构建重组慢病毒表达质粒pLV-ASFV-P54-AG。以同样的操作步骤构建pLV-AG质粒。
1.2.2 重组慢病毒的包装将HEK293V细胞接种到90 mm培养皿,当细胞汇合度为90%-95%时,通过PolyFect转染试剂将pLV-ASFV-P54-AG与辅助质粒pH1和pH2共转染HEK293V细胞,转染后48 h收集细胞培养上清,用PEG慢病毒纯化试剂盒纯化病毒,分装后置-80℃备用。以相同操作步骤,将pLV-AG质粒与辅助载体共转染HEK293V细胞,以制备表达Azami Green蛋白的慢病毒对照(以下标记为Vero-AG)。
1.2.3 慢病毒感染和细胞筛选将Vero细胞接种到35 mm培养皿,将1.2.2中纯化的慢病毒悬液300 μL加入1.7 mL DMEM培养基(含10%FBS),然后加入聚凝胺至终浓度为6 μg/mL,混合均匀,以其感染细胞密度为80%左右的正常Vero细胞,24 h后更换新鲜培养基,继续培养24 h,将Vero细胞消化后以200-500个/皿的密度接种于培养皿,加入嘌呤霉素至终浓度为5 μg/mL进行筛选,每隔2 d换液一次,并重新添加嘌呤霉素。筛选2周后不再死亡的细胞扩大培养后为多克隆细胞,消化后以有限稀释法筛选单克隆细胞并将单克隆细胞扩大培养后,一部分冻存;一部分用于表达情况检测。利用RNeasy® Mini Kit提取扩大培养后的单克隆细胞总RNA,以TransScript Green Two-Step qRT-PCR SuperMix试剂盒先将总RNA反转录为cDNA,再以该cDNA为模板进行双重荧光定量RT-PCR,同时检测ASFV-P54和GAPDH内参基因在Vero细胞中的表达水平,表达水平高的单克隆细胞进行后续鉴定试验。其中检测ASFV-P54基因表达的引物根据P54基因序列设计,具体引物序列为:P54-RT-F2:5'-AAGATCAGCAA-TGGGCAGAAGT-3',P54-RT-R2:5'-ACTGTCGTG-TAAGGCTCAGTCG-3';内参基因GAPDH的引物参照文献[8],具体引物序列为:GAPDH-F:5'-AACGG-ATTTGGTCGTATTGGG-3',GAPDH-R:5'-TCGCTC-CTGGAAGATGGTGAT-3'。上述引物均由北京六合华大基因科技有限公司合成。
1.2.4 细胞系的Western Blot鉴定收集1.2.3中筛选的约106个单克隆Vero细胞以RIPA裂解液提取总蛋白进行SDS-PAGE检测后半干转印至PVDF膜上,分别以鼠抗Azami Green的单抗(1:1 000),鼠抗β-actin的单抗(1:1 000),鼠抗P54的多抗(1:8 000)为一抗,采用HRP标记的山羊抗鼠单抗做1:5 000稀释后作为二抗,通过ECL系统显影,拍照,记录检测结果,筛选出最佳表达ASFV-P54的细胞系命名为Vero-AG-ASFV-P54。
1.2.5 细胞系的间接免疫荧光鉴定制备Vero-AG-ASFV-P54、Vero-AG和Vero三种细胞的细胞爬片,以5% BSA封闭1 h后,以5% BSA做抗体稀释液,分别以鼠抗Azami Green的单抗(1:1 000)、SPF猪阴性血清(1:50)、鼠抗P54的多抗(1:1 000)和ASFV感染猪阳性血清(1:50)作为一抗,以TRITC标记的山羊抗鼠荧光抗体(1:100)和TRITC标记的兔抗猪荧光抗体(1:100)作为二抗对细胞进行荧光染色,利用荧光显微镜观察检测结果(该实验在波兰国家兽医研究所进行)。
2 结果 2.1 重组慢病毒质粒的构建利用设计的特异引物采用两轮PCR搭桥扩增的方法,获得P54-AG融合目的基因片段。琼脂糖凝胶电泳检测结果如图 1,目的片段大小为1 328 bp,与预期大小一致。胶回收目的片段,双酶切后克隆至慢病毒载体pLV-puro中,构建成重组慢病毒表达质粒pLV-ASFV-P54-AG。重组质粒测序结果表明,P54基因序列、插入位置以及阅读框准确无误。
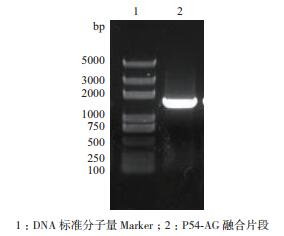
|
| 图 1 ASFV-P54基因与Azami绿色荧光蛋白的融合片段电泳图 |
利用PolyFect转染试剂将重组慢病毒质粒pLV-ASFV-P54-AG与辅助质粒pH1和pH2共转染HEK293V细胞,转染48 h后观察细胞是否存在CPE现象,然后收集重组慢病毒,结果显示,未见HEK293V细胞出现明显CPE。
2.3 稳定表达ASFV-P54蛋白的细胞系的筛选在6 μg/mL聚凝胺的作用下,将重组慢病毒感染Vero细胞,经过嘌呤霉素筛选最终获得多株可表达ASFV-P54蛋白的Vero单克隆细胞株,为选择一株表达量较高的稳定细胞株,对单克隆细胞株进行了ASFV-P54和GAPDH两基因的双重荧光RT-PCR检测,比较每株单克隆细胞株ASFV-P54基因的表达量。筛选结果见图 2,从图中可以看出,P54-21和P54-24两株单克隆细胞的表达量较高。
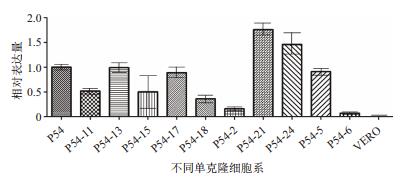
|
| 图 2 ASFV-P54基因在Vero细胞系中相对表达量的荧光RT-PCR检测统计结果 |
用RIPA细胞裂解液分别提取P54-21、P54-24、Vero-AG和Vero细胞的细胞总蛋白进行SDS-PAGE,分别以鼠抗Azami Green的单抗,鼠抗β-actin的单抗,鼠抗P54的多抗为一抗,用HRP标记的山羊抗鼠单抗做二抗进行Western Blot检测。通过比较P54-21和P54-24细胞中P54蛋白的表达水平,可以看出P54-24细胞系中P54的表达水平明显高于P54-21细胞系中P54的表达水平(43 kD大小的条带),因此将P54-24命名为Vero-AG-ASFV-P54,用于后续进一步的鉴定。从图中(图 3)我们可以看出,Vero-AG细胞对照只有一条26 kD的带,显示Azami Green已经表达;而Vero细胞可见只有β-actin有表达,既没有P54蛋白带也没有Azami Green蛋白带;P54-21和P54-24下方均有一条Azami Green蛋白带,我们推测可能是由于P54蛋白降解所导致的。

|
| 图 3 稳定表达ASFV P54基因的Vero细胞的Western Blot鉴定结果 |
制备Vero-AG-ASFV-P54、Vero-AG和Vero三种细胞的细胞爬片,以鼠抗Azami Green抗体、鼠抗P54的多抗和ASFV感染猪阳性血清作为一抗,TRITC标记的山羊抗鼠荧光抗体和TRITC标记的兔抗猪荧光抗体作为二抗进行IFA鉴定。鉴定结果显示,通过慢病毒包装系统构建的稳定表达非洲猪瘟病毒P54蛋白的Vero细胞(Vero-AG-ASFV-P54)不仅能够与鼠抗P54蛋白的多抗发生特异性反应(图 4),而且还能被ASFV感染猪阳性血清识别(图 5),同时还可观察到ASFV P54蛋白的绿色点状荧光信号(图 4、图 5,Azami Green),能够与多抗或猪阳性血清的红色染色信号(图 4、图 5,pAb ASFV-P54/positive ASFV Serum)发生共定位(图 4,图 5,Merge),与阴性血清则无反应(图 5,Negative serum)。而Vero细胞和Vero-AG细胞对照与P54多抗、ASFV感染的猪阳性血清均不发生反应(图 4、图 5)。
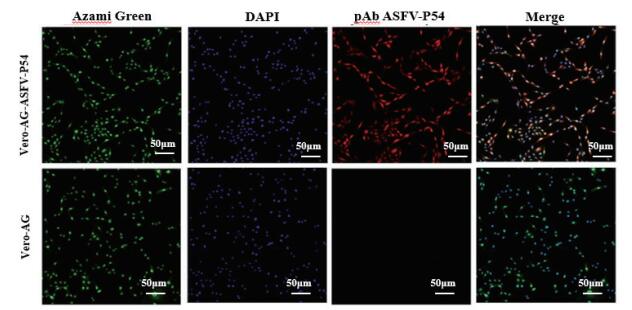
|
| 图 4 稳定表达ASFV P54基因的Vero细胞(Vero-AG-ASFV-P54)与P54多抗反应的IFA结果 |
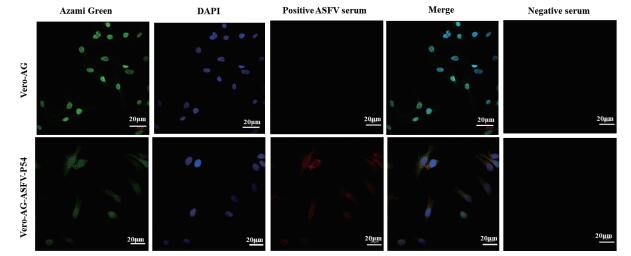
|
| 图 5 稳定表达ASFV P54基因的Vero细胞(Vero-AG-ASFV-P54)与ASFV感染猪血清反应的IFA结果 |
ASF可通过与野猪接触、受污染的猪制品和媒介昆虫传播[9]。除非洲外,该病已经在美洲、欧洲等多个国家发生,2018年该病传入我国,导致我国畜牧业损失重大,非洲猪瘟防控形势严峻。为了维持我国畜牧业健康持续发展,保护国民身体健康以及维护国家利益,开展该病的检测技术研究具有重大意义。
随着非洲猪瘟疫苗开始进入临床阶段,针对该疫病的抗体检测迫在眉睫。目前抗体的检测主要依赖国外进口试剂盒,国内没有成熟的商品化试剂盒,这些试剂盒成本昂贵,更重要的是试剂盒检测结果不能作为确诊方法,必须进行免疫荧光(IFA)方法进一步验证[10]。
基于病毒学的IFA研究方法,该方法是OIE推荐的实验室确诊方法[11]。但该方法需要病毒感染敏感细胞过程。目前非洲猪瘟主要感染原带猪肺泡巨噬细胞,获取原带猪肺泡巨噬细胞需要较高的实验条件[12]。研究表明,在Vero细胞系中,有些非洲猪瘟病毒也能复制,但存在滴度不高的现象。因此利用IFA对抗体阳性血清进行确证,操作繁琐耗时长,且涉及生物安全的问题,因此应用范围受限,亟需该方法的替代方法。目前已有很多烈性传染病利用稳定克隆细胞系表达病毒蛋白来替代IFA的方法,如Balamurugan等[13]利用稳定表达H蛋白的稳定克隆细胞系来检测小反刍兽疫抗体阳性,张永宁等[14]利用BHK-21细胞建立的稳定表达施马伦贝格病毒N蛋白的稳定克隆细胞系,为SBV血清抗体的检测提供了备用材料。
本研究利用Vero细胞首次建立了非洲猪瘟主要抗原P54蛋白的稳定单克隆Vero细胞系,利用Vero细胞稳定表达带有Azami Green荧光标签P54蛋白具有高效的生物活性,能够与P54多抗和ASFV阳性血清发生特异反应,在荧光显微镜下可以清晰的观察到荧光信号,而对照细胞则没有,整个操作过程无需活病毒感染,在普通条件下即可对样品进行确诊,且有效缩短了检测时间。这表明该细胞系有望成为非洲猪瘟感染后抗体检测和确诊的重要研究材料。且通过进一步的研究,该稳定单克隆Vero细胞系还能用于非洲猪瘟病毒致病机理的研究,其应用范围有待于进一步的深挖探究。
4 结论本研究成功构建了pLV-ASFV-P54-AG慢病毒表达系统,并且筛选到了一株能够高效稳定表达ASFV-P54蛋白的Vero细胞株,可以在不违背生物安全要求的情况下用于非洲猪瘟血清抗体的检测,应用前景广阔。
| [1] |
Guinat C, Gogin A, Blome S, et al. Transmission routes of African swine fever virus to domestic pigs:current knowledge and future research directions[J]. Veterinary Record, 2016, 178(11): 262-267. DOI:10.1136/vr.103593 |
| [2] |
Eustace Montgomery R. On a form of swine fever occurring in British East Africa(Kenya colony)[J]. The Journal of Comparative Pathology and Therapeutics, 1921, 34: 159-191. DOI:10.1016/S0368-1742(21)80031-4 |
| [3] |
Sanchez-Cordon PJ, Montoya M, Reis AL, et al. African swine fever:a re-emerging viral disease threatening the global pig industry[J]. Veterinary Journal, 2018, 233: 41-48. DOI:10.1016/j.tvjl.2017.12.025 |
| [4] |
Zhou X, Li N, Luo Y, et al. Emergence of African swine fever in China[J]. Transboundary and Emerging Disease, 2018, 65(6): 1482-1484. DOI:10.1111/tbed.12989 |
| [5] |
FAO. ASF situation in Asia update. http://www. fao. org/ag/againfo/programmes/en/empres/ASF/situation_update. html. 2019. Accessed 12 September 2019.
|
| [6] |
Jia N, Ou Y, Pejsak Z, et al. Roles of African swine fever virus structural proteins in viral infection[J]. Journal of Veterinary Research, 2017, 61(2): 135-143. DOI:10.1515/jvetres-2017-0017 |
| [7] |
王志亮. 非洲猪瘟研究进展[J]. 中国动物检疫, 2011, 28(6): 70-74. DOI:10.3969/j.issn.1005-944X.2011.06.030 |
| [8] |
马勇, 张桂铭, 孙立江. 大黄素增强顺铂对膀胱癌T24细胞移植瘤抑制作用的实验研究[J]. 现代泌尿外科杂志, 2015, 20(4): 260-263, 268. |
| [9] |
Costard S, Mur L, Lubroth J, et al. Epidemiology of African swine fever virus[J]. Virus Research, 2013, 173(1): 191-197. |
| [10] |
Cubillos C, Gómez-Sebastian S, Moreno N, et al. African swine fever virus serodiagnosis:a general review with a focus on the analyses of African serum samples[J]. Virus Research, 2013, 173(1): 159-167. |
| [11] |
OIE. African swine fever(Infection with African swine fever virus)[S]. France Paris: 2019.
|
| [12] |
欧云文, 闫传忠, 张杰, 等. 非洲猪瘟病毒的分子病原学及致病机理研究进展[J]. 中国畜牧兽医, 2017, 44(7): 2139-2146. |
| [13] |
Balamurugan V, Sen A, Saravanan P, et al. Development and characterization of a stable vero cell line constitutively expressing peste des petits ruminants virus(PPRV)hemagglutinin protein and its potential use as antigen in enzyme-linked immuneosorbent assay for serosurveillance of PPRV[J]. Clinical and Vaccine Immunology, 2006, 13(12): 1367-1372. DOI:10.1128/CVI.00273-06 |
| [14] |
张永宁, 吴绍强, 宋珊珊, 等. 稳定表达施马伦贝格病毒核衣壳蛋白的BHK-21细胞系的建立[J]. 中国预防兽医学报, 2015, 37(6): 438-443. DOI:10.3969/j.issn.1008-0589.2015.06.08 |




